砷化合物是自然界中普遍存在的环境毒物,被美国环境保护局(EPA)、有毒物质和疾病登记处(ATSDR)列为有害物质优先排序清单的首位[1]。在全球,砷(As)污染已成为一个严峻的环境问题,例如东亚和东南亚地区,大约有6000万人面临As中毒的风险[2]。As会造成心血管疾病、糖尿病、周围神经病变和外周血管病等,怀孕期间接触As会导致流产、婴儿出生体重低以及婴儿发育迟缓,长期饮用含As的水和食用含As食物或长期暴露在含As的环境中还会致癌[1, 3]。2014年,原环保部和原国土资源部对我国土壤污染状况的调查表明,19.4%的农田土壤遭受污染,其中重金属和类金属污染土壤占据82.4%,而As是5种主要超标重金属之一[3]。除火山活动、岩石风化等地球化学过程导致自然源As释放之外,采矿、冶炼、杀虫剂、含As地下水灌溉等人为活动也可导致土壤As的高度累积[1, 4]。在As污染土壤生长的水稻,由于其生存的淹水环境显著增加了As的迁移性和生物有效性,因而土壤中的As被大量吸收并在谷物中积累[5-7]。水稻是世界近30亿人的主食,尤其在亚洲地区,水稻As污染给以其为主食的人群带来了潜在的健康威胁[8]。近年来,水稻As污染及As诱发癌症的报道屡见不鲜,并引发了密切的关注。
1 As形态及转运 1.1 As形态及吸收As的迁移转运是导致其暴露风险的主要原因。在还原环境中,As通常以亚砷酸盐阴离子(HxAsO3x-3)的三价态As(Ⅲ)形式存在;在氧化环境中,As通常以砷酸盐阴离子(HxAsO4x-3)的五价态As(Ⅴ)形式存在,其中As(Ⅴ)对铁、铝和锰的氧化物具有较强特异性亲合力,从而可以吸附在土壤/沉积物中的矿物质上[9]。除了无机砷As(Ⅲ)和As(Ⅴ)以外,土壤中还存在较低含量的有机砷,如单甲基砷(MMA)和二甲基砷(DMA)[10]。无机砷的毒性远大于有机砷,而As(Ⅲ)的毒性是As(Ⅴ)的几十倍,因而总As浓度及As形态都是评价As污染环境风险的主要指标[11]。
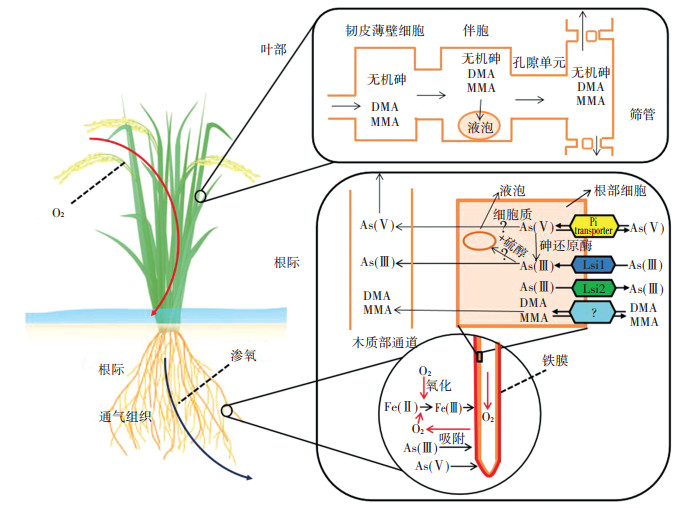
在稻田淹水条件下,土壤中释放出的As被水稻根系吸收,并进一步在谷物中累积。不同As形态吸收机制存在差异:无机砷酸盐[As(Ⅴ)]是一种磷酸盐类似物,可以被磷酸盐转运蛋白吸收从而进入到根中;而无机亚砷酸盐[As(Ⅲ)]可通过水稻根部细胞的硅酸运输通道进入水稻植株,因而土壤中的硅酸会与As(Ⅲ)竞争运输通道从而减少水稻对As的吸收[8, 12]。研究表明,转运蛋白Lsi1是水稻中As(Ⅲ)的主要摄取通道,而转运蛋白Lsi2在As(Ⅲ)迁移和在谷物中的积累上起重要作用[13]。有机甲基砷是在As污染土壤中的微生物产生的亚砷酸甲基酶作用下自然生成的[14]。在厌氧条件下,例如在水稻稻田中,MMA进一步生成DMA,产生的DMA可以被吸收进入水稻,并在水稻中积累[15]。稻米中的DMA虽然对人类毒性较小,但其可能会在烹饪过程中反向转化为无机砷,从而产生更大的毒性[15]。
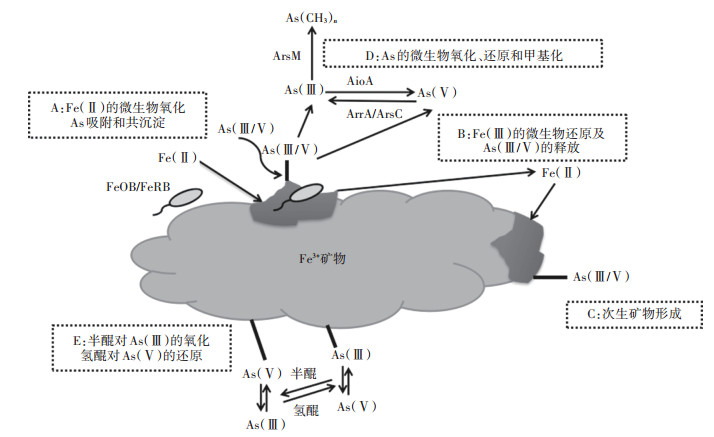
1.2 水稻As的代谢(根际、根-秸秆-谷粒)在淹水条件下,水稻对As(Ⅲ)的吸收和转运能力很强且远高于As(Ⅴ)[16-17](图 1)。Wu等[18]研究表明,水稻地上部分和地下部分的主要As形态都是亚砷酸盐。相对于其他谷类作物,水稻根系还原As(Ⅴ)的能力较高,吸收的As(Ⅴ)会快速还原成As(Ⅲ),随后转移到木质部汁液中,对谷粒中As积累的贡献很高[16]。Kopittke等[19]通过荧光X射线近边吸收光谱研究表明,根尖组织能够快速将As(Ⅴ)还原,使根被皮中只存在少量As(Ⅴ),还原后产生的As(Ⅲ)主要集中在根皮层和中柱中,100%与硫醇基团络合。而经根部直接吸收且未络合的As(Ⅲ)移动性很高,是木质部和韧皮部中主要的As形态,As(Ⅲ)-硫醇复合物的形成限制了As(Ⅲ)从根到茎的迁移。然而,Seyfferth等[20]提出了水稻根系As的不同分布机制,其研究表明木质部通道中As的主要形态是As(Ⅴ)(约86%),而还原态的As(Ⅲ)(71%)主要存在于与木质部相邻的液泡内,可能因为该研究所使用的是成熟水稻,而其他大多数研究中使用的是水稻幼苗。因此,水稻根系As形态分布的不同可能是由于根系成熟状况不同,还需要进一步研究不同生长阶段水稻根系As的分布情况[16, 20]。
|
图 1 根际Fe和As的生物地球化学过程[16-17] Figure 1 Biogeochemical processes of iron and arsenic in rhizosphere[16-17] |
相对于木质部通道,韧皮部转移As是谷粒产生高浓度As的重要途径,DMA到谷粒的迁移率比无机砷更高,且其分散在整个胚乳中,而无机砷集中存在于籽粒表皮的维管束中[16, 21-22]。Song等[23]研究表明,韧皮部伴胞内的一种液泡膜转运蛋白(OsABCC1)能够促使As进入液泡,从而降低谷粒中As的浓度。Carey等[21]研究表明,亚砷酸盐主要是通过韧皮部迁移至水稻谷粒,而DMA可以通过韧皮部和木质部通道迁移至谷粒中,且两种通道作用贡献基本均匀,破坏韧皮部通道后,谷粒中亚砷酸盐的浓度降低了90%,而DMA只降低了55%。此外,DMA与硫醇的络合可能会导致DMA在植物中的形态发生变化[21]。有机砷从叶到谷粒中的迁移率比无机砷更高。Carey等[22]报道,DMA和MMA能够高效地从旗叶转移到谷粒,而砷酸盐转移能力较低,其在旗叶内迅速被还原,产生的亚砷酸盐不再发生转移;此外,DMA能够在谷物中迅速分散,而MMA和无机砷主要集中在进入点附近。Wu等[5]研究表明,谷壳中的As主要是无机砷,占总As的82%~93%;而谷物中的As主要是无机砷和DMA,DMA占总As的33%~64%。
2 根际氧化还原条件对水稻As吸收的影响 2.1 渗氧对水稻As吸收的影响渗氧(Radial oxygen loss,ROL)是指氧气通过水稻等湿地植物的根部通气组织向根际土壤扩散的过程[5]。ROL主要作用于生长在淹水环境下的植物根际土壤,对根际土壤的物理化学性质起着重要的作用,例如改变营养元素的可利用性、潜在毒性物质的含量和微生物群落结构及活动等[5]。在淹水的土壤环境,水稻根部的ROL作用使得其根际土壤呈现好氧状态,这在很大程度上影响了根际土壤As的生物有效性[8]。Wu等[6]研究表明,水稻根部ROL能力存在显著的基因型差异,与As耐性呈显著正相关关系。水稻ROL能力与水稻根部孔隙度呈正相关关系,与As积累呈显著负相关关系,ROL能力越高,其吸收的无机砷含量越少[5-6, 18]。Pan等[8]研究发现,水稻ROL改变了水稻根际土壤的pH值和氧化还原电位,相较ROL能力低的水稻品种,ROL能力高的水稻根际土中As(Ⅲ)的比例更低。Wu等[5]发现,杂交稻的ROL显著低于常规稻,水稻根部和地上部分对于总As和无机砷的积累与水稻的ROL呈显著负相关关系。Wu等[11]研究表明,ROL改变了土壤As的结合形态,根际土壤中非特异性吸附态、特异性吸附态和无定型铁铝氧化物结合态As含量均高于非根际土壤。在水稻根部ROL作用下,还原性溶解的铁(氢)氧化物在水稻根表面形成铁膜,铁膜主要由水铁矿、针铁矿和纤铁矿构成,其能够强烈吸附土壤溶液中的As,从而降低As的迁移能力及毒性[18, 24]。水稻的ROL能力与水稻根部铁膜的含量显著相关,基因型、根部的位置以及曝气条件对铁膜的形成也都有显著性的影响[18]。Wu等[18]研究表明:间歇性排水条件下铁膜的形成量最高;根尖铁膜的形成量最高,随着距根尖距离的增大,铁膜的形成量逐渐减少。水稻ROL能力与根部铁膜形成和铁膜固定As的量呈显著正相关,其中铁膜固定的As主要为As(Ⅴ),大约是As(Ⅲ)的两倍,铁膜的形成减少了水稻地上部分和地下部分的As含量。Wu等[25]研究表明,As胁迫促进了水稻根表铁膜的形成,并且使ROL能力减弱。Pan等[8]研究表明,水稻根部铁膜形成量及其固定的As含量与根部ROL呈正相关关系,水稻根部铁膜形成量与水稻As含量呈显著负相关,ROL能力高的水稻植株可以在根际土壤中氧化更多的亚砷酸盐,促进铁膜的形成,即可固定更多As,降低植物地上组织对As的吸收,从而降低稻谷对无机砷的积累。因此,筛选和培养ROL能力强的水稻可能成为降低水稻根际As生物可利用性和水稻植物中As累积的有效措施。
2.2 水稻根际通气条件对水稻As吸收和As转运载体表达的影响水稻根系可以吸收无机砷和有机砷,有研究[7, 26-27]表明,更多的氧气(例如通气条件、间歇性淹水)可以改变土壤中无机砷的形态。然而,关于间歇性淹水对土壤中有机砷浓度的影响还需要进一步的研究。通气条件对水稻植物中As的吸收和积累具有深远的影响。Takahashi等[28]发现,As还原促进了As的溶解释放;当土壤未被淹没时,As吸附在铁(氢)氧化物上,然而在淹水条件下,铁(氢)氧化物的还原溶解和As(Ⅴ)被还原为As(Ⅲ)促进了As从土壤释放到孔隙水中。Xu等[7]报道,通气条件可以极大降低植物对As的生物可利用度,减少水稻中As的积累,与淹水处理相比,通气使无机砷的浓度降低了62%~ 66%。Li等[27]研究表明,淹水条件使土壤中亚砷酸盐的移动性增强,通气处理提高了水稻谷粒中无机砷的比例,但是相对于淹水处理,谷粒中无机砷的浓度仍相对较低。Hua等[29]报道,在淹水条件下,植物对As吸收能力较高可能与铁(氢)氧化物的溶解以及As的释放有关。Somenahally等[26]研究表明,与连续淹水情况相比,间歇淹水的根际和谷物中总As浓度显著降低,因此可以通过改变通气条件来降低根际土壤和谷粒中溶解性As的浓度。Yamaguchi等[30]报道,淹水处理导致土壤Eh降低、pH升高,土壤固相中的As(Ⅲ)百分含量增加,高达土壤总As的80%。Honma等[31]研究表明,Eh低于-100 mV会促使As从铁(氢)氧化物上释放到土壤,在中性条件下,Eh低于100 mV有利于As(Ⅴ)转化为As(Ⅲ)。Li等[32]研究表明,水稻种植方式(水稻和旱稻)对不同形态As的吸收存在显著差异。Norton等[33-34]研究表明,在淹水和非淹水条件下,谷粒As浓度的差异非常显著,淹水条件下平均As浓度是非淹水条件下的14倍;淹水条件对旗叶和谷壳的As浓度无显著影响。Hu等[35]研究表明,相对于通气处理,淹水和间歇淹水处理使DMA浓度显著增加,这可能是导致水稻糙米中总As浓度增加的主要原因。Wu等[4, 36]研究表明,与间歇淹水相比,通气处理增加了水稻根部和地上部分的长度及生物量,显著降低了水稻根际总As浓度;此外,通气条件显著增加了根际砷酸盐浓度,显著降低了亚砷酸盐浓度,且水稻根系总P浓度显著增高。与淹水处理相比,通气处理降低了水稻对总As和As(Ⅲ)的积累,促进了水稻吸收As(Ⅴ),减少了水稻根部细胞硅酸运输通道基因Lsi1和Lsi2的表达,减少了水稻根部磷酸运输通道基因的表达,但是促进了水稻根部磷酸载体蛋白基因表达。因此,改变通气条件可能是降低水稻As含量以及As对水稻影响的一条潜在途径。
3 硅对水稻As吸收的影响硅(Si)是土壤中第二大元素,它可以改善水稻生 长状况、提高水稻产量,增强水稻对害虫、疾病、盐度或干旱的抵抗力[11, 17]。土壤中添加Si对水稻As吸收的影响非常复杂,由于有类似的物理化学性质,Si可能与As(Ⅲ)竞争土壤矿物质的保留位点。Lee等[37]研究表明,硅酸盐降低了As(Ⅲ)的吸附速率,并且与其竞争吸附位点,使土壤溶液中的As浓度显著增加,使水稻地上部分和地下部分的As浓度显著增加,水稻幼苗积累更多As使土壤溶液中的As浓度增加,水稻幼苗积累更多As。研究表明,Si的施加使土壤溶液中的As浓度显著增加,在含As浓度较高的污染土壤添加Si,会增加水稻对As的吸收和积累[12, 27, 37-38]。Wu等[11]研究发现,Si的添加显著增加了根和谷物的生物量,此外,Si的添加显著增加了特异性吸附态和无定型铁铝氧化物结合态As含量,减少了结晶型铁铝氧化物结合态和残留态As含量,即Si添加增加了土壤As的生物有效性,且Si添加使根际土壤非特异性吸附态、特异性吸附态和无定型铁铝氧化物结合态As含量高于非根际土壤。
然而,水稻通常生长在淹水条件下,大量的研究表明,此时土壤中的As形态主要为As(Ⅲ),由于As(Ⅲ)是一种硅酸盐类似物,硅酸盐(Si)的施加不仅可以增加水稻产量,也可以抑制水稻对As的吸收和积累[11-12, 27, 39]。Bogdan等[40]报道,土壤中施加Si可能会降低稻米的As含量。Fleck等[39]报道,Si通过抑制As(Ⅲ)运输将未去除谷壳和去除谷壳稻谷中的As浓度降低了22%。因此,土壤中施加Si可能增加水稻As吸收也可能降低水稻As吸收,其取决于Si和As的相对含量及形态(表 1)。在中低浓度As含量的土壤中施加Si可以抑制植物对As的吸收,对于含As浓度较高的污染土壤,添加Si可能会增加水稻对As的摄取量[37]。当土壤孔隙水中Si浓度相对较低时,Si和As之间发生吸附位点的竞争,释放出的As被根吸收;当土壤孔隙水中Si浓度相对较高时,再次发生Si和As之间吸附位点的竞争,但是由于孔隙水中较高的Si浓度抑制了植物对As的吸收,谷粒和秸秆的总As与孔隙水中Si浓度呈负相关[12, 15]。Si/As较高时,添加Si可以减少水稻中的As含量;Si/As较低时,添加Si使土壤溶液中的As浓度增加,可能使水稻As含量升高[37]。由于施用Si的不利影响来自于As和Si之间对土壤吸附位点的竞争,因此叶面施用Si肥可能是促进水稻生长更有效的方法[37]。
|
|
表 1 Si与As在土壤-植物系统中的效应 Table 1 Effects of silicon(Si)on arsenic(As)accumulation and speciation in soil-plant systems |
硅在土壤溶液中以硅酸(H4SiO4)的形式存在[40]。可溶性Si添加对土壤孔隙水中的As浓度具有显著影响,然而,非可溶性Si的添加却对其无显著影响[11-12]。Seyfferth等[12]研究表明,加入Si-凝胶后溶解的Si浓度比加入硅藻土高近4倍,硅藻土的添加对土壤孔隙水和谷粒中的As浓度无显著影响,Si-凝胶的添加增加了土壤孔隙水中的As浓度,但显著降低了谷粒中的As浓度。Si的施加对谷粒中DMA的影响机制尚不明确。Liu等[38]研究表明,Si的添加减少了水稻中As(Ⅲ)的浓度,然而却增加了DMA的浓度。Kersten等[15]报道,在竞争土壤铁(氢)氧化物吸附位点时,硅酸对DMA的竞争性大于对As(Ⅲ)的竞争性。Li等[27]研究表明,Si的添加能够使谷粒中的无机砷降低59%,DMA升高33%。Wu等[11]研究表明,DMA从秸秆到谷物中的转移能力高于无机砷,Si的施加分别使谷粒中无机砷和DMA的含量降低了21%和58%。此外,Si添加可以提高水稻根部的ROL能力,促进根表铁膜的形成[5, 10, 41]。Wu等[5]报道,Si的添加显著增加了根和谷物的生物量,提高了不同基因型水稻根部的铁膜含量,使水稻根、秸秆和谷壳中的As浓度显著降低。
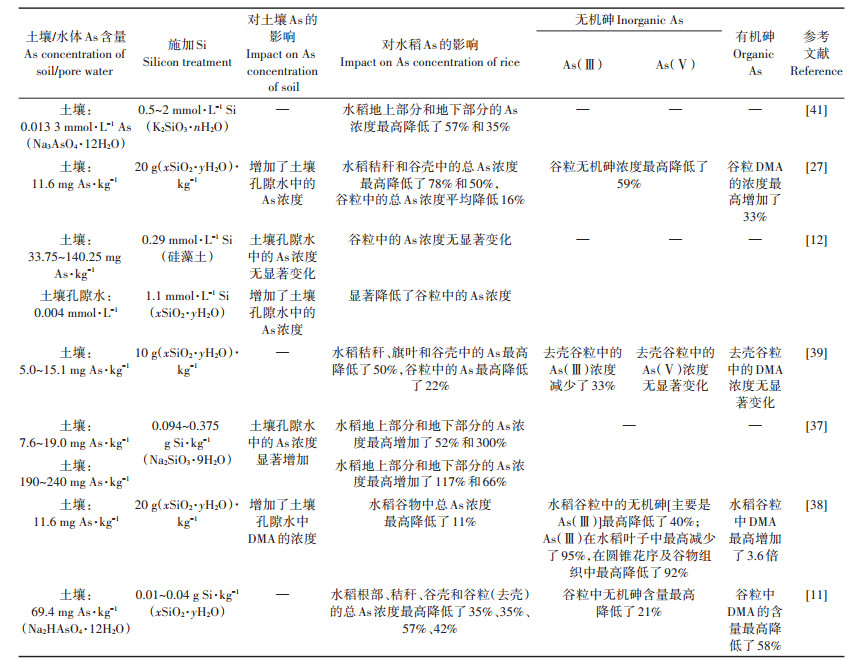
4 根际铁循环对水稻As吸收的影响 4.1 铁(氢)氧化物对As的吸附土壤是由矿物质、有机质、微生物和水分等组成的多相混合体,矿物及有机质等对As在土壤中的吸附-解吸过程有着重要的作用,影响As在土壤中的迁移性、生物有效性和毒性[42-43]。铁(氢)氧化物是土壤中广泛存在的矿物质,包括水铁矿、赤铁矿、针铁矿、纤铁矿及磁铁矿等多种类型[44]。由于具有大比表面积和正表面电荷等特性,铁(氢)氧化物对砷酸根等阴离子的吸附能力很强,因而常被作为修复剂来去除水体或固定土壤中的As[42]。Wu等[10]研究表明土壤中As大部分为铁(氢)氧化物结合态。As可以在铁(氢)氧化物表面形成内层双齿双核螯合形式的表面配位体,其吸附属专性吸附[43]。铁(氢)氧化物吸附As的能力受铁(氢)氧化物类型、As形态及浓度、pH、离子强度、吸附时间及温度和溶解性有机碳(DOC)等因素影响[43, 45]。水稻田通常处于淹水条件下,水稻土含As铁矿物中铁矿物的还原溶解、根表铁膜的生成、二次铁矿物的生成以及根际环境决定着土壤溶液中As的相对浓度和形态,因而研究水稻田中铁的氧化还原循环过程对As的迁移、毒性和环境归宿起着重要作用(图 2)[46]。铁的生物地球化学循环包括铁还原与亚铁氧化两个过程,分别由异化铁还原菌(FeRB)和亚铁氧化菌(FeOB)提供基本驱动力[47]。异化铁还原菌能以胞外不溶性的铁(氢)氧化物为末端电子受体,通过氧化电子供体偶联Fe(Ⅲ)还原,并从这一过程中贮存能量[48]。Laverman等[49]研究表明,细菌SES-3可以将As(Ⅴ)和Fe(Ⅲ)作为电子受体,通过还原As(Ⅴ)和Fe(Ⅲ)来获得能量维持生长。环境中铁(氢)氧化物的生物还原是一个重要的生物化学过程,不仅对铁矿物学形态产生影响,还会影响环境中As的形态和归宿[50]。Lovley等[50]研究认为微生物介导的以胞外不溶性铁(氢)氧化物为末端电子受体的Fe(Ⅲ)异化还原可能是最早的微生物代谢形式。Yan等[51]研究表明,水稻土等淹水厌氧环境中的异化铁还原菌具有多样性,在古细菌和细菌中都有分布。在土壤微生物作用下,铁(氢)氧化物与吸附的As相互作用会发生吸附、共沉淀及电子传递主导的氧化还原等过程,Fe的氧化还原过程导致As的被吸附和释放,还可能造成As形态的转变[44, 52-58]。因而识别Fe(Ⅱ,Ⅲ)系统对As的作用机制是治理农田As污染的有效途径[44]。
4.2 Fe还原对As的影响研究表明,在水体、沉积物和水稻土等还原环境中,FeRB介导的铁(氢)氧化物还原是导致As释放的主要原因,释放的As总量取决于As的价态、铁矿物类型、矿物质中As/Fe以及微生物种类和丰度等因素[45]。到目前为止,已有许多微生物被证实可以通过各种代谢方式还原Fe(Ⅲ),其中Shewanella oneidensis MR-1作为一种模式细菌能够利用许多物质作为电子受体进行异化厌氧呼吸,其他变形菌门的希瓦氏菌(Shewanella)也可以通过细胞色素在细胞膜上将Fe(Ⅲ)氧化物和电子传递系统联系起来从而还原不可溶的Fe(Ⅲ)氧化物[48]。Stroud等[54]研究表明,Fe(Ⅲ)的还原导致吸附在铁(氢)氧化物上的As(Ⅴ)被释放还原。Bennett等[55]研究发现土壤溶液中Fe(Ⅱ)与As(Ⅲ)存在极显著正相关性,说明铁矿物的还原溶解会显著影响As的迁移性。Jiang等[56]报道,FeRB能够通过还原土壤、矿物以及其他富铁环境中的铁(氢)氧化物来影响As的移动性。然而,也有研究认为含As铁氧化物的还原溶解并不能增加As的移动性,FeRB还原铁(氢)氧化物过程还可能会导致As的固定,这是因为铁还原过程中生成的次生矿物对As的吸附能力更强[44]。这两种相反的结果可能是由实验条件、铁矿物类型、矿物质中As/Fe以及特异微生物的差异造成的[34, 44, 54-60]。Saalfield等[59]研究发现水铁矿还原过程中生成了结晶度和稳定性更高的针铁矿和磁铁矿,降低了As的移动性。Kocar等[60]发现微生物还原含As(Ⅴ)的水铁矿可生成绿锈、磁铁矿等次生矿物,形成了含As的次生矿物。Guo等[44]报道菱铁矿向针铁矿转变提高了As的吸附率。Jiang等[56]研究表明,在铁还原菌S. oneidensis MR-1和Shewanella sp. HN-41作用下,As(Ⅴ)与溶液中生成的Fe(Ⅱ)发生共沉淀作用,溶液中As(Ⅴ)浓度降低。As的释放和不同Fe-As次生矿物的形成与不同细菌的还原能力有关[49]。Yang等[45]研究发现,沉积物中铁(氢)氧化物在异化还原初期会导致As(Ⅲ)的释放,然而由于异化铁还原导致的氧化还原电位的持续变化,释放的As在还原中后期不仅存在再吸附作用,而且能够与硫化物产生共沉淀,从而降低As的移动性。Thomasarrigo等[57]研究了还原条件下富铁有机絮凝物中Fe和As的形态变化,发现在含硫化物环境中,絮状水铁矿和纳米纤铁矿晶体形成了较高含量的四方硫铁矿,从铁矿物表面解吸的As形成了三硫化二砷矿物。此外,铁还原溶解过程还可能伴随着As形态的改变,Huang等[58]研究发现微生物还原铁(氢)氧化物过程发生了As(Ⅴ)的解吸和还原。Amstaetter等[52]研究表明,FeRB存在的环境中,在Fe(Ⅲ)羟基氧化物和Fe(Ⅱ)同时存在的情况下,可以发生As(Ⅲ)的氧化。汪明霞等[61]研究表明,Shewanella oneidensis MR- 1作用过程中,Fe(Ⅲ)被还原为Fe(Ⅱ)的同时伴随着As(Ⅲ)氧化为As(Ⅴ)。
在Fe的还原溶解产生次生矿物的过程中,以胞外不溶性铁氧化物为末端电子受体的微生物异化Fe(Ⅲ)还原是重要驱动力[48, 62-63]。微生物胞外电子传递(Extracellular electrontransfer,EET)包括微生物与矿物之间的“直接电子传递”以及微生物-腐殖质-矿物间的“间接电子传递”,是微生物胞外呼吸的本质[62-63]。胞外呼吸是指厌氧条件下,微生物在细胞内氧化有机物释放出电子,产生的电子经细胞膜电子传递链传递到胞外电子受体,并从中贮存能量维持自身生长代谢[63]。胞外电子传递能够利用土壤中的有机物,驱动微生物异化铁还原过程,并耦合As的迁移和形态转变。腐殖质能够作为电子受体加速电子传递,促进“间接电子传递”过程[63]。微生物能够间接诱导As(Ⅲ)氧化或As(Ⅴ)还原,生成一些有机或无机化合物,随后与As(Ⅴ)或As(Ⅲ)进行氧化还原反应[46]。如腐殖质中的半醌自由基可以将As(Ⅲ)氧化成As(Ⅴ),胡敏酸-醌模型化合物中的氢醌可以将As(Ⅴ)还原成As(Ⅲ),半醌和氢醌在Fe(Ⅲ)矿物的微生物还原中起着重要的电子转移作用[46]。生物质炭作为一种类固态腐殖质,其表面包含大量吩嗪类基团等参与电子传递的反应位点,能够作为电子穿梭体参与微生物对铁(氢)氧化物的异化还原。Piepenbrock等[64]研究表明,腐殖质作为电子穿梭体促进了Fe(Ⅲ)的还原。Zhou等[65]研究表明,厌氧氨氧化可以耦合异化铁的还原,添加电子穿梭体(如可溶性类腐殖质AQDS、生物质炭等)可以促进Fe(Ⅱ)的生成。Chen等[66]研究表明,微生物介导的As代谢以及Fe还原在地球As-Fe循环中产生着重要的作用,这个过程受DOM(溶解性有机物)的影响,0.05 mmol·L-1和0.10 mmol·L-1蒽醌- 2,6-二磺酸(AQDS)处理可以促进As(Ⅴ)和Fe(Ⅲ)的还原和释放,而1.00 mmol·L-1 AQDS处理反而会抑制As(Ⅴ)和Fe(Ⅲ)的还原和释放;与对照相比,0.05 mmol·L-1和0.10 mmol·L-1 AQDS处理分别使土壤中的As(Ⅲ)增加了13倍和6倍;与1.00 mmol·L-1 AQDS处理相比,0.05 mmol·L-1和0.10 mmol·L-1 AQDS处理分别使土壤中的Fe(Ⅱ)增加了4倍和3倍。Chen等[67]研究发现,生物质炭增加了微生物异化铁还原和溶解有机碳的含量,从而增加了沉积物中As的释放。Yin等[68]报道生物质炭增强了As的移动性。
4.3 Fe氧化对As的影响亚铁氧化在好氧和厌氧条件下均可以发生。微生物亚铁氧化可以在化学氧化无法进行的较低的pH值环境下进行;在近中性pH值条件下,好氧FeOB氧化将会和快速化学氧化产生竞争[46]。因此,FeOB主要生存在缺氧条件下尤其是好氧-厌氧界面,例如淹水植物的根部附近[46]。在中性、缺氧的环境中,光合和硝酸盐依赖型铁氧化细菌可以促使Fe(Ⅱ)氧化,而硝酸盐和氧化锰(Ⅳ)可作为Fe(Ⅱ)的化学氧化剂[46-47]。Croal等[69]报道,铁氧化细菌大多都属于变形杆菌。在中性的厌氧或低氧条件下,FeOB能够进行有效的生物亚铁氧化并生成难溶于水的Fe(Ⅲ)矿物,并以各种铁(氢)氧化物形式沉淀,这些铁(氢)氧化物为异化铁还原作用及污染物氧化还原转化提供了理想底物[50-51, 70]。在亚铁氧化过程中,As可与Fe(Ⅲ)发生共沉淀[71-72]。此外,生成的铁(氢)氧化物表面带正电荷,能够强烈地吸附AsO43-和AsO33-,从而降低As的移动性[47]。Hohmann等[53]研究表明,嗜中性FeOB氧化Fe(Ⅱ)产生的Fe(Ⅲ)矿物能够有效吸附As。Chen等[71]研究表明,土壤中添加硝酸盐可能会促进硝酸盐依赖型铁氧化菌氧化Fe(Ⅱ),使土壤中As吸附在Fe(Ⅲ)矿物表面或与Fe(Ⅲ)发生共沉淀,使水稻对As的吸收量减少。在水稻的根际区域,根部的ROL作用促进水稻根部表面铁膜形成,铁膜能强烈地吸附土壤溶液中的As从而降低As的移动性,此外,ROL还会影响根际铁氧化细菌的丰度,进一步促进根际的Fe(Ⅱ)氧化[5]。在Fe的生化地球循环过程中,不仅存在As的释放、吸附和共沉淀等作用,还会耦合As的氧化还原反应[52, 72-73]。在活性铁界面、Fe(Ⅱ)-针铁矿系统以及Fenton反应中,都发生了As(Ⅲ)的氧化过程[46, 52, 72-73]。Senn等[73]研究表明,硝酸盐能够氧化Fe(Ⅱ)生成可以吸附As的水合铁氧化物颗粒,并且氧化产生更多的As(Ⅴ)。王兆苏等[72]报道,在FeOB氧化Fe(Ⅱ)过程中,As(Ⅲ)被氧化,生成的As(Ⅴ)能够和Fe(Ⅲ)发生共沉淀或吸附在生成的铁氧化物的表面。Okibe等[74]研究发现,FeOB在介导Fe(Ⅱ)氧化的过程中,同时发生了As(Ⅲ)的氧化和固定。
Fenton反应是指在Fe(Ⅱ)催化作用下,H2O2产生强氧化能力活性氧自由基的反应。有研究表明Fenton反应可以将亚砷酸盐氧化成较低毒性的砷酸盐,并且有助于土壤铁(氢)氧化物、根际铁膜的形成[75-77]。Fe(Ⅱ)可存在于水稻淹水条件下,H2O2可存在于雨水中,因此在降雨丰富的地区,Fenton反应可能是一种天然存在的过程,可以影响水稻和土壤中As的生物地球化学行为,因此,可以通过使用Fenton试剂[H2O2和Fe(Ⅱ)的混合物]来减少水稻对As的吸收[77]。Qin等[76-77]研究表明,添加Fenton试剂促进了硝酚胂酸降解成砷酸盐,砷酸盐成为土壤中As的主要形态,并且由于砷酸盐的大量产生,促进了As的甲基化;添加Fenton试剂显著降低了As的毒性对植物的影响,降低了水稻对As的吸收和累积,促进了As污染土壤中水稻的生长。
5 展望鉴于水稻As污染对人体健康存在严重威胁,如何能更有效地降低As污染的环境风险仍是我国环境保护中必须关注的重点。因此,针对目前As污染问题,未来的研究应着重于以下几方面:识别水稻对有机砷的吸收和转运途径;研究不同根际氧化还原条件对土壤As、铁微生物群落,以及As的形态和生物地球化学行为的影响;基于目前研究成果,针对As污染土壤开展大田实验,确定Si的最适添加方式,研究Si的施加对As污染土壤的修复效果及机理。
迄今为止,大量的As/Fe氧化还原菌被成功分离、培养和研究,但环境中存在大量未分离的微生物,因对微生物介导的铁氧化还原过程中耦合的As转化及迁移的认识尚有不足,未来研究工作可着眼于以下几个方面:能够耦合As生物地球化学循环的铁氧化菌和铁还原菌的筛选分离及微生物基因组学研究;采用具有As氧化还原甲基化能力的铁氧化/还原菌株研究不同类型铁矿物生物还原条件下As/Fe迁移和形态变化及矿物相转换,研究微生物介导下的铁氧化还原过程反应机制;开展田间试验研究微生物驱动对水稻根际和非根际土壤形成的铁氧化物矿物组成、土壤微尺度As化学行为的影响;通过分子生物学等手段,研究不同元素(如N、S、P等)或有机物(如生物质炭等)作为电子穿梭体对铁氧化还原菌、As功能性微生物反应的影响;采用电化学分析方法、光谱计量学手段分析反应过程中铁氧化还原菌与其他元素间的电子传递机制及含铁矿物-生物质炭-微生物耦合的胞外电子传递过程对Fe的生物成矿耦合As钝化的影响机制,为最终降低As污染的环境风险提供理论基础。
| [1] |
Zhu Y G, Yoshinaga M, Zhao F J, et al. Earth abides arsenic biotransformations[J]. Annual Review Earth Planetary Sciences, 2014, 42(1): 443-467. DOI:10.1146/annurev-earth-060313-054942 |
| [2] |
Halder D, Bhowmick S, Biswas A, et al. Risk of arsenic exposure from drinking water and dietary components:Implications for risk management in rural Bengal[J]. Environmental Science & Technology, 2013, 47(2): 1120-1127. |
| [3] |
Zhao F J, Ma Y, Zhu Y G, et al. Soil contamination in China:Current status and mitigation strategies[J]. Environmental Science & Technology, 2015, 49(2): 750-759. |
| [4] |
Wu C, Wang Q L, Xue S G, et al. Do aeration conditions affect arsenic and phosphate accumulation and phosphate transporter expression in rice(Oryza sativa L.)?[J]. Environmental Science and Pollution Research, 2016, 25(1): 43-51. |
| [5] |
Wu C, Zou Q, Xue S G, et al. Effects of silicon(Si)on arsenic(As)accumulation and speciation in rice(Oryza sativa L.)genotypes with different radial oxygen loss(ROL)[J]. Chemosphere, 2015, 138(5): 447-453. |
| [6] |
Wu C, Ye Z H, Shu W S, et al. Arsenic accumulation and speciation in rice are affected by root aeration and variation of genotypes[J]. Journal of Experimental Botany, 2011, 62(8): 2889-2898. DOI:10.1093/jxb/erq462 |
| [7] |
Xu X Y, Mcgrath S P, Meharg A A, et al. Growing rice aerobically markedly decreases arsenic accumulation[J]. Environmental Science & Technology, 2008, 42(15): 5574-5579. |
| [8] |
Pan W S, Wu C, Xue S G, et al. Arsenic dynamics in the rhizosphere and its sequestration on rice roots as affected by root oxidation[J]. Journal of Environmental Sciences, 2014, 26(4): 892-899. DOI:10.1016/S1001-0742(13)60483-0 |
| [9] |
Ying S C, Kocar B D, Griffis S D, et al. Competitive microbially and Mn oxide mediated redox processes controlling arsenic speciation and partitioning[J]. Environmental Science & Technology, 2011, 45(13): 5572-5579. |
| [10] |
Wu C, Zou Q, Xue S G, et al. The effect of silicon on iron plaque formation and arsenic accumulation in rice genotypes with different radial oxygen loss(ROL)[J]. Environmental Pollution, 2016, 212(5): 27-33. |
| [11] |
Wu C, Zou Q, Xue S G, et al. Effect of silicate on arsenic fractionation in soils and its accumulation in rice plants[J]. Chemosphere, 2016, 165: 478-486. DOI:10.1016/j.chemosphere.2016.09.061 |
| [12] |
Seyfferth A L, Fendorf S. Silicate mineral impacts on the uptake and storage of arsenic and plant nutrients in rice(Oryza sativa L.)[J]. Environmental Science & Technology, 2012, 46(24): 13176-13183. |
| [13] |
Ma J F, Yamaji N, Mitani N, et al. Transporters of arsenite in rice and their role in arsenic accumulation in rice grain[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(29): 9931-9935. DOI:10.1073/pnas.0802361105 |
| [14] |
Lomax C, Liu W J, Wu L, et al. Methylated arsenic species in plants originate from soil microorganisms[J]. New Phytologist, 2012, 193(3): 665-672. DOI:10.1111/j.1469-8137.2011.03956.x |
| [15] |
Kersten M, Daus B. Silicic acid competes for dimethylarsinic acid (DMA)immobilization by the iron hydroxide plaque mineral goethite[J]. Science of the Total Environment, 2015, 508: 199-205. DOI:10.1016/j.scitotenv.2014.11.093 |
| [16] |
Wang X, Peng B, Tan C Y, et al. Recent advances in arsenic bioavailability, transport, and speciation in rice[J]. Environmental Science and Pollution Research, 2015, 22(8): 5742-5750. DOI:10.1007/s11356-014-4065-3 |
| [17] |
Zhao F J, Mcgrath S P, Meharg A A. Arsenic as a food chain contaminant:Mechanisms of plant uptake and metabolism and mitigation strategies[J]. Annual Review of Plant Biology, 2010, 61(1): 535-559. DOI:10.1146/annurev-arplant-042809-112152 |
| [18] |
Wu C, Ye Z H, Li H, et al. Do radial oxygen loss and external aeration affect iron plaque formation and arsenic accumulation and speciation in rice?[J]. Journal of Experimental Botany, 2012, 63(8): 2961-2970. DOI:10.1093/jxb/ers017 |
| [19] |
Kopittke P M, de Jonge M D, Wang P, et al. Laterally-resolved speciation of arsenic in roots of wheat and rice using[J]. New Phytologist, 2014, 201(4): 1251-1262. DOI:10.1111/nph.12595 |
| [20] |
Seyfferth A L, Webb S M, Andrews J C, et al. Defining the distribution of arsenic species and plant nutrients in rice(Oryza sativa L.) from the root to the grain[J]. Geochim et Cosmochim Acta, 2011, 75(21): 6655-6671. DOI:10.1016/j.gca.2011.06.029 |
| [21] |
Carey A M, Scheckel K G, Lombi E, et al. Grain unloading of arsenic species in rice[J]. Plant Physiol, 2010, 152(1): 309-319. DOI:10.1104/pp.109.146126 |
| [22] |
Carey A, Norton G J, Deacon C, et al. Phloem transport of arsenic species from flag leaf to grain during grain filling[J]. New Phytologist, 2011, 192(1): 87-98. DOI:10.1111/j.1469-8137.2011.03789.x |
| [23] |
Song W Y, Yamaki T, Yamaji N, et al. A rice ABC transporter, OsABCC1, reduces arsenic accumulation in the grain[J]. Proceedings of the National Academy of Sciences, 2014, 111(44): 15699-15704. DOI:10.1073/pnas.1414968111 |
| [24] |
Syu C H, Jiang P Y, Huang H H, et al. Arsenic sequestration in iron plaque and its effect on As uptake by rice plants grown in paddy soils with high contents of As, iron oxides, and organic matter[J]. Soil Science & Plant Nutrtion, 2013, 59(3): 463-471. |
| [25] |
Wu C, Li H, Ye Z H, et al. Effects of As levels on radial oxygen loss and As speciation in rice[J]. Environmental Science and Pollution Research, 2013, 20(12): 8334-8341. DOI:10.1007/s11356-013-2083-1 |
| [26] |
Somenahally A C, Hollister E B, Yan W G, et al. Water management impacts on arsenic speciation and iron-reducing bacteria in contrasting rice-rhizosphere compartments[J]. Environmental Science & Technology, 2011, 45(19): 8328-8335. |
| [27] |
Li R Y, Stroud J L, Ma J F, et al. Mitigation of arsenic accumulation in rice with water management and silicon fertilization[J]. Environmental Science & Technology, 2009, 43(10): 3778-3783. |
| [28] |
Takahashi Y, Minamikawa R, Hattori K H, et al. Arsenic behavior in paddy fields during the cycle of flooded and non-flooded periods[J]. Environmental Science & Technology, 2004, 38(4): 1038-1044. |
| [29] |
Hua B, Yan W G, Wang J M, et al. Arsenic accumulation in rice grains:Effects of cultivars and water management practices[J]. Environmental Engineering Science, 2011, 28(8): 591-596. DOI:10.1089/ees.2010.0481 |
| [30] |
Yamaguchi N, Nakamura T, Dong D, et al. Arsenic release from flooded paddy soils is influenced by speciation, Eh, pH, and iron dissolution[J]. Chemosphere, 2011, 83(7): 925-932. DOI:10.1016/j.chemosphere.2011.02.044 |
| [31] |
Honma T, Ohba H, Kaneko-Kadokura A, et al. Optimal soil Eh, pH, and water management for simultaneously minimizing arsenic and cadmium concentrations in rice grains[J]. Environmental Science & Technology, 2016, 50(8): 4178-4185. |
| [32] |
Li H, Wu C, Ye Z H, et al. Uptake kinetics of different arsenic species in lowland and upland rice colonized with Glomus intraradices[J]. Journal of Hazardous Materials, 2011, 194(5): 414-421. |
| [33] |
Norton G J, Pinson S R M, Alexander J, et al. Variation in grain arsenic assessed in a diverse panel of rice(Oryza sativa)grown in multiple sites[J]. New Phytologist, 2012, 193(3): 650-664. DOI:10.1111/j.1469-8137.2011.03983.x |
| [34] |
Norton G J, Adomako E E, Deacon C M, et al. Effect of organic matter amendment, arsenic amendment and water management regime on rice grain arsenic species[J]. Environmental Pollution, 2013, 177(4): 38-47. |
| [35] |
Hu P, Ouyang Y, Wu L, et al. Effects of water management on arsenic and cadmium speciation and accumulation in an upland rice cultivar[J]. Journal of Environmental Sciences, 2015, 27(1): 225-231. |
| [36] |
Wu C, Huang L, Xue S G, et al. Oxic and anoxic conditions affect arsenic(As)accumulation and arsenite transporter expression in rice[J]. Chemosphere, 2017, 168: 969-975. DOI:10.1016/j.chemosphere.2016.10.114 |
| [37] |
Lee C H, Huang H H, Syu C H, et al. Increase of As release and phytotoxicity to rice seedlings in As-contaminated paddy soils by Si fertilizer application[J]. Journal of Hazardous Materials, 2014, 276(9): 253-261. |
| [38] |
Liu W J, Mcgrath S P, Zhao F J. Silicon has opposite effects on the accumulation of inorganic and methylated arsenic species in rice[J]. Plant & Soil, 2014, 376(1/2): 423-431. |
| [39] |
Fleck A T, Mattusch J, Schenk M K. Silicon decreases the arsenic level in rice grain by limiting arsenite transport[J]. Journal of Plant Nutrition and Soil Science, 2013, 176(5): 785-794. |
| [40] |
Bogdan K, Schenk M K. Arsenic in rice(Oryza sativa L.)related to dynamics of arsenic and silicic acid in paddy soils[J]. Environmental Science & Technology, 2008, 42(21): 7885-7890. |
| [41] |
Guo W, Zhu Y G, Liu W J, et al. Is the effect of silicon on rice uptake of arsenate(AsV) related to internal silicon concentrations, iron plaque and phosphate nutrition?[J]. Environmental Pollution, 2007, 148(1): 251-257. DOI:10.1016/j.envpol.2006.10.021 |
| [42] |
Ackermann J, Vetterlein D, Kuehn T, et al. Minerals controlling arsenic distribution in flood plain soils[J]. European Journal of Soil Science, 2010, 61(4): 588-598. DOI:10.1111/ejs.2010.61.issue-4 |
| [43] |
石荣, 贾永锋, 王承智. 土壤矿物质吸附砷的研究进展[J]. 土壤通报, 2007, 38(3): 584-589. SHI Rong, JIA Yong-feng, WANG Cheng-zhi. A review of arsenic adsorption onto mineral constitutions in the soft[J]. Chinese Journal of Soil Science, 2007, 38(3): 584-589. DOI:10.3321/j.issn:0564-3945.2007.03.035 |
| [44] |
Guo H M, Ren Y, Liu Q, et al. Enhancement of arsenic adsorption during mineral transformation from siderite to goethite:Mechanism and application[J]. Environmental Science & Technology, 2013, 47(2): 1009-1016. |
| [45] |
Yang C, Li S, Liu R, et al. Effect of reductive dissolution of iron(hydr) oxides on arsenic behavior in a water-sediment system:First release, then adsorption[J]. Ecological Engineering, 2015, 83: 176-183. DOI:10.1016/j.ecoleng.2015.06.018 |
| [46] |
Borch T, Kretzschmar R, Kappler A, et al. Biogeochemical redox processes and their impact on contaminant dynamics[J]. Environmental Science & Technology, 2010, 44(1): 15-23. |
| [47] |
Kappler A. Geomicrobiological cycling of iron[J]. Reviews in Mineralogy & Geochemistry, 2005, 59(1): 85-108. |
| [48] |
O'Loughlin E J, Gorski C A, Scherer M M, et al. Effects of oxyanions, natural organic matter, and bacterial cell numbers on the bioreduction of lepidocrocite(γ-FeOOH)and the formation of secondary mineralization[J]. Environmental Science & Technology, 2010, 12(44): 4570-4576. |
| [49] |
Laverman A M, Blum J S, Schaefer J K, et al. Growth of strain SES-3 with arsenate and other diverse electron acceptors[J]. Applied & Environmental Microbiology, 1995, 61(10): 3556-3561. |
| [50] |
Lovley D R, Holmes D E, Nevin K P. Dissimilatory Fe(Ⅲ)and Mn(Ⅳ)reduction[J]. Advances in Microbial Physiology, 2004, 49(2): 219-286. |
| [51] |
Yan B, Methé B A, Lovley D R, et al. Computational prediction of conserved operons and phylogenetic footprinting of transcription regulatory elements in the metal-reducing bacterial family Geobacteraceae[J]. Journal of Theoretical Biology, 2004, 230(1): 133-144. DOI:10.1016/j.jtbi.2004.04.022 |
| [52] |
Amstaetter K, Borch T, Larese-Casanova P, et al. Redox transformation of arsenic by Fe(Ⅱ)-activated goethite(α-FeOOH)[J]. Environmental Science & Technology, 2010, 44(1): 102-108. |
| [53] |
Hohmann C, Winkler E, Morin G, et al. Anaerobic Fe(Ⅱ)-oxidizing bacteria show as resistance and immobilize as during Fe(Ⅲ)mineral precipitation[J]. Environmental Science & Technology, 2010, 44(1): 94-101. |
| [54] |
Stroud J L, Norton G J, Islam M R, et al. The dynamics of arsenic in four paddy fields in the Bengal delta[J]. Environmental Pollution, 2011, 159(4): 947-953. DOI:10.1016/j.envpol.2010.12.016 |
| [55] |
Bennett W W, Teasdale P R, Panther J G, et al. Investigating arsenic speciation and mobilization in sediments with DGT and DET:A mesocosm evaluation of oxic-anoxic transitions[J]. Environmental Science & Technology, 2012, 46(7): 3981-3989. |
| [56] |
Jiang S H, Lee J H, Kim D H, et al. Differential arsenic mobilization from As-bearing ferrihydrite by iron-respiring Shewanella Strains with different arsenic-reducing activities[J]. Environmental Science & Technology, 2013, 47(15): 8616-8623. |
| [57] |
Thomasarrigo L K, Mikutta C, Lohmayer R, et al. Sulfidization of organic freshwater flocs from a minerotrophic peatland:speciation changes of iron, sulfur, and arsenic[J]. Environmental Science & Technology, 2016, 50(7): 3607-3616. |
| [58] |
Huang J H, Voegelin A, Pombo S A, et al. Influence of arsenate adsorption to ferrihydrite, goethite, and boehmite on the kinetics of arsenate reduction by Shewanella putrefaciens strain CN-32[J]. Environmental Science & Technology, 2011, 45(18): 7701-7709. |
| [59] |
Saalfield S L, Bostick B C. Changes in iron, sulfur, and arsenic speciation associated with bacterial sulfate reduction in ferrihydrite-rich systems[J]. Environmental Science & Technology, 2009, 43(23): 8787-8793. |
| [60] |
Kocar B D, Borch T, Fendorf S. Arsenic repartitioning during biogenic sulfidization and transformation of ferrihydrite[J]. Geochimica et Cosmochimica Acta, 2010, 74(3): 980-994. DOI:10.1016/j.gca.2009.10.023 |
| [61] |
汪明霞, 王娟, 司友斌. Shewanella oneidensis MR-1异化还原Fe(Ⅲ)介导的As(Ⅲ)氧化转化[J]. 中国环境科学, 2014, 34(9): 2368-2373. WANG Ming-xia, WANG Juan, SI You-bin. As(Ⅲ)oxidization coupled to Fe(Ⅲ)reduction by Shewanella oneidensis MR-1[J]. China Environmental Science, 2014, 34(9): 2368-2373. |
| [62] |
司友斌, 王娟. 异化铁还原对土壤中重金属形态转化及其有效性影响[J]. 环境科学, 2015, 39(9): 3533-3542. SI You-bin, WANG Juan. Influence of dissimilatory iron reduction on the speciation and bioavailability of heavy metals in soil[J]. Environmental Science, 2015, 39(9): 3533-3542. |
| [63] |
吴云当, 李芳柏, 刘同旭. 土壤微生物-腐殖质-矿物间的胞外电子传递机制研究进展[J]. 土壤学报, 2016, 53(2): 277-291. WU Yun-dang, LI Fang-bai, LIU Tong-xu. Mechanism of extracellular electron transfer among microbe-humus-mineral in soil:A review[J]. Acta Pedologica Sinica, 2016, 53(2): 277-291. |
| [64] |
Piepenbrock A, Schröder C, Kappler A. Electron transfer from humic substances to biogenic and abiogenic Fe(Ⅲ)oxyhydroxide minerals[J]. Environmental Science & Technology, 2014, 48(3): 1656-1664. |
| [65] |
Zhou G W, Yang X R, Li H, et al. Electron shuttles enhance anaerobic ammonium oxidation coupled to iron(Ⅲ)reduction[J]. Environmental Science & Technology, 2016, 50(17): 9298-9307. |
| [66] |
Chen Z, Wang Y P, Jiang X L, et al. Dual roles of AQDS as electron shuttles for microbes and dissolved organic matter involved in arsenic and iron mobilization in the arsenic-rich sediment[J]. Science of the Total Environment, 2017, 574: 1684-1694. DOI:10.1016/j.scitotenv.2016.09.006 |
| [67] |
Chen Z, Wang Y P, Xia D, et al. Enhanced bioreduction of iron and arsenic in sediment by biochar amendment influencing microbial community composition and dissolved organic matter content and composition[J]. Journal of Hazardous Materials, 2016, 311: 20-29. DOI:10.1016/j.jhazmat.2016.02.069 |
| [68] |
Yin D, Wang X, Chen C, et al. Varying effect of biochar on Cd, Pb and As mobility in a multi-metal contaminated paddy soil[J]. Chemosphere, 2016, 152: 196-206. DOI:10.1016/j.chemosphere.2016.01.044 |
| [69] |
Croal L R, Jiao Y Q, Newman D K. The fox operon from Rhodobacter strain SW2 promotes phototrophic Fe(Ⅱ)oxidation in Rhodobacter capsulatus SB1003[J]. Journal of Bacteriology, 2006, 189(5): 1774-1782. |
| [70] |
林超峰, 龚骏. 嗜中性微好氧铁氧化菌研究进展[J]. 生态学报, 2012, 32(18): 5889-5899. LIN Chao-feng, GONG Jun. Recent progress in research on neutrophilic, microaerophilic iron(Ⅱ)-oxidizing bacteria[J]. Acta Ecologica Sinica, 2012, 32(18): 5889-5899. |
| [71] |
Chen X P, Zhu Y G, Hong M N, et al. Effects of different forms of nitrogen fertilizers on arsenic uptake by rice plants[J]. Environmental Toxicology & Chemistry, 2008, 27(4): 881-887. |
| [72] |
王兆苏, 王新军, 陈学萍, 等. 微生物铁氧化作用对砷迁移转化的影响[J]. 环境科学学报, 2011, 31(2): 328-333. WANG Zhao-su, WANG Xin-jun, CHEN Xue-ping, et al. The effect of microbial iron oxidation on arsenic mobility and transformation[J]. Acta Scientiae Circumstantiae, 2011, 31(2): 328-333. |
| [73] |
Senn D B, Hemond H F. Nitrate controls on iron and arsenic in an Urban Lake[J]. Science, 2002, 296(5577): 2373-2376. DOI:10.1126/science.1072402 |
| [74] |
Okibe N, Koga M, Sasaki K, et al. Simultaneous oxidation and immobilization of arsenite from refinery waste water by thermoacidophilic iron-oxidizing archaeon, Acidianus brierleyi[J]. Minerals Engineering, 2013, 48(7): 126-134. |
| [75] |
黎俏文, 秦俊豪, 陈桂葵, 等. H2O2介导的Fenton反应对砷镉污染下水稻生物量的影响[J]. 农业环境科学学报, 2015, 34(7): 1233-1238. LI Qiao-wen, QIN Jun-hao, CHEN Gui-kui, et al. Effect of hydrogen peroxide induced Fenton reaction on biomass of rice in soil contaminated by Cd and As[J]. Journal of Agro-Environment Science, 2015, 34(7): 1233-1238. |
| [76] |
Qin J H, Li H S, Lin C X. Fenton process-affected transformation of roxarsone in paddy rice soils:Effects on plant growth and arsenic accumulation in rice grain[J]. Ecotoxicology and Environmental Safety, 2016, 130: 4-10. DOI:10.1016/j.ecoenv.2016.03.047 |
| [77] |
Qin J H, Li Y J, Feng M L, et al. Fenton reagent reduces the level of arsenic in paddy rice grain[J]. Geoderma, 2017, 307: 73-80. DOI:10.1016/j.geoderma.2017.07.039 |
 2019, Vol. 38
2019, Vol. 38