汞是环境中毒性最强的重金属元素之一,在自然界中以单质汞、无机汞和有机汞的形态存在[1]。自工业革命以来,随着人类对汞的大量使用和排放,汞污染带来的生态环境和人体健康危害引发了广泛的社会关注,其中以日本的水俣病最为著名。汞具有持久性、迁移性、高毒性和生物累积性,其污染的严重性和复杂性在某些方面超过了持久性有机污染物[1]。为保护人类与环境免受汞及其化合物人为排放和释放造成的危害,国际社会达成并签署了具有全球法律约束力的《关于汞的水俣公约》,并已于2017年8月16日生效[2]。尽管该公约将通过控制和削减全球人为汞排放和含汞产品的使用来降低环境汞污染,但全球汞污染的现状在短期内不会出现根本性的改善。
汞可以通过呼吸道、消化道和皮肤进入人体,在体内积累至一定量时会对人体造成危害,导致汞中毒[3]。汞的不同形态之间毒性相差很大:无机汞的毒性相对较弱,而无机汞转化成的甲基汞具有高神经毒性、致癌性、心血管毒性、生殖毒性、免疫系统效应和肾脏毒性等,能给人体健康带来严重危害[4]。
通常认为非职业接触人群的甲基汞暴露主要来自于日常摄食的海产品,但近期有研究表明摄食大米很可能是东南亚国家内陆居民甲基汞暴露的一个重要途径[5-7]。由于甲基汞的生物放大效应,其在水生生物(如鱼和贝类)体内具有很高的富集[5-6, 8]。有些植物(如苔藓)具有富集汞的能力,而水稻也具有很强的甲基汞富集能力。例如Feng等[9]发现我国贵州汞矿区的大米中具有高含量的总汞和甲基汞,其中甲基汞含量高达180 ng·g-1,摄食大米是当地居民甲基汞暴露的重要途径。全球90%的稻米产自亚洲,而我国作为世界稻作的起源地,有近三分之二的人口以稻米为主食[10]。与此同时,我国是世界上最大的汞生产国、使用国和排放国,长期大规模的涉汞工矿业活动,如汞冶炼、混汞采金、铅锌冶炼以及氯碱生产等,在局部地区造成了严重的汞污染问题[11]。因此,摄食汞污染地区产出的大米有可能给居民带来潜在健康风险。
国内外学者已对文献中报道的全球各地大米汞污染情况、检测方法及人群通过食物摄入的甲基汞暴露情况进行了总结。例如,Li等[12]对比总结了我国人群通过摄食鱼和大米的甲基汞暴露情况,Rothenberg等[13]对1980—2013年间全球范围内大米汞污染情况及检测方法进行了总结,并对大米中汞的来源机理进行了分析汇总。本文针对全球范围内关于大米汞污染、包括大米在内的食品中汞含量分析及人群摄食大米汞暴露的研究进行了归纳总结,更新了最新的测定数据、检测方法及研究进展,旨在分析目前大米汞污染情况的基础上,明确摄食大米是否是污染区域人群甲基汞暴露的重要途径,是否构成严重的健康风险。此外,还展望了未来需要针对性加强研究的重要问题,以期为评估摄食大米对人类健康的影响、粮食安全等提供科学依据。
1 汞污染的来源汞污染的来源主要有自然来源和人为来源,除去近百年在土壤、海洋中已存在的汞的“再排放”,人为来源排放贡献大[14]。天然环境介质如岩石、土壤和水体及底泥中均存在汞,其多以矿物形式存在于自然界中,如常见的硫化汞矿、氯硫汞矿等,而水体及底泥中通常存在有机形态的含汞化合物(如甲基汞)[15]。火山喷发、森林大火、岩石风化、海水蒸发等都是大气中汞的重要自然来源,汞矿及含汞温泉是周边区域土壤、水体的天然汞污染源[15]。联合国环境规划署(United Nations Environment Programme,UNEP)在2018年发布的《全球汞评估报告》中指出,2015年全球大气汞中仅有约10%为自然来源[14]。
人为源排放的汞主要以蒸气形式进入大气,近年来各国虽然对汞的人为排放进行了控制,但2015年全球人为源向大气中排放汞的总量仍比2010年增长了20%[14]。相较于农业和生活活动,工业生产是汞的最主要人为排放源。化石燃料及生物质燃烧的汞排放量约占全球人为排放总量的24%,其中燃煤占21%;而矿石开采冶炼及采金、垃圾焚烧等相关工业活动的汞排放量也不容忽视,其中2015年全球民间开采及小规模采金等不规范工业活动所产生的废物、废水共向陆地及淡水环境排放了约1220 t汞[14]。农业生产中含汞肥料(如磷肥的平均汞含量可达0.25 mg·kg-1)和农药的不合理施用、污水灌溉都能导致土壤汞污染[15]。与商业和日常生活相关的活动所涉及的含汞产品(如荧光灯、体温计等)废弃后在处理处置过程也不可避免地会向环境中释放汞[15]。
汞在常温下可蒸发,而以蒸气形态存在的汞在大气中非常稳定。汞可在全球范围内随大气环流进行传输,因此《全球汞评估报告》将其列为全球性污染物[2, 14]。全球汞循环模型显示,北美洲地区汞的主要外源是大气传输带来的东南亚地区的排放,而欧洲、东南亚和印度次大陆排放的汞是非洲汞污染的主要贡献源[14]。有研究发现,北极地区汞污染情况正在加剧,永冻土中汞含量远高于地球上其他地区,已经成为全球汞的“汇” [16],这一问题是由北美、北欧等地区排放的气态及颗粒态汞经大气传输后在北极的干、湿沉降所导致的[17]。有研究表明,新沉降汞的二次释放也是大气汞的重要来源[18]。Zhu等[19]发现,由于人为汞的排放和大气汞的沉降,人为汞污染源(如冶炼厂、氯碱厂、发电厂等)附近的土壤通常呈现较高的汞含量,而土壤汞通量、汞净沉降量的计算结果表明,一部分新沉降的汞可以迅速重新释放回到大气中。截至目前,受人类活动影响的地表汞源和汇的特征尚未得到充分验证,还需进一步开展研究。此外,汞在土壤中发生生物、非生物还原后,通过挥发也可以释放进入大气[18]。Eckley等[20]的研究发现新沉降到极地地区土壤、水生系统和积雪中的大气汞很容易转化为汞蒸气重新释放,加速了汞的全球循环。汞在生物地球化学循环过程中可以通过埋藏在深海、湖泊沉积物和地下土壤中而与生物圈隔离,但这些过程通常需要几个世纪甚至更长的时间,这也说明了汞污染具有持久性,很难治理消除[14]。
2 甲基汞的人体健康危害以蒸气形态存在的单质汞可以通过呼吸道进入人体,被吸收后生物利用率接近100%,在肝、肾及大脑等部位富集[3]。汞具有很强的神经毒性,长期暴露在高汞环境中可能造成脑损伤甚至死亡[21]。甲基汞是毒性最强的汞形态之一,其进入人体的主要途径为含甲基汞食物(如鱼类、大米等)的摄食[12]。有确凿证据表明甲基汞暴露可导致成年男性患上心血管疾病(尤其是急性心肌梗死)[22-23]。虽然甲基汞在人体内转化为无机汞后主要存在于肝脏、肾脏中,但目前对于人体甲基汞暴露后的肾脏毒性、免疫系统损害方面的研究报道较少。
大脑是甲基汞的主要靶组织,甲基汞可穿过血脑屏障,造成人体神经系统的严重损伤[4]。据世界卫生组织(World Health Organization,WHO)报道,高甲基汞暴露情况下(血汞浓度达到200 μg·L-1),5%的成人会出现神经系统紊乱症状[4]。慢性低剂量甲基汞的暴露同样可以对成人神经系统造成影响,导致运动、视觉及认知功能缺陷[24]。Feitosa-Santana等[25]针对亚马逊中部地区未与汞污染源直接接触的当地人群开展的研究发现,长期暴露于低水平甲基汞的亚马逊河边居民的神经系统遭到损伤,主要体现在视觉障碍,例如亮度对比敏感度丧失、视野受限和色觉缺陷。由此可见,不仅高甲基汞暴露,长期低剂量甲基汞暴露同样可能导致人群神经性疾病。值得指出的是虽然甲基汞具有很强的神经毒性,但人群甲基汞暴露导致神经学变化的临床证据仍然缺失,存在争议[26]。Puty等[26]通过系统梳理近十年的相关文献,考察了地方性甲基汞中毒风险区域人群神经系统的改变与环境甲基汞暴露之间的关系,发现从方法学角度只能得出甲基汞可能会对暴露人群的神经功能造成损伤的结论,主要体现在心理感觉系统和运动协调系统的相关改变,包括运动共济失调、听力损失、视力障碍、情绪改变和智商降低。因此,甲基汞暴露对人类神经系统的影响仍需要开展深入系统的研究。
甲基汞还可通过胎盘屏障、乳汁喂养向胎儿传递,母亲体内甲基汞含量高时会导致不孕不育、流产或死产[21]。在低剂量甲基汞暴露的情况下,即使母亲当下没有表现出甲基汞中毒的症状,但甲基汞通过母体的传递,胎儿长大以后也可能出现神经性疾病,如妊娠期高鱼类摄入量的母亲所生的女婴出现反射不对称情况增加[27]。Prpić等[28]的研究表明,母亲在产前暴露低剂量的甲基汞对婴儿精细动作技能的损害在婴儿18个月时显现,并推断这是由于婴儿小脑及其功能受母亲产前低水平甲基汞暴露的影响所导致。母亲在妊娠期或哺乳期共同暴露于低剂量甲基汞和其他环境神经毒性化合物时会存在联合效应,可能增加婴儿患神经性疾病的风险,导致婴儿期出现抽搐及其他发育障碍,但目前尚无法对其进行预测[29]。整体而言,为了保护儿童的健康,对于母亲和儿童来说,即使是低剂量的甲基汞暴露(如摄食)也有必要进行控制。
3 水稻对甲基汞的吸收和累积进入环境中的汞可以通过在大气、土壤和水体中的一系列迁移转化过程,进入食物网而对人类健康带来潜在危害。采矿、冶炼工业活动排入大气中的汞可被传输至世界各地,最终沉降到土壤、水体或植物上;随工业废水排入水体中的汞可以再次挥发到大气中,或再发生迁移转运并被水生动植物吸收而进入食物网;含汞肥料施用导致汞直接进入土壤,土壤中的汞可被降水冲淋随地表径流进入水体,或向下渗透进入地下水中,或被植物(如水稻、蔬菜等)吸收进入食物网[30-31]。
水稻在种植过程中的周期性灌水淹育和排水疏干使得稻田土壤中交替发生还原与氧化反应,对汞的形态转化和植物吸收产生潜在的重要影响。在微生物作用下,土壤中的无机汞(即Hg2+)可通过厌氧微生物(硫酸盐还原菌、铁还原菌等)的甲基化作用转化为毒性更强的甲基汞、二甲基汞,进而被植物吸收、累积[9]。如图 1所示,在水稻生长的淹水阶段,上层为静水层,间隔含氧水-土界面下为缺氧土壤层,这为具有汞甲基化能力的厌氧微生物提供了很好的生存环境,具有很高的汞甲基化潜力[32-33]。土壤中Hg2+的甲基化受生物因素(如厌氧微生物的活性)和非生物因素(如汞的生物可利用性、土壤中有机质、含铁矿物、硫化物等的含量、pH)影响。通常情况下土壤中生物可利用的汞形态(Hg2+和HgS)占比不高。大量研究表明土壤中的活性Hg2+易被甲基化微生物利用。Tomas等[34]的最新研究提出了甲基化微生物吸收Hg2+的两种潜在机制:(1)中性HgS的被动扩散,尤其是纳米尺寸的HgS更易被吸收;(2)微生物通过主动运输摄取Hg2+。有研究表明,相比溶解性有机质结合形成的HgS颗粒,纳米尺寸的HgS颗粒在土壤中扩散速度快,被甲基化微生物利用的可能性更大[35-36]。纳米HgS聚合会进一步生成惰性的HgS,导致微生物甲基化活性显著降解,因此第二种机制才是甲基化微生物吸收Hg2+的主要途径[9, 13, 32]。
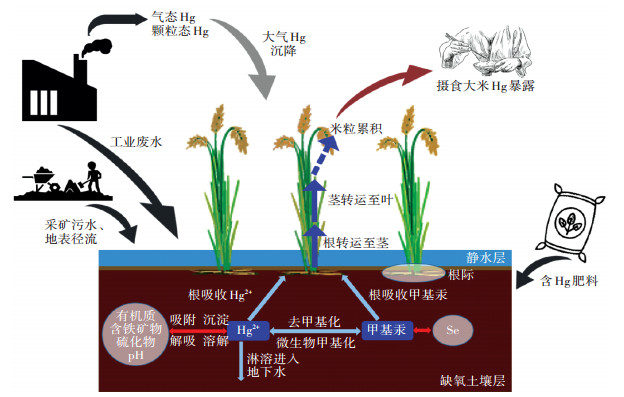
|
图 1 水稻田中汞的人为来源、汞循环及水稻中汞的吸收、转运和累积过程示意图 Figure 1 Schematic illustration on anthropogenic sources of mercury in paddy field, cycling of mercury in paddy soil, and the uptake, translocation, and bioaccumulation of mercury in rice plants |
微生物的活性直接影响Hg2+甲基化过程,而土壤中有机质、含铁矿物的含量高时可显著吸附Hg2+,同时硫化物可与Hg2+生成HgS沉淀,这些过程均可降低Hg2+的生物有效性,进而减少可被水稻吸收的Hg2+及甲基汞[37-39]。Haitzer等[40]的研究表明,高pH条件下Hg2+的生物有效性降低,导致土壤中水稻可吸收的Hg2+及甲基汞含量减少。Zhao等[41]最近的研究显示,在低pH条件下新沉降至土壤表层的大气汞的量与土壤中甲基汞含量呈显著正相关。Meng等[37]和Hintel⁃ mann等[42]均认为相较于其他来源途径的Hg2+,大气沉降至土壤中的Hg2+更容易被微生物利用进而形成甲基汞。除上述因素之外,水稻对土壤中甲基汞的吸收也受到土壤中其他共存元素的影响,如硒可与甲基汞结合形成硒-甲基汞化合物,从而减少可被水稻吸收的甲基汞[43]。Tomiyasu等[44]的研究发现有机质分解对土壤中甲基汞的形成有一定影响,由落叶携带的汞会随其飘落至土壤表面,而落叶的分解会导致汞吸附于土壤中,进而增加土壤中可被生物利用的汞含量。
在汞甲基化的同时,土壤环境中还存在甲基汞的去甲基化过程,主要包括生物去甲基化作用和非生物去甲基化作用(即光脱甲基化作用)[33, 45]。生物去甲基化作用包括还原去甲基化和氧化去甲基化两种途径。前者依赖于土壤中的耐汞细菌,其通常存在于汞污染地区,可将甲基汞还原为Hg2+或Hg0,是自然界中主要的去甲基化途径;而后者则与甲基化微生物(如硫酸盐还原菌、产甲烷菌等部分厌氧微生物)有关,其可将甲基汞还原为Hg2+,在这种情况下,甲基化作用和去甲基汞作用同时进行,表现为甲基汞净产率[45]。非生物去甲基化作用(即光脱甲基化过程)在周期性淹水的稻田环境中不容忽视。有研究表明,夏季时紫外线强,淹水环境中光脱甲基化率高,但在这一过程中水稻的快速生长和增加的叶面积限制了甲基汞从土壤孔隙水中向地表水的扩散,从而将甲基汞限制在土壤中,且甲基汞进入水稻后不再受到光辐照,水稻中光脱甲基化率相应降低[33]。因此,虽然淹水环境中光脱甲基化率升高,但稻田、水稻中甲基汞净含量仍呈现上升趋势,这也可能与厌氧微生物在淹水阶段强活性所导致的甲基化作用增强等因素有关。尽管近几年对土壤中汞的甲基化、去甲基化的认识取得了一些进展,但仍未能阐明相关过程的具体机理,尤其是同时发生的多个过程间的相互影响。
现有研究认为,挥发性大且溶解性强的汞化合物易通过根际被植物吸收,因此甲基汞在水稻中的迁移能力强于无机汞。部分学者认为水稻中甲基汞的唯一来源是水稻对土壤中甲基汞的吸收,且水稻不同器官对于甲基汞的累积能力不同,但也有学者认为大气直接沉降至水稻上的汞也是重要的贡献源[37, 46]。Yin等[46]的研究显示,水稻植株中的汞不仅来源于土壤,大气汞的贡献也不可忽视,原因是气态单质汞具有亲脂性,可以直接通过气孔进入叶片组织后,经过角质层扩散到达水稻根部,进而转运至茎、籽粒中累积。大气汞在水稻各部位的贡献占比呈现叶>茎>籽粒>根的递减趋势,其中叶片中汞的主要来源为大气,根部汞的主要来源为土壤,而茎、籽粒中的汞受双源控制。目前大气汞进入水稻后在植株体内的转运和转化机制(如何转化为甲基汞)仍存在争议,还有待进一步研究。Meng等[37]和Ogawa等[47]的研究发现,水稻主要通过根来吸收土壤中的甲基汞:未结穗阶段,甲基汞在水稻的根、茎中与蛋白质结合而累积;结穗直至完全成熟阶段,根、茎中甲基汞的含量出现下降,而籽粒中甲基汞的含量迅速增加,且超过根、茎,说明甲基汞由根、茎转运至籽粒中并进行累积,并与钾、磷等营养物质的转运同步。也有学者发现水稻籽粒中甲基汞以甲基汞-L-半胱氨酸的形态存在,但具体转运机理尚不明晰[48]。另外,不同基因型的水稻籽粒累积甲基汞的能力也不同,Rothenberg等[39]针对贵州大米的研究表明,去壳籽粒中甲基汞含量与水稻基因型有显著相关性,而带壳籽粒不存在这一现象,同时无机汞的累积也并不表现出这一趋势,说明水稻中存在控制甲基汞从米壳向籽粒转运过程的基因,但机理尚不明确。甲基汞如何通过根、茎转运至水稻籽粒中,如何在籽粒中发生累积仍有待进一步的探究。
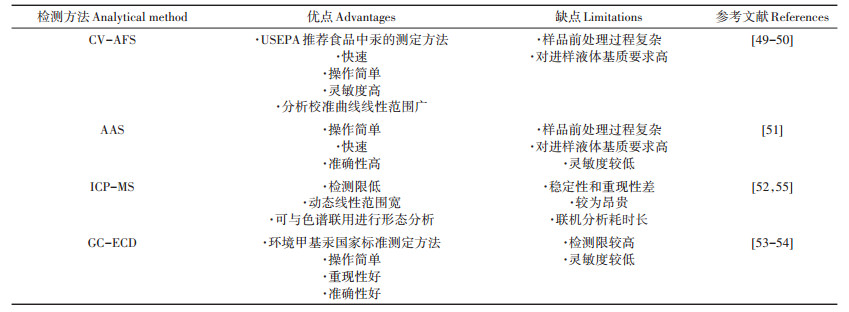
4 食品(含大米)中汞形态的分析方法因为不同形态的汞化合物毒性差异很大,因此在评估包括大米在内的食品中汞的健康风险时不仅需要测定其总量,还要分析其赋存形态。高灵敏度的形态分析方法对于测定大米等食品样品中汞的含量是非常必要的。目前针对食品中总汞、甲基汞的检测方法主要包括:冷原子荧光光谱法(Cold vapor-atomic absorption spectrometry,CV-AFS)、原子吸收光谱法(Atomic absorption spectrophotometry,AAS)、电感耦合等离子体质谱法(Inductively coupled-mass spectrometry,ICP-MS)、气相色谱电子捕获法(Gas chromatography-electron capture detector,GC-ECD)等[49-55]。这些方法在汞检测中的优缺点参见表 1。
|
|
表 1 不同分析方法应用于汞检测的优缺点 Table 1 Advantages and limitations of different analytical methods in the measurement of mercury |
早年多采用传统方法如气相色谱法、光谱法等对食品中汞形态进行检测。我国早期对环境水体中甲基汞测定的标准方法为GC-ECD[53]。原子光谱法如AAS以及在AFS基础上发展而来的CV-AFS,是美国环境保护署(United States Environmental Protection Agency,USEPA)对环境样品、食品中汞形态分析采用的标准检测方法[50]。单独使用AAS进行测定时方法检测限较高,相比之下CV-AFS由于不点火而直接在液态样品中将汞离子还原为基态汞原子蒸气,样品损失少,检测限显著降低,加之使用成本较低,已经发展成为大米中总汞、甲基汞含量检测应用最广泛的方法[51]。
近年来针对食品中汞形态分析的色谱与质谱联用方法取得了巨大进步,结合色谱的强分离能力和质谱的高灵敏度、高选择性,这类方法可以很好地将各形态汞分离后准确测定。ICP-MS作为痕量元素分析的通用方法,其检测限低、动态线性范围宽和多元素同位素信号同步测定的特点使其在测定生物样品中的总汞、甲基汞含量方面具有明显优势[52]。值得注意的是,由于汞的挥发性导致其容易吸附在仪器管路上造成污染,存在样品损耗,导致测定准确性和重现性较差。ICP-MS与色谱[如高效液相色谱(High performance liquid chromatography,HPLC)、反相色谱(Reversed phase chromatography,RPC)、GC]联用后能够很好地分离各形态的汞(如Hg2+、甲基汞、乙基汞),方法灵敏度和准确性均有所提高[55]。在HPLC-ICP-MS分析中通常向流动相中添加含巯基的化合物(如2-巯基乙醇、3-巯基-1-丙磺酸钠盐、L-半胱氨酸等),使不同形态的汞与其配位形成离子态的汞-巯基络合物,这些络合物的极性存在一定的差异,导致在反相C18柱上呈现出不同的保留时间,达到各形态汞分离的目的[56]。Jagtap等[56]运用HPLC-ICP-MS分析鱼肉组织中的Hg2+和甲基汞,选择加入0.1%(m/V)2-巯基乙醇或L-半胱氨酸、60 mmol·L-1醋酸胺的5%甲醇作为流动相,使用C18柱(250 mm×4.6 mm,5 μm)实现了Hg2+、甲基汞的高效分离。Cheng等[57]建立了离子对RPC-ICP-MS快速测定鱼肉样品中Hg2+、甲基汞、乙基汞的分析方法,采用两种流动相:(1)2.0 mmol·L-1 L-半胱氨酸、2.0 mmol·L-1十二烷基苯磺酸钠和1.0 mmol·L-1苯丙氨酸(pH 3.0);(2)2.0 mmol·L-1 3-巯基-1-丙磺酸钠盐、4.0 mmol·L-1四丁基氢氧化铵和1.0 mmol·L-1苯丙氨酸(pH 6.0),使用C18柱(12.5 mm×2.1 mm,5 μm),均实现了各形态汞的分离。目前大部分联机分析方法存在的一个主要缺点为色谱分离时间长、成本高、不利于大批量食品样品的日常测定。
食品中汞元素测定通常采用USEPA推荐的Method 7474,利用硝酸对食品进行消解后使用CVAFS法测定[50]。现有的大多数检测方法无法对汞形态直接进行测定,需要通过前处理将样品中的甲基汞萃取分离后方可测定。国内外学者对于食品中甲基汞的测定已有一定研究,目前对于甲基汞的萃取分离方法主要有溶液浸提、微波辅助萃取等。溶液浸提主要包括酸浸取和碱浸取,并通常辅以有机溶剂进行萃取。食品中富含氨基酸、蛋白质等,这些物质中的巯基容易与甲基汞结合形成络合物,因此需要通过氢卤酸(如盐酸、氢氟酸)将甲基汞从食品基质中释放出来,然后溶解于甲苯、二氯甲烷等有机溶剂中。Huang等[58]运用盐酸浸提的方法从鱼肉样品中提取甲基汞,回收率高达98%。Liang等[59]建立了针对环境和生物样品中甲基汞的溶剂浸提方法:25%(m/V)氢氧化钾-甲醇在75 ℃下水浴3 h消解样品,加入盐酸调节pH后再加入二氯甲烷振荡离心萃取样品中的甲基汞并分离各相,取有机相加入蒸馏水在60~70 ℃下加热气化二氯甲烷并氮吹实现甲基汞反萃取,最后用四乙基硼酸钠乙基化进行测定。该方法具有较好的样品加标回收率(80.2%~111%),已经被应用于大米甲基汞含量的测定[60-61]。溶液浸提方法所用的试剂量较大,且一般耗时长,不适合样品快速测定,但作为广泛认可的传统方法,其回收率高、应用范围广。除了采用酸溶液或碱溶液浸提外,近期还发展了采用生物酶破坏样品组织后进行萃取的新方法。Jagtap等[56]先使用蛋白酶破坏鱼肉组织再采用L-半胱氨酸萃取甲基汞,Coufalík等[62]运用纤维素酶水解植物样品后加入6 mol·L-1盐酸-醋酸钠提取植物样品中的甲基汞,都取得了比较理想的提取效果。
微波辅助萃取主要是借助有机溶剂(如甲苯、二氯甲烷)在密闭容器中利用微波能量,快速均匀加热溶剂,在高温高压条件下将甲基汞从样品基质中萃取出来。Luo等[63]利用甲苯-30%盐酸在110 ℃下对大米中甲基汞进行微波萃取,然后使用0.15%(m/V)L-半胱氨酸萃取有机相实现甲基汞的反萃取。微波辅助萃取的方法目前在大米甲基汞前处理过程中已经得到初步应用,具有速度快、操作简单、耗时短、节省试剂等优点[63]。
因不存在食物链生物放大情况,大米中总汞、甲基汞的含量要远低于鱼类,因此,检测大米中汞形态对分析方法灵敏度要求更高[64]。随着技术进步,汞形态分析方法不断完善,检出限由早年的100 ng·g-1逐渐优化至5 ng·g-1,现如今基本可达到0.01 ng·g-1,使得大米汞含量测定结果更加准确[13]。
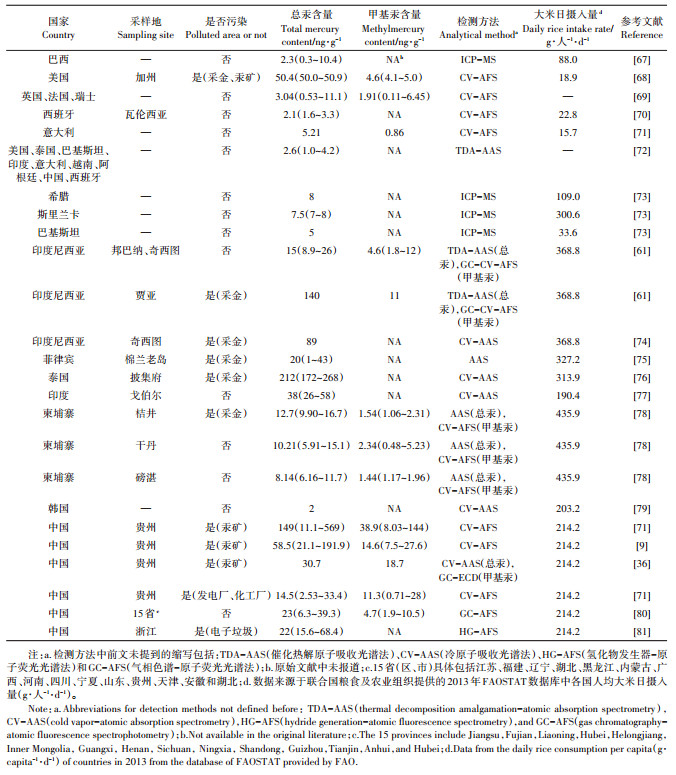
5 全球大米汞污染现状表 2总结了全球18个水稻种植国家(美国、巴西、阿根廷、英国、法国、瑞士、西班牙、意大利、斯里兰卡、巴基斯坦、越南、印度尼西亚、菲律宾、泰国、印度、柬埔寨、韩国和中国)大米的汞污染情况,以及相关的产地、检测方法与人群大米日摄入量(g·人-1·d-1)信息。从表 2数据可以看出,受污染地区采集的大米中总汞、甲基汞含量明显高于未受污染地区的大米(Wilcoxon test,P < 0.05)。相比电子垃圾污染、发电厂及化工厂污染,汞矿开采和采金活动所造成的大米汞污染情况更为严重,这一结果与不同汞污染源贡献程度一致。污染地区产出的大米中无机汞、甲基汞主要来源于水稻根际吸收土壤中的无机汞、甲基汞,而土壤中的无机汞、甲基汞污染存在两种途径:首先是汞矿开采或土法采金释放到大气中的汞通过干、湿沉降回到附近稻田;其次是含汞工业废水对稻田的灌溉[37]。稻田周期性的淹水为厌氧甲基化微生物提供了丰富的有机碳源,因此土壤中的Hg2+极易通过微生物甲基化作用转化为甲基汞,而水稻籽粒对于甲基汞的吸收富集能力强于其他部位,因此导致大米的汞污染[37]。基于上述结果和分析,可以认为大米的汞污染是一个相对局部的问题,更多依赖于附近的污染源,因此针对特定汞污染场地进行清理修复有望消除严重汞污染的稻米。
|
|
表 2 文献报道的全球大米中总汞、甲基汞的含量与相应的检测方法,以及该国家/地区居民的平均大米日摄入量 Table 2 Summary of the contents of total mercury and methylmercury in rice worldwide, and the analytical methods used, along with the daily rice intake rates in the corresponding countries/regions |
综合表 2中成对的总汞-甲基汞数据可以发现,大米中总汞与甲基汞含量呈正相关(Pearson's chisquared test,P=0.898),但也有出现大米样品中总汞含量高但甲基汞含量不高的情况,说明大米中汞的甲基化和生物积累取决于很多因素,但目前机理尚不明晰,究竟是土壤因子还是水稻基因型起决定作用还有待深入研究[38-39, 42, 65]。
根据联合国粮农组织(Food and Agriculture Organization,FAO)提供的2013年各国人均大米日摄入量数据,目前包括缅甸(363.8 g·人-1·d-1)、越南(396.0 g·人-1·d-1)、老挝(435.9 g·人-1·d-1)、孟加拉(470.5 g·人-1·d-1)等东南亚国家人均大米日摄入量非常高,但关于这些国家大米总汞、甲基汞含量的报道数据匮乏,应加强对当地大米汞污染情况的检测研究[66]。
6 摄食大米导致的甲基汞暴露健康风险目前广泛认为沿海地区居民的甲基汞暴露主要来自于摄食的海产品,但作为主粮摄食的大米很可能是内陆地区人群甲基汞暴露的一个重要途径[6, 8-9]。全球接近一半的人口,包括几乎整个东亚和东南亚的人口,都以大米为主粮[66]。因此,考察不同地区居民摄食大米的甲基汞暴露情况及评估相应的健康风险非常必要。
现有研究主要采用人群总汞或甲基汞每日可能摄入量(Probable daily intake,PDI,μg·kg-1·d-1)作为评估人群摄食大米总汞、甲基汞暴露健康风险的指标,对大米摄食所带来的总汞、甲基汞PDI进行估计时,大多假定成人体重为60 kg,根据各国相应的人均大米摄入量(g·人-1·d-1)数据进行计算[49, 69-70]。国际上已经提出人群每日允许总汞、甲基汞摄入量限值:USEPA提出的甲基汞参考剂量(Reference dose,RfD)为0.10 μg·kg-1·d-1;食品添加剂联合专家委员会(Joint FAO/WHO Expert Committee on Food Additives,JECFA)提出的甲基汞每周允许摄入量(Provisional tolerable weekly intake,PTWI)为1.6 μg·kg-1bw,换算为每日允许摄入量为0.23 μg·kg-1·d-1;美国加州环境健康危害评估办公室(Office of Environmental Health Hazard Assessment,OEHHA)建议总汞的RfD值为0.10 μg·kg-1·d-1[82-84]。
2003年Horvat等[71]首x次发现我国贵州汞矿区的大米中具有高含量的总汞和甲基汞,大米中甲基汞含量高达144 ng·g-1,加之贵州省居民大米日摄入量高,研究得出大米是矿区人群暴露甲基汞的重要途径,当地居民摄食大米会有一定健康风险的结论。冯新斌团队测定并估算了贵州清镇、万山汞矿区摄食大米的成人甲基汞暴露量,发现清镇居民的甲基汞PDI最大值为0.19 μg·kg-1·d-1,超过USEPA提出的0.10 μg·kg-1·d-1限值,但低于JECFA建议的0.23 μg·kg-1·d-1限值,而万山居民甲基汞PDI超标情况严重,最高达到1.74 μg·kg-1·d-1,说明汞矿区大米的摄食给当地居民带来了严重的健康威胁[9]。Qiu等[85]和Li等[86]对广东吴川汞矿区人群大米甲基汞暴露的研究结果与贵州汞矿区情况相似,成人甲基汞PDI范围分别为0.04~0.18 μg·kg-1·d-1和0.03~0.12 μg·kg-1·d-1,均出现了超标情况。因此可以确定,对于我国南方内陆汞矿区人群来说,相较于摄食鱼类,摄食大米是甲基汞更重要的暴露途径。
非污染地区大米摄食是否会对人群健康产生危害仍存在争议,近年来有许多研究对非矿区种植的大米进行了居民甲基汞暴露情况分析。Shi等[80]计算出中国15省大米的成人甲基汞PDI值为0.02~0.11 μg·kg-1·d-1,基本不超过USEPA限值。Zhang等[87]在我国天津开展的研究结果表明,当地成人摄食污水灌溉区域产出大米的甲基汞PDI为0.009 5~0.49 μg·kg-1bw,远低于JECFA提出的1.6 μg·kg-1bw PTWI,而由于天津为沿海城市,摄食鱼类对于当地人群甲基汞暴露贡献更大。Lin等[72]在加拿大的研究数据显示,摄食大米的成人总汞PDI为0.006 μg·kg-1bw,远低于OEHHA提出的总汞RfD值(0.10 μg·kg-1·d-1)。Zhao等[88]2019年针对中国15省大米的最新研究也表明,成人甲基汞PDI范围为0.001 2~0.013 μg·kg-1·d-1,远低于EPA及JECFA的限值。综合以上结果可以认为,非污染地区人群摄食大米的甲基汞暴露健康风险较小,大米对沿海地区人群的总汞暴露贡献远低于海产品。
国际上已有部分对亚洲高大米摄入量的国家(如印度尼西亚、柬埔寨)采金矿区及邻近地区人群大米甲基汞暴露情况的研究报道。印度尼西亚奇西图、贾亚采金矿区中的大米有很高的总汞、甲基汞含量,奇西图矿区成人总汞PDI在0.35~6.02 μg·kg-1bw,远超OEHHA限值,而矿区邻近村落如邦巴纳的大米中同样有较高的甲基汞含量,摄食大米的当地居民存在显著的甲基汞暴露健康风险[61, 74]。Cheng等[78]在柬埔寨的研究数据显示,桔井采金矿区及邻近省份磅湛、干丹成人摄食大米带来的甲基汞PDI为0.02、0.03、0.04 μg·kg-1·d-1,未出现超标情况,但由于当地其他食品(尤其是鱼类)的摄食导致当地人群饮食甲基汞PDI超标;同时,因为磅湛、干丹居民大米日摄入量要高于桔井居民,导致出现采金矿区成人摄食大米带来的甲基汞PDI反而低的情况。考虑不同地区居民膳食结构的差异,加之汞的大气传输能力,在大米摄食量较高的亚洲国家中,邻近汞矿区或混汞采金区域的人群通过摄食大米的甲基汞暴露同样值得密切关注。
值得指出的是,目前大多数研究中未将儿童、孕妇这两类敏感人群单独考虑,针对儿童、孕妇摄食大米甲基汞暴露健康风险的报道十分有限。2017年Brombach等[69]考察了英国、法国和瑞士居民摄食当地种植大米的甲基汞暴露情况,研究中采用大米日摄入量400 g·d-1,居民成人体重65 kg进行计算,发现全部87份样品中的甲基汞含量均不会使成人在正常摄食情况下出现PDI超出限值的情况。该研究还对1岁儿童的可能暴露情况进行了模拟计算,发现作为敏感人群,虽然甲基汞的PDI未超标,但远高于成人。由于儿童相比成人更加容易受到甲基汞的危害,其通过摄食大米的甲基汞暴露应该引起重视。
7 总结与展望国内外已经开展的相对有限的研究表明摄食大米是人群无机汞、甲基汞暴露的途径之一,尤其对于大米摄食量大的东亚和东南亚的内陆居民,摄食汞污染的大米可以带来显著的健康风险。目前针对大米中总汞、甲基汞的检测方法逐渐成熟,国际上已建立了准确可靠的测定方法。不同地区大米中总汞、甲基汞含量有很大差异,已知与外界污染、土壤性质和水稻基因型有关,但大米中甲基汞的含量与汞污染源以及水稻中无机汞含量之间的关系尚不明晰。总体而言,非污染地区人群正常摄食大米基本不存在甲基汞暴露健康风险,而摄食污染严重地区产出的大米可给当地居民带来严重的健康风险。
大米是发展中国家,尤其是东亚和东南亚地区国家居民最主要的粮食作物,而因为工业活动导致的汞污染在这些国家也较为普遍。因此,开展广泛的大米汞污染调查与相应的人群摄食暴露健康风险评估工作,以及水稻对环境中汞吸收、转运和累积的机制研究非常必要。具体而言,未来应着重开展以下4个方面的工作:
(1)目前缺乏对全球大米汞污染状况的调查数据,需要获取更多来自高大米摄入量地区,如我国南方以及世界其他主要水稻种植区的大米汞含量数据。同时应注重对各地区人群,包括孕妇、儿童两类敏感人群摄食大米甲基汞暴露健康风险的评估,为认识大米汞污染的公众健康风险提供可靠依据。
(2)不同于鱼类,大米中总汞含量较低,同时甲基汞/总汞比例也相对较低,但其摄入量非常高。同时,大米与鱼类相比所含营养物质少,大米中的甲基汞进入人体内的消化、吸收、代谢过程与摄食鱼类有很大不同。因此,需要深入开展人体摄食大米后甲基汞暴露的机制研究。
(3)目前大米中无机汞、甲基汞的主要污染源存在争议,主要集中在大气中汞直接干、湿沉降及污染土壤中汞通过根际传输两种说法。同时,水稻生长过程中无机汞、甲基汞在其各器官之间的转运、累积机理以及相应的形态转化也尚未厘清。因此,亟待开展相关的基础研究,为后续制定控制水稻汞吸收和积累的策略,保障大米质量安全提供科学基础。
(4)我国居民膳食结构存在较大的地域性差异,南方内陆地区以大米为主食,东南沿海地区鱼类、大米摄入量大。因此,需要有针对性地对不同膳食结构区域的人群开展汞、甲基汞暴露健康风险评价。在此基础上,制定相应的国家和地方性食品总汞、甲基汞含量限值,有针对性地保护居民健康。
| [1] |
Hylander L D. Global mercury pollution and its expected decrease after a mercury trade ban[J]. Water Air & Soil Pollution, 2001, 125(1): 331-344. |
| [2] |
United Nations Environment Programme. Minamata convention on mercury[EB/OL].(2013-1-19)[2019-3-25]. https://www.unenvironment.org/resources/report/minamata-convention-mercury.
|
| [3] |
许韫. 汞对人体健康的影响及其防治[J]. 国外医学(卫生学分册), 2005, 32(5): 278-281. XU Yun. Effects of mercury on human health and its control[J]. Foreign Medical Sciences (Hygiene fascicle), 2005, 32(5): 278-281. |
| [4] |
World Health Organization(WHO). Environmental health criteria 101: Methylmercury[S]. Geneva: WHO, 1990.
|
| [5] |
Joanna B, Stern A H, Michael G. Mercury in commercial fish: Optimizing individual choices to reduce risk[J]. Environmental Health Perspectives, 2005, 113(3): 266-271. DOI:10.1289/ehp.7315 |
| [6] |
Liu J L, Xu X R, Yu S, et al. Mercury contamination in fish and human hair from Hainan Island, South China Sea: Implication for human exposure[J]. Environmental Research, 2014, 135(135C): 42-47. |
| [7] |
Hu Y, Cheng H, Tao S. The Challenges and solutions for cadmium-contaminated rice in China: A critical review[J]. Environment International, 2016, 92/93: 515-532. DOI:10.1016/j.envint.2016.04.042 |
| [8] |
Liu J, Xu X, Yu S, et al. Mercury pollution in fish from South China Sea:Levels, species-specific accumulation, and possible sources[J]. Environmental Research, 2014, 131: 160-164. DOI:10.1016/j.envres.2014.03.004 |
| [9] |
Feng X, Li P, Qiu G, et al. Human exposure to methylmercury through rice intake in mercury mining areas, Guizhou Province, China[J]. Environmental Science & Technology, 2008, 42(1): 326-332. |
| [10] |
Hu Y, Cheng H. Control of mercury emissions from stationary coal combustion sources in China: Current status and recommendations[J]. Environmental Pollution, 2016, 218: 1209-1221. DOI:10.1016/j.envpol.2016.08.077 |
| [11] |
Maclean J L, Dawe D C, Hardy B, 等. 水稻知识大全[M]. 三版. 福建: 福建科学技术出版社, 2000. Maclean J L, Dawe D C, Hardy B, et al. Completely works of Rice knowledge[M]. Third Edition. Fujian: Fujian Science & Technology Publishing House, 2000. |
| [12] |
Li P, Feng X, Qiu G. Methylmercury exposure and health effects from rice and fish consumption: A review[J]. International Journal of Environmental Research and Public Health, 2010, 7(6): 2666-2691. DOI:10.3390/ijerph7062666 |
| [13] |
Rothenberg S E, Windham-Myers L, Creswell J E. Rice methylmercury exposure and mitigation: A comprehensive review[J]. Environmental Research, 2014, 133: 407-423. DOI:10.1016/j.envres.2014.03.001 |
| [14] |
United Nations Environment Programme. Global mercury assessment 2018[EB/OL].(2018) [2019-3-25]. https://www.unenvironment.org/resources/publication/global-mercury-assessment-2018.
|
| [15] |
环境保护部. 国家污染物环境健康风险名录(化学第一分册)[M]. 北京: 中国环境科学出版社, 2009. Ministry of Environment and Protection. National pollutant environmental health risk inventory(chemistry first volume)[M]. Beijing: China Environmental Science Press, 2009. |
| [16] |
Kirk J L, Lehnherr I, Andersson M, et al. Mercury in arctic marine ecosystems:Sources, pathways and exposure[J]. Environmental Research, 2012, 119(5): 64-87. |
| [17] |
Dastoor A, Ryzhkov A, Durnford D, et al. Atmospheric mercury in the Canadian Arctic. Part Ⅱ: Insight from modeling[J]. Science of the Total Environment, 2015, 509/510: 16-27. DOI:10.1016/j.scitotenv.2014.10.112 |
| [18] |
Zhu W, Lin C J, Wang X, et al. Global observations and modeling of atmosphere–surface exchange of elemental mercury: A critical review[J]. Atmospheric Chemistry and Physics, 2016, 16(7): 4451-4480. DOI:10.5194/acp-16-4451-2016 |
| [19] |
Zhu W, Li Z G, Li P, et al. Re-emission of legacy mercury from soil adjacent to closed point sources of Hg emission[J]. Environmental Pollution, 2018, 242: 718-727. DOI:10.1016/j.envpol.2018.07.002 |
| [20] |
Eckley C S, Blanchard P, Mclennan D, et al. Soil-air mercury flux near a large industrial emission source before and after closure(Flin Flon, Manitoba, Canada)[J]. Environmental Science & Technology, 2015, 49(16): 9750-9757. |
| [21] |
Zahir F, Rizwi S J, Haq S K, et al. Low dose mercury toxicity and human health[J]. Environmental Toxicology Pharmacology, 2005, 20(2): 351-360. DOI:10.1016/j.etap.2005.03.007 |
| [22] |
Salonen J T, Kari S, Lakka T A, et al. Mercury accumulation and accelerated progression of carotid atherosclerosis: A population-based prospective 4-year follow-up study in men in eastern Finland[J]. Atherosclerosis, 2000, 148(2): 265-273. DOI:10.1016/S0021-9150(99)00272-5 |
| [23] |
Stern A H. A review of the studies of the cardiovascular health effects of methylmercury with consideration of their suitability for risk assessment[J]. Environmental Research, 2005, 98(1): 133-142. DOI:10.1016/j.envres.2004.07.016 |
| [24] |
Lebel J, Mergler D, Branches F, et al. Neurotoxic effects of low-level methylmercury contamination in the amazonian basin[J]. Environmental Research, 1998, 79(1): 20-32. DOI:10.1006/enrs.1998.3846 |
| [25] |
Feitosa-Santana C, Souza G d S, Sirius E V P, et al. Color vision impairments with low-level methylmercury exposure of an Amazonian population-Brazil[J]. Neuro Toxicology, 2018, 66: 179-184. |
| [26] |
Puty B, Leão L K R, Crespo-Lopez M E, et al. Association between methylmercury environmental exposure and neurological disorders: A systematic review[J]. Journal of Trace Elements in Medicine and Biology, 2019, 52: 100-110. DOI:10.1016/j.jtemb.2018.12.001 |
| [27] |
Xu Y, Khoury J C, Sucharew H, et al. Low-level gestational exposure to mercury and maternal fish consumption: Associations with neurobehavior in early infancy[J]. Neurotoxicology and Teratology, 2016, 52: 61-67. |
| [28] |
Prpić I, Milardović A, Vlašić-Cicvarić I, et al. Prenatal exposure to low-level methylmercury alters the child′s fine motor skills at the age of 18 months[J]. Environmental Research, 2017, 152: 369-374. DOI:10.1016/j.envres.2016.10.011 |
| [29] |
Dórea, José G. Multiple low-level exposures: Hg interactions with cooccurring neurotoxic substances in early life[J]. Biochimica Et Biophysica Acta(BBA)-General Subjects, 2018. DOI:10.1016/j.bbagen.2018.10.015 |
| [30] |
Bollen A, Wenke A, Biester H. Mercury speciation analyses in HgCl2-contaminated soils and groundwater: Implications for risk assessment and remediation strategies[J]. Water Research, 2008, 42(1): 91-100. |
| [31] |
O'Connor D, Hou D, Ok Y S, et al. Mercury speciation, transformation, and transportation in soils, atmospheric flux, and implications for risk management:A critical review[J]. Environment International, 2019, 126: 747-761. DOI:10.1016/j.envint.2019.03.019 |
| [32] |
Branfireun B A, Roulet N T, Kelly C A, et al. In situ sulphate stimulation of mercury methylation in a boreal peatland: Toward a link between acid rain and methylmercury contamination in remote environments[J]. Global Biogeochemical Cycles, 1999, 13(3): 743-750. DOI:10.1029/1999GB900033 |
| [33] |
Windham-Myers L, Fleck J A, Ackerman J T, et al. Mercury cycling in agricultural and managed wetlands: A synthesis of methylmercury production, hydrologic export, and bioaccumulation from an integrated field study[J]. Science of the Total Environment, 2014, 484: 221-231. DOI:10.1016/j.scitotenv.2014.01.033 |
| [34] |
Thomas S A, Rodby K E, Roth E W, et al. Spectroscopic and microscopic evidence of biomediated HgS species formation from Hg(Ⅱ)-cysteine complexes: Implications for Hg(Ⅱ)bioavailability[J]. Environmental Science & Technology, 2018, 52: 10030-10039. |
| [35] |
Fernandez-Martinez R, Rucandio I. Total mercury, organic mercury and mercury fractionation in soil profiles from the Almaden mercury mine area[J]. Environmental Science-Processes & Impacts, 2014, 16: 333-340. |
| [36] |
Zhang H, Feng X, Zhu J, et al. Selenium in soil inhibits mercury uptake and translocation in rice(Oryza sativa L.)[J]. Environmental Science & Technology, 2012, 46: 10040-10046. |
| [37] |
Meng B, Feng X, Qiu G, et al. The process of methylmercury accumulation in rice(Oryza sativa L.)[J]. Environmental Science & Technology, 2011, 45(7): 2711-2717. |
| [38] |
Wang X, Ye Z, Li B, et al. Growing rice aerobically markedly decreases mercury accumulation by reducing both Hg bioavailability and the production of MeHg[J]. Environmental Science & Technology, 2014, 48(3): 1878-1885. |
| [39] |
Rothenberg S E, Feng X, Zhou W, et al. Environment and genotype controls on mercury accumulation in rice(Oryza sativa L.)cultivated along a contamination gradient in Guizhou, China[J]. Science of the Total Environment, 2012, 426: 272-280. DOI:10.1016/j.scitotenv.2012.03.024 |
| [40] |
Haitzer M, Aiken G R, Ryan J N. Binding of mercury(Ⅱ)to aquatic humic substances: Influence of pH and source of humic substances[J]. Environmental Science & Technology, 2003, 37(11): 2436-2441. |
| [41] |
Zhao L, Anderson C W N, Qiu G, et al. Mercury methylation in paddy soil: Source and distribution of mercury species at a Hg mining area, Guizhou Province, China[J]. Biogeosciences, 2016, 13: 2429-2440. DOI:10.5194/bg-13-2429-2016 |
| [42] |
Hintelmann H, Harris R, Heyes A, et al. Reactivity and mobility of new and old mercury deposition in a boreal forest ecosystem during the first year of the METAALICUS study[J]. Environmental Science & Technology, 2002, 36(23): 5034-5040. |
| [43] |
Cheng J, Zhao W, Wang Q, et al. Accumulation of mercury, selenium and PCBs in domestic duck brain, liver and egg from a contaminated area with an investigation of their redox responses[J]. Environmental Toxicology and Pharmacology, 2013, 35(3): 388-394. DOI:10.1016/j.etap.2013.01.011 |
| [44] |
Tomiyasu T, Kodamatani H, Imura R, et al. The dynamics of mercury near Idrija mercury mine, Slovenia: Horizontal and vertical distributions of total, methyl, and ethyl mercury concentrations in soils[J]. Chemosphere, 2017, 184: 244-252. DOI:10.1016/j.chemosphere.2017.05.123 |
| [45] |
谷春豪, 许怀凤, 仇广乐. 汞的微生物甲基化与去甲基化机理研究进展[J]. 环境化学, 2013, 32(6): 926-936. GU Chun-hao, XU Huai-feng, QIU Guang-le. The progress in research on mechanism of microbial mercury methylation and de-methylation[J]. Environmental Chemistry, 2013, 32(6): 926-936. |
| [46] |
Yin R, Feng X, Meng B. Stable mercury isotope variation in rice plants(Oryza sativa L.)from the Wanshan mercury mining district, SW China[J]. Environmental Science & Technology, 2013, 47(5): 2238-2245. |
| [47] |
Ogawa M, Tanaka K, Kasai Z. Accumulation of phosphorus, magnesium and potassium in developing rice grains: Followed by electron microprobe X-ray analysis focussing on the aleurone layer[J]. Plant and Cell Physiology, 1979, 20: 19-27. |
| [48] |
Li L, Wang F, Meng B, et al. Speciation of methylmercury in rice grown from a mercury mining area[J]. Environmental Pollution, 2010, 158(10): 3103-3107. DOI:10.1016/j.envpol.2010.06.028 |
| [49] |
Li P, Feng X, Yuan X, et al. Rice consumption contributes to low level methylmercury exposure in southern China[J]. Environment International, 2012, 49(1): 18-23. |
| [50] |
United States Environmental Protection Agency(USEPA). Mercury in sediment and tissue samples by atomic fluorescence spectrometry, EPA-SW-846-7474[S]. Government Printing Office, Washington, DC, US, 1998.
|
| [51] |
Torres D P, Olivares I R, Queiroz H M. Estimate of the uncertainty in measurement for the determination of mercury in seafood by TDA AAS[J]. Journal of Environmental Science & Health Part B, 2015, 50(8): 622-631. |
| [52] |
Zhao G F, Zhou H D, Wang Z J. Concentrations of selected heavy metals in food from four e-waste disassembly localities and daily intake by local residents[J]. Journal of Environmental Science and Health Part A Toxic, 2010, 45(7): 824-835. DOI:10.1080/10934521003709016 |
| [53] |
国家环境保护总局.环境甲基汞的测定—气相色谱法GB/T 17132 —1997[S].北京: 国家环境保护总局, 1998. National Environmental Protection Agency. Environmental methylmercury analysis: Gas chromatography method GB/T 17132—1997 [S]. Beijing: National Environmental Protection Agency, 1998. |
| [54] |
Akagi H, Castillo E S, Cortesmaramba N, et al. Health assessment for mercury exposure among schoolchildren residing near a gold processing and refining plant in Apokon, Tagum, Davao del Norte, Philippines[J]. Science of the Total Environment, 2000, 259(1): 31-43. |
| [55] |
Maher W, Krikowa F, Ellwood M, et al. Overview of hyphenated techniques using an ICP-MS detector with an emphasis on extraction techniques for measurement of metalloids by HPLC-ICPMS[J]. Microchemical Journal, 2012, 105: 15-31. DOI:10.1016/j.microc.2012.03.017 |
| [56] |
Jagtap R, Krikowa F, Maher W, et al. Measurement of methyl mercury(Ⅰ)and mercury(Ⅱ)in fish tissues and sediments by HPLCICPMS and HPLC-HGAAS[J]. Talanta, 2011, 85(1): 50-55. |
| [57] |
Cheng H, Chen X, Shen L, et al. Ion-pairing reversed-phase chromatography coupled to inductively coupled plasma mass spectrometry as a tool to determine mercurial species in freshwater fish[J]. Journal of Chromatography A, 2018, 1531: 104-111. DOI:10.1016/j.chroma.2017.11.029 |
| [58] |
Huang Z, Pan X D, Han J L, et al. Determination of methylmercury in marine fish from coastal areas of Zhejiang, China[J]. Food Additives & Contaminants Part B Surveillance, 2012, 5(3): 182-187. |
| [59] |
Liang L, Horvat M, Cernichiari E, et al. Simple solvent extraction technique for elimination of matrix interferences in the determination of methylmercury in environmental and biological samples by ethylation-gas chromatography-cold vapor atomic fluorescence spectrometry[J]. Talanta, 1996, 43(11): 1883-1888. DOI:10.1016/0039-9140(96)01964-9 |
| [60] |
李平, 冯新斌, 仇广乐. 贵州汞矿区居民食用大米的甲基汞暴露及健康风险评价[J]. 生态学杂志, 2011, 30(5): 914-921. LI Ping, FENG Xin-bin, QIU Guang-le. Methylmercury exposure through rice consumption and its health risk assessment for the residents in Guizhou mercury mining areas[J]. Chinese Journal of Ecology, 2011, 30(5): 914-921. |
| [61] |
Rothenberg S E, Yin R, Hurley J P, et al. Stable mercury isotopes in polished rice(Oryza sativa L.)and hair from rice consumers[J]. Environmental Science and Technology, 2017, 51(11): 6480-6488. DOI:10.1021/acs.est.7b01039 |
| [62] |
Coufalík P, Meszarosová N, Coufalíková K, et al. Determination of methylmercury in cryptogams by means of GC-AFS using enzymatic hydrolysis[J]. Microchemical Journal, 2018, 140: 8-13. DOI:10.1016/j.microc.2018.03.040 |
| [63] |
Luo Q, Gao X, Hu Y, et al. Determination of methylmercury in rice using microwave-assisted extraction coupled with thermal decomposition amalgamation atomic absorption spectrometry(MAE-TDA-AAS)[J]. Analytical Methods, 2019, 11: 1361-1370. DOI:10.1039/C8AY02738B |
| [64] |
Paiva E L D, Alves J C, Milani R F, et al. Sushi commercialized in Brazil:Organic Hg levels and exposure intake evaluation[J]. Food Control, 2016, 69: 115-123. DOI:10.1016/j.foodcont.2016.04.029 |
| [65] |
Krupp E M, Mestrot A, Wielgus J, et al. The molecular form of mercury in biota: identification of novel mercury peptide complexes in plants[J]. Chemical Communications, 2009, 28(28): 4257-4259. |
| [66] |
Food and Agriculture Organization of the United Nations(FAO). FAOSTAT[DB/OL].(2013) [2019-3-25]. http://www.fao.org/faostat/zh/#data/CC.
|
| [67] |
Batista B L, Nacano L R, de Freitas R, et al. Determination of essential(Ca, Fe, I, K, Mo)and toxic elements(Hg, Pb)in Brazilian rice grains and estimation of reference daily intake[J]. Food and Nutrition Science, 2012, 3: 129-134. |
| [68] |
Windham-Myers L, Marvin-Dipasquale M, Kakouros E, et al. Mercury cycling in agricultural and managed wetlands of California, USA: Seasonal influences of vegetation on mercury methylation, storage, and transport[J]. Science of the Total Environment, 2014, 484(24): 308-318. |
| [69] |
Brombach C C, Manorut P, Kolambage-Dona P P P, et al. Methylmercury varies more than one order of magnitude in commercial European rice[J]. Food Chemistry, 2017, 214: 360-365. DOI:10.1016/j.foodchem.2016.07.064 |
| [70] |
da Silva M, Paim A, Pimentel M F. Determination of mercury in rice by cold vapor atomic fluorescence spectrometry after microwave-assisted digestion[J]. Analytica Chimica Acta, 2010, 667(1): 43-48. |
| [71] |
Horvat M, Nolde N, Fajon V, et al. Total mercury, methylmercury and selenium in mercury polluted areas in the province Guizhou, China[J]. Science of the Total Environment, 2003, 304(3): 231-256. |
| [72] |
Lin H, Santa-Rios A, Barst B D, et al. Occurrence and bioaccessibility of mercury in commercial rice samples in Montreal(Canada)[J]. Food and Chemical Toxicology, 2019, 126: 72-78. DOI:10.1016/j.fct.2019.02.006 |
| [73] |
Jallad K N. Heavy metal exposure from ingesting rice and its related potential hazardous health risks to humans[J]. Environmental Science and Pollution Research, 2015, 22(20): 15449-15458. DOI:10.1007/s11356-015-4753-7 |
| [74] |
Bose-O'Reilly S, Schierl R, Nowak D, et al. A preliminary study on health effects in villagers exposed to mercury in a small-scale artisanal gold mining area in Indonesia[J]. Environmental Research, 2016, 149: 274-281. DOI:10.1016/j.envres.2016.04.007 |
| [75] |
Appleton J D, Weeks J M, Calvez J P S, et al. Impacts of mercury contaminated mining waste on soil quality, crops, bivalves, and fish in the Naboc River area, Mindanao, Philippines[J]. Science of the Total Environment, 2006, 354(2/3): 198-211. |
| [76] |
Pataranawat P, Parkpian P, Polprasert C, et al. Mercury emission and distribution: Potential environmental risks at a small-scale gold mining operation, Phichit Province, Thailand[J]. Journal of Environmental Science and Health Part A Toxic/Hazardous Substances & Environmental Engineering, 2007, 42(8): 1081-1093. |
| [77] |
Sarkar A, Aronson K J, Patil S, et al. Emerging health risks associated with modern agriculture practices: A comprehensive study in India[J]. Environmental Research, 2012, 115: 37-50. DOI:10.1016/j.envres.2012.03.005 |
| [78] |
Cheng Z, Wang H S, Du J, et al. Dietary exposure and risk assessment of mercury via total diet study in Cambodia[J]. Chemosphere, 2013, 92(1): 143-149. DOI:10.1016/j.chemosphere.2013.02.025 |
| [79] |
Lee H, Cho Y, Park S, et al. Dietary exposure of the Korean population to arsenic, cadmium, lead and mercury[J]. Journal of Food Composition & Analysis, 2006, 19: S31-S37. |
| [80] |
Shi J B, Liang L N, Jiang G B. Simultaneous determination of methylmercury and ethylmercury in rice by capillary gas chromatography coupled on-line with atomic fluorescence spectrometry[J]. Journal of AOAC International, 2005, 88(2): 665-669. |
| [81] |
Fu J, Zhou Q, Liu J, et al. High levels of heavy metals in rice(Oryza sativa L.)from a typical e-waste recycling area in southeast China and its potential risk to human health[J]. Chemosphere, 2008, 71(7): 1269-1275. DOI:10.1016/j.chemosphere.2007.11.065 |
| [82] |
United States Environmental Protection Agency(USEPA). Mercury study report to the congress, volume Ⅴ: Health effects of mercury and mercury compounds[S]. Government Printing Office, Washington, DC, US, 1997.
|
| [83] |
Joint FAO/WHO Expert Committee on Food Additives(JECFA). Summary and conclusions of the sixty-first meeting of the joint FAO/WHO expert committee on food additives[S]. Joint FAO/WHO Expert Committee on Food Additives, Rome, Italy, 2003.
|
| [84] |
Office of Environmental Health Hazard Assessment(OEHHA). Revised air toxics hot spots program technical support document for the derivation of non-cancer reference exposure levels and RELs for six chemicals[S]. California Environmental Protection Agency, US, 2008.
|
| [85] |
Qiu G, Feng X, Wang S, et al. Environmental contamination of mercury from Hg-mining areas in Wuchuan, northeastern Guizhou, China[J]. Environmental Pollution, 2006, 142(3): 549-558. DOI:10.1016/j.envpol.2005.10.015 |
| [86] |
Li P, Feng X, Qiu G, et al. Mercury exposure in the population from Wuchuan mercury mining area, Guizhou, China[J]. Science of the Total Environment, 2008, 395(2/3): 72-79. |
| [87] |
Zhang H, Wang D, Zhang J, et al. Total mercury in milled rice and brown rice from China and health risk evaluation[J]. Food Additives & Contaminants: Part B, 2014, 7(2): 141-146. |
| [88] |
Zhao H, Yan H, Zhang L, et al. Mercury contents in rice and potential health risks across China[J]. Environment International, 2019, 126: 406-412. DOI:10.1016/j.envint.2019.02.055 |
 2019, Vol. 38
2019, Vol. 38