随着化学工业的迅猛发展,大量重金属通过各种途径进入到土壤环境中,造成土壤的重金属污染[1]。重金属易在植物、动物及人体内富集,对生态环境及人体健康产生严重威胁[2-3]。近年来,有关土壤Cd污染的研究越来越深入,宋伟等[4]依托收集的我国重金属污染案例资料,通过建立数据库分析得出Cd元素是当前我国耕地土壤重金属污染的最主要元素,污染发生概率为25.20%;Zhou等[5]研究了中国4个矿区中土壤与作物的Cd污染情况,指出矿区对土壤及作物Cd污染有重要影响;Naidu等[6]研究了离子强度与pH不同时土壤对Cd的吸附特征,表明离子强度与pH通过改变土壤表面电荷强度影响土壤对Cd的吸附。
土壤成分复杂,各组分势必对污染物的吸附解吸产生不同影响。很多学者[7-10]从土壤组分入手,研究土壤组分对污染物的吸附机理。层状双氢氧化物(Layered double hydroxide,LDH)是一种阴离子黏土矿物。LDH的化学组成为[M(1-x)2+Mx3+(OH)2](Ax/2n-)y·H2O,其中,M2+表示二价金属阳离子,M3+表示三价金属阳离子,An-为层间可交换的阴离子,x为M3+与M2++ M3+的物质的量比。一定条件下,土壤中重金属可原位反应生成LDH[11]。有关LDH的研究多集中在污水处理[12-16]、土壤修复[17-20]、医学药物载体[21-22]等方面。随着LDH的广泛应用,通过污水处理、土壤修复等方式进入土壤的LDH越来越多,LDH具有特殊的结构及性质,其对土壤环境的改变使土壤污染物的吸附迁移活动变得更为复杂。梁学峰等[23-24]详细介绍了LDH对金属离子的吸附机理及影响因素,表明LDH对金属离子的吸附机理主要有:金属与LDH表面的羟基发生表面络合反应生成络合物;重金属与LDH表面氢氧化物反应形成沉淀;重金属与LDH层间阴离子发生螯合反应生成螯合物;重金属与层上金属离子发生同构置换反应形成新的LDH。
本文通过将自然界常见的LDH定量加入到土壤中,与原土壤作对照,研究不同阳离子类型下LDH的存在对重金属Cd在土壤中吸附迁移的影响,并通过纯物质实验对LDH及其吸附重金属后的样品进行红外光谱扫描及X射线衍射分析,探讨LDH对Cd的吸附机理。这对于深入了解Cd在土壤中的吸附迁移过程、防治地下水污染具有重要意义。
1 材料与方法 1.1 供试材料实验土壤取自青岛市南村实验田,去除表层植物根系,取0~20 cm深处的土壤,置于阴暗处自然风干,过10目筛备用。土壤理化性质如表 1所示。
|
|
表 1 土壤理化性质 Table 1 Physical and chemical properties of the soil |
实验用药品NaCl、KCl、CaCl2、MgCl2、Cd(NO3)2·4H2O均为分析纯。实验用LDH购自北京泰克莱尔科技有限公司,分子式Mg4Al2(OH)12CO3·mH2O,pH(20 g·L-1悬浮液)约为8,平均粒径D90=0.4 μm。
1.2 实验方法 1.2.1 Mg-Al-CO3 LDH土壤的制备称取一定量的Mg-Al-CO3 LDH,加入到过10目筛的土壤中,再加入适量的蒸馏水湿润土壤,充分搅拌混匀,得到Mg-Al-CO3 LDH含量为300、500、1000、1200 mg·kg-1的土壤。将各浓度土壤置于阴暗处风干,过10目筛后放置老化2个月以使其与土壤充分接触反应,备用。以下称L土。
1.2.2 动力学吸附实验以0.01 mol·L-1的KCl为背景溶液,配制浓度为500 mg·L-1的Cd溶液,调节pH至5.5。分别称取2 g自然土壤及L土于50 mL聚丙烯离心管中,按水土比10:1加入20 mL背景溶液为KCl的Cd溶液,在25 ℃、250 r·min-1振荡器中振荡。分别在10、20、30 min和1、2、3、4、12、24、48 h后取出样品,以4000 r·min-1的速度离心5 min,过滤,测上清液中Cd2+浓度。
1.2.3 不同Mg-Al-CO3 LDH浓度的批量静态吸附实验以0.01 mol·L-1的KCl为背景溶液,配制浓度为0、50、100、200、250、300、400 mg·L-1的Cd溶液,调节pH为5.5。分别称取2 g LDH含量为0、300、500、1000、1200 mg·kg-1的土壤于50 mL离心管中,按水土比10:1加入20 mL Cd溶液,于250 r·min-1下振荡24 h,4000 r·min-1离心5 min,过滤,测上清液中Cd2+浓度。
1.2.4 不同阳离子类型的批量静态吸附实验分别以0.01 mol·L-1的KCl、NaCl、CaCl2、MgCl2为背景溶液,配制浓度为0、50、100、200、300、400 mg·L-1的Cd溶液,调节pH至5.5。称取2 g自然土壤及L土于50 mL聚丙烯离心管中,按水土比10:1加入20 mL背景溶液为KCl、NaCl、CaCl2和MgCl2的Cd溶液,在25 ℃、250 r·min-1振荡器中振荡24 h,以4000 r·min-1的速度离心5 min,过滤,测上清液中Cd2+浓度和pH。
上述实验处理均做3个重复。
1.2.5 纯物质实验配制Cd2+浓度为50、100、200、300、400、500 mg·L-1的溶液,调节pH至5.5。准确称取0.03 g Mg-AlCO3 LDH于50 mL聚丙烯离心管中,加入10 mL Cd溶液,振荡、离心、过滤,测上清液Cd2+浓度。取吸附率较高的样品粉末,室温下晾干后,进行红外光谱扫描和X射线衍射分析。
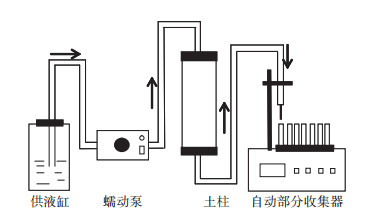
1.2.6 室内土柱迁移实验分别取350 g土壤(自然土壤与L土),分6次均匀填装到直径为4.5 cm、高20 cm的土柱中,土柱由有机玻璃加工而成。为了使土柱填装均匀,避免大孔隙出现,每次使用压实器压实后再填装下一层;在土柱两端的接口处均放置适量脱脂棉,以防止土壤颗粒随溶液流出,堵塞出液口;在柱子两端分别加入一张与土柱直径相当的滤纸,并填装约2.5 cm的石英砂,以保证供液时,溶液可以均匀渗入到土壤中。启动蠕动泵,先用0.01 mol·L-1的KCl/NaCl/CaCl2/MgCl2溶液自下而上饱和土柱,待土柱饱和并出流稳定后,调节流速为8.6 cm·h-1,自上而下输入20 PV(Pore Volume)的pH为5.5、浓度为500 mg·L-1的Cd溶液,其后用0.01 mol·L-1的KCl/NaCl/CaCl2/MgCl2溶液冲洗。收集出流液,测定Cd2+浓度,并测其pH。实验装置示意图如图 1所示。
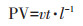
|
|
图 1 土柱实验示意图 Figure 1 Schematic diagram of the soil column experiment |
式中:PV为孔隙体积,无量纲,故也可表示时间;v为孔隙水流速,cm·h-1;t为时间,h;l为土体长度,cm。
1.3 试剂及分析方法用ICP-OES(Optima 8000)测定重金属浓度;用pH计(PHS-3C)测定pH;用电导率仪(DDB-303A)测定电导率。
样品的X射线衍射分析于X射线衍射仪(DX 2700)上进行,扫描速率(2θ)为2 °·min-1,扫描范围为5°~90°,Cu靶,Kα(λ=1.541 8 Å),加速电压40 kV,电流30 mA。
样品的红外分析测试于傅里叶变换红外光谱仪(Nicolet iS50)上进行,波数为400~4000 cm-1。
吸附量计算公式及吸附动力学模型如下:
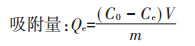
|
(1) |
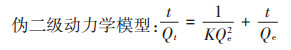
|
(2) |

|
(3) |

|
(4) |
式中:Qe为达吸附平衡时Cd2+在土壤中的吸附量,mg·kg-1;C0为Cd2+的初始浓度,mg·L-1;Ce为达到平衡后Cd2+的浓度,mg·L-1;V为溶液体积,L;m为土壤质量,kg;Qt为t时刻的吸附量,mg·kg-1;K为伪二级吸附速率常数,kg·mg-1·h-1;a、b为Elovich常数;kid为颗粒间扩散速率常数,mg·kg-1·h-1/2;I为与边界层厚度有关的常数。
2 结果与讨论 2.1 Cd在自然土壤和L土中的动力学吸附如图 2所示,Cd在两种土壤中的吸附过程均可分为3个阶段:第一阶段为快速吸附阶段,Cd2+进入土壤后,由于此时土壤表面含有大量的吸附位点,使Cd2+被迅速吸附,该阶段在30 min内即可完成;第二阶段为动态平衡阶段,Cd2+在土壤中的吸附出现了一定的波动,在此阶段内,Cd2+开始向土壤颗粒内部或MgAl-CO3 LDH层间扩散,因此吸附速率有所减慢;第三阶段为吸附平衡阶段,此时吸附解吸逐渐达到平衡,吸附量变化很小。在吸附平衡阶段,L土中的吸附量仍有一定程度的增大,这是由于Mg-Al-CO3 LDH提供的大量CO32-仍可与Cd2+结合以完成吸附。
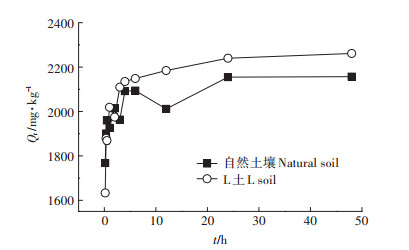
|
图 2 Cd在两种土壤中的吸附动力学曲线 Figure 2 Kinetic adsorption curves of the adsorption of Cd in two soils |
表 2为利用伪二级动力学模型及Elovich模型拟合所得参数。伪二级动力学模型是基于假定吸附速率受化学反应或通过电子共享或电子得失的化学吸附的控制[25],从表中可看出,R2均接近于1,拟合效果非常好,且其拟合得到的平衡吸附量与实际测定值很接近,说明土壤对Cd2+的吸附能力与吸附位点有关,吸附速率受控于化学吸附。Elovich模型可描述吸附体系的动力学机制,更适用于吸附体系中活化能变化较大,即吸附剂化学组分较为复杂的过程[26]。L土中Elovich模型拟合R2相对较高,说明Mg-Al-CO3 LDH的存在增加了土壤化学组分的复杂性,使Cd2+在土壤中的非均相扩散过程更为明显。
|
|
表 2 动力学吸附拟合参数 Table 2 Parameters for kinetic models |
通过内扩散模型可以判断颗粒间扩散是否为控制步骤[27-28]。若t1/2-Qt呈线性关系,且过原点,则说明颗粒间扩散是唯一控速步骤[26]。从图 2可以看出,在自然土壤与L土中t1/2与Qt之间线性关系不明显,说明吸附速率受多步骤控制。曲线开始出现的快速上升阶段代表液膜扩散或高速率的表面吸附,随后是颗粒间扩散,最后平台期表示吸附平衡状态。因此,土壤对Cd2+的吸附速率受液膜扩散、颗粒间扩散以及化学反应等综合作用的影响,颗粒间扩散并不是唯一的控速步骤。
2.2 不同Mg-Al-CO3 LDH含量时Cd在土壤中的等温吸附图 3为不同Mg-Al-CO3 LDH含量时Cd2+在土壤中的吸附等温线,可以看出随Mg-Al-CO3 LDH含量的升高,吸附量逐渐增大,说明Mg-Al-CO3 LDH的存在可促进土壤对Cd2+的吸附。Mg-Al-CO3 LDH表面含有大量羟基,增加了土壤对Cd2+的吸附位点,其次,LDH中的CO32-可与Cd2+反应,增大吸附量。
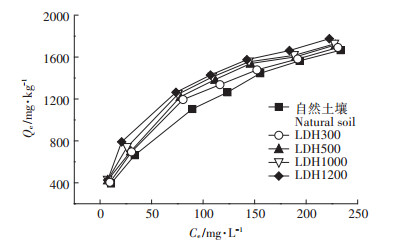
|
图 3 Cd2+在不同Mg-Al-CO3 LDH含量时的吸附等温线 Figure 3 Adsorption isotherms for Cd2+ at different LDH contents |
土壤溶液中的阳离子会与重金属离子竞争土壤表面的吸附位点,从而影响土壤对重金属的吸附。如图 4所示,不同离子类型时L土对Cd2+的吸附量均大于自然土壤,即Mg-Al-CO3 LDH起促进吸附的作用。这主要是因为Mg-Al-CO3 LDH表面含有的大量OH-使土壤pH升高,促使金属氢氧化物的形成[29],增大吸附量。另外,Mg-Al-CO3 LDH含有的大量CO32-也可与Cd2+反应形成CdCO3沉淀,对Cd2+的运移起到阻滞作用。阳离子类型不同时,土壤对Cd2+的吸附能力不同,两种土壤中吸附量大小均为Na+ > K+ > Mg2+ > Ca2+,即随着阳离子价态的升高,吸附量下降。这是因为阳离子价态越高,其与土壤胶体颗粒的亲和力越强,从而与Cd2+竞争吸附位点,影响吸附量。土壤胶体对同价阳离子吸附的选择性与阳离子的水合半径或水化能有关。水合离子半径越小,单位体积的电荷密度越大;同时,离子与胶体表面的距离也越近,库仑力增大,因此其吸附性越强[30]。4种阳离子水合半径大小顺序为K+ < Na+,Ca2+ < Mg2+,则土壤对阳离子吸附性为K+ > Na+,Ca2+ > Mg2+,即K+、Ca2+更易与Cd2+竞争吸附位点,从而使土壤对Cd2+的吸附量相对较低。
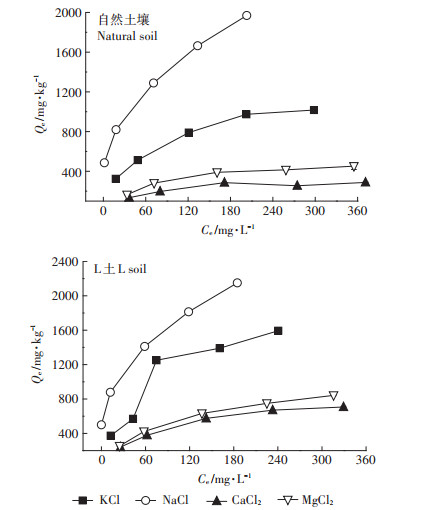
|
图 4 Cd2+在不同阳离子类型下的吸附等温线 Figure 4 Adsorption isotherms for Cd2+ in the presence of different cationic species |
图 5为平衡溶液中pH的变化曲线,可以看出,L土的pH明显大于自然土壤,这是因为Mg-Al-CO3 LDH为碱性物质,表面带有大量的OH-。Cd2+进入土壤后,与土壤表面及土壤溶液中的羟基反应,消耗OH-,同时置换出H+,使pH下降。Cd2+浓度越高,置换出的H+也就越多,因此随初始Cd2+浓度的升高,pH逐渐下降。NaCl为背景溶液时,其pH明显大于其他背景溶液。有研究表明[31-32],Na+的存在会改变土壤的理化性质,引起土壤颗粒的膨胀和分散,且当Na+/Ca2+ > 4时,土壤易发生碱化,pH升高。本研究土壤溶液中Na+/Ca2+远大于4,表明土壤已经发生碱化,导致pH升高。
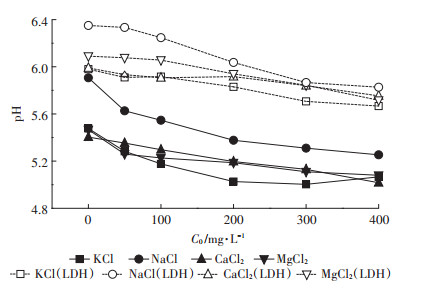
|
图 5 平衡溶液中pH变化曲线 Figure 5 Breakthrough curves of pH in the equilibrium solution |
从图 6可以看出Cd2+在L土的出流时间均大于自然土壤,说明Mg-Al-CO3 LDH的存在对Cd2+的迁移起抑制作用。用Cd溶液淋洗土柱时,土壤中的MgAl-CO3 LDH可以与Cd2+发生表面络合反应,或Cd2+与Mg-Al-CO3 LDH表面及边缘的CO32-反应生成CdCO3沉淀[33],因此,Mg-Al-CO3 LDH的存在可促进Cd2+的吸附,使穿透时间延长。输入20 PV Cd2+后,用相应背景离子进行反冲洗。反冲洗阶段,所有土柱中Cd2+的相对浓度并不是缓慢下降,而是先急剧下降,然后出流浓度相对稳定或有小的突起而后再缓慢下降,有明显的“拖尾”现象。反冲洗初始阶段,随着背景离子的进入,吸附在土壤表面的Cd2+逐渐被背景溶液中的阳离子置换下来,从而出现了一段相对稳定的出流浓度;不同离子类型时Cd穿透曲线的“拖尾”现象说明存在化学非平衡吸附,即吸附解吸过程并不是迅速完成,而是依赖于时间。从图中可以看出,离子类型为CaCl2、MgCl2时,反冲洗阶段L土中Cd2+的出流浓度高于自然土壤,这可能是因为与CO32-结合的Cd2+逐渐被背景离子置换下来,使出流浓度升高。
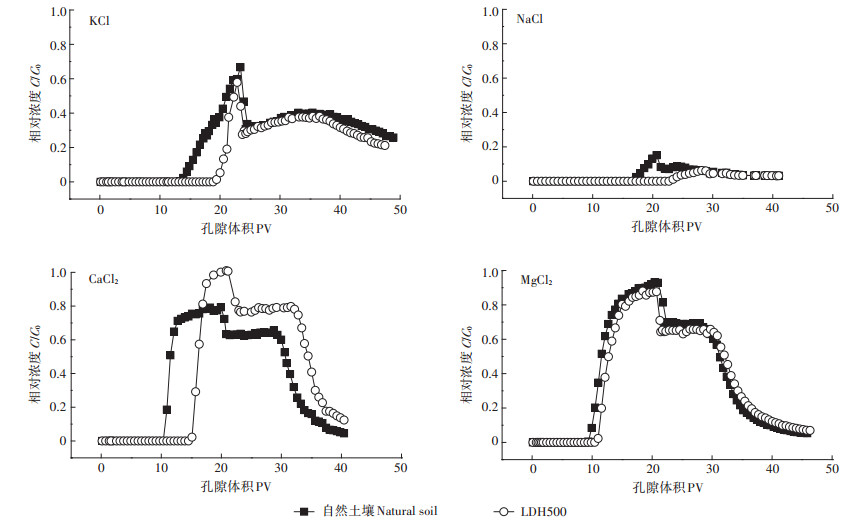
|
图 6 不同离子类型时Cd2+在两种土壤中的穿透曲线 Figure 6 Breakthrough curves of Cd2+ in two soils under different cation species |
如图 7所示,不同离子类型时Cd2+在土壤中的迁移能力各不相同。无论有无Mg-Al-CO3 LDH,Cd2+的出流顺序均依次为Mg2+、Ca2+、K+、Na+,即高价态阳离子更易与Cd2+竞争吸附位点,促进Cd在土壤中的迁移。然而,不同离子类型时,在两种土壤中Cd2+的出流峰值有所差异,自然土壤中当背景离子为Mg2+时峰值最高,而在L土中,背景离子为Ca2+时其峰值最高,这是因为土壤对金属离子的吸附过程分为两个阶段。金属离子进入土壤后,首先与土壤及Mg-Al-CO3 LDH表面的羟基发生表面络合反应,这一过程相对较快。已知KspCa(OH)2为5.5×10-6,KspMg(OH)2为1.8×10-11,即Mg2+更易与Cd2+竞争吸附位点产生沉淀,则Mg2+存在时可促进Cd2+的迁移,所以背景溶液为MgCl2时Cd2+最先出流。随着时间的推移,由于MgAl-CO3 LDH的存在,金属离子逐渐与Mg-Al-CO3 LDH表面或边缘的CO32-反应,生成沉淀。已知KspCaCO3为3.36×10-9,KspMgCO3为6.82×10-6,即Ca2+更易与Cd2+竞争吸附位点产生沉淀,所以离子类型为Ca2+时会促进Cd2+的迁移,所以L土中背景离子为CaCl2时其峰值最高。
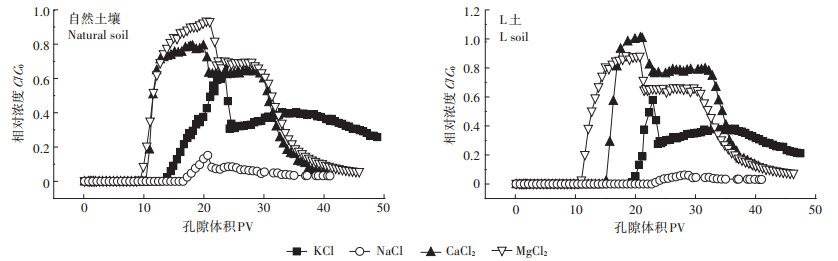
|
图 7 不同离子类型时Cd2+的穿透曲线 Figure 7 Breakthrough curves of Cd2+ under different cation species |
离子类型为NaCl时,出流液中Cd2+浓度很低,即大部分Cd2+均被吸附,仅在反冲洗阶段,有微量的Cd2+出流,并表现出“拖尾”现象。这可能是因为Na+的土壤非专性吸附属性很难将专性吸附的Cd2+交换下来,也可能是由于背景离子Na+的大量存在使土壤发生碱化,pH升高,Cd2+与土壤溶液中的OH-反应生成Cd(OH)2沉淀的几率增大,从而抑制迁移。
图 8为4种离子类型时出流液的pH随时间的变化曲线图。自然土壤中出流液pH变化大体呈先下降后缓慢上升的趋势;L土中出流液pH变化呈先降后升的趋势,且上升速率更快。Cd2+进入土壤后被土壤所吸附,同时置换出土壤表面的H+,使土壤溶液pH下降。反冲洗阶段,出流液pH趋于土壤pH,逐渐升高。由于Mg-Al-CO3 LDH表面有大量的OH-,输入Cd2+时可以中和部分被置换下来的H+,反冲洗时又可释放少量OH-,使L土出流液pH明显高于自然土壤。从图中可以看出,以NaCl为背景溶液时其出流液pH明显高于其他背景溶液,同样地,这可能与Na+对吸附态Cd2+的弱置换能力有关。
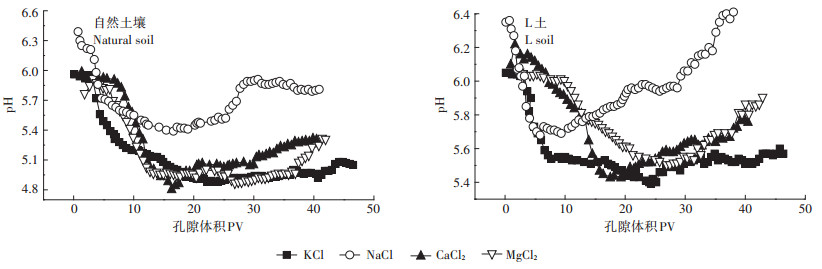
|
图 8 不同离子类型时出流液pH随时间的变化 Figure 8 pH change in the outflow solution under different cation species |
对Mg-Al-CO3 LDH及其吸附Cd2+后的样品进行光谱分析,以探究其吸附机理。图 9为Mg-Al-CO3 LDH及其吸附Cd2+后的红外光谱分析图,3 358.88 cm-1为Mg-Al-CO3 LDH层间的羟基或水分子引起的对称伸缩振动峰;959.93 cm-1为羟基的弯曲振动峰;2 915.44、2 848.38 cm-1为-CH的伸缩振动峰;1 575.25、1 539.84、1 470.92 cm-1对应于- C=O的不对称伸缩振动峰;400~800 cm-1则为Mg/Al-O的变形振动峰。吸附Cd后,3 358.88、664.74 cm-1处峰强减弱,这可能是由吸附反应后Mg-Al-CO3 LDH层间-OH及CO32-减少引起。859.17 cm-1处出现一个新的特征峰,对应于Cd-C伸缩振动峰,说明Cd与Mg-Al-CO3 LDH边缘的CO32-反应并产生了CdCO3沉淀。整体来看,吸附反应前后Mg-Al-CO3 LDH的峰形并未发生较大变化,但其峰强均有所减弱,这可能是由CdCO3沉淀覆盖层效应所致[24]。
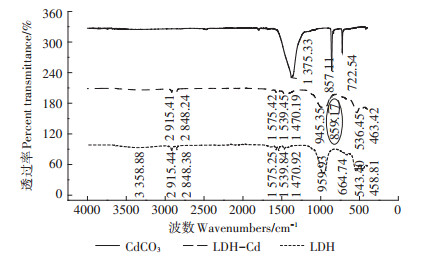
|
图 9 LDH及其吸附Cd2+后的红外光谱图 Figure 9 Infrared spectra of LDH before and after Cd2+ adsorption |
如图 10所示,分别在2θ为11.38、23.42、34.32附近出现3个衍射强度相对较大的特征衍射峰,归属于003、006、012衍射晶面,与标准卡的结果基本一致,具有Mg-Al-CO3 LDH的典型特征峰。吸附Cd后的LDH出峰没有发生明显变化,但峰强减弱。另外,对照标准卡,在LDH-Cd谱图中出现了CdCO3的峰,进一步说明Cd2+进入Mg-Al-CO3 LDH层间,与CO32-反应生成了CdCO3沉淀,并伴随有Mg-Al-CO3 LDH结构的轻微破坏。图中出现少量杂峰,这可能是在MgAl-CO3 LDH制备过程中掺入少许杂质引起。由光谱分析可知,Mg-Al-CO3 LDH对Cd2+的吸附机理主要为沉淀反应。

|
图 10 LDH及吸附Cd2+后的X射线衍射图 Figure 10 X-ray diffraction patterns of LDH before and after Cd2+ adsorption |
(1)伪二级动力学模型拟合效果较好,说明土壤对Cd2+的吸附过程主要为物理化学吸附;在L土中,Elovich模型拟合效果相对较好,表明Mg -Al-CO3 LDH的存在增加了Cd2+在土壤中的非均相扩散过程。t1/2与Qt之间线性关系并不明显,即吸附速率受多步骤影响,颗粒间扩散并不是唯一控速步骤。
(2)批量静态吸附实验结果表明,阳离子价态越高,吸附量越小。Mg-Al-CO3 LDH的存在使土壤pH升高,促使表面沉淀反应的发生;且大量CO32-的存在,使得Mg-Al-CO3 LDH起到促进吸附的作用。
(3)在自然土壤与L土中,不同离子类型下Cd2+的出流顺序均依次为Mg2+、Ca2+、K+、Na+。即高阳离子价态可促进Cd2+的迁移,同价阳离子类型时,阳离子水合半径越小,越有利于Cd的迁移。Mg-Al-CO3 LDH存在时可抑制Cd的迁移。两种土壤不同离子类型时Cd穿透曲线均存在明显的“拖尾”现象,说明土壤对Cd2+的吸附存在非平衡吸附现象。
(4)光谱分析结果表明,Mg-Al-CO3 LDH对Cd2+的吸附机制主要为沉淀反应。
| [1] |
周建军, 周桔, 冯仁国. 我国土壤重金属污染现状及治理战略[J]. 中国科学院院刊, 2014, 29(3): 315-320. ZHOU Jian-jun, ZHOU Ju, FENG Ren-guo. Status of China's heavy metal contamination in soil and its remediation strategy[J]. Bulletin of the Chinese Academy of Sciences, 2014, 29(3): 315-320. |
| [2] |
Adagunodo T, Sunmonu L, Emetere M. Heavy metals' data in soils for agricultural activities[J]. Data in Brief, 2018, 18: 1847-1855. DOI:10.1016/j.dib.2018.04.115 |
| [3] |
Tepanosyan G, Sahakyan L, Belyaeva O, et al. Continuous impact of mining activities on soil heavy metals levels and human health[J]. Science of the Total Environment, 2018, 639: 900-909. DOI:10.1016/j.scitotenv.2018.05.211 |
| [4] |
宋伟, 陈百明, 刘琳. 中国耕地土壤重金属污染概况[J]. 水土保持研究, 2013, 20(2): 293-298. SONG Wei, CHEN Bai-ming, LIU Lin. Soil heavy metal pollution of cultivated land in China[J]. Research of Soil and Water Conservation, 2013, 20(2): 293-298. |
| [5] |
Zhou Z, Chen Z, Pan H, et al. Cadmium contamination in soils and crops in four mining areas, China[J]. Journal of Geochemical Exploration, 2018, 192: 72-84. DOI:10.1016/j.gexplo.2018.06.003 |
| [6] |
Naidu R, Bolans N S, Kookana R S, et al. Ionic-strength and pH effects on the sorption of cadmium and the surface charge of soils[J]. European Journal of Soil Science, 1994, 45: 419-429. DOI:10.1111/j.1365-2389.1994.tb00527.x |
| [7] |
孙军娜, 徐绍辉. Cu/Pb/Zn/Cd在石英砂中的迁移实验及模拟[J]. 土壤学报, 2010, 47(6): 1101-1109. SUN Jun-na, XU Shao-hui. Modeling Cu/Pb/Zn/Cd transport in quartz sand column[J]. Acta Pedologica Sinica, 2010, 47(6): 1101-1109. |
| [8] |
Liao M. Effects of organic acids on adsorption of cadmium onto kaolinite, goethite, and bayerite[J]. Pedosphere, 2006, 16(2): 185-191. DOI:10.1016/S1002-0160(06)60042-8 |
| [9] |
Hizal J, Apak R. Modeling of cadmium (Ⅱ) adsorption on kaolinitebased clays in the absence and presence of humic acid[J]. Applied Clay Science, 2006, 32(3/4): 232-244. |
| [10] |
李丽, 宁阳, 李朝丽. 不同矿质胶体对镉的吸附动力学及热力学研究[J]. 山西农业大学学报, 2016, 36(11): 786-792. LI Li, NING Yang, LI Zhao-li. Kinetics and thermodynamics of Cd(Ⅱ) adsorption on to soil colloids[J]. Journal of Shanxi Agricultural University, 2016, 36(11): 786-792. DOI:10.3969/j.issn.1671-8151.2016.11.007 |
| [11] |
Siebecker M G, Li W, Sparks D L. The important role of layered double hydroxides in soil chemical processes and remediation:What we have learned over the past 20 years[J]. Advances in Agronomy, 2017, 147: 1-59. |
| [12] |
于志敏, 刘景丽, 陈天虎, 等. 原位合成层状双氢氧化物处理含镍废水[J]. 硅酸盐学报, 2006, 34(11): 1420-1424. YU Zhi-min, LIU Jing-li, CHEN Tian-hu, et al. Treatment of wastewater containing nickel by layer double hydroxide synthesis in situ[J]. Journal of the Chinese Ceramic Society, 2006, 34(11): 1420-1424. DOI:10.3321/j.issn:0454-5648.2006.11.025 |
| [13] |
姚铭, 杜莉珍, 王凯雄, 等. 合成水滑石治理水体阴离子染料污染研究[J]. 环境科学学报, 2005, 25(8): 1034-1040. YAO Ming, DU Li-zhen, WANG Kai-xiong, et al. Application of synthetic hydrotalcite in remediation of aqueous anionic dye pollution[J]. Acta Scientiae Circumstantiae, 2005, 25(8): 1034-1040. DOI:10.3321/j.issn:0253-2468.2005.08.007 |
| [14] |
郗丽娟, 刘莹, 吕洪滨. 层状双金属氢氧化物的制备及其在处理阴离子污染物方面的应用[J]. 硅酸盐通报, 2013, 32(8): 1567-1572. XI Li-juan, LIU Ying, LÜ Hong-bin. Synthesis and application of layered double hydroxides for removal of anions in wastewater[J]. Bulletin of the Chinese Ceramic Society, 2013, 32(8): 1567-1572. |
| [15] |
Kameda T, Saito S, Umetsu Y. Mg-Al layered double hydroxide intercalated with ethylene-diaminetetraacetate anion:Synthesis and application to the uptake of heavy metal ions from an aqueous solution[J]. Separation and Purification Technology, 2005, 47: 20-26. DOI:10.1016/j.seppur.2005.06.001 |
| [16] |
臧运波, 侯万国, 王文兴. Cr(Ⅵ)在Mg-Al型类水滑石上的吸附-脱附性研究Ⅰ.吸附性[J]. 化学学报, 2007, 65(9): 773-778. ZANG Yun-bo, HOU Wan-guo, WANG Wen-xing. Adsorption-desorption of chromium(Ⅵ) on Mg-Al hydroxide-like compounds part Ⅰ[J]. Adsorption Acta Chimica Sinica, 2007, 65(9): 773-778. DOI:10.3321/j.issn:0567-7351.2007.09.001 |
| [17] |
张晓伟, 李剑超, 李晓静, 等. Mg/Al-CO3-LDH对土壤磷素行为的影响试验研究[J]. 水土保持学报, 2010, 24(3): 252-255. ZHANG Xiao-wei, LI Jian-chao, LI Xiao-jing, et al. Experiment of Mg/Al-CO3-LDH's inflence to phosphorus in soil[J]. Journal of Soil and Water Conservation, 2010, 24(3): 252-255. |
| [18] |
Park M, Lee C I, Lee E J. Layered double hydroxides as potential solid base for beneficial remediation of endosulfan-contaminated soils[J]. Physics and Chemistry of Solids, 2004, 65: 513-516. DOI:10.1016/j.jpcs.2003.09.022 |
| [19] |
Grünewald G, Kaiser K, Jahn R. Hydrotalcite:A potentially significant sorbent of organic matter in calcareous alkaline soils[J]. Geoderma, 2008, 147(3/4): 141-150. |
| [20] |
Torres-Dorante L O, Lammel J, Kuhlmann H. Use of a layered double hydroxide (LDH) to buffer nitrate in soil:Long-term nitrate exchange properties under cropping and fallow conditions[J]. Plant Soil, 2009, 315: 257-272. DOI:10.1007/s11104-008-9748-4 |
| [21] |
段雪, 张慧, 邹亢, 等. 5-氨基水杨酸插层药物缓释剂及其制备方法: CN1712010[P]. 2005-12-28. DUAN Xue, ZHANG Hui, ZOU Kang, et al. 5-aminosalicylic acid intercalation drug sustained release agent and its preparation method: CN1712010[P]. 2005-12-28. |
| [22] |
段雪, 张慧, 徐向宇.一种超分子插层结构缓释型卡托普利及其制备方法: CN1640395[P]. 2005-07-20. DUAN Xue, ZHANG Hui, XU Xiang-yu. A sustained-release captopril with supramolecular intercalation structure and its preparation method: CN1640395[P]. 2005-07-20. |
| [23] |
Liang X F, Zang Y B, Xu Y M, et al. Sorption of metal cations on layered double hydroxides[J]. Physicochemical and Engineering Aspects, 2013, 433: 122-131. DOI:10.1016/j.colsurfa.2013.05.006 |
| [24] |
梁学峰. Pb(Ⅱ)在层状双金属氢氧化物上的吸附规律研究[D].济南: 山东大学, 2008. LIANG Xue-feng. Adsorption of Pb(Ⅱ) on layered bimetallic hydroxides[D]. Jinan: Shandong University, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10422-2008189140.htm |
| [25] |
唐海, 沙俊鹏, 宋珍霞, 等. 改性ZSM-5介孔沸石分子筛对焦化尾水吸附行为及动力学[J]. 环境工程学报, 2015, 9(10): 4857-4863. TANG Hai, SHA Jun-peng, SONG Zhen-xia, et al. Adsorption behavior and kinetics for coking biological treated effluent by modified ZSM-5 mesopores zeolite molecular sieve[J]. Techniques and Equipment for Environmental Pollution Control, 2015, 9(10): 4857-4863. DOI:10.12030/j.cjee.20151038 |
| [26] |
史贵涛, 陈振楼, 毕春娟, 等. 城郊小河流沉积物吸附Pb2+的动力学过程[J]. 环境科学, 2009, 30(6): 1749-1755. SHI Gui-tao, CHEN Zhen-lou, BI Chun-juan, et al. Kinetics of adsorption of Pb2+ onto small river sediment[J]. Chinese Journal of Environmental Science, 2009, 30(6): 1749-1755. DOI:10.3321/j.issn:0250-3301.2009.06.033 |
| [27] |
李朝丽, 周立祥. 黄棕壤不同粒级组分对镉的吸附动力学与热力学研究[J]. 环境科学, 2008, 29(5): 1406-1411. LI Zhao-li, ZHOU Li-xiang. Kinetics and thermodynamics of Cd(Ⅱ) adsorption onto particle-sized fractions of yellow-brown soil[J]. Environmental Science, 2008, 29(5): 1406-1411. DOI:10.3321/j.issn:0250-3301.2008.05.044 |
| [28] |
Wang S, Zhong H, Liu G Y. Synthesis and adsorption properties for Au(Ⅲ) of alkoxycarbonyl thiourea resin[J]. Journal of Central South University, 2008, 15(4): 463-468. DOI:10.1007/s11771-008-0087-7 |
| [29] |
Park M, Choi C L, Seo Y J, et al. Reactions of Cu2+ and Pb2+ with Mg/Al layered double hydroxide[J]. Applied Clay Science, 2007, 37(1/2): 143-148. |
| [30] |
李法虎. 土壤物理化学[M]. 北京: 化学工业出版社, 2006: 142-148. LI Fa-hu. Soil physicochemistry[M]. Beijing: Chemical Industry Press, 2006: 142-148. |
| [31] |
于天仁, 王振权. 土壤分析化学[M]. 北京: 科学出版社, 1988. YU Tian-ren, WANG Zhen-quan. Soil analytical chemistry[M]. Beijing: Science Press, 1988. |
| [32] |
吴忠东, 王全九. 微咸水钠吸附比对土壤理化性质和入渗特性的影响研究[J]. 干旱地区农业研究, 2008, 26(1): 231-236. WU Zhong-dong, WANG Quan-jiu. Study on impact of sodium adsorption ratio of saline water on soil physical and chemical properties and infiltration characteristics[J]. Agricultural Research in the Arid Areas, 2008, 26(1): 231-236. |
| [33] |
Shan R R, Yan L G, Yang K, et al. Adsorption of Cd(Ⅱ) by Mg-AlCO3-and magnetic Fe3O4/Mg-Al-CO3-layered double hydroxides:Kinetic, isothermal, thermodynamic and mechanistic studies[J]. Journal of Hazardous Materials, 2015, 299(9): 42-49. |
 2019, Vol. 38
2019, Vol. 38




