2. 甘肃省农业生态与资源保护技术推广总站, 兰州 730000;
3. 甘肃省分析测试中心, 兰州 730000
2. Gansu Agroecology and Resource Protection Technology Extension General Station, Lanzhou 730000, China;
3. Gansu Analyze and Research Center, Lanzhou 730000, China
邻苯二甲酸酯(PAEs)作为增塑剂被广泛用于工业、农业和家庭生活中,包括建筑材料、汽车、化妆品和食品药品包装。国内外研究表明,多种邻苯二甲酸酯类化合物具有内分泌干扰性,部分邻苯二甲酸酯类化合物甚至具有致癌和致突变的作用[1]。地膜加工过程中,为了提高农用地膜的化学稳定性、柔韧性、透明度等,常在地膜中添加超过40%的增塑剂[2]。PAEs与塑料基质间以微弱的范德华力或氢键连接,稳定性较差,容易从地膜中迁出,因此能够直接污染土壤并被土壤有机质吸附而长期累积在土壤中,影响土壤安全性。农膜覆盖是旱作农业土壤中增塑剂污染的重要来源[3]。
西北地区干旱少雨,塑料地膜具有保水增温的功能特性,因此在蔬菜、粮食等农作物种植中得到广泛应用,仅甘肃省2013年全省地膜使用总量就达15万t,年残留总量4万t[4]。农膜大量使用带来的环境危害日益严重,土壤残膜成为危害土壤和粮食安全的重要问题[5]。生物降解地膜在自然条件下可被微生物分解,生成环境友好的水和CO2,对环境造成的负面影响较小或产生的生态毒性很少,因具备PE膜的功能[6],将成为PE地膜替代技术而被逐渐推广应用[7]。除此之外,还有光降解地膜、热氧化双降解膜等添加不同催化助剂的促降解地膜产品。目前,以动物、植物、微生物和化石等天然材料为原料的可生物降解地膜成为国内外学者研究的焦点。然而生物降解地膜使用的天然材料具有一定的功能限制,部分材料在加工过程中需要添加更多的化学助剂以增强地膜的耐用性和延展性,包括增塑剂PAEs[8]。若大面积推广无需回收的生物降解地膜,长期使用是否会增加农业土壤PAEs含量从而导致更高的环境累积风险,是我们需要关注的问题。
近年来,我国土壤环境中PAEs的广泛污染使得土壤中残留的PAEs被农作物吸收并在可食部分累积的问题逐渐引起社会广泛关注[9-10]。作物的富集作用将PAEs转移到食物链中,增加了人体摄入的健康风险[11]。一些研究探讨了PAEs在土壤-作物系统中的发生和累积状况、影响植物吸收和积累有机污染物的因素[12-13]。然而,这些研究大多是针对蔬菜作物,对谷物作物中PAEs的累积,特别是从源头分析地膜中PAEs与农田土壤、作物之间关系的研究很少。甘肃是地膜覆盖的主要省份之一,沟垄覆膜玉米种植技术的大面积推广,使得全省地膜使用量逐年增长。因此,本研究以干旱区农田土壤为研究对象,分析不同类型地膜、地膜处理方式和地膜使用年限对土壤PAEs累积的影响,探讨地膜PAEs与土壤、玉米中PAEs的关系,以期为PAEs在土壤和作物中的累积风险、地膜覆盖的环境效应评价及安全使用提供理论依据。
1 材料与方法 1.1 实验材料不同厚度(0.012、0.010、0.008 mm)和不同颜色(白膜、黑膜)的塑料地膜均来自甘肃本地同一品牌的PE地膜。不同降解类型地膜选择了热氧化双降解膜(2种)和全生物降解地膜(省内2种、外省1种)共5种。
1.2 地膜暴晒与填埋试验试验在甘肃省榆中县和永昌县田间进行。5种降解地膜包括热氧化双降解膜2种和全生物降解地膜3种,对照为当地使用的传统PE地膜,地膜厚度均为0.010 mm的黑膜。在地膜降解的60、90、180 d,采集膜下0~5 cm土层带回室内分析。采用单因素随机区组设计,共6个处理,每个处理为一个试验小区,随机排列,3次重复。
暴晒试验按玉米沟垄覆膜作业方式进行铺膜,每个小区每种地膜覆膜长度均为10 m,宽度为玉米种植的垄宽70 cm,每个小区重复3次,曝晒期间不种植任何作物,暴晒区不进行灌溉,用石块对地膜进行固定,以防大风揭膜,确保采样效果。填埋试验每个小区面积约为1.2 m2,将5种降解地膜和普通地膜分别裁剪成40 cm(横向) ×30 cm(纵向)的单层膜片,装入20目防虫网袋中,做好标记,埋入10 cm土层下,每个小区每种地膜放置6片,每个小区重复3次。地膜暴晒试验和填埋试验的农田管理条件相同,试验地点远离田间道路、作物和建筑物,避免遮挡阳光和人为扰动。
1.3 大田覆膜试验不同覆膜年限的玉米沟垄覆膜试验在榆中县马家寺进行,所覆地膜为0.008 mm的传统白色PE地膜。分别采集玉米覆膜种植时间为0(CK)、5、15、25年的田间土壤,不覆膜土壤作为对照,覆膜土壤为沟垄覆膜种植方式,垄宽70 cm,垄高10 cm,85 cm宽的地膜覆在垄上,沟内不覆膜。在玉米生长期间,田间施肥等管理按当地习惯进行。在玉米收获期,分别采集小区垄上覆膜下0~10 cm土壤和对应小区的玉米籽粒。
1.4 样品采集和处理采集的土壤用铝盒保存,避免与塑料制品接触。土壤风干后挑拣去植物根系和地膜等杂物,过1 mm土壤筛并保存在纸质信封袋中。玉米脱粒后,用去离子水冲洗,冷冻干燥,然后用不锈钢研磨机研磨,将细磨的籽粒样品储存在-20 ℃下,待分析。
1.5 PAEs含量测定PAEs检测方法采用气相色谱/质谱法(GCMS)。土样风干过筛,称取5 g土壤(玉米)样品于玻璃离心瓶,加入20 mL丙酮:正己烷(1:1,V/V)(正己烷为色谱级,丙酮为分析纯),隔夜放置后超声波萃取30 min,离心后取上清液于三角瓶,土壤(玉米)再加入20 mL丙酮-正己烷混合液,重复上述步骤两次。60 mL的上清液用旋转蒸发仪在40 ℃下浓缩至1~2 mL,再加入5 mL正己烷以交换丙酮,浓缩到小于1 mL后用0.22 mm膜玻璃过滤器过滤,然后转移到棕色样品瓶并定容至1 mL。目标化合物的回收率在82.2%~106.9%,相对偏差≤10。
气相色谱-质谱系统Agilent 7890GC-5975 MSD (GC-MS)(Agilent Technologies,Avondale,PA)测定提取的化合物。在电子碰撞和全离子监测模式下,用DB-5(30 m×0.25 mm×0.25 mm)熔融石英毛细管柱色谱分离。高纯氦气(99.999 9%)作为载气,保持1.2 mL·min-1的恒定流速。温度设置为50 ℃维持1 min,以15 ℃·min-1升温到200 ℃并维持1 min,然后再以8 ℃·min-1升温到280 ℃并维持3 min,提取液(2 μL) 250 ℃注射到GC–MS系统的传输线,在285 ℃运行温度下以非脉冲不分流进样模式进行测定。
1.6 数据处理用SPSS 17.0进行统计分析,Excel 2016作图。用单因素方差分析(ANOVA)对不同处理间的数据进行Duncan多重比较,以检验差异显著性。使用一元线性回归模型分析玉米籽粒中PAEs含量与土壤中PAEs含量之间的相关性。
2 结果与分析 2.1 不同地膜中PAEs的含量 2.1.1 不同厚度地膜中PAEs的含量不同厚度塑料地膜(0.012、0.010、0.008 mm,均为传统PE地膜)中PAEs含量有显著差异(图 1)。随着塑料地膜厚度的增加,PAEs添加量逐渐增多,0.008 mm地膜中PAEs含量比0.012 mm的减少了56.42%。不同厚度地膜中增塑剂的含量比例也不同,其中DEHP的添加比例明显多,0.012 mm地膜中DEHP的含量比例为92.86%,而0.008 mm地膜中为44.56% (图 2);比较0.010 mm厚度的黑膜与白膜发现,黑膜中PAEs的添加量显著高于白膜。

|
图 1 不同厚度和不同颜色地膜中PAEs含量 Figure 1 Contents of PAEs in plastic films with different thicknesses and with different colors |

|
图 2 不同厚度和不同颜色地膜中PAEs的组成 Figure 2 Components of PAEs in plastic films with different thicknesses and with different colors |
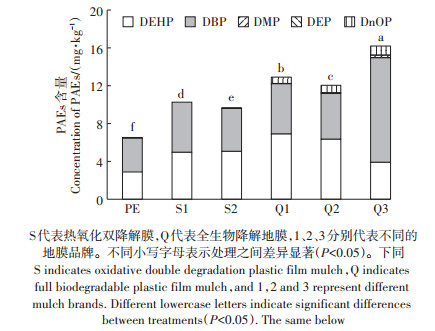
图 3显示,不同降解类型的地膜产品均检测到PAEs类增塑剂,PAEs检测含量在6.60~16.63 mg · kg-1。5种PAEs添加量按从大到小的顺序为邻苯二甲酸二丁酯(DBP)>邻苯二甲酸二(2-乙基)己酯(DEHP) >邻苯二甲酸二正辛酯(DnOP) >邻苯二甲酸二乙酯(DEP) >邻苯二甲酸二甲酯(DMP)。每种地膜的PAEs添加比例、种类不同,添加量较多的种类为DBP和DEHP。不同降解类型地膜中PAEs含量表现为全生物降解地膜>热氧化双降解膜>传统PE地膜,其中Q3生物降解地膜PAEs含量是PE地膜的2.45倍。
|
图 3 不同降解类型地膜中PAEs含量 Figure 3 PAEs contents in different degradation types of plastic film |
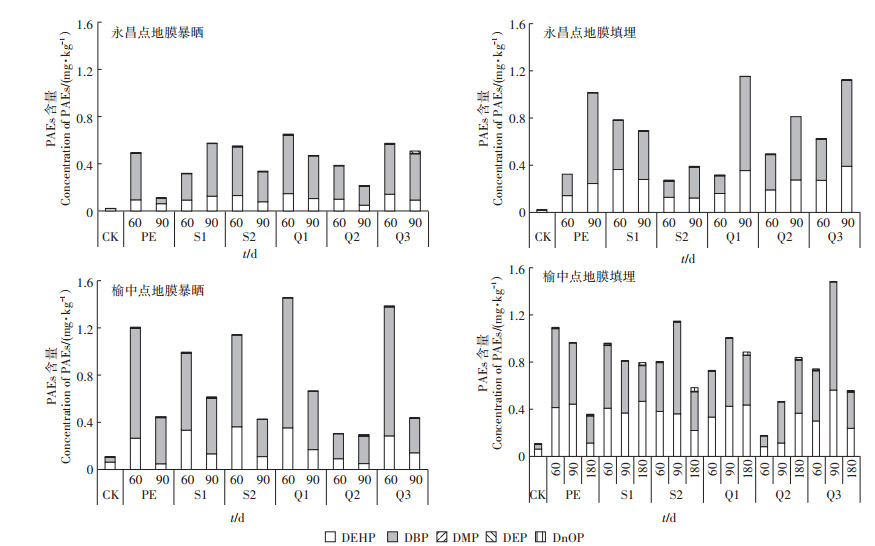
如图 4所示,与对照土样(未覆膜)相比,不同降解类型地膜暴晒和地膜填埋处理下土壤中PAEs含量增加,土壤PAEs含量从大到小的顺序为DBP>DEHP> DEP>DMP>DnOP,其中DBP和DEHP检出率和检出量最高,同时发现当地土壤已出现一定的PAEs累积。在地膜暴晒和地膜填埋处理90 d后,大多数土壤中DBP含量均超过美国环保局规定的DBP土壤控制标准0.080 mg·kg-1,部分土壤DMP和DEP也超过相应的控制标准0.071 mg·kg-1和0.200 mg·kg-1限量[14]。
|
图 4 地膜不同田间处理方式下土壤中PAEs含量 Figure 4 Contents of soil PAEs under different modes of plastic film treatment in field |
在永昌和榆中两个试验点的土壤检测结果均显示,地膜填埋处理土壤PAEs累积量要明显高于地膜暴晒处理,平均高出1.49倍,表明地膜中的PAEs已迁移到土壤中。在60、90、180 d地膜不同处理方式下(暴晒180 d因为地膜完全碎裂无法取样),暴晒处理土壤PAEs累积量随时间的延长大致呈下降趋势,而填埋处理土壤PAEs含量则随填埋时间的延长覆盖90 d后大量累积,在180 d后PAEs部分降解,土壤累积量有所下降。
此外,不同类型地膜中PAEs的含量影响土壤中PAEs的累积量。结合图 3可以看出Q3地膜PAEs含量最多,在地膜填埋和暴晒处理中,Q3土壤中PAEs含量也几乎都高于其他类型地膜,最高达到1.49 mg·kg-1。
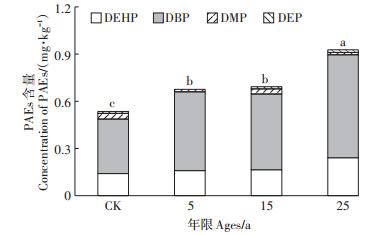
2.3 地膜使用年限对土壤PAEs累积的影响随着地膜使用年限的增加,土壤中PAEs累积不断增加(图 5)。对照组土壤PAEs含量为0.537 mg· kg-1,覆膜种植年限为5、15、25 a的土壤中PAEs含量与CK相比,分别增加了26.35%、29.38%、73.25%,其中DEHP和DBP的检出率最高为100%,DBP的含量最高,变化范围为0.348~0.657 mg·kg-1,全部超过美国土壤PAEs化合物控制标准0.08 mg·kg-1的限量值,占PAEs总量的64.8%~63.9%。此外,DMP和DEP在土壤中含量虽然较低,但二者的土壤控制标准限量值较低,分别为0.020 mg·kg-1和0.071 mg·kg-1,因此二者的超标率也相对较高,而DEHP含量均未超过土壤控制标准的限量值(4.35 mg·kg-1)。
|
图 5 不同地膜使用年限土壤中PAEs含量 Figure 5 Content of PAEs in soil with different mulching ages of plastic film |
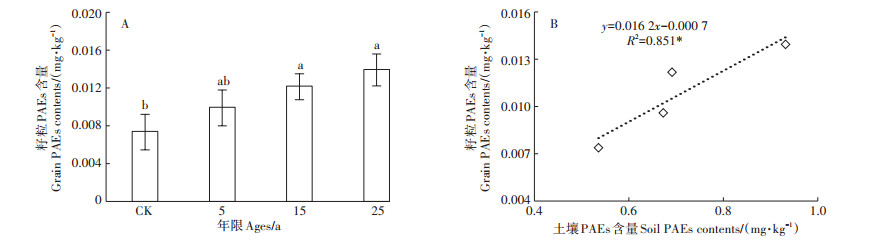
玉米籽粒中仅检测到了DBP(图 6A),其含量为0.037~ 0.013 mg·kg-1之间,而我国卫生部对食品中DBP的最大允许残留量为0.3 mg·kg-1 [15],表明玉米籽粒中DBP含量在安全范围内。不同覆膜种植年限的玉米籽粒中PAEs含量均高于未覆膜种植,但不同覆膜种植年限间玉米籽粒PAEs含量差异不显著。对玉米籽粒和土壤PAEs含量进行相关分析表明,田间土壤和玉米籽粒之间PAE同系物浓度呈正相关关系(图 6B)。
|
图 6 地膜不同使用年限玉米籽粒中PAEs含量及其与土壤PAEs含量的相关性 Figure 6 PAEs content in maize grain with different mulching ages of plastic film and the correlation with soil PAEs content |
塑料制品中PAEs与塑料分子之间由氢键或范德华力连接,彼此保持各自相对独立的化学性质,所以稳定性相对较差,容易从塑料中渗出,这意味着地膜中PAEs的添加量会直接影响其向土壤中迁移的数量[16]。试验发现0.012 mm地膜相对其他厚度地膜PAEs添加量最高。PAEs主要用作塑料的增塑剂和软化剂,可提高塑料制品的可塑性和强度,因此,更厚的地膜需要添加更多的PAEs以增加塑料的抗撕裂能力和延展性[12]。考虑到农田残膜污染问题,0.008 mm的超薄地膜已经在农业实践中被淘汰,推广使用较厚的标准地膜时,其中的PAEs污染问题也不容忽视。
本研究检出可降解地膜PAEs含量高于普通PE地膜(图 3)。传统LLDPE(低密度线性聚乙烯材料)本身具有极高的抗伸强度、抗穿透性、抗撕裂性和伸长率,更加适用于制造薄膜,减少了加工过程中PAEs的添加。目前生物降解地膜多为聚乳酸(PLA)、聚羟基酯肪酸酯(PHAs)、热塑性淀粉等新型可降解母料,然而这些材料都存在一定的耐水性、稳定性和弹性差的问题[17],因此,在地膜加工过程中需要添加更多的PAEs以增加塑料的稳定性和柔韧性以便于地膜吹塑,提高成品地膜的使用性能[16]。相比于传统地膜,PAEs含量高的可降解地膜可能会导致更大的PAEs迁出风险,使其在土壤中累积量相对增加。因此,在可降解地膜推广应用时,不能只片面强调其优点,而忽略增塑剂带来的土壤污染风险。目前,在没有环保型增塑剂替代的情况下,大面积推广全生物降解地膜需要更加谨慎。
3.2 地膜田间处理方式对土壤PAEs降解的影响应对农田残膜问题研发的易降解、无需回收的降解地膜已经在各地区推广使用,然而本研究发现,地膜填埋处理相对于暴晒处理会导致土壤中PAEs的增加。目前研究发现PAEs降解途径包括水解、光解和生物降解,生物降解是PAEs降解的主要途径,自然因素影响PAEs的降解主要通过影响微生物活性的方式进行[8]。暴晒条件(如光热)一方面促进塑料地膜的老化,使PAEs挥发到空气中;另一方面,土壤表层良好的水热条件也有助于已经迁移的PAEs发生生物降解。土壤残膜在翻耕模式下被埋进土壤,与土壤充分接触,不利于PAEs的自然挥发,导致PAEs直接迁移到土壤中。随着土壤深度的增加,土壤温度和土壤含氧量的变化限制了微生物的活性,从而减缓了PAEs生物降解的发生。土壤中PAEs同系物含量较高的DEP有两种降解途径,一种是脱酯化,即两条二乙基链先水解为单酯MEP,然后水解为PA;另一种降解途径是脱甲基或酯交换,水解产物PA通过乙基的DEP脱甲基形成EMP,两种降解途径的最终产物都为CO2和水[18]。同系物DEHP在各种土壤中降解的主要代谢产物为MEHP,最终降解产物为CO2和水,但MEHP的生态毒性高于DEHP[19]。研究还发现,与好氧性土壤相比,DEHP污染会在厌氧性淹没土壤中产生更多的有毒单酯代谢物(MEHP),并诱导细菌菌群发生变化。PAEs的降解并不意味着其生态毒性的消失,虽然填埋处理减少了PAEs的挥发,但可能导致了PAEs厌氧性降解发生,从而产生更多的有毒降解中间体,引起土壤PAEs含量的上升。因此,增加地膜厚度以提高地膜回收率、减少替代地膜翻耕填埋可能是减少白色污染残留和增塑剂在土壤中累积风险的有效措施之一。
3.3 地膜使用年限对土壤和玉米籽粒中PAEs累积的影响研究表明,有机污染物进入土壤环境后可能发生的行为包括渗入地下水、生物降解、挥发以及发生老化作用与土壤固相结合并转移到生物体[20]。老化行为的发生使PAEs生物有效性降低,并随着时间的推移促进非生物可利用残留物的形成,使PAEs难以被生物利用或降解,长期固存于土壤中造成土壤累积风险[21]。通过地膜暴晒和填埋大田试验的动态监测发现,地膜中PAEs能够迁移到土壤中,它在短期内不能完全降解和挥发,土壤PAEs的累积量还受不同类型地膜PAEs剂量大小的影响,并且发现DBP累积量超出美国环保局对土壤中DBP含量制定的控制标准0.080 mg·kg-1。通过田间地膜长期使用年限试验(榆中县)发现,随着地膜覆盖年限的延长,土壤PAEs含量呈现上升趋势,且与CK相比差异显著。由此推测,虽然微生物在一定程度上能够降解地膜迁移到土壤中的PAEs,但伴随着土壤PAEs老化行为的发生,PAEs与土壤有机组分结合而残留在土壤中,可造成PAEs在土壤中长时间累积。Wu等[22]研究结果表明,PAEs会与土壤有机物结合,其累积量与土壤有机物含量呈正相关关系。因此,地膜长期使用和地膜残留会增加土壤中PAEs的含量,增加土壤污染风险。
不同覆膜种植年限的玉米籽粒中均检测到了DBP,证明玉米能够吸收土壤中的PAEs污染物并在体内累积,这与Sun等[23]研究结果一致。Ling等[24]研究发现细胞壁为有机污染物的主要存储区,它们可能参与了植物中污染物的耐受性和排毒。Gao等[25]发现多环芳烃(PAHs)能够穿过细胞壁,溶解在细胞溶液并分配到黑麦草丛枝菌根的细胞器中。此外,值得注意的是本研究玉米籽粒中仅检测到了DBP,而其他PAEs污染物几乎未检出,推测与有机化合物本身化学物质辛醇水分配系数有关,有机污染物通常从土壤孔隙水中被摄入植物体内,碳链越长、分子量越大的有机化合物辛醇分配系数越高,化合物亲脂性越强,极性越弱。因此,分子量较大的DEHP相对于DBP亲水性较弱,很难被植物吸收到体内[26-27]。研究还发现土壤中DBP含量与籽粒中的含量具有显著正相关关系,Shi等[28]在小麦籽粒研究中也观察到相似的结果,推测籽粒中PAE的积累可能主要来自土壤中根系吸收和转移,然而玉米吸收转运和分配的具体过程还需要进一步研究。DBP含量较高的土壤可能导致玉米籽粒中累积较多的污染物,因此,需要更加关注土壤PAEs污染导致的人体健康风险。
4 结论(1) 0.012 mm的加厚地膜比普通地膜含有更多的PAEs;可降解地膜中PAEs的含量高于传统PE地膜。地膜中PAEs含量与土壤PAEs累积量呈正相关。
(2) 地膜填埋处理与暴晒处理相比会导致PAEs在土壤累积,即使使用可生物降解地膜,也建议尽量采取回收措施。覆膜种植年限更长的土壤存在较高的PAEs累积风险。
(3) 玉米能够吸收土壤中的PAEs污染物并累积到籽粒中,PAEs在籽粒中的累积可能与自身的化学性质有关,需要关注土壤PAEs污染导致的作物污染以及人体暴露风险。
| [1] |
李玉双, 陈琳, 郭倩, 等. 沈阳市新民设施农业土壤中邻苯二甲酸酯的污染特征[J]. 农业环境科学学报, 2017, 36(6): 1118-1123. LI Yu-shuang, CHEN Lin, GUO Qian, et al. Pollution characteristics of phthalate esters in greenhouse agricultural soil in Xinmin, Shenyang City[J]. Journal of Agro-Environment Science, 2017, 36(6): 1118-1123. |
| [2] |
梁曾恩妮, 方志辉, 谢秋涛, 等. 农用地膜及其增塑剂检测方法研究进展[J]. 塑料科技, 2017, 45(11): 109-114. LIANG Zeng-enni, FANG Zhi-hui, XIE Qiu-tao, et al. Recent progress in agricultural film and detection methods for plasticizer[J]. Plastics Science and Technology, 2017, 45(11): 109-114. |
| [3] |
You Y M, Wang Z G, Xu W H, et al. Phthalic acid esters disturbed the genetic information processing and improved the carbon metabolism in black soils[J]. The Science of the Total Environment, 2019, 653: 212-222. DOI:10.1016/j.scitotenv.2018.10.355 |
| [4] |
Li Q, Li H B, Zhang L, et al. Mulching improves yield and water-use efficiency of potato cropping in China:A meta-analysis[J]. Field Crops Research, 2018, 221: 50-60. DOI:10.1016/j.fcr.2018.02.017 |
| [5] |
马彦, 杨虎德. 甘肃省农田地膜污染及防控措施调查[J]. 生态与农村环境学报, 2015, 31(4): 478-483. MA Yan, YANG Hu-de. Investigation on pollution caused by mulching plastic film in Gansu Province and the countermeasures[J]. Journal of Ecology and Rural Environment, 2015, 31(4): 478-483. |
| [6] |
Kyrikou I, Briassoulis D. Biodegradation of agricultural plastic films:A critical review[J]. Journal of Polymers and the Environment, 2007, 15(2): 125-150. DOI:10.1007/s10924-007-0053-8 |
| [7] |
Kasirajan S, Ngouajio M. Polyethylene and biodegradable mulches for agricultural applications:A review[J]. Agronomy for Sustainable Development, 2012, 32(2): 501-529. |
| [8] |
Abdel Daiem M M, Rivera-Utrilla J, Ocampo-Pérez R, et al. Environmental impact of phthalic acid esters and their removal from water and sediments by different technologies:A review[J]. Journal of Environmental Management, 2012, 109: 164-178. |
| [9] |
Mo C H, Cai Q Y, Tang S R, et al. Polycyclic aromatic hydrocarbons and phthalic acid esters in vegetables from nine farms of the Pearl River Delta, south China[J]. Archives of Environmental Contamination and Toxicology, 2009, 56: 181-189. DOI:10.1007/s00244-008-9177-7 |
| [10] |
Ma T T, Christie Peter, Luo Y M. Phthalate esters contamination in soil and plants on agricultural land near an electronic waste recycling site[J]. Environmental Geochemistry and Health, 2013, 35(4): 465-476. DOI:10.1007/s10653-012-9508-5 |
| [11] |
Toft G, Jönsson B A G, Lindh C H, et al. Association between pregnancy loss and urinary phthalate levels around the time of conception[J]. Environmental Health Perspectives, 2012, 120(3): 458-463. DOI:10.1289/ehp.1103552 |
| [12] |
Fu X W, Du Q Z. Uptake of Di-(2-ethylhexyl)phthalate of vegetables from plastic film greenhouses[J]. Journal of Agricultural and Food Chemistry, 2011, 59(21): 11585-11588. DOI:10.1021/jf203502e |
| [13] |
Collins C, Fryer M, Grosso A. Plant uptake of non-ionic organic chemicals[J]. Environmental Science & Technology, 2006, 40(1): 45-52. |
| [14] |
New York State Department of Environmental Conservation. SVOCs soil cleanup objectives. AppendixAofTAGM#4046[S/OL]. (2006-11)[2017-10-05]. http//www.dec.state.ny.us/website/der/tagms/prtg4046c, 2003.
|
| [15] |
中华人民共和国卫生和计划生育委员会.食品安全国家标准: 食品接触材料及制品用添加剂使用标准GB 9685-2016[S].北京: 中国标准出版社, 2017. National Health Commission of the People's Republic of China. National food safety standard: National food safety standard standard food contact materials articles GB 9685-2016[S]. Beijing: China Standards Press, 2017. |
| [16] |
Marcilla A, García S, García-Quesada J C. Study of the migration of PVC plasticizers[J]. Journal of Analytical and Applied Pyrolysis, 2004, 71(2): 457-463. DOI:10.1016/S0165-2370(03)00131-1 |
| [17] |
严昌荣, 刘勤. 生物降解地膜技术存在问题与应用分析[J]. 生物技术, 2016, 34(9): 66-67. YAN Chang-rong, LIU Qin. Problems and application analysis of biodegradable mulch technology[J]. Biotechnology, 2016, 34(9): 66-67. |
| [18] |
Sun C Z, Zhang G, Zheng H, et al. Fate of four phthalate esters with presence of Karenia brevis:Uptake and biodegradation[J]. Aquatic toxicology, 2019, 206: 81-90. DOI:10.1016/j.aquatox.2018.11.010 |
| [19] |
Zhu F X, Zhu C Y, Zhou D M, et al. Fate of di(2-ethylhexyl)phthalate and its impact on soil bacterial community under aerobic and anaerobic conditions[J]. Chemosphere, 2019, 216: 84-93. DOI:10.1016/j.chemosphere.2018.10.078 |
| [20] |
Reid B J, Jones K C, Semple K T. Bioavailability of persistent organic pollutants in soils and sediments:A perspective on mechanisms, consequences and assessment[J]. Environmental Pollution, 2000, 108(1): 103-112. |
| [21] |
赵青, 李培军. 有机污染物在土壤中老化行为的研究进展[J]. 生态学杂志, 2008, 27(3): 476-479. ZHAO Qing, LI Pei-jun. Research progress in aging behaviors of soil organic pollutants[J]. Chinese Journal of Ecology, 2008, 27(3): 476-479. |
| [22] |
Wu X, Zhu L Z. Evaluating bioavailability of organic pollutants in soils by sequential ultrasonic extraction procedure[J]. Chemosphere, 2016, 156: 21-29. DOI:10.1016/j.chemosphere.2016.04.113 |
| [23] |
Sun J, Wu X, Gan J. Uptake and metabolism of phthalate esters by edible plants[J]. Environmental Science & Technology, 2015, 49(14): 8471-8478. |
| [24] |
Ling W T, Lu X D, Gao Y Z, et al. Polyphenol oxidase activity in subcellular fractions of tall fescue contaminated by polycyclic aromatic hydrocarbons[J]. Journal of Environmental Quality, 2012, 41(3): 807-813. |
| [25] |
Gao Y Z, Cao X Z, Kang F X, et al. PAHs pass through the cell wall and partition into organelles of arbuscular mycorrhizal roots of ryegrass[J]. Journal of Environmental Quality, 2011, 40(2): 653-65. |
| [26] |
Kong S F, Ji Y Q, Liu L L, et al. Diversities of phthalate esters in suburban agricultural soils and wasteland soil appeared with urbanization in China[J]. Environmental Pollution, 2012, 170: 161-168. DOI:10.1016/j.envpol.2012.06.017 |
| [27] |
Staples C A, Peterson D R, Parkerton T F. The environmental fate of phthalate esters:A literature review[J]. Chemosphere, 1997, 35(4): 667-749. DOI:10.1016/S0045-6535(97)00195-1 |
| [28] |
Shi M, Sun Y Y, Wang Z H, et al. Plastic film mulching increased the accumulation and human health risks of phthalate esters in wheat grains[J]. Environmental Pollution, 2019, 250: 1-7. DOI:10.1016/j.envpol.2019.03.064 |
 2020, Vol. 39
2020, Vol. 39


