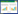文章信息
- 王立, 安广楠, 马放, 吴洁婷, 张雪, 王敏
- WANG Li, AN Guang-nan, MA Fang, WU Jie-ting, ZHANG Xue, WANG Min
- AMF对镉污染条件下水稻抗逆性及根际固定性的影响
- Effects of Arbuscular Mycorrhizal Fungi on Cadmium Tolerance and Rhizospheric Fixation of Rice
- 农业环境科学学报, 2014, 33(10): 1882-1889
- Journal of Agro-Environment Science, 2014, 34(17): 1882-1889
- http://dx.doi.org/10.11654/jaes.2014.10.002
-
文章历史
- 收稿日期:2014-3-27
随着工业发展及人类不合理活动,含有Cd的污染物通过各种途径进入土壤,由于Cd在土壤中的长期滞留性和难降解性,致使其通过作物可食部分进入食物链,进而危害人类健康。目前,Cd已成为我国污染面积最大、影响最为深远的重金属元素。
水稻是我国最重要的经济作物之一,极易受到Cd污染的影响,其富集系数高达0.15左右[1].Cd污染环境条件下,一方面由于Cd的胁迫作用,导致作物生长受到抑制,影响产量;另一方面由于作物的富集作用导致严重的粮食生产安全问题。
自1981年Bradley等[2,3]首次报道石楠属菌根能降低宿主植物对过量重金属铜的吸收以来,菌根真菌对植物在过量重金属条件下的耐受性影响,以及菌根植物对重金属元素转运过程的影响等研究已逐渐引起人们的关注。丛枝菌根(AM)是一种菌根真菌与宿主植物根系形成的共生体系,这一复合吸收器官可通过改善植物根际的营养水平促进植物生长、提高植物抗逆性能,并影响重金属元素的吸收、固定与转运过程。已有研究结果表明,在铜[4,5,6]、锌[7,8,9]、镉[10]等重金属元素胁迫条件下,菌根真菌的接种均可在一定程度上缓解重金属对植物的毒害作用,并在其吸收、转运过程中发挥着重要的作用。但是,由于菌根是一个多生物组分的复杂系统,不同菌种与宿主的共生体对不同浓度和不同种类重金属的敏感性有所不同,目前该领域的研究成果相当有限,结论也并不相同。有研究表明菌根真菌的存在可通过对植物元素吸收和生长过程,加速对重金属元素的吸收与富集[7],但也有证据表明菌根可通过菌丝固持和分泌物螯合等作用增强植物根际对重金属的固持作用[11]而降低宿主植物对过量重金属的吸收。目前,有关菌根真菌接种条件下水稻对重金属Cd的吸收、转运过程并不明朗,急需进行专门研究,揭示Cd污染条件菌根的形成对水稻根际Cd元素的吸收与积累过程的影响情况。
本文拟通过Cd污染胁迫实验,探讨菌根对水稻根际Cd元素固持或积累过程中可能发挥的重要角色,以期找到一种在当前我国土壤Cd污染面积广泛、难以完全弃耕条件下有效缓解重金属对水稻的毒害并同步减少水稻Cd富集的有效方法。 1 材料与方法 1.1 试验材料
供试菌剂由黑龙江大学生命技术学院提供,AMF分别为:摩西球囊霉(Glomus mosseae)和根内球囊霉(Glomus intraradice).供试水稻品种为北稻4号,种子购于黑龙江省农科院,全生育期120 d.供试土壤采自黑龙江省双城市前进乡城市水资源与水环境国家重点实验室“农用化学品源头减量示范基地”(125°41′~126°42′E,45°08′~45°43′N),基本理化性质如下:有机质含量19.67 g·kg-1,全氮含量834.27 mg·kg-1,有效磷含量221.12 mg·kg-1,有效钾含量53.67 mg·kg-1,总镉0.011 mg·kg-1,pH为6.1~6.5.土样经过121 ℃高压灭菌120 min后晾干备用。
污染土壤的制备:配置CdCl2·2.5H2O混合液,均匀加入供试土样,设0、0.5、1、2、5 mg·kg-1(纯Cd计)五个处理。污染土样风干后,分装于10 L整理箱,加去离子水淹没土壤,避光保存4周备用。 1.2 试验方法
称取4.0 kg含水率相同的污染土样置于长、宽、高分别为65 cm、18 cm、20 cm的塑料盆钵中,将所用菌剂以200 g·pot-1混入处理过的土样,设CK(对照组)、GM(G. mosseae)、GI(G. intraradice)三种处理,其中 CK 为接种等量的灭菌后的菌剂和不灭菌接种剂的滤液 15 mL,以保证土壤微生物区系一致性。加水至50%田间最大持水量,静置过夜。将水稻种子用0.1%~0.2%的高锰酸钾溶液浸种24 h后,在28 ℃恒温箱中加水浸润催芽1周,将长势相对良好的秧苗移栽到装有处理土样的塑料盆钵中,其后1周和2周时两次间苗,最后每盆留苗10株。 1.3 测定方法
侵染率测定:取新鲜根样,剪成 1 cm 根段,随机取出部分根样用曲利苯蓝-直线截获法测定根系侵染率,并在显微镜下观察丛枝菌根侵染状况。
株高测定:水稻生长至成熟期,每个处理随机取3株,从茎基部至穗顶部测量株高,并取平均值。
生物量测定:将采集的植物样品在 105 ℃下预处理 30 min 后,于 70 ℃下烘干 24 h,称量地上部和根系干重。
光合速率测定:待移栽45 d后,水稻-重金属-根系微生物之间相互作用的关系趋于稳定时测定,此时水稻正处于分蘖旺期,生长旺盛。光合速率(Pn)采用Li-6400(美国)便携式光合作用测定仪测定。测定时取完全展开的倒二叶。
生理指标测定:采集水稻倒三叶,鲜样液氮速冻,分析SOD(超氧化物歧化酶)活性、MDA(丙二醛)和Pro(脯氨酸)含量。SOD活性采用NBT法[13],MDA含量参照Dixit等[12]的方法,Pro含量用磺基水杨酸提取,茚三酮比色法测定[13].
植物样品中Cd元素分析:植物样品用粉碎机磨碎后,称取0.300 0 g至50 mL三角瓶中,以HNO3∶HClO4=7∶3(V/V)比例的混合溶液浸泡过夜,次日在电热板上消解至溶液清亮,将消解液用超纯水定容至25 mL.采用等离子体-电感耦合发射光谱仪(ICE-OES)测定消解液中Cd含量。
土壤基本理化性质的测定采用常规分析方法[14]. 1.4 数据统计与分析
光合速率(Pn)对光合有效辐射强度(PAR)响应曲线(Pn-PAR曲线)依据Bassman和Zwier[15]的方法拟合,曲线方程为:
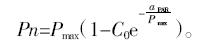
式中:Pmax为最大净光合速率;a为弱光下光量子利用效率;C0为弱光下度量光合速率趋近于0的指标。 以PAR为横坐标、Pn为纵坐标作出光合响应曲线。
生物富集系数以及转运系数的计算方法[16,17]如下:生物富集系数=地上部植物中元素质量分数/土壤中元素质量分数;转运系数=地上部植物中元素质量分数/地下部植物中元素质量分数。
采用SPSS 17.0对试验数据进行统计分析,5%水平下 LSD 多重比较检验各处理平均值之间的差异显着性。 2 结果与讨论 2.1 AMF对Cd胁迫条件下水稻生长的影响
水稻可与两种受试菌种GM、GI形成良好的互利共生关系,其中GM侵染率为48.53%,GI为37.13%.两种菌剂的侵染均可显着促进水稻的生长,并在不同程度上弥补Cd胁迫带来的生长抑制。
株高是反映植物营养生长状况的最直接指标,不同处理条件下水稻的生长状况如图 1所示。随着Cd浓度增加,不同菌剂处理条件下的水稻株高均呈现先急剧后趋平稳的降低规律。无Cd胁迫条件下,GM侵染水稻株高最高,达75.4 cm,GI侵染植株次之,为74.8 cm,非侵染水稻最矮,为71.6 cm.GM、GI处理下的株高与对照组相比,菌根效应分别为5.3和4.5.低浓度Cd胁迫下(0.5 mg·kg-1)并未表现出刺激水稻生长的作用,可能是因为Cd在自然环境土壤中含量很低,水稻对Cd的添加较为敏感,而0.5 mg·kg-1超出其耐受极限范围,导致在此浓度下产生胁迫效应。有学者对比研究了不同基因型水稻Cd的耐受程度,当超过0.3 mg·kg-1时,生长指标便有所下降[18].当 Cd含量达到5 mg·kg-1时,水稻株高受Cd胁迫更为明显,各处理间差异也趋于显着,GM、GI处理下的株高与对照组相比,菌根效应分别为13.8和10.3.
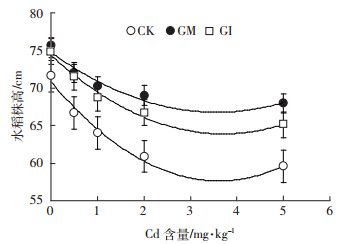
|
| 图 1 不同Cd 含量处理下,菌剂对水稻株高的影响 Figure 1 Effect of AMF on rice plant height under different concentrations of Cd |
从表 1曲线的初始斜率可知三种处理条件下水稻株高降低程度为CK>GI>GM.Cd含量高于2 mg·kg-1后,对植物的生长抑制效应均逐渐减弱,不同处理水稻先后达到生长胁迫的临界点附近(3.61、3.57、3.71 mg·kg-1),在此浓度附近水稻营养生长维持在较低值,表明Cd含量的继续增加将导致水稻陆续死亡,而不再呈现以株高降低为特征的抗逆生长响应。试验浓度梯度内的5 mg·kg-1Cd已经达到水稻抗性生长的临界极限。
图 2是不同Cd浓度下,各处理间水稻地上、地下部分的生物量。接种 AMF 后,水稻生物量明显增加。与 CK 相比,AMF 接种处理相应地上部干重增加幅度为9.7%~18.1%,根干重增加幅度为 14.9%~40.9%,说明两种 AMF 均对水稻生长有明显的促进作用,尤其是根系。随着Cd胁迫浓度的提高,各处里间生物量有不同程度的降低,菌剂处理条件下的水稻生物量降低程度明显低于对照组(P<0.05).这表明在此浓度梯度内的Cd胁迫下,AMF对水稻生长有明显的保护作用。
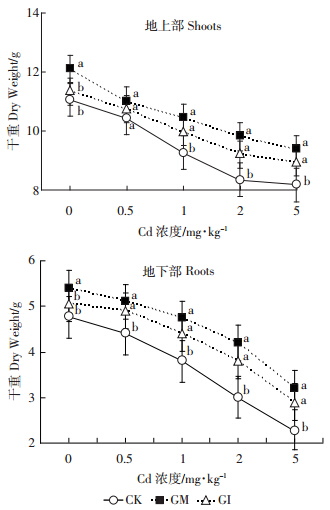
|
| 同一浓度下不同字母表示差异显著(P<0.05) 图 2 不同Cd含量处理下菌剂对水稻生物量的影响 Figure 2 Effect of AMF on rice biomass under different concentrations of Cd |
总体来说,过量的Cd会导致植物细胞膜系统,蛋白质、核酸等生物大分子遭到破坏,抑制水稻生长[19,20,21].AMF的接种促使矿质营养的增加,进一步促进了根系的生长,而根外菌丝的延伸作用,使植株能从根系不能到达的区域摄取额外的矿质营养,以满足水稻正常生长的营养需求。因此,GM与GI均可有效降低Cd胁迫对水稻生长的影响。二者相比,GM效果更佳。 2.2 AMF对Cd胁迫条件下水稻光合作用的影响
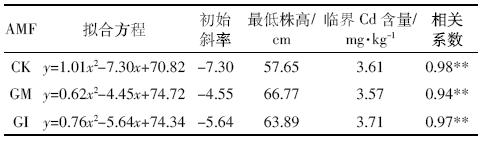
最大净光合速率是体现植物光合能力的重要参数。当Cd含量为0时,GM与GI处理的水稻其光合速率高于对照组,但二者之间差异并不显着;随着Cd含量的升高,各组光合速率均不同程度地下降,当Cd含量达到5 mg·kg-1时,各菌剂处理间的差异最为明显(P<0.05).这可能是因为Cd处理导致水稻叶片中叶绿素的含量、叶绿体捕获光能的能力都有所降低,与光合作用有关的酶类也会受到抑制[22,23].
菌剂的添加可以显着缓解Cd对水稻光合生理的胁迫作用,当Cd含量达到5 mg·kg-1时,GM与GI处理条件下,水稻的净光合速率分别较对照组提高48.9%和24.0%.这可能是由于接种AMF 促进了水稻叶片叶绿素和类胡萝卜素的合成速率,加强了水分和其他营养成分的吸收与转运,使光合速率有了较大程度的提高[24].从两种菌剂的对比来看,GM处理后的植物净光合速率更高,且在高Cd胁迫条件保证植物仍具有较旺盛的光合能力。
Pn-PAR曲线最初部分的斜率可以表征光量子效率(AQY),是光能转化效率指标之一[25].如表 2所示,低Cd(<2 mg·kg-1)浓度范围内,GM与GI处理条件下,水稻的AQY均高于对照组,表明菌剂添加可以提高植物对弱光的利用效率。随着Cd浓度的增加,水稻的AQY变化并不显着,表明弱光条件下光照强度是限制植物光合作用的限制因子。
Pn-PAR曲线趋近于最大值时的光照强度为光饱和点LSP(Light Saturation Point)[26],是表征植物在强光下光能利用能力的生理指标。由图 3可知,水稻的LSP与土壤中Cd含量呈负相关关系。强光条件下,光照强度不再成为光合作用的限制因子,水稻对光资源的利用范围明显降低。GM与GI组水稻的光饱和点较对照组均有显着的提高(P<0.05),且随着Cd胁迫的增强,菌剂的保护作用逐渐增强。在5 mg·kg-1 Cd浓度条件下,GM与GI处理的水稻光饱和点分别较对照提高44.2%和26.9%.AMF的接种可在一定程度上缓解Cd对水稻利用强光的胁迫作用。
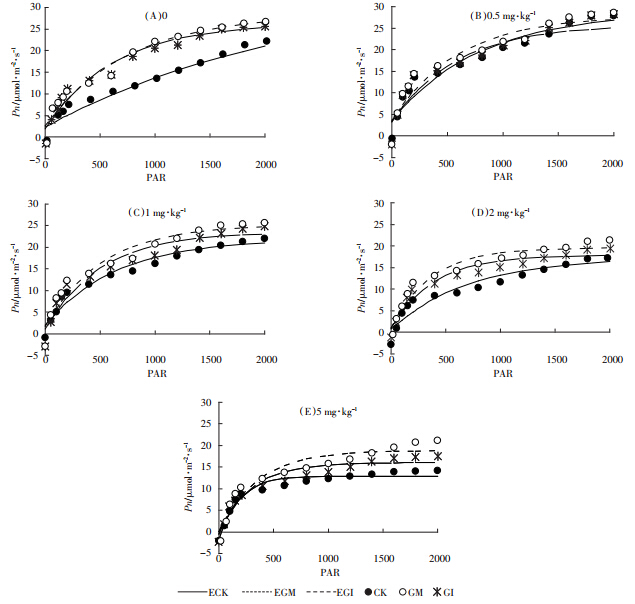
|
| 图 3 各浓度下不同AMF处理水稻的Pn-PAR曲线 Figure 3 The Pn-PAR curves of rice inoculated with AMF under different concentrations of Cd |
由以上分析可知,AMF可以提高逆境下植株光合作用水平[27],本实验结果也证明了这点。接种AMF可促进水稻叶片叶绿素的合成速率,加强水分和其他营养成分的吸收与转运,使之有利于菌根植物的气体交换。因此,Cd浓度的增加在一定程度上虽然抑制水稻光资源利用效率和范围,但是接种AMF菌剂可有效缓解重金属的胁迫作用,保护水稻正常光合生理活性。 2.3 AMF对Cd胁迫条件下水稻生理的影响
为进一步分析AMF对镉胁迫下水稻生长生理响应的影响机制,选择处理间差异最为显着的5 mg·kg-1的Cd处理为例,对比分析水稻体内与抗逆胁迫密切相关的几种生理指标的变化情况。SOD是一种保护酶类,具有清除和减少破坏性氧自由基的作用,其活性可以表征植物的抗氧化能力;MDA是植物在逆境中遭受氧化胁迫发生膜脂过氧化的产物,可反映植物对逆境条件反应的强弱;Pro可以作为细胞质渗透调节物质,其含量的增减是植物对逆境胁迫的一种生理生化反应,既可能是植物细胞结构和功能受损伤的表现,又可能是植物对逆境胁迫的适应性反应[28,29].SOD活性和Pro含量与植株Cd含量呈负相关,而MDA含量与植株Cd含量呈正相关;即植株Cd含量高的情况下,SOD活性、Pro含量较低,而MDA含量较高[30].
表 3结果表明,同样的处理条件下,两种菌剂对于水稻的SOD活性均有一定的促进作用。GM组与GI组比对照组分别提高69.8%与94.0%,SOD活性维持一个较高的水平时更能保证生物膜的能量交换、物质运输等过程的正常进行[8].对照组的MDA含量高于GM组与GI组,表明在AMF侵染条件下,膜质过氧化程度较轻,细胞质膜因Cd胁迫作用引起的伤害程度较弱[29].GM组与GI组的Pro含量均高于对照,分别提高36.4%与57.4%,这说明菌剂可显着提高水稻对Cd胁迫条件下的忍耐力和适应性[31].
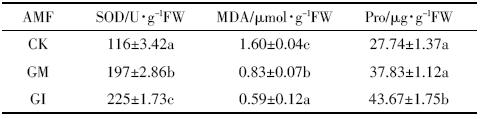 |
AMF的接种使得Cd胁迫下SOD活性相对稳定,可以持续清除膜脂过氧化作用所产生的氧自由基,因而植物体内MDA含量较低。Cd胁迫下,Pro的积累使细胞和组织持水平衡,稳定生物大分子结构,保持膜结构的完整性使细胞免受伤害[32].菌剂的添加能有效保护水稻在Cd污染条件下对营养、水分的吸收和利用,进一步证实了高Cd (5 mg·kg-1)胁迫下,菌剂对水稻的生长有较为明显的促进作用。因此可证明,菌剂对水稻的耐胁迫性有显着提高(P<0.05),对水稻在逆境中的生长提供一定的保护。 2.4 AMF对Cd在水稻体内转运的影响
接种AMF后,重金属Cd在水稻地上部分与根系的分配变化明显。如表 4所示,在外源添加重金属Cd的条件下,两种AMF处理的水稻的富集系数和转运系数均低于对照。其中菌剂处理条件下的转运系数与对照组差别较为明显。
从富集系数表征情况来看,菌剂在一定程度上降低了水稻对Cd的积累程度。GI处理条件下的富集系数在浓度梯度内的2 mg·kg-1效果最为显着,与对照组相比降低74.76%.而GM处理条件下的富集系数在浓度梯度内的0.5 mg·kg-1效果最为显着,与对照组相比降低68.01%.
菌剂处理条件下各个浓度处理的转运系数均明显低于对照且均小于0.5.在实验的5个浓度条件下,GI处理的效果最为明显,与对照组相比,其转运系数降低47.06%~91.22%,在2 mg·kg-1时效果最为显着;GM处理条件下,转运系数与对照相比降低35.29%~72.72%,在5 mg·kg-1时效果最为显着。
AMF很可能通过菌丝固持作用促进根系分泌小分子有机酸,与重金属发生螯合作用抑制土壤中重金属的移动性[33,34,35,36],进而抑制Cd从植物根部转移到地上部分,提高宿主的耐性。另外,AMF的根外菌丝对重金属的吸持能力较强,其菌丝和孢子均能吸附和固持大量的金属[38].这些都可能是导致Cd在水稻根系固定的原因,除此之外,还与土壤的营养条件以及重金属抗性等因素有关,这仍需要通过进一步研究证实。 3 结论
(1)在不同浓度的Cd胁迫下,接种AMF均有助于水稻的生长,其中在高浓度的Cd胁迫下,菌剂的效果最为明显。与未接菌对照组相比,接种菌根GM、GI使得水稻株高分别提高了13.8%、10.3%,地上及根系生物量分别提高18.1%、40.9%及9.3%、27.8%.AMF的接种可以显着地改善Cd胁迫下水稻对强光的利用效率,提高水稻的光合作用能力,土壤中Cd浓度达到5 mg·kg-1时,GM与GI处理条件下的植物净光合速率分别较对照提高48.9%和24.0%
(2)在对水稻的不同处理中,可以看出AMF侵染条件下,水稻对Cd胁迫有更强的耐受性,水稻植株SOD活性及Pro含量均有显着提高,MDA含量明显降低(P<0.05).因此,在高Cd污染条件下,菌剂对水稻有较强的保护作用。
(3)接种AMF处理影响了Cd在水稻植株以及根系的转运及分布。从效果上来看,两种AMF处理均有将Cd固定在根系并减少其向上转移的作用,有效地降低了Cd在水稻籽实中过度积累的可能性,并促进了其在水稻根际的固定化过程,因而对农业生产中涉及到的环境安全问题具有积极意义。
| [1] | 张红振, 骆永明, 章海波, 等. 水稻、小麦籽粒砷、镉、铅富集系数分布特征及规律[J]. 环境科学, 2010, 31(2):488-495. ZHANG Hong-zhen, LUO Yong-ming, ZHANG Hai-bo, et al. Characterizing the plant uptake factor of As, Cd and Pb for wheat cereal[J]. Environmental Science, 2010, 31(2):488-495. |
| [2] | Bradley R, Burt A J, Read D J. The biology of mycorrhiza in the Ericaceae:Ⅷ. The role of mycorrhiza infection in heavy resistance[J]. New Phytologist, 1982, 91(2):197-209. |
| [3] | Bradley R, Burt A J, Read D J. Mycorrhiza infection and resistance to heavy metal toxicity in Callaunanvulgarism[J]. Nature, 1981, 292:336-337. |
| [4] | Loland J Ø, Singh B R. Copper contamination of soil and vegetation in coffee orchards after long-term use of Cu fungicides[J]. Nutrient Cycling in Agroecosystems, 2004, 69(3):203-211. |
| [5] | 申 鸿, 刘 于, 李晓林, 等. 丛枝菌根真菌(Glomuscaledonium)对铜污染土壤生物修复机理初探[J]. 植物营养与肥料学报, 2005, 11(2):199-204. SHEN Hong, LIU Yu, LI Xiao-lin, et al. Influence of arbuscularmycorrhizal fungus(Glomuscaledonium) on maize seedlings grown in copper contaminated soil[J]. Plant Nutrition and Fertilizer Science, 2005, 11(2):199-204. |
| [6] | Andrade S A L, Grato P L, Azevedo R A, et al. Biochemical and physiological changes in jack bean under mycorrhizal symbiosis growing in soil with increasing Cu concentrations[J]. Environmental and Experimental Botany, 2010, 68(2):198-207. |
| [7] | 陶红群, 李晓林, 张俊铃. 锌污染条件下VA菌根对三叶草生长和元素吸收的影响[J]. 应用与环境生物学报, 1997, 3(3):263-267. TAO Hong-qun, LI Xiao-lin, ZHANG Jun-ling. Effect of VA-mycorrhizal infection on growth and nutrition uptake of red clover at different Zn supply levels[J]. Chinese Journal of Applied Environmental Biology, 1997, 3(3):263-267. |
| [8] | Chen B D, Li X L, Tao H Q, et al. The role of arbuscularmycorrhiza in zinc uptake by red clover growing in a calcareoussoil spiked with various quantities of zinc[J]. Chemospere, 2003, 50:839-846. |
| [9] | Arriagada C, Pereira G, García-Romera I, et al. Improved zinc tolerance in Eucalyptus globulus inoculated with Glomus deserticola and Trametes versicolor or Coriolopsis rigida[J]. Soil Biology & Biochemistry, 2010, 42(1):118-124. |
| [10] | Weissenhorn I, Leyval C, Belgy G, et al. Arbuscular mycorrhizal contribution to heavy metal uptake by maize(Zea mays L.) in pot culture with contaminated soil[J]. Mycorrhiza, 1995, 5(4):245-251. |
| [11] | 黄 晶, 凌婉婷, 孙艳娣, 等. 丛枝菌根真菌对紫花苜蓿吸收土壤中镉和锌的影响[J]. 农业环境科学学报, 2012, 31(1):99-105. HUANG Jing, LING Wan-ting, SUN Yan-di, et al. Impacts of arbuscular mycorrhizal fungi inoculation on the uptake of cadmium and zinc by alfalfain contaminated soil[J]. Journal of Agro-Environment Science, 2012, 31(1):99-105. |
| [12] | Dixit V, Pandey V, Shyam R. Differential antioxidative responses to cadmium in roots and leaves of pea(Pisumsativum L. cv. Azad)[J]. Journal of Experimental Botany, 2001, 52:1001-1009. |
| [13] | 刘家尧, 刘 新. 植物生理学实验教程[M]. 北京:高等教育出版社, 2010. LIU Jia-yao, LIU Xin. The experimental course of plant physiology[M]. Beijing:Higher Education Press, 2010. |
| [14] | 中国科学院南京土壤研究所. 土壤理化分析[M]. 上海:上海科学技术出版社, 1978. Institute of Soil Science, CAS. Methods on soil physics and chemistry[M]. Shanghai:Shanghai Science and Technology Press, 1978. |
| [15] | Bassman J H, Zwier J C. Gas exchange characteristics of Populus trichocarpa, Populus deltoides and Populus trichocarpa × P. deltoides clones[J]. Tree Physiology, 1991, 8(8):145-149. |
| [16] | 陈华勇, 欧阳建平, 马振东. 大冶有色冶炼厂附近农田镉污染的现状与治理对策[J]. 土壤, 2003(1):76-82. CHEN Hua-yong, OUYANG Jian-ping, MA Zhen-dong. Status quo of and countermeasures for Cd contamination of farmland in the vicinity of Daye smeltery[J]. Soil, 2003(1):76-82. |
| [17] | 冯德福. 镉污染与防治[J]. 沈阳化工, 2000, 29(1):44-46. FENG De-fu. The pollution and treatment of cadmium[J]. Shenyang Chemical Industry, 2000, 29(1):44-46. |
| [18] | 喻 华, 冯文强, 秦鱼生, 等. 镉胁迫对不同基因型水稻生长和镉吸收的影响[J]. 西南农业学报, 2013, 26(3):878-883. YU Hua, FENG Wen-qiang, QIN Yu-sheng, et al. Effects of cadmium stress on growth and cadmium uptake of different rice genotypes[J]. Southwest China Journal of Agricultural Sciences, 2013, 26(3):878-883. |
| [19] | 刘海亮, 崔世民, 李 强, 等. 镉对作物种子萌发、幼苗生长及氧化同工酶的影响[J]. 环境科学, 1992, 13(5):31-35. LIU Hai-liang, CUI Shi-min, LI Qiang, et al. Effects of cadmium on seed germination, seedling growth and oxidase isozymes in crops[J]. Chinese Journal of Environmental Science, 1992, 13(5):31-35. |
| [20] | 张金彪, 黄维南. 镉对植物的生理生态效应的研究进展[J]. 生态学报, 2000, 20(5):514-523. ZHANG Jin-biao, HUANG Wei-nan. Advances on physiological and ecological effects of cadmium on plants[J]. Acta Ecologica Sinica, 2000, 20(5):514-523. |
| [21] | 夏汉平. 土壤植物系统中的镉研究进展[J]. 应用与环境生物学报, 1997, 3(3):289-298. XIA Han-ping. Studies on cadmium in soil-plant system[J]. Chinese Journal of Applied Environmental Biology, 1997, 3(3):289-298. |
| [22] | Milone M T, Sgherri C, Clijsters H, et al. Antioxidative responses of wheat treated with realistic concentration of cadmium[J]. Environmental and Experimental Botany, 2003, 50(3):265-276. |
| [23] | 秦天才, 阮 捷, 王腊娇. 镉对植物光合作用的影响[J]. 环境科学与技术, 2000(增刊):33-35. QIN Tian-cai, RUAN Jie, WANG La-jiao. Effect of Cd on the plant photosynthesis[J]. Environmental Science and Technology, 2000(Suppl):33-35. |
| [24] | 刘爱荣, 陈双臣, 刘燕英, 等. 丛枝菌根真菌对低温下黄瓜幼苗光合生理和抗氧化酶活性的影响[J]. 生态学报, 2011, 31(12):3497-3503. LIU Ai-rong, CHEN Shuang-chen, LIU Yan-ying, et al. Effects of AM fungi on leaf photosynthetic physiological parameters and antioxidant enzyme activities under low temperature[J]. Acta Ecologica Sinica, 2011, 31(12):3497-3503. |
| [25] | 许大全. 光合作用效率[M]. 上海:上海科学技术出版社, 2002. XU Da-quan. Photosynthetic efficiency[M]. Shanghai:Shanghai Science and Technology Press, 2002. |
| [26] | Xu W Z, Deng X P, Xu B C. Effects of water stress and fertilization on leaf gas exchange and photosynthetic light-response curves of Bothriochloaischaemum L. [J]. Photosynthetica, 2013, 51(4):603-612. |
| [27] | Zhu X C, Song F B, Xu H W. Effects of arbuscular mucorrhizal fungi on photosynthetic characteristics of maize under low temperature stress[J]. Chinese Journal of Applied Ecology, 2010, 21(2):470-475. |
| [28] | Becana M, Dalton D A. Reactive oxygen species and antioxidants in legume nodules[J]. Physiologia Plantarum, 2000, 109(4):372-381. |
| [29] | Kanazawa S, Sano S, Koshiba T. Changes in antioxidative enzymes in cucumber cotyledons during natural senescence:Comparison with those during dark-induced senescence[J]. Physiologia Plantarum, 2000, 109:2311-2316. |
| [30] | 章秀福, 王丹英, 储开富, 等. 镉胁迫下水稻SOD活性和MDA含量的变化及其基因型差异[J]. 中国水稻科学, 2006, 20(2):194-198. ZHANG Xiu-fu, WANG Dan-ying, CHU Kai-fu, et al. Changes of SOD activity and MDA content in rice exposed to Cd stress as affected by genotype[J]. Chinese Journal of Rice Science, 2006, 20(2):194-198. |
| [31] | Schat H, Sharma S S, Vooijs R . Heavy metal-induced accumulation of free proline in a metal-tolerant and a nontolerant ecotype of Silene vulgaris[J]. Physiologic Plant, 1997, 101(3):477-482. |
| [32] | 李子芳, 刘惠芬, 熊肖霞, 等. 镉胁迫对小麦种子萌发幼苗生长及生理生化特性的影响[J]. 农业环境科学学报, 2005, 24(增刊):17-20. LI Zi-fang, LIU Hui-fen, XIONG Xiao-xia, et al. Effect of cadmium on seed germination, seedling development and physiological and biochemical characteristics of wheat[J]. Journal of Agro-Environment Science, 2005, 24(Suppl):17-20. |
| [33] | Tullio M, Pierandrei F, Salerno A, et al. Tolerance to cadmium of vesicular arbuscular mycorrhizae spores isolated from a cadmium-polluted and unpolluted soil[J]. Biology and Fertility of Soils, 2003, 37(4):211-214. |
| [34] | Christie P, LI X L, CHEN B D. Arbuscular mycorrhiza can depress translocation of zinc to shoots of host plants in soils moderately polluted with zinc[J]. Plant and Soil, 2004, 261(1-2):209-217. |
| [35] | Janoušková M, Pavlikova D, Macek T, et al. Influence of arbuscular mycorrhiza on the growth and cadmium uptake of tobacco with inserted metallothionein gene[J]. Applied Soil Ecology, 2005, 29(3):209-214. |
| [36] | Zhang X H, Zhu Y G, Chen B D, et al. Arbuscular mycorrhizal fungi contribute to the resistance of upland rice to combined metal contamination of soil[J]. Journal of Plant Nutrition, 2005, 28(12):2065-2077. |
| [37] | Tullio M, Pierandrei F, Salerno A, et al. Tolerance to cadmium of vesicular arbuscular mycorrhizae spores isolated from a cadmium-polluted and unpolluted soil[J]. Biology and Fertility of Soils, 2003, 37(4):211-214. |
 2014, Vol. 33
2014, Vol. 33