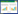文章信息
- 王晓维, 黄国勤, 徐健程, 聂亚平, 万进荣, 杨潇一, 杨文亭
- WANG Xiao-wei, HUANG Guo-qin, XU Jian-cheng, NIE Ya-ping, WAN Jin-rong, YANG Xiao-yi, YANG Wen-ting
- 铜胁迫和间作对玉米抗氧化酶活性及丙二醛含量的影响
- Effects of Copper Stresses and Intercropping on Antioxidant Enzyme Activities and Malondialdehyde Contents in Maize
- 农业环境科学学报, 2014, 33(10): 1890-1896
- Journal of Agro-Environment Science, 2014, 33(10): 1890-1896
- http://dx.doi.org/10.11654/jaes.2014.10.003
-
文章历史
- 收稿日期:2014-4-23
2. 江西农业大学农学院, 南昌 330045
2. College of Agronomy, Jiangxi Agricultural University, Nanchang 330045, China
铜既是生物生长必需的营养元素,又是一种污染 元素。近几十年来,随着工农业生产的快速发展,铜的 用途越来越广泛,用量也迅速增加。铜矿的过度开采, 农业生产上含铜杀菌剂和畜牧业中含铜饲料的大量 使用及工业生产中含铜污染物的大量排放,导致农田 土壤中铜含量严重超过正常范围,铜污染已成为世界 性问题[1]。当土壤中铜含量超过一定浓度时会产生很 高的植物毒性[2],影响其生长发育及产量,同时通过富 集作用累积到作物体内进入食物链对人体造成危害。 如何预防和修复土壤重金属污染已成为亟须解决的 重要问题。植物间作体系能够充分利用资源分布的 异质性,提高资源的利用效率,将其应用于土壤重金 属污染的修复,被认为是一条有效的新途径[3]。蒋成爱 等[4]研究表明,将东南景天与不同根系植物间作,发现 与玉米和大豆间作,可以显著提高东南景天地上部对 Zn、Pb、Cd 3种重金属的吸收。王吉秀等[5]研究表明玉 米和不同蔬菜间套模式是抑制作物可食部分吸收累 积重金属Pb、Cu、Cd含量的有效措施。在没有重金属 胁迫的条件下,Xia 等[6]田间试验表明,玉米和豆科作 物(蚕豆、鹰嘴豆和大豆)间作能够减少玉米籽粒中铜 元素的含量。在有重金属胁迫的条件下,玉米间作番 茄也能降低玉米地上部和根系铜含量[7]。Jiang 等[8]将 重金属超富集植物与低累积作物玉米间作,超富集植 物提取重金属的效率比单种超富集植物明显提高,同 时能够生产符合卫生标准的玉米产品,是一条不需要 间断农业生产、较为经济合理的治理方法。Evans等[9] 通过将豌豆PsMTA 基因导入酵母菌及拟南芥中,发 现豌豆该基因具有抗重金属铜功能。针对江西近年来 迅猛发展的畜牧业,大量的畜禽粪污对环境的污染也 是急需解决的难题,特别是饲料中大剂量使用铜、锌 元素导致农田环境污染,破坏土壤质地和微生物结 构,甚至影响作物产量和品质[10]。
江西玉米种植面积达2.81×104 hm2,而豆类作物 (大豆和豌豆为主)种植面积达到1.59×105 hm2[11],是 江西省旱地重要的种植作物,其中亦有部分种植面积 为玉米间作豆类作物。综合来看,通过作物间作来修 复江西红壤铜污染可能是一种合理的植物修复方法。 因此,本文以玉米和豌豆间作体系为研究对象,通过 研究不同Cu2+添加量对间作和单作玉米干重、铜含量 以及根和叶中抗氧化酶活性和丙二醛含量的影响,以 期探讨间作模式对铜污染条件下玉米抗氧化酶系统 及质膜损伤机理的影响机制,为合理利用间作修复土 壤铜污染及合理的有机肥施用量提供一定的理论依 据。 1 材料与方法 1.1 供试材料
供试土壤采自江西农业大学农业科技园红壤试 验地表层(0~20 cm)红壤,土壤先于室内自然风干,剔 除植物根系后,过2 mm 筛备用。试验土壤基本理化 性状为:pH 3.96,有机质含量31.34 g·kg-1,全氮1.74 g·kg-1,碱解氮121.33 mg·kg-1,有效磷31.68 mg·kg-1, 速效钾163.67 mg·kg-1,全铜含量为33.52 mg·kg-1,有 效态铜含量为2.31 mg·kg-1。供试作物玉米(Zea mays) 品种为中糯103,豌豆(Pisum sativum L.)品种为中豌 4号,均购于南昌市种业公司。 1.2 盆栽试验与采样
本试验设置2 种种植模式和5 种铜浓度,共10 个处理(表 1),每处理重复3 次,共30盆。盆钵高7.5 cm,盆口直径5 cm,每盆装土250 g。于7月30 日按 每千克土壤0、100、200、400、600 mg 铜离子量添加铜 溶液(CuSO4·5H2O,分析纯),平衡45 d。9月4日进行 玉米和豌豆育苗,9月16 日移栽,玉米每盆定植1 株;间作豌豆每盆定植2 株。自播种之日起,每3 d用 30 mL Hoagland 营养液(四水硝酸钙945 mg·L-1,硝酸 钾506 mg·L-1,硝酸铵80 mg·L-1,磷酸二氢钾136 mg· L-1,硫酸镁493 mg·L-1,铁盐溶液2.5 mL,pH6.0,蒸馏 水)浇灌,以保证玉米和豌豆生长及土壤水分。11月5 日进行取样,取样时沿土面将玉米地上部和地下部分 离,以去离子水将玉米和豌豆植株洗净,分别称取去 除叶脉后叶片和及白根各0.2 g 用于测定抗氧化酶活 性及丙二醛含量,剩余部分称鲜重后105 ℃杀青30 min,70 ℃烘干至恒重,根据折干率换算用于测定酶 活及丙二醛含量的植株样品干重。利用湿式消解法处 理植株样品,原子吸收分光光度法测定植株中的铜含 量。
分别剪取各处理玉米根系和叶片(去除叶脉)0.3 g 置于预冷的研钵中,加入50 mmol·L-1 pH7.8 的磷酸缓 冲液5 mL(内含2%聚乙烯吡咯烷酮)研磨匀浆,4 ℃ 10 000 r·min-1离心0.5 h,上清即为酶粗提液。 1.3.2 超氧化物歧化酶(Super oxide dismutase,SOD) 活性的测定
利用SOD 对氮蓝四唑(NBT)的光抑制作用来测 定[12]。在试管中分别加入不同体积的0.05 mol·L-1磷 酸缓冲液(pH7.8)、0.13 mol·L-1Met 溶液、0.75 mmol·L-1 的NBT 溶液、0.1 mmol·L-1 的EDTA-Na2 溶 液、0.02 mmol·L-1的核黄素溶液、粗酶液和蒸馏水,混 匀后把其中一支对照管遮光,与其他各管同时置于 4000 lx 的日光灯下反应20 min,用黑布罩上试管终 止反应。以遮光的对照管作为空白调零,在560 nm波 长下测定各管的吸光度。 1.3.3 过氧化物酶(Peroxidase,POD)活性的测定
利用愈创木酚法测定[12]。取粗酶液0.5 mL于试管 中,加入0.05 mol·L-1 的磷酸缓冲液(pH7.8)1.5 mL, 25 mmol·L-1愈创木酚0.5 mL,0.2 mol·L-1H2O2 0.5 mL, 摇匀立即计时3 min,每隔1 min 读数一次,以0.5 mL 0.05 mol·L-1磷酸缓冲液替代粗酶液470 nm下调零。 1.3.4 过氧化氢酶活性(Catalase,CAT)的测定
利用紫外吸收法测定[12]。取粗酶液0.05 mL 于试 管中,加入0.05 mol·L-1 的磷酸缓冲液(pH7.0)3 mL, 0.2 mol·L-1的H2O2 0.05 mL,摇匀立即计时3 min,每 隔30 s读数一次,以0.5 mL 0.05 mol·L-1 磷酸缓冲液 替代粗酶液470 nm下调零。 1.3.5 丙二醛含量(Malondialdehyde,MDA)测定
利用硫代巴比妥酸法测定[12]。取粗酶液1 mL 于 试管中,加入0.5%硫代巴比妥酸2 mL 混匀后,沸水 浴20 min 立即放于冰水浴中,冷却后3000 r·min-1 离 心10 min,于532、600、450 nm 比色,以0.5%硫代巴 比妥酸为空白。 1.3.6 植株铜含量测定
植物样品采用硝酸-高氯酸消煮,用火焰原子吸 收分光光度法测定[13]。 1.4 数据统计
用Microsoft Excel 2010 进行数据处理,SPSS 17.0 统计软件进行方差分析。 2 结果与分析 2.1 铜胁迫和间作对玉米和豌豆干重的影响
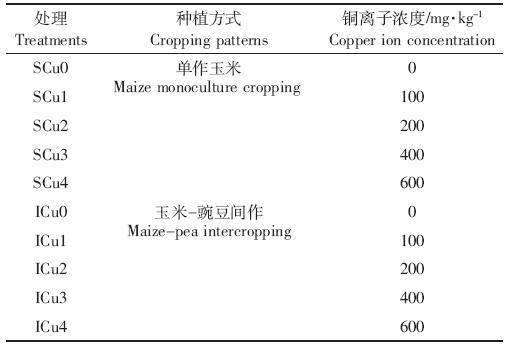
从表 2 来看,两种种植模式下,玉米干重均随着 铜浓度升高而降低,当铜浓度达到Cu4 时干重达到 最小,与对照干重存在显著差异,其他各浓度处理均 与对照无显著差异。铜胁迫对豌豆干重的影响与玉米 表现一致,当铜浓度达到Cu2 时,与对照不存在显著 差异,Cu3 和Cu4 处理干重均与对照存在显著差异, 铜浓度达到Cu4 时,豌豆干重最小,且Cu2 与Cu4 之 间豌豆干重存在显著差异。
 |
与单作相比,间作地上部与地下部的干物质累积 量表现较为一致。Cu0~Cu2胁迫的间作玉米地上部干 重较单作分别降低了22.32%、16.37%、26.03%,而 Cu3 胁迫的间作地上部干重则与单作持平,当铜胁迫 达到Cu4 时,间作玉米地上部干重较单作提高了 16.67%,但差异均未达到显著水平。在Cu0~Cu2胁迫 下间作玉米地下部较单作分别降低了23.65%、 11.13%、4.22%,Cu3胁迫下间作地上部干重则与单作 持平,当铜浓度胁迫达到Cu4 时,间作玉米地上部干 重较单作提高了24.47%,但差异均未达到显著水平。 这说明高浓度铜胁迫下,间作模式对玉米生长有一定 的保护作用,且对地下部的促进作用高于地上部。
从植株铜元素含量看(表 2),与单作相比,不同铜 浓度胁迫下(Cu1~Cu4),间作模式均降低了玉米地上 部铜含量,分别降低了86.81%、44.57%、22.01%、 11.11%;但一定程度上提高了玉米地下部的铜含量, 分别提高78.89%、24.79%、35.29%、13.31%。不同铜浓 度胁迫下,间作模式玉米植株地上部铜含量与单作的 差值存在显著差异,但二者差值随着铜浓度升高而减 小,在Cu4 胁迫下差值最小;间作模式下玉米植株地 下部铜含量与单作的差值也存在显著差异,但二者差 值随着铜浓度升高而增大,在Cu3胁迫下差值达到最 大,而Cu4 胁迫可能由于铜浓度过高,导致间作玉米 与单作差值减小,但与对照相比差异显著。 2.2 铜胁迫和间作对玉米SOD活性的影响
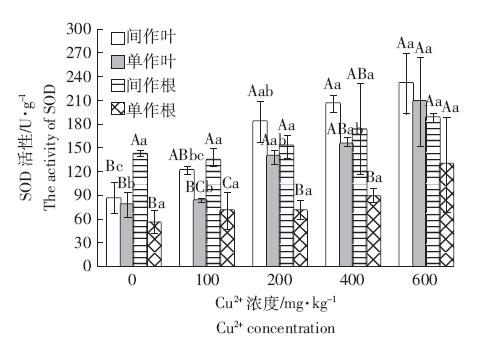
SOD 是生物体内超氧阴离子自由基的清除剂,能 有效地防止它们对生物体的损害,参与植物体对重金 属胁迫所做出的各种生理生化反应,是植物体内一种 很重要的抗氧化酶类[14]。由图 1 可以看出,无论玉米 单作还是间作,玉米根或叶的SOD 活性均表现为随 着土壤中铜浓度增加逐渐升高,在Cu4 时,SOD 活性 达到最高值,与田胜尼等[15]通过盆栽实验研究铜对 鸭跖草SOD 活性的影响有较为一致的结果。在高浓 度Cu2+处理下,重金属参与植物体内的氧化还原循 环,引起活性氧的变化,在一定浓度范围内活性氧作 为信号分子可提高SOD 活性。随着铜离子浓度的上 升,间作模式中玉米叶的SOD 活性均有一定的提 高。与对照(ICu0)相比,ICu1 处理的玉米叶SOD 活 性无显著增加,而ICu2、ICu3 和ICu4 的玉米叶SOD 活性均有显著提高,但3 个Cu2+浓度之间没有显著 差异。对于玉米单作来说,与对照(SCu0)相比,只有 SCu4 玉米叶SOD 活性有显著提高。不同浓度Cu2+胁 迫对玉米根的SOD 活性均不存在显著影响。
|
| 不同大写字母表示同一浓度下两种种植模式根和叶存在
显著差异(P<0.05),不同小写字母表示同一种植模式下相
同玉米器官,在不同铜浓度下存在显著差异(P<0.05)。下同 Activities with different capital letters at the same cropper concentration indicate significant differences in leaves or roots between two cropping patterns at P<0.05; Activities with different lowercase letters in the same cropping pattern and the same maize tissue indicate significant differences between different copper concentrations at P<0.05. The same as below 图 1 铜胁迫与间作对玉米SOD活性的影响 Figure 1 Effects of copper stresses and intercropping on SOD activity in leaves and roots of maize |
在相同浓度的Cu2+胁迫下,不同种植模式下的玉 米SOD 活性也表现了一定的差异。在Cu0 中,间作模 式下玉米根的SOD 活性显著高于单作玉米根,活性 提高了167.36%,但间作模式的玉米叶SOD 活性与 单作模式的无显著差异。Cu1 和Cu2 的结果比较一 致,间作玉米根的SOD 活性均显著高于单作玉米根, 分别提高了97.61%和117.27%,间作玉米叶SOD 活 性较单作也有一定的增加趋势,但无显著差异。Cu3 和Cu4处理,间作玉米叶和根的SOD 活性均高于单 作玉米,但差异不显著。在Cu2+胁迫下,间作模式在一 定程度上影响了玉米叶和根的SOD 活性,提高了玉 米对Cu2+胁迫的适应能力。 2.3 铜胁迫和间作对玉米POD活性的影响
POD 是植物体内酶促防御系统的一种保护酶, 能有效催化过氧化氢分解成水,从而有效阻止过氧化 氢在植物体内的累积,排除其对植物细胞膜结构的潜 在伤害[16]。从图 2 可以看出,无论是单作还是间作玉 米根和叶的POD 活性均表现为一致的趋势,随着 Cu2+浓度升高,玉米POD 活性逐渐增强,在Cu4 时玉 米POD 活性达到最高值。在间作条件下,与Cu0 相 比,Cu1 的玉米叶POD 活性无显著差异,但Cu2、 Cu3、Cu4 的玉米叶POD活性均有显著提高,分别提 高了341.48%、380.92%和411.85%;玉米根的POD 活性,仅Cu4 时与Cu0 相比提高了120.03%,差异达 到显著水平。单作条件下,与Cu0 相比,玉米叶和根 的POD 活性随着Cu2+浓度升高均有提高,仅Cu4 时 达到显著水平,分别提高了94.45%和105.35%。
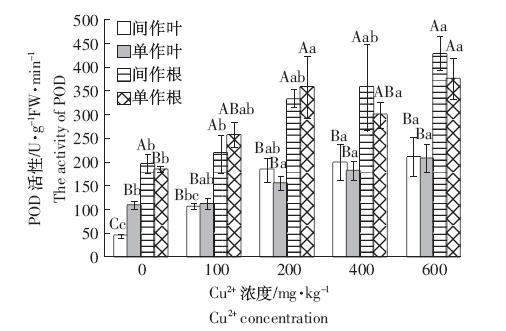
|
| 图 2 铜胁迫与间作对玉米POD 活性的影响 Figure 2 Effects of copper stresses and intercropping on POD activity in leaves and roots of maize |
在相同浓度的Cu2+胁迫下,玉米单作和间作模式 下的POD活性存在一定的差异。在Cu0 中,相比玉米 单作,间作模式显著降低了玉米叶的POD 活性,降低 了158.77%,但间作模式下的玉米根SOD 活性无显 著差异。在有Cu2+胁迫时,相比玉米单作,间作模式下 玉米叶POD 活性有一致的增加趋势,间作模式下玉 米根的POD 活性在Cu1 和Cu2 时有降低的趋势,但 在Cu3 和Cu4 时有增大的趋势,在Cu4 时达到最大。 种植模式在Cu2+胁迫的条件下对玉米POD 活性没有 显著影响,但没有Cu2+胁迫时间作模式显著降低了玉 米叶POD 活性。在Cu0、Cu1、Cu2时间作模式能在一 定程度上缓解重金属铜对玉米的胁迫。 2.4 铜胁迫和间作对玉米CAT活性的影响
CAT与过氧化氢具有较高的亲和力,主要清除线 粒体电子传递、脂肪酸氧化过程中产生的过氧化氢, 其含量变化是植物体内过氧化氢在体内变化的标志 性反应[17,18]。由图 3可以看出,当Cu2+浓度为Cu0~Cu3 时,随着Cu2+浓度的提高,间作玉米叶的CAT 活性逐 渐升高,Cu3 时CAT活性达到最大。随着Cu2+浓度的 继续提高,CAT 活性逐渐降低,与其他浓度处理的 CAT活性存在显著差异,呈现典型的单峰变化趋势。 当Cu2+浓度在Cu0~Cu2 范围时,间作玉米根和单作 玉米叶的CAT 活性逐渐下降,Cu2 时CAT 活性达到 最小;当Cu3 时间作玉米根和单作玉米叶的CAT 活 性上升,Cu2+浓度超过400 mg·kg-1后,玉米CAT 活性 迅速下降。单作玉米根的CAT 活性随着Cu2+浓度的 上升而逐渐降低,但Cu4 时单作根的CAT 活性最低, 明显低于其他浓度处理的CAT活性。
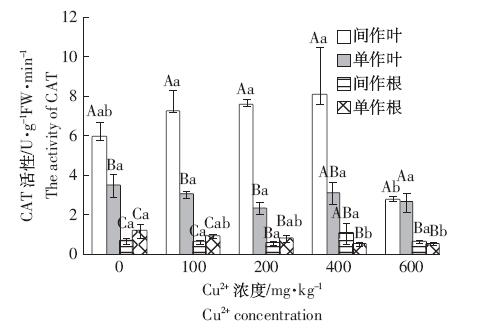
|
| 图 3 铜胁迫与间作对玉米CAT活性的影响 Figure 3 Effects of copper stresses and intercropping on CAT activity in leaves and roots of maize |
在相同浓度的Cu2+胁迫下,玉米单作和间作模式 下的CAT 活性表现出较为一致的规律。Cu4 时玉米 间作和单作叶CAT 活性无显著差异,其余Cu2+浓度 (Cu0、Cu1、Cu2、Cu3)胁迫下,均表现为间作玉米叶 CAT 活性均显著高于单作,分别提高了71.37%、 140.40%、229.80%和161.75%。在中低浓度Cu2+胁迫 下(Cu0~Cu2)均表现为单作玉米根CAT 活性高于间 作,当Cu2+浓度达到Cu3~Cu4 时,则表现为间作玉米 根CAT活性高于单作,且差异均达到显著水平。上述 结果表明,在较低浓度的Cu2+胁迫下,间作模式有利 于提高玉米叶适应Cu2+胁迫环境,过高浓度的Cu2+胁 迫,破坏了玉米的CAT活性。 2.5 铜胁迫和间作对玉米MDA含量的影响
MDA 是膜脂过氧化的最终分解产物,是植物细 胞膜质过氧化程度的体现,其含量可以反映植物遭受 逆境伤害的程度[19]。丙二醛含量高,说明植物细胞膜 质过氧化程度高,细胞膜受到的伤害严重。从图 4 可 以看出,间作叶和单作根的MDA 含量随着Cu2+浓度 的上升而逐渐上升,但各处理之间没有显著差异。在 低浓度时(Cu0、Cu1),单作玉米叶的MDA 含量随着 Cu2+浓度的升高而增加,Cu2、Cu3 时MDA 含量随着 Cu2+浓度的上升而下降,Cu4 时MDA 含量达到最大 值,但各处理之间无显著差异。
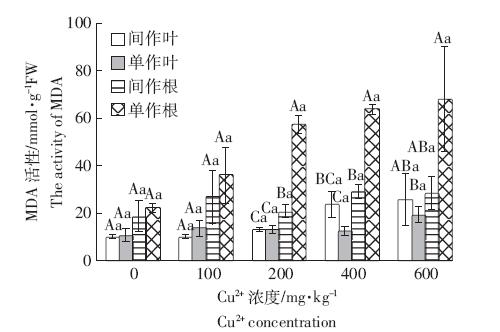
|
| 图 4 铜胁迫与间作对玉米MDA含量的影响 Figure 4 Effects of copper stresses and intercropping on MDA content in leaves and roots of maize |
在相同浓度的Cu2+胁迫下,玉米单作和间作模式 下的MDA含量表现出较为一致的规律。在Cu0~Cu2 时,叶中MDA 含量均表现为单作高于间作,而Cu3~ Cu4 时,则表现为间作高于单作,但两种模式比较,玉 米MDA 含量均无显著差异。根中MDA 含量均表现 为单作高于间作,在Cu0~Cu1 时,两种种植模式下玉 米根的MDA 含量均无显著差异,而Cu2~Cu4 时均表 现为单作玉米根MDA 含量显著高于间作玉米,分别 提高了181.93%、120.50%和142.27%。 3 讨论
铜是植物生长必需元素,植物体可作为多种酶的 辅基,且对非催化蛋白质也具有很强的亲合力。当铜 含量超过一定限度时,则会对植物生长、呼吸、光合等 生理过程产生明显的抑制作用,直接或间接启动膜质 的过氧化作用,导致膜的损伤和叶绿素分解。而植物 亦可通过累积脯氨酸、增强抗氧化酶活性等方式来提 高自身对铜的抵抗能力[20]。综合来看,玉米间作豌豆受 盆栽空间所限,由于种间竞争,在低浓度Cu2+胁迫下 反而降低了玉米的干重,而高浓度Cu2+胁迫下,种间 竞争减小,间作优势体现在玉米干物质累积量。高浓 度的Cu2+胁迫致使玉米叶中的超氧自由基含量升高, 导致SOD 活性上升,催化超氧自由基转变为H2O2,与 金进等[21]研究结果较为一致。Cu2+处理下间作玉米叶 和根的SOD 活性均高于单作玉米,可能是由于间作 模式下,两种作物根系分泌物,尤其是豌豆分泌的有 机酸可能活化土壤中的铜,使得土壤有效态铜含量升 高,促进了玉米对Cu2+的吸收。当较多的Cu2+进入玉米 后,致使玉米体内的超氧自由基含量高于单作,而 SOD 为超氧自由基清除剂,进而增强SOD 活性来清 除过多的超氧自由基,故表现为间作模式下玉米SOD 活性高于单作玉米。POD 活性与SOD 活性表现出较 为一致的规律,SOD 将超氧自由基氧化成H2O2,随着 H2O2含量不断升高,POD 和CAT 活性也呈现上升趋 势,这是玉米体内的一种自我保护机制[22]。随着Cu2+胁 迫的加剧(600 mg·kg-1),CAT 活性开始呈现下降趋 势,表明玉米体内的保护性酶系统可能开始受到破 坏,由SOD催化产生的H2O2已无法进一步分解,使得 H2O2在玉米体内大量累积,H2O2成为玉米体内胁迫的 主要物质。而POD具有双重性,既能催化H2O2与其他 底物进行氧化反应而被清除,又能催化超氧自由基和 H2O2转变为羟自由基而加重过氧化作用[23]。在高浓度 Cu2+胁迫下玉米体内产生H2O2及过氧化物,POD活性 上升,可能导致羟自由基增多,引起叶片膜脂过氧化 加剧,使得MDA 含量增加[24]。 4 结论
(1)高浓度Cu2+胁迫下,玉米间作豌豆能提高玉 米地上部和地下部的干物质累积量,从而保持玉米在 高浓度Cu2+胁迫下的生长。
(2)与单作相比,间作模式显著降低了玉米地上 部铜含量,而显著提高了玉米地下部铜含量,且随着 铜浓度的升高,二者之间的差值呈下降趋势。
(3)在一定范围内的Cu2+胁迫下,玉米体内的SOD、 POD、CAT 活性和MDA 含量均随着Cu2+胁迫浓度的 增加而提高,但Cu2+浓度达到600 mg·kg-1时,玉米体 内的CAT活性有所下降。
(4)相同的Cu2+浓度胁迫下,与单作相比,玉米 间作豌豆能增强玉米叶和根中的SOD 和CAT 活性。 在高浓度Cu2+胁迫下,提高了间作玉米根的POD 活 性,降低了间作玉米根中MDA 含量和质膜氧化损伤 程度。
| [1] | 张文韬, 黄保健, 郭世荣, 等. 铜对空心菜光合作用及保护酶活性的影响[J]. 江苏农业学报, 2010, 26(2):303-307. ZHANG Wen-tao, HUANG Bao-jian, GUO Shi-rong, et al. Effects of copper on photosynthesis and protective enzyme activities of Ipomoea aquatica Forsk[J]. Jiangsu Agricultural Science, 2010, 26(2):303-307. |
| [2] | Bona E, Marsano F, Cavaletto M, et al. Proteomic characterization of copper stress response in Cannabis sativa roots[J]. Proteomics, 2007, 7(7):1121- 1130. |
| [3] | 卫泽斌, 郭晓方, 丘锦荣, 等.间套作体系在污染土壤修复中的应用研究进展[J].农业环境科学学报, 2010, 29(增刊):267-272. WEI Ze-bin, GUO Xiao-fang, QIU Jin-rong, et al. Innovative technologies for soil remediation:Intercropping or co-cropping[J]. Journal of Agro-Environment Science, 2010, 29(Suppl):267-272. |
| [4] | 蒋成爱, 吴启堂, 吴顺辉, 等.东南景天与不同植物混作对土壤重金属吸收的影响[J].中国环境科学, 2009, 29(9):985-990. JIANG Cheng-ai, WU Qi-tang, WU Shun-hui, et al. Effect of co-cropping Sedum alfredii with different plants on metal uptake[J]. China Environmental Science, 2009, 29(9):985-990. |
| [5] | 王吉秀, 祖艳群, 李 元, 等. 玉米和不同蔬菜间套模式对重金属Pb、Cu、Cd累积的影响研究[J].农业环境科学学报, 2011, 30(11):2168-2173. WANG Ji-xiu, ZU Yan-qun, LI Yuan, et al. Effects of maize and vegetable intercropping system on accumulation of Pb, Cu and Cd in plants[J]. Journal of Agro- Environment Science, 2011, 30(11):2168-2173. |
| [6] | Xia H Y, Zhao J H, Sun J H, et al. Maize grain concentrations and above-ground shoot acquisition of micronutrients as affected by intercropping with turnip, faba bean, chickpea, and soybean[J]. Science China Life Sciences, 2013, 56(9):823-834. |
| [7] | An L Y, Pan Y H, Wang Z B, et al. Heavy metal absorption status of five plant species in monoculture and intercropping[J]. Plant and Soil, 2011, 345(1-2) :237-245. |
| [8] | Jiang C A, Wu Q T, Sterckeman T, et al. Co-planting can phytoextract similar amounts of cadmium and zinc to mono-cropping from contaminated soils[J]. Ecological Engineering, 2010, 36:391-395. |
| [9] | Evans K, Gatehouse J, Lindsay W, et al. Expression of the pea metallothionein-like gene PsMTA in Escherichia coli and Arabidopsis thaliana and analysis of trace metal ion accumulation:Implications for PsMTA function[J]. Plant Molecular Biology, 1992, 20(6):1019-1028 |
| [10] | 袁玲花, 徐加宽, 颜士敏, 等. 土壤铜胁迫对不同籼型水稻品种产量和品质的影响[J]. 农业环境科学学报, 2008, 27(2):435-441. YUAN Ling-hua, XU Jia-kuan, YAN Shi-min, et al. Effects of soil Cu stress on grain yield and quality of indica rice cultivars[J]. Journal of Agro-Environment Science, 2008, 27(2):435-441. |
| [11] | 江西省统计局. 江西统计年鉴[M]. 北京:中国统计出版社, 2013. Statistic Bureau of Jiangxi. Jiangxi statistical year book[M]. Beijing :China Statistice Press, 2013. |
| [12] | 张志良, 瞿伟菁, 李小芳. 植物生理学实验指导[M]. 四版. 北京:高等教育出版社, 2009. ZHANG Zhi-liang, QU Wei-jing, LI Xiao-fang. Plant physiology experimental guidance[M]. Fourth edition. Beijing:Higher Education Press, 2009. |
| [13] | 鲍士旦. 土壤农化分析[M]. 第三版. 北京:高等教育出版社, 2008. BAO Shi-dan. Soil Agricultural Chemistry Analysis[M]. Third edition, Beijing:Higher Education Press, 2008. |
| [14] | Rosenbaugh E G, Manickam D S, Batrakova E V, et al. Neuronal uptake and subcellular localization of functional nanoformulated copper/zinc superoxide dismutase(SOD nano)[J]. The FASEB Journal, 2012, 26:893. 2. |
| [15] | 田胜尼, 彭少麟, 张玉琼, 等. 铜胁迫对鸭跖草的生长及生理特性的影响[J]. 中国农学通报, 2009, 25(9):144-147. TIAN Sheng-ni, PENG Shao-lin, ZHANG Yu-qiong, et al. The effects of copper stresses on the growth and physiological characteristics for Commelina communis[J]. Chinese Agricultural Science Bulletin, 2009, 25(9):144-147. |
| [16] | 王松华, 张 华, 何庆元. 铜胁迫对紫花苜蓿幼苗叶片抗氧化系统的影响[J]. 应用生态学报, 2011, 22(9):2285-2290. WANG Song-hua, ZHANG Hua, HE Qing-yuan. Effects of copper stress on Medicago sativa seedlings leaf antioxidative system[J]. Chinese Journal of Applied Ecology, 2011, 22(9):2285-2290. |
| [17] | R Doctrow S, Liesa M, Melov S, et al. Salen Mn complexes are superoxide dismutase/catalase mimetics that protect the mitochondria[J]. Current Inorganic Chemistry, 2012, 2(3):325-334. |
| [18] | Jessica E S. Nanoceria exhibit redox state-dependent catalase mimetic activity[J]. Chemical Communications, 2010, 46(16):2736-2738. |
| [19] | Weismann D, Hartvigsen K, Lauer N, et al. Complement factor H binds malondialdehyde epitopes and protects from oxidative stress[J]. Nature, 2011, 478 (7367):76-81. |
| [20] | Dong Y J, Xu L L, Wang Q H, et al. Effects of exogenous nitric oxide on photosynthesis, antioxidative ability, and mineral element contents of perennial ryegrass under copper stress[J]. Journal of Plant Interactions, 2014, 9(1):402-411. |
| [21] | 金 进, 叶亚新, 李 丹, 等. 重金属铜对玉米的影响[J]. 玉米科学, 2006, 14(3):83-86. JIN Jin, YE Ya-xin, LI Dan, et al. Effect of heavy metal(copper) coercion on maize[J]. Journal of Maize Sciences, 2006, 14(3):83-86. |
| [22] | Vural H, Demirin H, Kara Y, et al. Alterations of plasma magnesium, copper, zinc, iron and selenium concentrations and some related erythrocyte antioxidant enzyme activities in patients with Alzheimer's disease[J]. Journal of Trace Elements in Medicine and Biology, 2010, 24(3):169-173. |
| [23] | Thounaojam T C, Panda P, Mazumdar P, et al. Excess copper induced oxidative stress and response of antioxidants in rice[J]. Plant Physiology and Biochemistry, 2012, 53:33-39. |
| [24] | Drażkiewicz M, Skórzyńska-Polit E, Krupa Z. Copper-induced oxidative stress and antioxidant defence in Arabidopsis thaliana[J]. Biometals, 2004, 17(4 ):379-387. |
 2014, Vol. 33
2014, Vol. 33