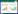文章信息
- 赵北北, 刘永, 李纯厚, 徐姗楠, 齐占会, 肖雅元
- ZHAO Bei-bei, LIU Yong, LI Chun-hou, XU Shan-nan, QI Zhan-hui, XIAO Ya-yuan
- 氮营养对两种红树植物根际去除柴油污染的影响
- Effects of Nitrogen Nutrition on Diesel Fuel Removal by Rhizosphere of Two Mangrove Seedlings
- 农业环境科学学报, 2015, 34(10): 1865-1872
- Journal of Agro-Environment Science, 2015, 34(10): 1865-1872
- http://dx.doi.org/10.11654/jaes.2015.10.005
-
文章历史
- 收稿日期: 2015-04-17
2. 上海海洋大学水产与生命学院, 上海 201306
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China
随着经济的发展,海上石油开采活动日益频繁,沿海重化工业快速发展,海上石油运输也日趋活跃,发生石油泄漏污染海洋的风险也不断增加。近几年国内外频繁发生的海上溢油事故,对海洋生态环境造成了严重影响,其漂移至海岸带的油膜对生态系统具有长期危害,油膜的主要污染物为石油烃类,可进入近岸生态系统,并通过食物链向人类传递,对生态系统和人体健康造成潜在威胁[1, 2]。
红树植物因其独特的生活环境和发达的根系而具环境修复特征,被广泛用于人工污水中氮、磷等生源要素[3, 4]、重金属[5]以及多环芳烃[6, 7]等的修复。秋茄(Kandelia candle)和桐花树(Aegiceras corniculatum)作为华南常见的红树植物种类,对石油等有机物污染具有较高的耐性和较好的修复效果[8, 9]。通过研究不同浓度石油污染条件下幼苗的生理生态指标,证明红树植物秋茄对石油污染具有一定的耐受性[10];对红树植物去除多环芳烃污染的研究表明,秋茄对菲污染具有较好的修复效果[11]。
氮是湿地植物生长必需的营养要素,对于红树植物木榄(Bruguiera gymnorrhiza),增加NO3--N和NH4+-N可以显著提高叶部生物量和株高,而且增加氮营养元素可以提高木榄对高盐度的耐受;通过对红海榄(Rhizophora stylosa)、角果木(Ceriops tagal)和白骨壤(Avicennia marina)的研究发现,氮浓度水平的增加明显促进这三种红树植物的叶片生长[12];对白骨壤的研究表明,氮营养对白骨壤的根、茎、叶的生长均有一定的促进作用,尤其是对茎和叶,促进作用更为显著[13]。因此,增加氮营养元素,可以有效促进红树植物地上部分,特别是叶部的生长。
目前红树林生态系统中氮营养对石油等有机物污染修复影响的研究主要集中在C∶N∶P之比对微生物降解碳氢化合物的限制方面[14, 15]。适合的氮营养条件是构建人工湿地生态系统的重要环境因子之一,然而对于氮营养是否可以提高其对石油污染的去除效果尚未研究。本文以广东省典型的红树植物种类——秋茄和桐花树为研究对象,以石油的代表种类——柴油为材料,设定不同氮营养浓度,研究两种红树植物对不同浓度柴油污染的耐受性和去除效果的影响,以期为构建红树林人工湿地修复石油污染提供科学依据。
1 材料与方法 1.1 试验材料秋茄和桐花树胚轴分别于2013年4月和7月采自广州市番禺区海鸥岛红树林区(22° 54′ 36.31" N,113° 32′55.83" E),温室内培育一年(温度25~32 ℃,相对湿度70%~90%),选取大小接近、生长状况良好的幼苗备用(均具12片叶的树苗),2014年7月开始进行试验。
1.1.2 供试基质本试验采用沙质培养,供试基质采自深圳市大鹏新区某河道。采集后,用大量清水冲洗4~5次,尽量减少沙自身所携带营养物质对试验的干扰,自然风干后,过80目筛备用。
1.1.3 供试试剂供试柴油为0#轻柴油,放置通风橱中过夜,除去其挥发性物质;试验处理和植物浇灌所需试剂均为分析纯及以上,试验提取溶剂为色谱纯;试验浇灌所用海水取自深圳市大鹏新区大鹏镇东山村杨梅坑海区(南海水产研究所深圳基地附近海域),过滤后用纯净水将盐度稀释至1.2%作为浇灌液配置溶剂备用。
1.1.4 试验仪器本实验主要使用的仪器:越平JA10003电子天平用于生物量的测定;中浪DGX-9073电热恒温鼓风干燥箱用于样品的恒温干燥;晶玻SHZ-82水浴恒温振荡器用于样品测定时的温育;岛津UV-2550紫外分光光度计用于柴油浓度测定分析。
1.2 试验设计 1.2.1 试验设置本实验为单因子设计实验,5个基质柴油浓度梯度(分别为0、25、50、75、100 mg·kg-1),浇灌营养液分为低、中、高氮3个浓度(分别施加NO3--N浓度0.1、0.5、2 mmol·L-1)。处理组合包括:5个柴油污染水平× 3个氮营养水平,每个处理4个平行。每个根际袋中种植2株植物为一个平行,装入900 g污染沙,两个相同处理的根际袋放在一个PVC盆(直径13 cm,高25 cm)中,根际袋外用相应浓度污染沙填满PVC盆。试验设置1个对照组,不种植红树植物。
1.2.2 污染沙配置柴油污染沙的配制参考相关文献中提到的多环芳烃污染基质配制的标准方法进行[17]。称量2 g前期处理过的柴油溶于1.5 L分析纯的丙酮中,然后和2 kg洗净的沙混合,充分搅拌均匀,放置于通风橱中过夜,使丙酮挥发干净,获得1 mg·kg-1的高浓度污染沙。分别称取0、22.5、45、67.5、90 g高浓度的污染沙加入烧杯,依次加入相应重量的干净沙,使得每份总干量均为900 g,加入丙酮后充分混匀,通风橱抽干丙酮后得到5个试验处理浓度的柴油污染沙。
1.2.3 营养液配置对植物浇灌的营养液采用稀释至1.2%海水为溶剂,配置10%浓度的Hoagland′s 营养液[CaCl2 4 mmol·L-1,KCl 6 mmol·L-1,MgSO4 10 mmol·L-1,H3BO4 46 μmol·L-1,ZnSO4 1 μmol·L-1,CuSO4 0.5 μmol·L-1,MnSO4 10 μmol·L-1,H2MoO4 0.1 μmol·L-1,Fe(Ⅱ)-EDTA 50 μmol·L-1][5]。试验期间,分别浇灌氮浓度为0.1、0.5、2 mmol·L-1的营养液(其中氮浓度使用NH4Cl),用HCl或NaOH调整pH至6.5左右。等量浇灌营养液,使其淹没沙面2 cm,每周平行添加2~3次,补充蒸发带来的水分损失。在温室条件下(温度25~32 ℃,相对湿度70%~90%)培养处理4个月后采样分析。
1.3 样品分析 1.3.1 植物生长指标测定种植4个月后收获植物,用大量自来水冲洗根、茎、叶,再用蒸馏水充分淋洗,用滤纸吸干植物表面水分,测量其鲜重以及最长的根长、株高(茎长)。
1.3.2 植物生物量测定将测定生长指标后的植物分为根、茎和叶3部分,用锡纸盛放,并放入60 ℃恒温干燥箱中烘干,称量干重。天平的检测限为0.001 g。
1.3.3 沙质中柴油含量的测定根际袋内和根际袋外的沙样在3 cm以下范围采样,每盆采用三点随机取样,将沙样充分混匀放置于-20 ℃暂存。基质沙样分批进行冷冻干燥,过80目筛,用锡箔包好,放入装有干燥剂的密封袋内,置于-20 ℃冰箱中保存,待提取和分析。
称取2 g沙样于40 mL棕色样品瓶中,加入10 mL 二氯甲烷,然后放入恒温水浴振荡器中振荡30 min(25 ℃,180 r·min-1),静置后,移取适量上清液于10 mL比色管中,定容至刻度线,摇匀后用紫外分光光度计在229 nm波长处测定其吸光度,利用标准曲线确定沙样中柴油浓度[18]。根据沙样中柴油的浓度决定上清液的取出量,从而使稀释后的溶液吸光度处于标准曲线范围之内。
1.4 数据处理
试验数据取4次重复的平均值±标准差(Mean±S.D.)表示。数据采用SPSS 16.0软件在95%的置信区间下做One-way ANOVA和LSD差异显著检验,不同处理间的差异显著性采用配对样本进行评价。采用Origin 8.0进行数据分析与绘图。数据处理中计算公式:
柴油去除率=(柴油初始浓度-柴油终浓度)/柴油初始浓度×100%
2 结果与分析 2.1 植物生长状况对两种红树植物试验前后的最长根长和株高分别进行测定,并进行试验前后数据对比分析,主要得到如下结果:
(1)对于最长根长,秋茄受柴油污染后,不同氮处理条件下均出现最长根受损,试验后的根长普遍短于试验前;桐花树则表现出相对较高的耐受性,最长根受损情况轻于秋茄,但最长根生长也普遍被柴油污染所抑制(表 1)。
 |
(2)对于株高,秋茄和桐花树即使在高浓度柴油污染下,处理后的株高仍显著高于处理前(P<0.05),说明柴油污染对根的抑制显著大于地上部,而且柴油浓度越高,两种红树植物的株高生长越被抑制(表 1)。
(3)对于不同氮浓度处理,氮浓度越高,秋茄和桐花树的地上部生长状况越好,但根部生长无明显影响,说明氮营养增加可有效提高红树植物地上部的耐性(表 1)。
2.2 植物生物量及耐性通过对两种红树植物的根、茎、叶生物量进行数据分析,结果显示:
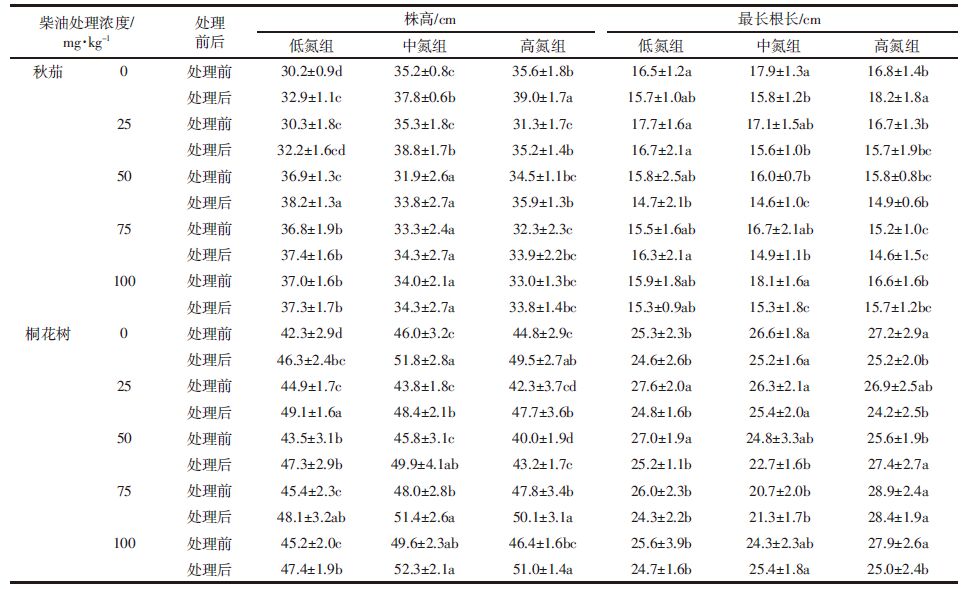
(1)在不同柴油污染浓度条件下,秋茄和桐花树的根部反应较为敏感,柴油污染浓度增加,两种红树植物的根部生物量受显著抑制;而且,增加氮营养水平,可以显著促进桐花树根部生物量(图 1A、图 1B)。
|
| 图 1 不同浓度柴油处理下施加不同浓度氮对两种红树植物生物量的影响 Figure 1 Effects of nitrogen supplies on biomass of two mangrove seedlings under different concentrations of diesel fuel |
(2)秋茄和桐花树的茎部生长对柴油污染较为敏感,茎部生物量随柴油污染浓度增加受一定程度抑制,秋茄受抑制程度更显著;对于两种植物,增加氮营养浓度,可显著促进茎的生长(P<00.05,图 1C、图 1D)。
(3)两种红树植物的叶部对柴油污染都较敏感,随着柴油污染浓度增加,其生长受到显著抑制(P<00.05),且秋茄受抑制程度更显著;在柴油污染中高浓度(50、75、100 mg·kg-1)下,增加氮浓度可以显著促进叶部生物量(P<00.05,图 1E、图 1F)。
2.3 柴油去除率通过对根际和非根际区的沙样柴油含量进行分析,计算出柴油去除率,结果显示:
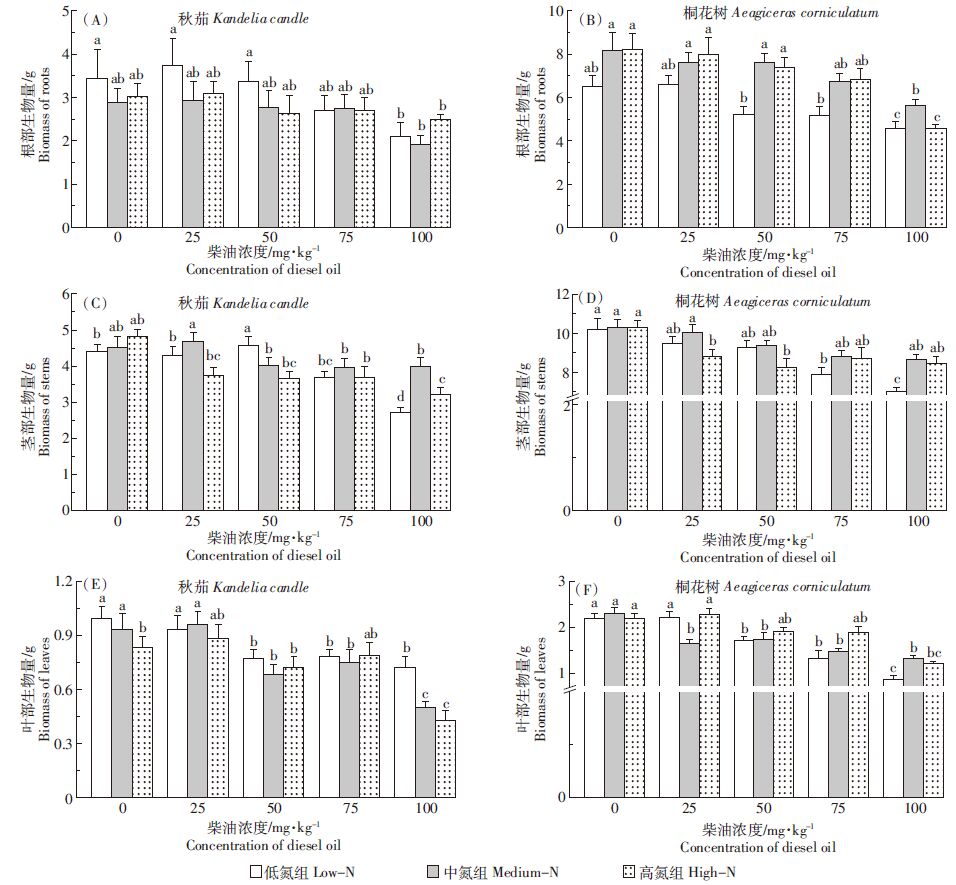
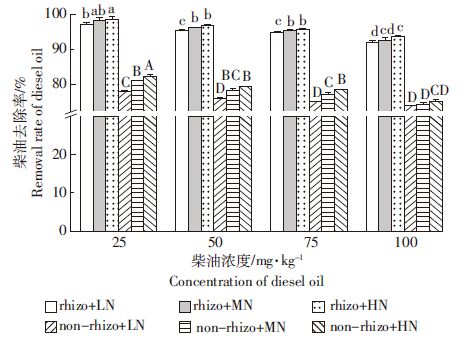
(1)秋茄根际对柴油的去除率高于桐花树,并远远高于非根际区(图 2、图 3),说明红树植物的根际效应对柴油的去除具有促进作用,且秋茄根际效应对柴油污染的去除促进效果更佳。
|
| rhizo:根际区, non-rhizo:非根际区, LN:低氮, MN:中氮, HN:高氮。下同 rhizo:rhizosphere, non-rhizo:non-rhizosphere, LN:low nitrogen, MN:medium nitrogen, HN:high nitrogen. The same below 图 2 施加不同浓度氮的秋茄根际与非根际区对柴油污染去除率 Figure 2 Effects of different nitrogen concentrations on diesel fuel removals in rhizosphere and non-rhizosphere areas of K. candle |

|
| 图 3 施加不同浓度氮的桐花树根际与非根际区对柴油污染去除率 Figure 3 Effects of different nitrogen concentrations on diesel fuel removals in rhizosphere and non-rhizosphere areas of A. corniculatum |
(2)对于秋茄,在柴油的低浓度污染(25、50 mg·kg-1)时,增加氮营养对柴油去除率具有显著的促进作用(P<0.05),在柴油的中高污染浓度(75 mg·kg-1)时,氮营养增加到0.5 mmol·L-1时可以显著提高柴油的去除效率(P<0.05),在柴油高浓度污染(100 mg·kg-1)时,氮营养增加到2.0 mmol·L-1后才能显著促进柴油的去除效率(P<0.05,图 2)。
(3)对于桐花树,在柴油的低浓度污染(25、50 mg·kg-1)时,增加氮营养对柴油去除率没有显著的促进作用,而在柴油的中高浓度污染(75、100 mg·kg-1)时,增加氮营养则可以显著提高柴油的去除效率(P<0.05,图 3)。
(4)对于两种植物的非根际区域,在柴油的各浓度污染条件下,氮营养增加对其去除率均能显著增加(P<0.05,图 2、图 3)。
2.4 相关性分析通过氮营养浓度分别与红树植物生长指标、生物量、柴油去除率的相关性分析,氮营养与秋茄、桐花树的最长根长无显著相关性(P>0.05);氮营养与桐花树的株高有显著正相关(P<0.05);氮营养与秋茄根部、茎部和叶部的生物量无显著相关性,但与桐花树的根部生物量有显著正相关性,与高浓度处理下的桐花树茎部和叶部生物量具有显著正相关(P<0.05);在各浓度柴油处理条件下,氮营养均能显著促进秋茄和桐花树的柴油去除率(P<0.05,表 2)。
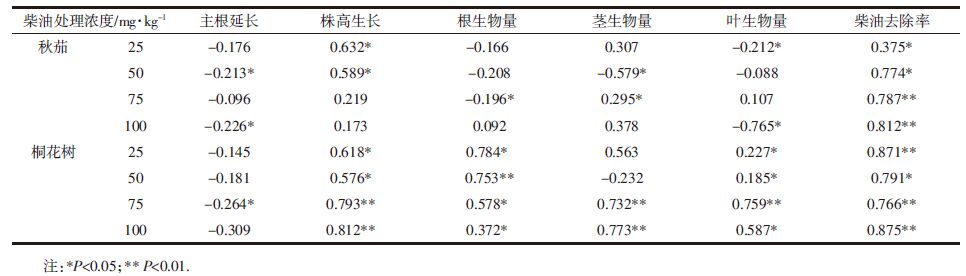 |
氮是湿地植物生长必需的营养要素,研究表明,在一定范围内增加氮营养浓度,可促进湿地植物的生长,尤其是促进湿地植物地上部的生长[16, 17]。在红树植物的研究中,对于红树植物木榄,一定范围内增加NO3--N和NH4+-N,可以显著提高叶部生物量和株高,通过增加氮营养元素还可以提高木榄对高盐度的耐受性[21];研究还发现,用三种不同浓度的NH4Cl处理白骨壤三个月后,不同浓度的NH4+-N对根部的生长率无显著影响,然而提高NH4+-N浓度可显著促进白骨壤地上部生长,并且在NH4+-N最大浓度(1 mmol·L-1)下,地上部的生物量达到最大值[13]。最近对海榄雌属红树植物Avicennia germinans的调查研究发现,氮的浓度升高可促进植物叶片面积、数量以及生物量的显著增加[18]。因此,增加氮营养元素,可以有效促进红树植物地上部,特别是叶部的生长。
此外,应用红树林生态系统处理人工污水的模拟实验研究中,通过分析营养污染物氮在系统中的分配、循环及被净化的效果,发现秋茄、白骨壤和桐花树不仅可以有效吸收和去除人工污水中的TN(总氮)、NH4+-N和NO3--N,而且三种红树植物能正常生长,尤其地上部生长旺盛[3, 4]。本研究的实验结果与已有研究类似,在不同浓度柴油污染浓度条件下,在一定浓度范围内增加氮营养水平,虽对地下部的生物量影响不大,但可以有效提高红树植物秋茄和桐花树株高生长,并显著提高地上部的生物量。由此可见,在一定浓度水平下,氮营养的增加可以有效促进湿地植物和红树植物的地上部特别是叶的生长,而根部则对氮营养浓度的变化并不敏感,受影响较小。
3.2 红树植物对有机污染物的修复石油污染中总石油烃(包括烷烃、芳香烃)具有“三致效应”和持久污染性,其污染日益严重,备受关注[19]。尽管红树林生态系统正逐渐遭受石油油膜的污染,且程度还在加剧[8, 20],但并未导致大范围的枯萎或死亡,说明红树植物对石油污染具有较高的耐受性,可以作为有机污染物和石油污染修复的备选植物。研究表明,红树植物秋茄生长于多环芳烃污染土壤时,从外观看不到植物受到毒性的症状,多环芳烃可通过减低植物对水分和营养物质的吸收而抑制其生物量,使其生物量显著下降,但对不同浓度多环芳烃的处理仍表现出较高耐受性[9]。除了生长指标,一些研究还通过对红树植物的酶活性、叶绿素含量等指标反映其对污染物的耐性,如通过分析叶片中叶绿素组成和含量、游离脯氨酸含量和膜质过氧化产物丙二醛的含量分析,证明红树植物桐花树比秋茄对多氯联苯(PCBs)具有更高的耐性[21]。本研究也得到类似结果,不同浓度的柴油污染对两种红树植物均表现出了生长抑制作用,浓度越高,抑制作用越明显。仅从生长指标来看,桐花树和秋茄对柴油污染均表现出较高耐性,且桐花树对柴油污染的耐性高于秋茄。
应用植物修复有机烃污染研究表明,植物参加的修复过程可有效提高土壤对烃类的降解效率[22]。植物参与的烃类污染修复机制普遍被认为是:(1)植物直接吸收;(2)植物根际的微生物降解;(3)根际行为对污染物的共代谢作用;(4)根际腐殖质的吸附作用[5, 9, 11, 23]。根际微生物被认为是多环芳烃、石油烃等有机污染物降解的重要作用者,研究表明,在石油烃污染的红树林区采集泥土,对其中的真菌进行分离和纯化,可以获得对多环芳烃、石油烃具有降解作用的菌株[24]。然而,大量的研究证实种植植物比未种植的土壤对有机污染物(多环芳烃)的去除有更高的效率[23, 25]。室内盆栽实验表明,利用红树林生态系统(底泥+植物)对多环芳烃的修复具有较显著的去除效果,红树林根际微生物是多环芳烃高效降解的重要作用者,而种植木榄、秋茄则可以对其降解起有效促进作用,使降解率高达90%以上[9, 11]。
最近研究证实了红树植物可应用于石油事故性污染修复。菲律宾的吉马拉斯岛在2006年8月的溢油事故造成200 km海岸带污染,在三年后对红海榄红树林的砍伐区和保留区进行对比调查发现,红树林保留区内各采样点的多环芳烃(PAHs)浓度已达到美国国家海洋和大气管理局(NOAA)的安全水平标准[26]。室内的模拟实验也得到相似结果,应用海榄雌属植物Avicennia schaueriana对总石油烃进行三个月的修复研究表明,红树植物具有对生物修复促进的作用,种植红树植物比不种植有效提高石油中各烃类组分的降解,总石油烃的去除率可达87%以上[27]。本研究结果显示,红树植物非根际区域对柴油去除率在72%~80%范围,而种有秋茄和桐花树则可以显著提高柴油去除率,在根际区域可以高达90%以上,尤其在低污染浓度时去除率可以超过95%。由此可见,秋茄和桐花树不仅对柴油污染具有较高的耐性,而且对其污染具有较好的修复效果,可作为柴油污染生物修复的备选物种。
3.3 氮元素对生物修复的影响对许多湿地植物去除有机污染物的研究发现,多种湿地植物的TN条件与COD和BOD5的去除率呈显著正相关,有效提高了湿地系统的污染净化能力,湿地植物具有较高的生物量,污染物去除能力较好[17]。在一定浓度范围内,增加氮营养水平可以有效提高红树植物的生物量,研究也显示,提高红树植物生物量可以增加其对重金属污染、有机污染的耐受性[5, 9]。还有研究显示,湿地环境中氮营养物质的长期输入,可以维持湿地生态系统的物种组成和结构稳定性,并提高人工湿地对污染物的去除效率[28]。最近有研究表明,受到石油污染土壤中的营养元素(尤其是氮和磷)是参与石油烃类生物降解的微生物生长的关键因子,营养元素浓度的增加可以有效提高石油污染的修复效率;同时,营养元素也是植物生长最为重要的因素,不仅可以促进植物对石油污染的耐性,还可以有效提高植物对石油污染的去除[29]。本研究结果表明,红树植物秋茄和桐花树可以有效去除柴油污染。而氮营养浓度分别与红树植物生长指标、生物量、柴油去除率的相关性分析表明,氮营养对秋茄和桐花树的生物量有显著促进作用,可较大提升红树植物对中高浓度柴油污染的耐受性,并能有效促进两种红树植物对柴油的去除,使其去除率高达92%以上。由此可见,以秋茄和桐花树作为备选植物,通过营养条件的控制与调节,可构建人工红树林湿地,有效去除柴油对近岸生态系统的中长期污染。
4 结论(1)柴油污染对红树植物秋茄和桐花树的生长具有一定的抑制作用,对根部的抑制作用比地上部显著;在一定浓度范围内,增加氮营养水平可以促进红树植物对中高浓度柴油污染(50、75、100 mg·kg-1)的耐受性。
(2)柴油污染在非根际区的去除率在70%~80%水平,种植红树植物秋茄和桐花树,可有效提高柴油去除率,柴油在其根际去除率均达到90%以上,达到较好的生物修复效果。
(3)增加氮营养水平,不仅能有效维持人工湿地系统的稳定性,而且可有效促进秋茄和桐花树对柴油的生物去除效率。在一定氮营养水平下,构建以秋茄和桐花树为主体的人工红树林湿地,可以有效去除柴油对近岸生态系统的污染。
| [1] | 王传远, 贺世杰, 李延太, 等. 中国海洋溢油污染现状及其生态影响研究[J]. 海洋科学, 2009, 33(6):57-60.WANG Chuan-yuan, HE Shi-jie, LI Yan-tai, et al. Study on the state and ecological effect of spilled oil pollution in Chinese coastal waters[J]. Marine Sciences, 2009, 33(6):57-60. |
| [2] | 孙闰霞, 林 钦, 柯常亮, 等. 海洋生物体多环芳烃污染残留及其健康风险评价研究[J]. 南方水产科学, 2012, 8(3):71-78. SUN Run-xia, LIN Qin, KE Chang-liang, et al. Review of assessment of residual contamination and health risk of PAHs in marine organisms[J]. South China Fisheries Science, 2012, 8(3):71-78. |
| [3] | Wong Y S, Tam N F Y, Lan C Y. Mangrove wetlands as wastewater treatment facility:A field trial[J]. Hydrobiologia, 1997, 352(3):49-59. |
| [4] | 陈桂珠, 陈桂葵, 谭凤仪, 等. 白骨壤模拟湿地系统对污水的净化效应[J]. 海洋环境科学, 2000, 19(4):24-26.CHEN Gui-zhu, CHEN Gui-kui, Tam N F Y, et al. Purifying effects of Avicennia marina simulated wetland system on sewage[J]. Marine Environmental Science, 2000, 19(4):24-26. |
| [5] | Liu Y, Tam N F Y, Yang J X, et al. Mixed heavy metal tolerance and radial oxygen loss in mangrove seedlings[J]. Marine Pollution Bulletin, 2009, 58(12):1843-1849. |
| [6] | Santos H F, Carmo F L, Paes J E S, et al. Bioremediation of mangroves impacted by petroleum[J]. Water, Air, and Soil Pollution, 2011, 216(1):329-350. |
| [7] | Tam N F Y, Wong Y S. Effectiveness of bacterial inoculum and mangrove plants on remediation of sediment contaminated with polycyclic aromatic hydrocarbons[J]. Marine Pollution Bulletin, 2008, 57(6):716-726. |
| [8] | Tam N F Y, Ke L, Wang X H, et al. Contamination of polycyclic aromatic hydrocarbons in surface sediments of mangrove swamps[J]. Environmental Pollution, 2001, 114(2):255-263. |
| [9] | Ke L, Wang Q B, Wong T W Y, et al. Removal of pyrene from contaminated sediments by mangrove microcosms[J]. Chemosphere, 2003, 51(1):25-34. |
| [10] | 李 玫, 陈桂珠. 含油废水对秋茄幼苗的几个生理生态指标的影响[J]. 生态学报, 2000, 20(3):528-532.LI Mei, CHEN Gui-zhu. Effect of oil wastewater on some eco-physiological indexes of Kandelia candel seedlings[J]. Acta Ecological Sinica, 2000, 20(3):528-532. |
| [11] | 方 宇, 严重玲, 杜静娜, 等. 红树植物秋茄对菲污染沉积物的根际修复研究[J]. 农业环境科学学报, 2011, 30(6):1160-1165.FANG Yu, YAN Chong-ling, DU Jing-na, et al. Rhizosphere remediation of phenanthrane-contaminated sediment by Kandelia candle(L.)Druce[J]. Journal of Agro-Environmental Sciences, 2011, 30(6):1160-1165. |
| [12] | Yates E J, Ashwath N, Midmore D J. Responses to nitrogen, phosphorus, potassium and sodium chloride by three mangrove species in pot culture[J]. Trees, 2002, 16(2):120-125. |
| [13] | Naidoo G. Effects of salinity and nitrogen on growth and water relations in the mangrove, Avicennia marina(Forsk.) Vierh[J]. New Phytologist, 1987, 107(2):317-325. |
| [14] | Gallego J L R, Loredo J, Llamas J F, et al. Bioremediation of diesel-contaminated soils:Evaluation of potential in situ techniques by study of bacterial degradation[J]. Biodegradation, 2001, 12(5):325-335. |
| [15] | Taketani R G, Yoshiura C A, Dias A C F, et al. Diversity and identification of methanogenic archaea and sulphate-reducing bacteria in sediments from a pristine tropical mangrove[J]. Antonie van Leeuwenhoek, 2010, 97(4):401-411. |
| [16] | 章文龙, 曾从盛, 张林海, 等. 闽江河口湿地植物氮磷吸收效率的季节变化[J]. 应用生态学报, 2009, 20(6):1317-1322.ZHANG Wen-long, ZENG Cong-sheng, ZHANG Lin-hai, et al. Seasonal dynamics of nitrogen and phosphorus absorption efficiency of wetland plants in Minjiang River estuary[J]. Chinese Journal of Applied Ecology, 2009, 20(6):1317-1322. |
| [17] | 石 雷, 杨 璇. 人工湿地植物量及其对净化效果影响的研究[J]. 生态环境学报, 2010, 19(1):28-33.SHI Lei, YANG Xuan. Phytomass and its impact on the pollutant removal ability of constructed wetland[J]. Ecology and Environmental Sciences, 2010, 19(1):28-33. |
| [18] | Simpson L T, Feller I C, Chapman S K. Effects of competition and nutrient enrichment on Avicennia germinans in the salt marsh-mangrove ecotone[J]. Aquatic Botany, 2013, 104(1):55-59. |
| [19] | Wilcke W. Synopsis polycyclic aromatic hydrocarbons(PAHs) in soil:A review[J]. Journal of Plant Nutrition and Soil Science, 2000, 163(3):229-248. |
| [20] | Maiti S K M, Chowdhury A. Effects of anthropogenic pollution on mangrove biodiversity:A review[J]. Journal of Environmental Protection. 2013, 4(12):1428-1434. |
| [21] | 刘亚云, 孙红斌, 陈桂珠, 等. 秋茄(Kandelia candle)幼苗对对氯联苯污染的生理生态响应[J]. 生态学报, 2007, 27(2):746-754.LIU Ya-yun, SUN Hong-bin, CHEN Gui-zhu, et al. Eco-physiological responses of Kandelia candle seedlings to polychlorinated biphenyls(PCBs) treatment[J]. Acta Ecologica Sinica, 2007, 27(2):746-754. |
| [22] | Xu S Y, Chen Y X, Wu W X, et al. Enhanced dissipation of phenanthrene and pyrene in spiked soils by combined plants cultivation[J]. Science of the Total Environment, 2006, 363(1):206-215. |
| [23] | Gao Y, Zhu L. Plant uptake, accumulation and translocation of phenanthrene and pyrene in soils[J]. Chemosphere, 2004, 55(9):1169-1178. |
| [24] | Gofar N. Characterization of petroleum hydrocarbon decomposing fungi isolated from mangrove rhizosphere[J]. Journal of Tropical Soils, 2013, 16(1):39-45. |
| [25] | Maila M P, Randima P, Cloete T E. Multispecies and monoculture rhizoremediation of polycyclic aromatic hydrocarbons(PAHs) from the soil[J]. International Journal of Phytoremediation, 2005, 7(2):87-98. |
| [26] | Abner P B, Resurreccion B S. Recovery of mangrove deforested areas from M/T solar oil spill in Guimaras, Philippines[J]. International Oil Spill Conference Proceedings, 2014, 1(5):2260-2272. |
| [27] | Moreira I T A, Oliveira O M C, Triguis J A, et al. Phytoremediation in mangrove sediments impacted by persistent total petroleum hydrocarbons(TPHs) using Avicennia schaueriana[J]. Marine Pollution Bulletin, 2013, 67(1):130-136. |
| [28] | 徐治国, 何 岩, 闫百兴, 等. 湿地植物对外源氮、磷输入的响应研究[J]. 环境科学研究, 2007, 20(1):64-68.XU Zhi-guo, HE Yan, YAN Bai-xing, et al. Response of wetland plants to nitrogen and phosphorus inputs[J]. Research of Environmental Sciences, 2007, 20(1):64-68. |
| [29] | Nsobilaatibila E. Using nitrogen and phosphorus to stimulate microbial degradation of diesel oil in four Ghanaian soils[D]. Accra: University of Ghana, 2013. |
 2015, Vol. 34
2015, Vol. 34