文章信息
- 李维宏, 杨宁, 魏晓峰, 岳秀萍, 徐建
- LI Wei-hong, YANG Ning, WEI Xiao-feng, YUE Xiu-ping, XU Jian
- 一株Cr(Ⅵ)还原菌的筛选鉴定及其还原特性研究
- Isolation, Identification and Cr(Ⅵ)-Reducing Capacity of a Cr(Ⅵ)-Reducing Strain Enterobacterhormaechei
- 农业环境科学学报, 2015, 34(11): 2133-2139
- Journal of Agro-Environment Science, 2015, 34(11): 2133-2139
- http://dx.doi.org/10.11654/jaes.2015.11.014
-
文章历史
- 收稿日期: 2015-04-15
2. 山西农业大学资源环境学院, 山西 太谷 030801;
3. 山西农业大学食品科学与工程学院, 山西 太谷 030801;
4. 中国环境科学研究院环境基准与风险评估国家重点实验室, 北京 100012
2. College of Resources and Environment, Shanxi Agriculture University, Taigu 030801, China;
3. College of Food Science and Engineering, Shanxi Agriculture University, Taigu 030801, China;
4. State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012, China
铬是重要的化工原料,广泛应用于电镀、冶金、建材、鞣革、防腐、染料、化工等工业,在其生产和使用过程中会产生大量的固体废物和废液,如未经处理直接排放,将给生态环境和人类健康带来严重的威胁。铬在环境中主要以Cr(Ⅲ)和Cr(Ⅵ)的形态存在,其中Cr(Ⅲ)溶解度小,移动性弱,毒性小,而Cr(Ⅵ)易溶于水,氧化性强,毒性约是Cr(Ⅲ)的100倍,Cr(Ⅵ)通过口腔进入人体后,可以引起一系列的病变,如贫血、心肌病变、肝肾病变、循环衰竭,甚至死亡[1],被许多国家列为优先处理的污染物[2]。因此,把Cr(Ⅵ)转变成Cr(Ⅲ),不仅是一种有效的解毒方式,而且是最终从环境中去除的关键步骤[3]。
针对Cr(Ⅵ)污染的传统治理方法有固定化/稳定化、化学还原、化学淋洗、电动修复和植物修复等,但大多对场地要求较高,限制较多[4, 5]。微生物修复技术修复效果好、投资小、费用低、易于管理与操作、不产生二次污染,因而日益受到人们的重视,成为重金属污染土壤修复的研究热点[6]。从Cr(Ⅵ)污染介质中分离微生物,并有针对性地将其应用于污染土壤及水体的修复治理,是一种较为理想的修复方法。
目前,已分离出多种具有Cr(Ⅵ)还原作用的菌种,如节杆菌[7]、微球菌[8]、大肠杆菌[9]、棒状杆菌、芽孢杆菌[10, 11]、硫杆菌、溶血不动杆菌、无色杆菌、细杆菌[12]、布鲁斯氏菌[13]、假单胞菌[14, 15, 16]等。其中除了芽孢杆菌和假单胞菌等种属的菌株能在好氧条件下将Cr(Ⅵ)还原之外,绝大多数种类的菌株都只能在厌氧的条件下还原Cr(Ⅵ),而且其中大多数菌种的培养成本高,离工业应用还有一定的距离。因此,有必要进一步筛选耐性好、还原能力强、培养成本低的功能菌株,为后期实践应用奠定基础。
本研究从山西某铬渣污染地采集、分离、筛选并培养出高效Cr(Ⅵ)还原功能菌,通过研究该菌的培养特性,并利用分子生物学方法对该菌的16S rRNA进行扩增和测序,结合细菌生理生化特征鉴定其种属关系,分析其在系统发育学的地位,研究该菌还原Cr(Ⅵ)的行为特征,考察温度、pH值、初始Cr(Ⅵ)浓度对生长中的细菌还原Cr(Ⅵ)的影响,探索Cr(Ⅵ)还原菌株还原特性,旨在为抗性菌株修复Cr(Ⅵ)污染土壤提供科学依据和实验材料。
1 材料与方法 1.1 菌种的富集和分离土壤样品采自山西某铬渣堆场及铬渣堆场周围不同区域土壤,该铬渣堆场始建于1997年,周边为生态林区。按三角形布设采样点,在铬渣堆场周围按距渣堆50、100、150 m采集土壤样品,采用随机布点法,取离地面5~15 cm深度的土壤,每3~5个点均匀混合后用四分法取舍组成一个混合样,样品均装在清洁的玻璃瓶中,统一编号保存。
取10 g土壤样品,加入装有100 mL灭菌的蒸馏水中,摇匀后取10 mL加入已灭菌的液体培养基中。添加重铬酸钾溶液,使Cr(Ⅵ)质量浓度为100 mg·L-1,在30 ℃的恒温振荡箱中150 r·min-1振荡培养3 d,进行驯化和富集;然后依次以100 mg·L-1递增,每个浓度培养3 d,直到最后Cr(Ⅵ)质量浓度为500 mg·L-1,每个浓度均设3个重复。取驯化后的菌液1 mL,按10-1、10-2、……、10-6进行梯度稀释,分别取l mL接种到平板上,用涂布棒将菌液涂匀,移入30 ℃培养箱中培养24 h,待菌落长出后挑取单菌落,再以同样方法进一步分离纯化,直至菌落形态、菌体形态一致。
液体培养基成分:胰蛋白胨10 g·L-1,氯化钠10 g·L-1,酵母提取物5 g·L-1,葡萄糖1 g·L-1[17]。
固体培养基成分:牛肉膏5 g·L-1,蛋白胨10 g·L-1,氯化钠5 g·L-1,琼脂20 g·L-1。
1.2 Cr(Ⅵ)还原菌的筛选将分离得到的菌种接种到液体培养基中,在30 ℃、150 r·min-1条件下培养24 h进行活化,然后转接到Cr(Ⅵ)质量浓度为100 mg·L-1的液体培养基中,30 ℃、150 r·min-1条件下培养;分别培养24 h和48 h,在4 ℃、10 000 r·min-1条件下离心15 min,收集上清液;测试上清液中Cr(Ⅵ)浓度,判断细菌是对Cr(Ⅵ)存在还原作用,还是只对Cr(Ⅵ)有一定的耐受能力,确保筛选出的最终菌株为Cr(Ⅵ)还原菌,再选取Cr(Ⅵ)还原效果最好的菌株进行后续实验。培养过程中每个菌株设3个重复并设置空白进行质量控制。
1.3 Cr(Ⅵ)的测定Cr(Ⅵ)的测定采用二苯碳酰二肼分光光度法,参见GB 7467—1987。
1.4 Cr(Ⅵ)还原率的计算Cr(Ⅵ)的还原率采用如下公式[18]计算:
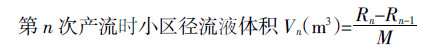
将分离得到的对Cr(Ⅵ)还原效果最好的菌株进行16S rDNA序列分析,由北京六合华大基因科技有限公司完成。主要试验方法如下:
1.5.1 变性在培养基中挑取菌体置于50 μL Lysis Buffer for Microorganism to Direct PCR中变性后离心取上清作为模板。反应条件:80 ℃,15 min。
1.5.2 PCR 扩增使用所选细菌16S rDNA的特异性引物进行PCR扩增。
反应体系:上述变性液1 μL,PCR Premix 25 μL,Forward primer(20 pmol·μL-1)0.5 μL,Reverse primer2(20 pmol·μL-1)0.5 μL,16S-free H2O 23 μL,共 50 μL。
反应条件:94 ℃、5 min,1个循环;94 ℃、1 min,55 ℃、1 min,72 ℃、1.5 min,30个循环;72 ℃、5 min,1个循环。
取切胶回收目的片段进行DNA 测序。
1.5.3 测序以SEQ Forward、SEQ Internal 和SEQ Reverse 为引物进行DNA 测序。将测得的序列提交到Gen-Bank 数据库进行BLAST 相似性分析,并利用MEGA5.0 软件构建系统发育树。
1.6 pH、温度、Cr(Ⅵ)初始浓度对菌株还原Cr(Ⅵ)的影响将所得高效还原Cr(Ⅵ)菌株进行还原条件优化,探讨pH值、温度、Cr(Ⅵ)初始浓度对菌株还原Cr(Ⅵ)性能的影响[19, 20]。取高效还原Cr(Ⅵ)菌株的种子液5 mL,接入装有100 mL液体培养基的250 mL锥形瓶中,于30 ℃、150 r·min-1的恒温摇床中活化16 h。
将活化后处于对数生长期菌液(3×107 CFU)按照10%的接种量接入装有100 mL液体培养基的250 mL锥形瓶中,其中Cr(Ⅵ)初始质量浓度为100 mg·L-1,实验pH设定为5.0、6.0、7.0、8.0和9.0,于30 ℃、150 r·min-1的恒温摇床中培养。在此期间,前12 h每隔3 h取一次样,后60 h每隔12 h取一次样,样品离心后,测定上清液的Cr(Ⅵ)浓度,计算Cr(Ⅵ)还原率。
将活化后处于对数生长期菌液按照10%的接种量,接入装有100 mL液体培养基的250 mL锥形瓶中,Cr(Ⅵ)初始质量浓度为100 mg·L-1,选取最优pH值,分别于25、30、35、40、45 ℃,150 r·min-1恒温摇床中培养。在此期间,前12 h每隔3 h取一次样,后60 h每隔12 h取一次样,样品离心后,测定上清液的Cr(Ⅵ)浓度,计算Cr(Ⅵ)还原率。
将活化后处于对数生长期菌液按照10%的接种量,接入装有100 mL液体培养基的250 mL锥形瓶中,Cr(Ⅵ)初始质量浓度为50、100、200、400、800 mg·L-1,选取最优pH值和温度,150 r·min-1恒温摇床中培养。在此期间,前12 h每隔3 h取一次样;后60 h每隔12 h取一次样,样品离心后,测定上清液的Cr(Ⅵ)浓度,计算Cr(Ⅵ)还原率。
以上所有实验均设3次重复,结果数据处理均为平均值。
2 结果与分析 2.1 菌种的分离经过多次分离、筛选和纯化,得到10株能够耐受500 mg·L-1 Cr(Ⅵ)的菌株,分别为A1H、A2H、B3L、B4L、C1L、C2L、C3L、D1H、E1H、E2H。但并不是所有Cr(Ⅵ)抗性菌株都具有较好的Cr(Ⅵ)还原能力,因此需要对初步分离出来的菌株进行还原能力检测,从中筛选高效的Cr(Ⅵ)还原菌株。
通过对这10株菌Cr(Ⅵ)还原性的筛选,发现有5株菌对Cr(Ⅵ)有一定的还原性,分别为A1H、A2H、B4L、C2L、E2H。经计算其在Cr(Ⅵ)质量浓度为100 mg·L-1的液体培养基中Cr(Ⅵ)还原率分别为60.3%、78.9%、50.3%、92.5%、82.3%,据此选择高效还原Cr(Ⅵ)的菌株C2L作为进一步研究对象。
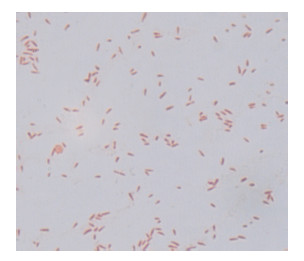
2.2 菌株形态学鉴定将获得的菌株在胰蛋白胨培养基上30 ℃恒温培养24 h,革兰氏染色为红色,在光学显微镜下观察,菌体为短杆状(图 1)。该菌株菌落形态特征为圆形、光滑、乳白色。
|
| 图 1 C2L 菌株的形态特征 Figure 1 Morphological characteristics of strain C2L |
挑取适量的C2L菌株接种于自制发酵管内,于30 ℃恒温培养,观察其生理生化反应。结果表明:该菌能利用葡萄糖产酸,但不产气;甘油或肌醇发酵不产气;氧化酶反应、吲哚实验、淀粉水解实验、MR实验均为阴性;过氧化氢酶反应、VP反应、明胶液化结果均为阳性。
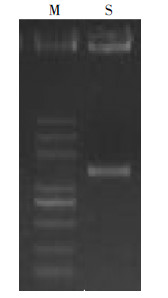
2.4 菌株分子生物学鉴定利用细菌16S rDNA 通用引物,用PCR的方法扩增菌株16S rDNA 部分片段,通过PCR 产物测序获得该片段序列如图 2,测序所得C2L菌株的 16S rDNA长度 1405 bp,结果为:
|
| M:Marker DL2000 plus,从下至上依次为:5000、3000、2000、1000、750、500、250、100bp。S:样品 图 2 琼脂糖凝胶电泳检测PCR产物图 Figure 2 Image of agarose gel electrophoresis of PCR product |
CCGAAGGTTAAGCTACCTACTTCTTTTGCAACC CACTCCCATGGTGTGACGGGCGGTGTGTACAAGGC CCGGGAACGTATTCACCGTGGCATTCTGATCCACG ATTACTAGCGATTCCGACTTCATGGAGTCGAGTTGC AGACTCCAATCCGGACTACGACGCACTTTATGAGG TCCGCTTGCTCTCGCGAGGTCGCTTCTCTTTGTATG CGCCATTGTAGCACGTGTGTAGCCCTACTCGTAAG GGCCATGATGACTTGACGTCATCCCCACCTTCCTC CAGTTTATCACTGGCAGTCTCCTTTGAGTTCCCGG CCTAACCGCTGGCAACAAAGGATAAGGGTTGCGC TCGTTGCGGGACTTAACCCAACATTTCACAACACG AGCTGACGACAGCCATGCAGCACCTGTCTCAGAG TTCCCGAAGGCACCAAAGCATCTCTGCTAAGTTCT CTGGATGTCAAGAGTAGGTAAGGTTCTTCGCGTTG CATCGAATTAAACCACATGCTCCACCGCTTGTGCG GGCCCCCGTCAATTCATTTGAGTTTTAACCTTGCGG CCGTACTCCCCAGGCGGTCGACTTAACGCGTTAGC TCCGGAAGCCACGCCTCAAGGGCACAACCTCCAA GTCGACATCGTTTACGGCGTGGACTACCAGGGTAT CTAATCCTGTTTGCTCCCCACGCTTTCGCACCTGA GCGTCAGTCTTTGTCCAGGGGGCCGCCTTCGCCAC CGGTATTCCTCCAGATCTCTACGCATTTCACCGCTA CACCTGGAATTCTACCCCCCTCTACAAGACTCTAG CCTGCCAGTTTCGAATGCAGTTCCCAGGTTGAGCC CGGGGATTTCACATCCGACTTGACAGACCGCCTGC GTGCGCTTTACGCCCAGTAATTCCGATTAACGCTT GCACCCTCCGTATTACCGCGGCTGCTGGCACGGA GTTAGCCGGTGCTTCTTCTGCGGGTAACGTCAATC GACAAGGTTATTAACCTTATCGCCTTCCTCCCCGCT GAAAGTACTTTACAACCCGAAGGCCTTCTTCATAC ACGCGGCATGGCTGCATCAGGCTTGCGCCCATTGT GCAATATTCCCCACTGCTGCCTCCCGTAGGAGTCT GGACCGTGTCTCAGTTCCAGTGTGGCTGGTCATCC TCTCAGACCAGCTAGGGATCGTCGCCTAGGTGAGC CGTTACCCCACCTACTAGCTAATCCCATCTGGGCAC ATCCGATGGCAAGAGGCCCGAAGGTCCCCCTCTTT GGTCTTGCGACGTTATGCGGTATTAGCTACCGTTTC CAGTAGTTATCCCCCTCCATCAGGCAGTTTCCCAG ACATTACTCACCCGTCCGCCACTCGTCAGCAAAGC AGCAAGCTGCTTGCCTGTTACCGTTCGTGCTGCAT GGT
将上述所得测序结架应用BLAST工具进行基因同源性和相似性分析,经BLAST同源性检索比对,得到如下结果:C2L菌株与Enterobacterhormaechei strain亲缘关系较近。
根据BLAST分析结果,C2L菌株所属生物细菌分类学信息如下:
domain Bacteria(0/20/659718)
phylum “Pmteobacteria”(0/20/183305)
class “Gammapwteobacteria”(0/20/83510)
order “Enterobacteriales”(0/20/18387)
family “Enterobacteriaceae”(0/20/18387)
genus “Enterobacterhormaechei”(0/20/1678)
将测得的序列提交到Gen-Bank 数据库,进行BLAST 相似性分析,并利用MEGA5.0 软件中Neighbor Joining方法构建系统发育树如图 3。

|
| 图 3 菌株C2L 基于16S rDNA 序列所构建的系统发育树 Figure 3 Phylogenetic tree based on partial 16S rDNA sequences of C2L |
通过系统发育树可看出,C2L菌株与Enterobacterhormaechei strain亲缘关系较近,达到99%。
2.5 pH对微生物还原Cr(Ⅵ)的影响pH 通过影响细胞质膜结构的稳定性、膜的透性和物质的电离性或溶解性来影响营养物质的吸收,从而影响微生物的生长速率和Cr(Ⅵ)的还原速率,确定菌株还原Cr(Ⅵ)的最适pH 范围,有助于拓宽其在生产中的应用[21, 22]。
图 4为不同pH下C2L菌株的Cr(Ⅵ)还原率。可知,该菌株在初始pH为5.0~8.0的范围内,随着pH的升高,Cr(Ⅵ)还原率增大;此后,随着pH的进一步上升,Cr(Ⅵ)还原率减小。在pH 7.0~9.0范围内,菌体对Cr(Ⅵ)都有一定的还原能力,Cr(Ⅵ)还原率均保持在85%以上,表明该菌在较大pH范围内可以生长。在pH为8.0时Cr(Ⅵ)还原率最大,达到93.6%,故确定C2L菌株处理含Cr(Ⅵ)废水的最佳pH值为8.0。
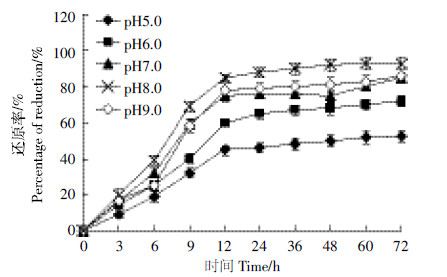
|
| 图 4 pH 值对C2L 菌株Cr(遇)还原率的影响 Figure 4 Effect of pHon reduction efficiencies of Cr(遇) by strain C2L |
由图 5可知,当温度为30 ℃时,Cr(Ⅵ)还原率达到最大,为93.9%;进一步提高温度,菌体生长受到抑制,Cr(Ⅵ)的还原率随温度的升高迅速下降。温度过高不利于C2L菌株的生长及Cr(Ⅵ)的还原,其原因可能是温度过高引起了C2L菌株细胞内蛋白质的变性。因此,确定30 ℃为最佳培养温度。
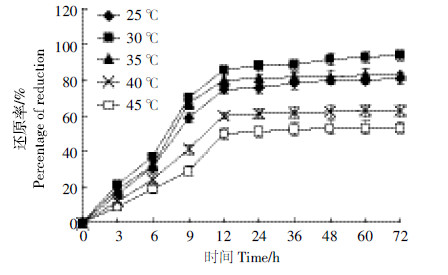
|
| 图 5 温度对C2L菌株Cr(遇)还原率的影响 Figure 5 Effect of temperature on reduction efficiencies of Cr(遇)by strain C2L |
图 6表明,在Cr(Ⅵ)初始浓度为50、100、200、400、800 mg·L-1时,C2L菌株对Cr(Ⅵ)均有一定的还原作用,还原率分别为99.3%、94.2%、85.6%、82.1%、58.2%。在较低的初始浓度50 mg·L-1,还原率最高,达到了99.3%,而且表现出了很好的还原速率。随着Cr(Ⅵ)初始浓度的升高,还原率有所下降,但均在58%以上。这说明,随着Cr(Ⅵ)初始浓度的升高,对细菌产生了一定的毒性,使得细菌生长受到抑制,最终影响其对Cr(Ⅵ)的还原效果。
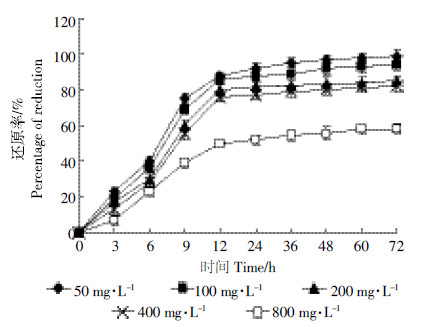
|
| 图 6 不同Cr(遇)初始浓度对C2L 菌株Cr(遇)还原率的影响 Figure 6 Effects of initial concentrations of Cr(遇)on reduction efficiencies of Cr(遇)by strain C2L |
研究表明,在pH 5.0~9.0范围内,C2L菌株对环境中Cr(Ⅵ)的还原能力都达到了52.2%以上,表明该菌的适宜pH值范围较广。但在碱性环境下,C2L菌株还原Cr(Ⅵ)的能力明显优于酸性环境。在pH为8.0时Cr(Ⅵ)还原率最大,在12 h达到85.6%,72 h后达到93.6%。Ma等[23]对无色杆菌Achromobacter sp.的研究结果表明,菌株的最佳Cr(Ⅵ)还原pH为9。而Wang等[24]对肠杆菌Enterbacter sp.的研究结果显示,该菌株仅能在pH 6.5~8.5范围内获得理想的Cr(Ⅵ)还原效果,当pH小于5或大于9时,菌株的生长与Cr(Ⅵ)还原会受到强烈的抑制。这与本研究基本一致。目前只有少数铬还原菌的最优反应 pH 值偏碱性,如Leucobacter sp. CRB1 细菌的最佳pH值为 9.0[19],该菌在pH6时,基本不具有Cr(Ⅵ)还原能力。这是因为该细菌由高碱性的土壤中分离所得,其所含还原酶在碱性条件下具有最好的还原性能。
当温度为30 ℃时,Cr(Ⅵ)还原率达到最大,为93.9%。类似的最适温度在其他文献[25]中也有报道。如球形芽孢杆菌Bacillus sp.的最佳还原温度为30 ℃[26]。此外,30~35 ℃范围内,温度对菌株还原Cr(Ⅵ)的影响相差不大,而45~50 ℃条件下Cr(Ⅵ)的还原率低于25 ℃。微生物的代谢活动都是由一系列生物化学反应参与完成的,这些反应受温度的影响比较大,所以温度过高会影响酶的活性进而造成还原率的降低。
文献报道E.cloacae HO1在Cr(Ⅵ)浓度为36 mg·L-1时,还原活性将会明显降低。而大肠杆菌E.coli 33456还原Cr(Ⅵ)的速率虽然会随着初始Cr(Ⅵ)浓度的升高而升高,但它还原Cr(Ⅵ)的时间却也会随着Cr(Ⅵ)初始浓度的升高而延长[27]。荧光假单胞菌P.fluorescens LB300菌株在初始Cr(Ⅵ)浓度为25 mg·L-1时,除Cr(Ⅵ)效率会大受影响[28]。通过比较可以看出,本研究筛选的菌株在高Cr(Ⅵ)浓度下还原率与低Cr(Ⅵ)浓度比较有所下降,但在较短时间内还原率都达到58%以上。在有氧、中温及碱性条件下,该菌株对Cr(Ⅵ)有较强的还原作用,相对于其他需要较高营养条件且环境适应能力差的Cr(Ⅵ)还原菌,该菌株更节约成本且环境适应能力强。
4 结论从山西某铬渣堆场附近的土壤中分离获得对Cr(Ⅵ)具有较高还原能力的菌株C2L,经鉴定,菌株为霍氏肠杆菌(Enterobacterhormaechei)。目前,还未见报道Enterobacterhormaechei菌株有还原Cr(Ⅵ)的能力。在有氧、中温及碱性条件下,该菌株对Cr(Ⅵ)有较强的还原作用,可还原质量浓度高达800 mg·L-1的Cr(Ⅵ)。
| [1] | 李丹丹, 郝秀珍, 周东美, 等. 淋洗法修复铬渣污染场地实验研究[J]. 农业环境科学学报, 2011, 30(12):2451-2457.LI Dan-dan, HAO Xiu-zhen, ZHOU Dong-mei, et al. Remediation of chromium residue contaminated soil using a washing technology[J]. Journal of Agro-Environment Science, 2011, 30(12):2451-2457. |
| [2] | 张建荣, 李 娟, 许 伟. 原位生物稳定固化技术在铬污染场地治理中的应用研究[J]. 环境科学, 2013, 34(9):3684-3689.ZHANG Jian-rong, LI Juan, XU Wei. Research on the application of in-situ biological stabilization solidification technology in chromium contaminated site management[J]. Environmental Science, 2013, 34(9):3684-3689. |
| [3] | 王晓雯. 土壤中铬污染修复技术研究进展[J]. 环境与可持续发展, 2014, 39(6):210-212.WANG Xiao-wen. Research progress of chromium pollution in soil remediation technology[J]. Environmental and Sustainable Development, 2014, 39(6):210-212. |
| [4] | 邓红艳, 陈刚才. 铬污染土壤的微生物修复技术研究进展[J]. 地球与环境, 2012, 40(3):466-471.DENG Hong-yan, CHEN Gang-cai. Process in research on microbial remediation on technologies of chromium-contaminated soil[J]. Earth and Environment, 2012, 40(3):466-471. |
| [5] | Wu H Y, Ting Y P. Metal extraction from municipal solid waste(MSW)incinerator fly ash:Chemical leaching and fungal bioleaching[J]. Enzyme and Microbial Technology, 2006, 38(6):839-847. |
| [6] | 黄益宗, 郝晓伟, 雷 鸣, 等. 重金属污染土壤修复技术及其修复实践[J]. 农业环境科学学报, 2013, 32(3):409-417.HUANG Yi-zong, HAO Xiao-wei, LEI Ming, et al. The remediation technology and remediation practice of heavy metals-contaminated soil[J]. Journal of Agro-Environment Science, 2013, 32(3):409-417. |
| [7] | Gvozdyak P I, Mogilevich N F, Rylskii A F, et al. Reduction of hexavalent chromium by collection strains of bacteria[J]. Microbiology, 1986, 55:962-965. |
| [8] | Shen H, Wang Y T. Characterization of enzymatic reduction of hexavalent chromium by escherichia coli ATCC 33456[J]. Applied and Environmental Microbiology, 1993, 59(11):3771-3777. |
| [9] | Megharaj M, Avudainayagam S, Naidu R. Toxicity of hexavalent chromium and its reduction by bacteria isolated from soil contaminated with tannery waste[J]. Current Microbiology, 2003, 47(1):51-54. |
| [10] | Srinath T, Verma T, Ramteke P W, et al. Chromium(Ⅵ) biosorption and bioaccumulation by chromate resistant bacteria[J]. Chemosphere, 2002, 48(4):427-435. |
| [11] | Viti C, Pace A, Giovannetti L. Characterization of Cr(Ⅵ) resistant bacteria isolated from chromium-contaminated soil by tannery activity[J]. Current Microbiology, 2003, 46(1):1-5. |
| [12] | Pattanapipitpaisal P, Brown N, Macaskie L. Chromate reduction and 16S rRNA identification of bacteria isolated from a Cr(Ⅵ) contaminated site[J]. Applied Microbiology and Biotechnology, 2001, 57(1/2):257-261. |
| [13] | Thacker U, Parikh R, Shouche Y, et al. Reduction of chromate by cell free extract of Brucella sp. isolated from Cr(Ⅵ) contaminated sites[J]. Bioresource Technology, 2007, 98(8):1541-1547. |
| [14] | McLean J, Beveridge T J. Chromate redutcion by a Pseudomonad isolated from a site contaminated with chromated copper arsenate[J]. Applied and Environmental Microbiology, 2001, 67(3):1076-1084. |
| [15] | Aravindhan R, Sreeram K J, Rao J R, et al. Biological removal of carcingoenic chromium(Ⅵ) using mixed Pseudomonas stains[J]. The Journal of General and Applied Microbiology, 2007, 53(2):71-79. |
| [16] | Park C H, Keyhan M, Wielinga B, et al. Purification to homogeneity and characterization of a novel Pseudomonas putida chromate reductase[J]. Applied Environmental Microbiology, 2000, 66(5):1788-1795. |
| [17] | Ahmed Z, Abdul R. Isolation of Cr(Ⅵ) reducing bacteria from industrial effluents and their potential use in bioremediation of chromium containing wastewater[J]. Journal of Environmental Sciences, 2009, 21:814-820. |
| [18] | 徐卫华. 微生物还原Cr(Ⅵ)的特性与机理研究[D]. 长沙:湖南大学, 2007:39.XU Wei-hua. Research on characteristics and mechanisms of microbial Cr(Ⅵ) reduction[D]. Changsha:Graduate School of Hunan University, 2007:39. |
| [19] | 朱文杰. Leucobacter sp. CRBl菌还原铬(Ⅵ)的机理及其在铬渣解毒中的应用[D]. 长沙:中南大学, 2007.ZHU Wen-jie. Mechanism of Cr(Ⅵ) reduction with Leueobacter sp. CRBI and its application in detoxification of chromite ore processing residue[D]. Changsha: Central South University, 2007. |
| [20] | 张 剑. 高效降Cr(Ⅵ)菌的筛选鉴定及其降解特性[D]. 湘潭: 湘潭大学, 2011.ZHANG Jian. Screening, identification and characteristics of a strain with high Cr(Ⅵ) degradation capacity[D]. Xiangtan: Xiangtan University, 2011. |
| [21] | 胡永娟, 李学梅, 王海磊, 等. 抗铬菌株的筛选鉴定及其生物学特性和吸附特性[J]. 环境工程学报, 2014, 8(6):2585-2591.HU Yong-juan, LI Xue-mei, WANG Hai-lei, et al. Screening of chromium resistance strains and their biological and absorption characteristics[J]. Chinese Journal of Environmental Engineering, 2014, 8(6):2585-2591. |
| [22] | Ramesh C P, Seidu M, Michael B, et al. Molecular characterization of chromium(Ⅵ) reducing potential in gram positive bacteria isolated from contaminated sites[J]. Soil Biology & Biochemistry, 2010, 42(10):1857-1863. |
| [23] | Ma Z M, Zhu W J, Long H Z, et al. Chromate reduction by resting cells of Achromobacter sp. Ch-1 under aerobic conditions[J]. Process Biochemistry, 2007, 42(6):1028-1032. |
| [24] | Wang P C, Mori T, Toda K, et al. Membrane-associated chromate reductase activity from Enterobacter cloacae[J]. Journal of Bacteriology, 1990, 172(3):1670-1672. |
| [25] | 陈建春, 林玉满, 陈祖亮. 六价铬还原菌的筛选及其还原特性研究[J]. 福建师范大学学报(自然科学版), 2010, 26(2):78-82.CHEN Jian-chun, LIN Yu-man, CHEN Zu-liang. Isolation and reduction characteristics of hexavalent chromium-reducing bacteria[J]. Journal of Fujian Normal University(Natural Science Edition), 2010, 26(2):78-82. |
| [26] | Ti T W. Microbial reduction of chromate environmental[J]. Microbe-Metal Inter actions, 2000, 10:225-232. |
| [27] | Apel W A, Turick C E. Bioremediation of hexavalent chromium by bacterial reduction[J]. Mineral Bioprocessing, 1991, 32(5):356-401. |
| [28] | Ohtake H, Fujii E, Toda K. A survey of effective of electron donors for reduction of toxic hexavalent chromium by Enterobacter cloacae(strain HO1)[J]. Journal General Applied Microbiology, 1990, 36(3):200-208. |
 2015, Vol. 34
2015, Vol. 34