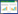文章信息
- 王丽萍, 张健, 胡红玲, 蒋晓梅, 张如意, 何书惠, 宋君祥, 张学才
- WANG Li-ping, ZHANG Jian, HU Hong-ling, JIANG Xiao-mei, ZHANG Ru-yi, HE Shu-hui, SONG Jun-xiang, ZHANG Xue-cai
- 3种土壤下巨菌草对镉胁迫的生理响应
- Physiological Responses of Pennisetum spp. to Cadmium Stress in Three Types of Soils
- 农业环境科学学报, 2015, 34(12): 2252-2260
- Journal of Agro-Environment Science, 2015, 34(12): 2252-2260
- http://dx.doi.org/10.11654/jaes.2015.12.002
-
文章历史
- 收稿日期: 2015-06-04
2. 四川农业大学林学院, 成都 611130;
3. 四川盈基新能源投资有限公司, 成都 610000
2. College of Forestry, Sichuan Agricultural University, Chengdu 611130, China;
3. Sichuan Yingji New Energy Investment Co, LTD, Chengdu 610000, China
随着工业化和城镇化的发展,土壤重金属污染问题越来越严重[1, 2]。据报道,在过去的50年里,全世界释放到环境中的Cd达2.2×107 kg[3]。Cd是植物生长发育过程中的非必需因素,但极易被植物吸收,并且产生毒害作用[4, 5],主要表现为影响植物的正常生长,干扰活性氧代谢、抑制光合作用等[6, 7, 8]。此外,Cd还会通过食物链进入人体,危害人类健康[9]。
植物修复技术(Phytoremediation)是近年来兴起的一种高效低耗、不易造成二次污染,同时具有美化景观作用的绿色生态技术,在清除土壤重金属污染方面有着广泛的应用前景[10, 11]。以往的植物修复技术通常采用具有超富集特性的植物富集土壤中的重金属,但目前研究发现的Cd超富集植物普遍存在生长缓慢、生物量小等缺点[12],在实际应用中修复效果并不理想。相对于超富集植物而言,具有一定的重金属耐性、适应能力强、生长速度快、能较好吸收和迁移土壤中重金属,生物量大且易于收割等优点的植物在修复土壤Cd污染方面更具有发展和应用潜力[13]。
巨菌草(Pennisetum spp)为目前正在引种栽培的多年生能源草本植物,兼具生物量巨大(干重达300~500 t·hm-2)、生长速度快、热值高、可用来提供能源等优点,且栽培面积较广[14],是高产优质的菌草之一。巨菌草根系发达,抗逆性强,已有研究报道巨菌草能够在Cd污染土壤上生长并且具有一定的富集能力[15],然而有关其在Cd胁迫环境下的生理响应与耐性机制的研究却未见报道。冲积土、紫色土和黄壤是长江上游四川盆地的3种典型土壤类型[16, 17],近年来由于人类活动和工农业生产的干扰,土壤Cd污染问题日益突出[18, 19]。本研究以巨菌草为试验材料,采用长江中下游四川盆地3种典型土壤,研究巨菌草在不同土壤类型不同Cd胁迫条件下的生长情况以及生理变化,探究其在不同土壤类型下对不同程度Cd污染的耐受性以及生理响应,为其在重金属Cd污染土壤修复方面的应用提供基础研究。
1 材料与方法 1.1 试验地点与材料试验于2013年在四川省雅安市雨城区四川农业大学科研园区内进行,地理位置为102°59′55″E、29°58′48″N,海拔600 m。该地区属亚热带湿润气候,年平均气温16.2 ℃,≥10 ℃的积温5231 ℃。月平均最高温29.9 ℃(7月),月平均最低温3.7 ℃(1月),年均日照时数1 039.6 h,无霜期298 d,年平均降雨量1 774.3 mm,空气平均湿度79%。巨菌草插条由福建农林大学菌草研究所提供。紫色土和黄壤采自于四川农业大学老板山,冲积土采自雅安市大兴镇,3种土壤的理化性质如表 1所示。
采用室外盆栽试验。于2013年4月采集土样并过筛,平铺晾置2 d后待用。采用统一规格的上口径30 cm、底直径25 cm、高27 cm的黑色聚丙烯塑料盆作为栽培容器,每盆装土16 kg。于2013年5月中旬取回插条,选取大小一致的插条栽入塑料盆中。试验期间,对所有供试植株进行统一灌溉,并进行除草、防虫和防病管理。
为了解巨菌草对镉污染环境的耐受性及其在不同土壤类型和不同程度Cd污染条件下的生长适应特征以及生理响应机制,结合国家土壤环境质量标准和四川盆地重金属污染发展状况[18],本试验共设置四个Cd处理水平:0、20、50、100 mg·kg-1。每个处理9个重复,共108盆。巨菌草生长一段时间后,于2013年8月初将重金属Cd以分析纯CdCl2·2.5H2O与去离子水配成水溶液,分别均匀施入盆内。
1.3 测定指标及方法2013年11月下旬,用卷尺测量巨菌草的株高,并按根、茎、叶将巨菌草植株全株收获。将栽培桶中的土壤混合均匀后采取土样,风干过筛后备用。植物各器官经去离子水清洗晾干后,于烘箱中用105 ℃杀青30 min后65 ℃烘干至恒重,并计算单株巨菌草各部分生物量。将根、茎、叶样品粉碎研磨后过筛混匀,以备Cd元素测定。
在收获全株巨菌草的前一周,由上往下数以第3片展开叶为准,采集巨菌草的新鲜叶片,测定生理生化指标。超氧化物歧化酶(SOD)活性采用硝基四氮唑蓝(NBT)还原法[20],过氧化氢酶(CAT)活性采用紫外分光光度法[21],过氧化物酶(POD)活性采用愈创木酚法[22, 23],丙二醛(MDA)采用硫代巴比妥酸(TBA)加热比色法[22],叶绿素采用丙酮-乙醇混合提取,分光光度法[24],可溶性蛋白采用考马斯亮蓝G-250染色法[22],可溶性糖采用蒽酮比色法[22]。植物和土壤样品经HNO3-HClO4混合酸(5∶1)消化后,使用岛津AA-7000火焰原子吸收光谱仪测定Cd含量。
1.4 数据处理实验结果为3次试验的平均值±标准误差。采用Excel 2010软件整理数据,Sigmaplot 10.0绘制图表,SPSS 20.0统计分析软件对数据进行单因素方差分析(One-way ANOVA),并用最小显著差法(LSD法)进行多重比较。
2 结果与分析 2.1 Cd处理对巨菌草生物量的影响由图 1可知,3种土壤类型下,随着Cd处理浓度的增加,巨菌草地下部分和地上部分的生物量均呈下降趋势,50、100 mg·kg-1的Cd处理显著降低了巨菌草的各部分生物量(P<0.05)。当Cd处理浓度为100 mg·kg-1时,生长在冲积土、紫色土和黄壤中的巨菌草地上部生物量分别减少了9.51%、22.81%和38.16%;地下部生物量分别减少了28.28%、43.19%和64.15%;黄壤中菌草生物量降幅最大,紫色土次之,冲积土中降幅最小。同一胁迫水平下,种植于不同土壤中的巨菌草总生物量表现为冲积土>紫色土>黄壤。

|
| 图中不同小写字母表示处理间差异显著(P < 0.05)。下同Different letters indicate significant differences (P < 0.05) between different treatments.The same below 图 1 3种土壤不同Cd 处理对巨菌草地下部分和地上部分生物量的影响 Figure 1 Belowground and aboveground biomass of Pennisetum spp under different Cd treatments in three soils |
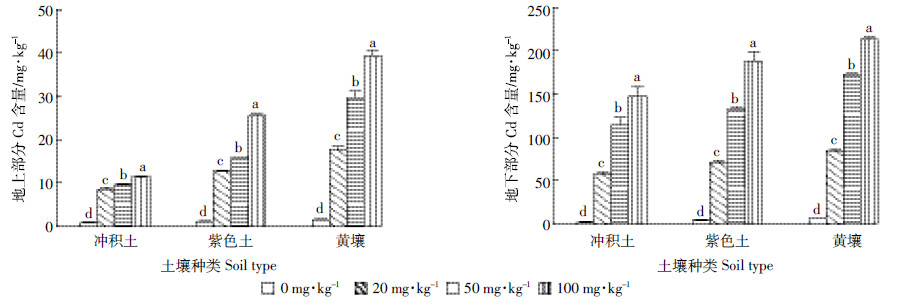
由图 2可知,3种土壤类型下,随着Cd处理浓度的增加,巨菌草地上部和地下部的Cd含量均显著增加(P<0.05)。当Cd浓度为100 mg·kg-1时,冲积土、紫色土和黄壤中巨菌草地上部分Cd含量分别达到11.51、25.48、39.30 mg·kg-1,为对照的15.85、24.05、26.60倍;地下部分Cd含量分别达到147.37、188.52、213.76 mg·kg-1,为对照的69.48、44.71、35.91倍。巨菌草各部分的Cd含量分布规律为地上部分 < 地下部分。同一胁迫水平下,巨菌草Cd含量在不同土壤类型中的分布规律为黄壤>紫色土>冲积土。
|
| 图 2 3种土壤不同Cd 处理对巨菌草地上部分与地下部分Cd含量的影响 Figure 2 Cadmium content of Pennisetum spp in aboveground and belewground parts under different Cd treatments in three soils |
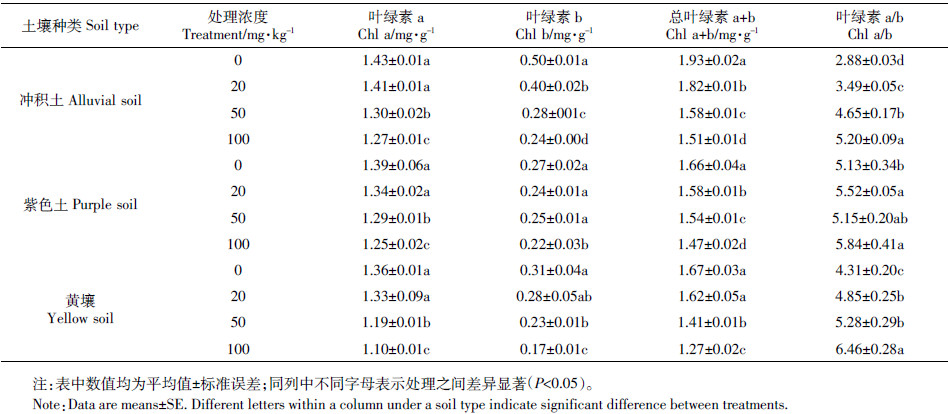
由表 2可知,3种土壤中,20 mg·kg-1的Cd处理使叶绿素a的含量有所降低,但未达显著水平(P>0.05),较高浓度的Cd使叶绿素a、叶绿素b以及叶绿素总量显著下降(P<0.05),冲积土、紫色土和黄壤中巨菌草叶绿素含量在100 mg·kg-1处理时分别下降了21.49%、11.35%和40.14%。叶绿素组成(a/b)随处理浓度的增加呈上升趋势,说明Cd对叶绿素b的影响较大。同一Cd处理浓度下,冲积土中叶绿素含量较高,紫色土次之,黄壤最小。
 |
由图 3可以看出,Cd胁迫使巨菌草植株体内SOD、POD和CAT的活性均呈现出明显的变化特征。

|
| 图 3 3种土壤不同Cd 处理对巨菌草SOD、POD、CAT活性和MDA 含量的影响 Figure 3 SOD, POD, CAT and MDA of Pennisetum spp under different Cd treatments in three soils |
3种土壤条件下,20 mg·kg-1 Cd处理显著增加了SOD的活性(P<0.05),与对照相比,冲积土、紫色土、黄壤中巨菌草叶片SOD活性分别增加了23.86%、24.83%和28.37%,较高浓度的Cd处理则使巨菌草叶片SOD活性出现不同程度的下降。
不同浓度Cd胁迫后,巨菌草叶片POD活性均随着处理浓度的增加呈现出先升高后降低的趋势,除冲积土外,各处理与对照之间的差异达到显著水平(P < 0.05)。50 mg·kg-1的胁迫水平下,3种土壤中巨菌草POD活性均达到峰值,与对照相比,分别增加了11.42%、23.55%和24.73%。当Cd处理浓度达到100 mg·kg-1时,3种土壤中巨菌草POD活性均下降。
3种土壤中CAT 活性变化有所不同。在50 mg·kg-1的胁迫水平下,种植于黄壤中的巨菌草CAT活性达到最高,而其余两种土壤中的巨菌草则在20 mg·kg-1时达到最高。在整个胁迫水平下,CAT活性表现出先增后降的变化趋势。
总体来看,3种土壤下,Cd胁迫使巨菌草叶片SOD、POD、CAT活性变化有所差异,但均表现出先增后降的趋势,表明低浓度的Cd促使3种酶活性增加,而高浓度的Cd则表现出抑制作用。同一浓度下,黄壤中3种酶的变化幅度较大,紫色土次之,冲积土中变化幅度最小。
2.5 镉胁迫下巨菌草植株MDA含量的变化由图 3可知,3种土壤类型下巨菌草叶片中的MDA含量随着Cd处理浓度的增加呈上升趋势;尽管在100 mg·kg-1的Cd处理下,冲积土中巨菌草叶片的MDA含量有所下降,但仍显著高于对照(P < 0.05)。50 mg·kg-1的Cd胁迫水平下,冲积土、紫色土和黄壤中巨菌草叶片的MDA含量与对照相比分别增加了30.46%%、36.23%和43.77%。同一Cd处理浓度下,黄壤中巨菌草MDA含量的变化幅度高于其余两种土壤。
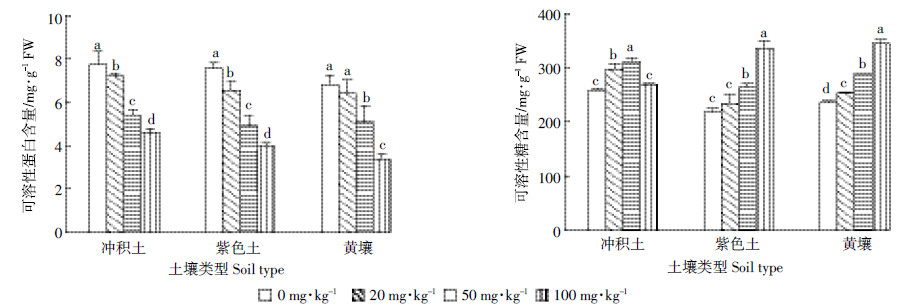
2.6 镉胁迫下巨菌草植株渗透调节物质的变化由图 4可以看出,3种土壤类型下,随着Cd处理浓度的增大,可溶性蛋白含量均呈下降趋势。100 mg·kg-1的Cd处理下,冲积土、紫色土、黄壤中可溶性蛋白含量与对照相比分别减少了40.47%、47.41%和50.07%。
|
| 图 4 3种土壤不同Cd 处理对巨菌草可溶性蛋白和可溶性糖含量的影响 Figure 4 Soluble protein and soluble sugar content of Pennisetum spp under different Cd treatments in three soils |
3种土壤中可溶性糖含量的变化有所不同。冲积土中,较低浓度的Cd处理使巨菌草可溶性糖含量显著上升(P<0.05),100 mg·kg-1时虽然有所下降,但与对照差异不显著(P>0.05)。随着Cd处理浓度的增加,紫色土和黄壤中可溶性糖含量呈现上升趋势,100 mg·kg-1时,两种土壤中巨菌草可溶性糖含量分别增加了54.12%和46.97%。
3 讨论 3.1 三种土壤中巨菌草生长对Cd胁迫的响应以及Cd在其植株中的分配Cd是植物生长的非必需元素,但却极易被植物吸收、富集,当过量的Cd累积于植物体内时,植物的生长就会受到一定的抑制,而生物量的变化能够直接反映出植物对Cd的耐性[25, 26]。本试验中,巨菌草各部分生物量均随着Cd处理浓度的增加而呈下降趋势;同时,随着Cd污染程度的增加,巨菌草各器官的Cd含量也显著增加,表明巨菌草具有一定的富集Cd的能力。有研究表明,植物不同器官对Cd的累积吸收能力往往存在较大差异[10, 27],植物根系对重金属具有很强的沉积作用[10, 28]。本研究中,巨菌草地下部分累积的Cd高于地上部分,表明巨菌草通过根系大量吸收土壤中的有效态Cd并积累于根部,从而减轻重金属对其地上部的毒害,提高植物对Cd的耐性,也降低了土壤重金属通过植物向生态系统迁移的风险[10]。
叶绿素是植物进行光合作用的主要色素,其含量的变化直接反映植物光合作用的强弱,同时标志着植物生长能力的强弱[1, 29]。本研究中,随着Cd处理浓度的增加,3种土壤中巨菌草的叶绿素总含量均呈下降趋势;同一Cd处理浓度下,冲积土中巨菌草叶绿素总含量较高、紫色土次之、黄壤最低。这表明Cd对巨菌草的叶绿体结构造成了伤害,导致植物光合作用减弱,植物的生长受到阻碍,最终造成巨菌草生物量整体呈下降趋势。另外,叶绿素a/b值逐渐增加,说明Cd胁迫对叶绿素a的抑制作用小于叶绿素b,与陶毅明等[30]的研究结果一致。
本研究中,尽管随着Cd处理浓度的增大,3种土壤中巨菌草的生长均表现出下降的趋势,但同一Cd处理浓度下黄壤中巨菌草的生长受到的抑制作用最大,冲积土最小,表明巨菌草在冲积土中对Cd的耐受性较高。同时,黄壤中巨菌草各部分Cd含量最大,紫色土次之,冲积土最小。这与林晓倩等[31]研究发现的酸性土壤中生长的巨桉生物量受到的影响最大,但同时各器官Pb含量比较高的结果类似。另有研究表明,土壤pH值是影响土壤重金属生物有效性的最重要因素。土壤pH值越小,重金属生物有效性越大,植物富集重金属的能力越强,同时植物受到的毒害作用也越大[32]。本试验采用的三种土壤最大的区别是pH值不同,冲积土pH值较大(pH7.1),紫色土次之(pH5.6),黄壤pH值最小(pH4.7)。这可能是生长在黄壤中巨菌草的生物量较低,而各部分Cd含量却比较高的原因。
3.2 三种土壤中巨菌草抗性生理特性及渗透调节对Cd胁迫的响应Cho等[33]的研究表明,植物在Cd胁迫环境下体内的代谢活动会受到影响,产生的大量活性氧物质(ROS)打破了原有的活性氧产生与代谢平衡,对植物体的结构和功能造成影响,从而扰乱了植物正常的生理生长过程。这些活性氧和自由基累积于植物体细胞内,将诱导细胞膜发生膜脂过氧化作用,而MDA是植物膜脂过氧化作用最重要的产物之一,因此通常将其作为衡量植物膜脂过氧化程度的重要指标[34]。汤叶涛等[35]对滇苦菜的研究表明,Cd胁迫浓度与MDA含量之间呈正相关关系。本研究中,在3种土壤条件下,巨菌草叶片MDA含量均随着处理浓度的增大而显著增加,说明重金属Cd对不同土壤条件下生长的巨菌草造成了脂质过氧化伤害,并且在同一Cd处理浓度下,黄壤中巨菌草MDA含量的变化幅度高于其他两种土壤,表明黄壤中巨菌草植株受到的毒害作用比较大,抗性较弱。
植物体内的抗氧化酶能够有效地清除细胞内过多的活性氧自由基,防止或减轻植物受到过氧化伤害[36, 37]。SOD、POD和CAT是细胞中重要的抗氧化酶,在逆境胁迫下,这3种酶活性提高,表明其发挥的抗氧化能力增强[28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38],从而使植物具有一定的适应和抵御伤害的能力[39, 40]。本研究中,在3种土壤条件下,SOD、POD以及CAT 活性均随着Cd处理浓度的增加表现出先升高后降低的趋势,可能是因为在Cd胁迫条件下,植物通过提高自身抗氧化酶的活性阻止细胞受到更严重的过氧化伤害,从而在一定程度上增加了植物对重金属的耐受能力。然而,植物对Cd的适应和耐受能力有限,当Cd浓度达到一定量时,植物抗氧化酶活性下降。另有研究表明,抗氧化酶活性变化幅度可以反应出植物受自由基伤害作用的大小[41],其变化幅度越大,说明植物受到的伤害越大,对Cd污染的抗性越弱。本研究中,黄壤中巨菌草3种抗氧化酶的活性变化幅度较大,而冲积土中变化幅度较小,表明巨菌草在黄壤中的抗性较弱,冲积土中抗性较强,可能是由于生长在黄壤中的巨菌草体内Cd含量比较大,诱导植物体内产生较多的活性氧物质,导致植物受到过氧化伤害较大,从而表现出的抗性较弱。这与吴旭红等[42]研究发现的3种苜蓿中Cd含量越大,植物抗性越弱的结果相似。
Cd会对植物造成过氧化伤害,抑制植物的生理代谢活动[43, 44]。植物体可以通过有机渗透调节物质的积累和分解来调节细胞渗透平衡,从而减轻重金属胁迫对植物的伤害[45]。可溶性蛋白大多是植物体内参与代谢过程的酶类,其含量可以反映出植物的总代谢情况[46]。本研究中,在3种土壤条件下,随着Cd胁迫程度的增加,可溶性蛋白质含量均呈下降趋势。这与杨海燕等[7]的研究结果一致,可能是由于过量的Cd累积于巨菌草体内,使细胞结构遭到破坏,导致可溶性蛋白质含量下降。可溶性糖是植物体内重要的渗透调节物质,Cd胁迫能够引起植物体内的可溶性糖含量发生显著变化[47]。本实验结果显示,Cd胁迫提高了巨菌草体内可溶性糖的含量,起到了一定的渗透调节作用,从而在一定程度上减轻了重金属对植物的毒害作用。这可能是植物在Cd胁迫条件下表现的适应性反应[48]。
4 结论(1)3种土壤类型条件下,不同浓度的Cd处理对巨菌草的生长造成了不同程度的抑制。随着Cd处理浓度的增加,巨菌草的生物量总体呈现下降趋势;其中,冲积土中巨菌草生物量下降幅度较小,紫色土次之,黄壤中下降幅度较大,巨菌草在3种土壤下对Cd的抗性表现为冲积土>紫色土>黄壤。
(2)巨菌草叶片的MDA含量随着Cd处理浓度的增加呈上升趋势,且在黄壤中的变化幅度大于冲积土和紫色土,表明黄壤中巨菌草受到的脂质过氧化程度较高;巨菌草抗氧化酶活性均表现为“先升后降”,3种土壤中抗氧化酶活性的变化幅度表现为黄壤>紫色土>冲积土。
总体来说,由于巨菌草具有一定的吸收和富集Cd的能力,并且对Cd污染具有较强的忍耐性;同时由于巨菌草生物量大,抗逆性强,且种植范围较广,可以考虑将其作为Cd污染地区的生态重建物种。
| [1] | 刘 洋, 胡芳杰, 陈良华, 等. 3种土壤类型下红椿幼苗对铅胁迫的光合响应[J]. 西北植物学报, 2014, 34(7):1411-1418. LIU Yang, HU Fang-jie, CHEN Liang-hua, et al. Response of Toona ciliatar Roem. saplings photosynthetic characteristics to lead stress under three soil types[J]. Acta Botanica Boreali-Occidentalia Sinica, 2014, 34(7):1411-1418. |
| [2] | 张金彪, 黄维南. 镉对植物的生理生态效应的研究进展[J]. 生态学报, 2000, 20(3):514-523. ZHANG Jin-biao, HUANG Wei-nan. Advances on physiological and ecological effects of cadmium on plants[J]. Acta Ecologica Sinica, 2000, 20(3):514-523. |
| [3] | Singh O V, Labana S, Pandey G, et al. Phytoremediation:An overview of metallic ion decontamination from soil[J]. Applied Microbiology and Biotechnology, 2003, 61:405-412. |
| [4] | 钟珍梅, 黄勤楼, 王义祥, 等. 圆叶决明(Chamaecrista rotundifolia)对重金属镉胁迫的响应及镉吸收效果研究[J]. 农业环境科学学报, 2010, 29(12):2287-2292. ZHONG Zhen-mei, HUANG Qin-lou, WANG Yi-xiang, et al. Response to cadmium stress and cadmium uptake of Chamaecrista rotundifolia[J]. Journal of Agro-Environment Science, 2010, 29(12):2287-2292. |
| [5] | Lin R Z, Wang X R, Luo Y, et al. Effects of soil cadmium on growth, oxidative stress and antioxidant system in wheat seedlings(Triticum aestivum L.)[J]. Chemosphere, 2007, 69:89-98. |
| [6] | Aslam R, Ansari M Y K, Choudhary A, et al. Genotoxic effects of heavy metal cadmium on growth, biochemical, cyto-physiological parameters and detection of DNA polymorphism by RAPD in Capsicum annuum L.:An important spice crop of India[J]. Saudi Journal of Biological Sciences, 2014, 21(5):465-472. |
| [7] | 杨海燕, 施国新, 徐勤松, 等. Cd2+胁迫对竹叶眼子菜的毒理学效应分析[J]. 应用与环境生物学报, 2008, 14(3):366-370. YANG Hai-yan, SHI Guo-xin, XU Qin-song, et al. Phytotoxicity of Cd2+ on leaf cells of Potamogeton malaianus[J]. Chinese Journal of Applied and Environmental Biology, 2008, 14(3):366-370. |
| [8] | 冯世静, 杨途熙, 张艳军, 等. 镉胁迫对杨树光合特性的影响[J]. 农业环境科学学报, 2013, 32(3):539-547. FENG Shi-jing, YANG Tu-xi, ZHANG Yan-jun, et al. Effect of cadmium on photosynthetic gas exchange and chlorophyll fluorescence of two species of poplar[J]. Journal of Agro -Environment Science, 2013, 32(3):539-547. |
| [9] | 李 源, 李金娟, 魏小红. 镉胁迫下蚕豆幼苗抗氧化能力对外源NO和H2O2的响应[J]. 草业学报, 2009, 18(6):186-191. LI Yuan, LI Jin-juan, WEI Xiao-hong. Responses of antioxidative capability in horsebean seedling to NO and H2O2 under Cd stress[J]. Acta Prataculturae Sinica, 2009, 18(6):186-191. |
| [10] | Liu Z L, He X Y, Chen W, et al. Accumulation and tolerance characteristics of cadmium in a potential hyperaccumulator Lonicera japonica Thunb[J]. Journal of Hazardous Materials, 2009, 169(1-3):170-175. |
| [11] | 聂发辉. 镉超富集植物商陆及其富集效应[J]. 生态环境, 2006, 15(2):303-306. NIE Fa-hui. Cd hyper-accumulator Phytolacca acinosa Roxb and Cd-accumulative characteristics[J]. Ecology and Environment, 2006, 15(2):303-306. |
| [12] | Baker A J M, Brooks R R. Terrestrial higher plants which hyperaccumulate metallic elements:A review of their distribution, ecology and phytochemistry[J]. Biorecovery, 1989, 1(2):81-126. |
| [13] | Marchiol L, Assolari S, Sacco P, et al. Phytoextraction of heavy metals by canola(Brassicanapus) and radish(Raphanus sativus) grown on multicontaminated soil[J]. Environment Pollution, 2004, 132:21-27. |
| [14] | 林兴生, 林占熺, 林冬梅, 等. 不同种植年限的巨菌草对植物和昆虫多样性的影响[J]. 应用生态学报, 2012, 23(10):2849-2854. LIN Xing-sheng, LIN Zhan-xi, LIN Dong-mei, et al. Effects of different years of planting Pennisetum sp. on the plant-and insect diversity in Pennisetum sp. communities[J]. Chinese Journal of Applied Ecology, 2012, 23(10):2849-2854. |
| [15] | 徐 磊, 周 静, 梁家妮, 等. 巨菌草对Cu/Cd污染土壤的修复潜力[J]. 生态学报, 2014, 34(18):5342-5348. XU Lei, ZHOU Jing, LIANG Jia-ni, et al. The remediation potential of Pennisetum sp on Cu, Cd contaminated soil[J]. Acta Ecologica Sinica, 2014, 34(18):5342-5348. |
| [16] | 夏建国, 邓良基, 张丽萍, 等. 四川土壤系统分类初步研究[J]. 四川农业大学学报, 2002, 2(2):117-122. XIA Jian-guo, DENG Liang-ji, ZHANG Li-ping, et al. Study on soil taxonomy in Sichuan[J]. Journal of Sichuan Agricultural University, 2002, 2(2):117-122. |
| [17] | 四川省农牧厅, 四川省土壤普查办公室. 四川土壤[M]. 成都:四川科学技术出版社, 1995. Sichuan Provincial Agricultural and Husbandry Department, Sichuan Office of Soil Survey. Sichuan soil[M]. Chengdu:Sichuan Science and Technology Press, 1995. |
| [18] | Wu F Z, Yang W Q, Zhang J, et al. Cadmium accumulation and growth responses of a poplar(Populus deltoids×Populus nigra) in cadmium contaminated purple soil and alluvial soil[J]. Journal of Hazardous Materials, 2010, 177:268-273. |
| [19] | 简 毅, 杨万勤, 张 健, 等. 岷江下游(五通桥段)土壤污染特征及生态风险评价[J]. 农业环境科学学报, 2009, 28(2):256-262. JIAN Yi, YANG Wan-qin, ZHANG Jian, et al. Characteristics and ecological risk of soil pollution in the lower reaches(Wutongqiao section) of Minjiang River[J]. Journal of Agro-Environment Science, 2009, 28(2):256-262. |
| [20] | 高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社, 2006:211. GAO Jun-feng. Plant physiology experimental guidance[M]. Beijing:Higher Education Press, 2006:211. |
| [21] | 赵世杰, 刘华山, 董新纯. 植物生理学实验指导[M]. 北京:中国农业科技出版社, 2002:214-219. ZHAO Shi-jie, LIU Hua-shan, DONG Xin-chun. The guidance of plant physiology[M]. Beijing:The Agricultural Science and Technology Press of China, 2002:214-219. |
| [22] | 熊庆娥. 植物生理学实验教程[M]. 成都:四川科学技术出版社, 2003:72-73, 85-86, 126-127. XIONG Qing-e. The experimental tutotial of plant physiology[M]. Chengdu:Sichuan Science and Technology Press, 2003:72-73, 85-86, 126-127. |
| [23] | 李合生, 孙 群, 赵世杰. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社, 2000:164-165. LI He-sheng, SUN Qun, ZHAO Shi-jie. Experimental principles and techniques of plant physiology and biochemistry[M]. Beijing:Higher Education Press, 2000:164-165. |
| [24] | 李得孝, 郭月霞, 员海燕, 等. 玉米叶绿素含量测定方法研究[J]. 中国农学通报, 2005, 2(6):153-155. LI De-xiao, GUO Yue-xia, YUAN Hai-yan, et al. Determine methods of chlorophyll from maize[J]. Chinese Agricultural Science Bulletin, 2005, 2(6):153-155. |
| [25] | 任安芝, 高玉葆, 刘 爽. 铬、镉、铅胁迫对青菜叶片几种生理生化指标的影响[J]. 应用与环境生物学报, 2000, 6(2):112-116. REN An-zhi, GAO Yu-bao, LIU Shuang. Effects of Cr, Cd and Pb on free proline content etc in leaves of Brassica chinensis L.[J]. Chinese Journal of Applied and Environmental Biology, 2000, 6(2):112-116. |
| [26] | Liu S L, Yang R J, Ma M D, et al. Effects of exogenous NO on the growth, mineral nutrient content, antioxidant system, and ATPase activities of Trifolium repens L. plants under cadmium stress[J]. Acta Physiologiae Plantarum, 2015, 37(1):1721-1723. |
| [27] | Aibibu N, Liu Y G, Zeng G M, et al. Cadmium accumulation in Vetiveria zizanioides and its effects on growth, physiological and biochemical characters[J]. Bioresource Techology, 2010, 101:6297-6303. |
| [28] | Zhang F Q, Wang Y S, Lou Z P, et al. Effect of heavy metal stress on antioxidative enzymes and lipid peroxidation in leaves and roots of two mangrove plant seedlings(Kandelia candel and Bruguiera gymnorrhiza)[J]. Chemosphere, 2007, 67:44-50. |
| [29] | Zhang X A, Wang Z H, Zhang X Q, et al. Effect of heavy metals and saline-alkali on growth, physiology and biochemistry of Orychophragmus violaceus[J]. Agricul Sci & Technol, 2012, 13:1478-1483, 1508. |
| [30] | 陶毅明, 陈燕珍, 梁士楚, 等. 镉胁迫下红树植物木榄幼苗的生理生化特性[J]. 生态学杂志, 2008, 27(5):762-766. TAO Yi-ming, CHEN Yan-zhen, LIANG Shi-chu, et al. Physiological and biochemical properties of Bruguiera gymnorrhiza seedlings under cadmium stress[J]. Chinese Journal of Ecology, 2008, 27(5):762-766. |
| [31] | 林晓倩, 张 健, 杨万勤, 等. 3种土壤类型下铅胁迫对巨桉幼苗的影响[J]. 林业科学, 2013, 49(1):1-6. LIN Xiao-qian, ZHANG Jian, YANG Wan-qin, et al. Effects of Pb on Eucalyptus grandis seedlings in three types of soil[J]. Scientia Silvae Sinicae, 2013, 49(1):1-6. |
| [32] | 侯伶龙, 黄 荣, 周丽蓉, 等. 鱼腥草对土壤中镉的富集及根系微生物的促进作用[J]. 生态环境学报, 2010, 19(4):817-821. HOU Ling-long, HUANG Rong, ZHOU Li-rong, et al. The accumulation of Cd in Huttuynia cordata and its promotion by rhizospheric microbes[J]. Ecology and Environmental Sciences, 2010, 19(4):817-821. |
| [33] | Cho U H, Seo N H. Oxidative stress in Arabidopsis thaliana exposed to cadmium is due to hydrogen peroxide accumulation[J]. Plant Science, 2005, 168(1):113-120. |
| [34] | Chaoui A, Mazhoudi S, Ghorbal M H, et al. Cadmium and zinc induction of lipid peroxidation and effects on antioxidant enzyme activities in bean(Phaseolus ulgaris L.)[J]. Plant Science, 1997, 127:139-147. |
| [35] | 汤叶涛, 关丽捷, 仇荣亮, 等. 镉对超富集植物滇苦菜抗氧化系统的影响[J]. 生态学报, 2010, 30(2):324-332. TANG Ye-tao, GUAN Li-jie, QIU Rong-liang, et al. Antioxidative defense to cadmium in hyperaccumulator Picris divaricata V.[J]. Acta Ecologica Sinica, 2010, 30(2):324-332. |
| [36] | 龚双姣, 马陶武, 姜业芳, 等. 镉胁迫下3种藓类植物抗氧化酶活性变化的比较研究[J]. 西北植物学报, 2008, 28(9):1765-1771. GONG Shuang-jiao, MA Tao-wu, JIANG Ye-fang, et al. Antioxidant enzyme activities induced by cadmium stress in three species of mosses[J]. Acta Botanica Boreali-Occidentalia Sinica, 2008, 28(9):1765-1771. |
| [37] | 袁 敏, 铁柏清, 唐美珍. 重金属单一污染对龙须草叶绿素含量和抗氧化酶系统的影响[J]. 土壤通报, 2005, 36(6):929-932. YUAN Min, TIE Bo-qing, TANG Mei-zhen. Effects of Cd, Pb, Cu, Zn and As single pollution on chlorophyll content and antioxidant enzyme systems of Eulaliopsis binata[J]. Chinese Journal of Soil Science, 2005, 36(6):929-932. |
| [38] | 曾秀存, 许耀照, 张芬琴. 两种基因型龙葵对镉胁迫的生理响应及镉吸收差异[J]. 农业环境科学学报, 2012, 31(5):885-890. ZENG Xiu-cun, XU Yao-zhao, ZHANG Fen-qin. Difference of cadmium absorption and physiological responses to cadmium stress in two different Solanum nigrum[J]. Journal of Agro-Environment Science, 2012, 31(5):885-890. |
| [39] | 李清飞, 仇荣亮. 麻疯树对镉胁迫的生理耐性及富集特征研究[J]. 农业环境科学学报. 2012, 31(1):42-47. LI Qing-fei, QIU Rong-liang. Cadmium physiological tolerance and accumulation characteristics of Jatropha curcas L.[J]. Journal of Agro -Environment Science, 2012, 31(1):42-47. |
| [40] | Li F T, Qi J M, Zhang G Y, et al. Effect of cadmium stress on the growth, antioxidative enzymes and lipid peroxidation in two Kenaf(Hibiscus cannabinus L.) plant seedlings[J]. Journal of Integrative Agriculture, 2013, 12:610-620. |
| [41] | 董 萌, 赵运林, 雷存喜, 等. 洞庭湖湿地Cd富集植物蒌蒿(Artemisia selengensis)的耐性生理机制研究[J]. 生态毒理学报, 2013, 8(1):111-120. DONG Meng, ZHAO Yun-lin, LEI Cun-xi, et al. Physiological mechanism of Cd-tolerance of Artemisia selengensis grown in Dongting Lake Wetland[J]. Asian J Ecoloxicol, 2013, 8(1):111-120. |
| [42] | 吴旭红. 三个苜蓿品种对镉污染的生理生态反应及抗性比较[J]. 生态环境, 2005, 14(5):658-661. WU Xu-hong. Comparison of the resistance of three varieties of alfalfa to cadmium stress[J]. Ecology and Environment, 2005, 14(5):658-661. |
| [43] | 刘周莉, 何兴元, 陈 玮. 镉胁迫对金银花生理生态特征的影响[J]. 应用生态学报, 2009, 20(1):40-44. LIU Zhou-li, HE Xing-yuan, CHEN Wei. Effects of cadmium stress on the growth and physiological characteristics of Lonicera japonica[J]. Chinese Journal of Applied Ecology, 2009, 20(1):40-44. |
| [45] | 郭艳丽, 台培东, 韩艳萍, 等. 镉胁迫对向日葵幼苗生长和生理特性的影响[J]. 环境工程学报, 2009, 3(12):2291-2296. GUO Yan-li, TAI Pei-dong, HAN Yan-ping, et al. Effects of cadmium on the growth and physiological characteristics of sunflower seedlings[J]. Chinese Journal of Environmental Engineering, 2009, 3(12):2291-2296. |
| [45] | 肖 强, 郑海雷, 陈 瑶, 等. 盐度对互花米草生长及脯氨酸、可溶性糖和蛋白质含量的影响[J]. 生态学杂志, 2005, 24(4):373-376. XIAO Qiang, ZHENG Hai-lei, CHEN Yao, et al. Effects of salinity on the growth and proline, soluble sugar and protein contents of Spartina alterniflora.[J]. Chinese Journal of Ecology, 2005, 24(4):373-376. |
| [46] | 王 欣, 刘云国, 艾比布·努扎艾提, 等. 苎麻对镉毒害的生理耐性机制及外源精胺的缓解效应[J]. 农业环境科学学报, 2007, 26(2):487- 493. WANG Xin, LIU Yun-guo, Aibibu Nuzhaaiti, et al. Endurance mechanism of ramie to Cd and the alleviating effect of exogenous spermine[J]. Journal of Agro-Environment Science, 2007, 26(2):487- 493. |
| [47] | 郭 智, 原海燕, 奥岩松. 龙葵和茄子幼苗对镉胁迫的生理响应[J]. 生态环境, 2008, 17(3):1009-1015. GUO Zhi, YUAN Hai-yan, AO Yan-song. Physiological response of Solanum nigrum L. and Solanum melongena L. seedlings to cadmium stress[J]. Ecology and Environment, 2008, 17(3):1009-1015. |
| [48] | 郭晓音, 严重玲, 叶彬彬. 镉锌复合胁迫对秋茄幼苗渗透调节物质的影响[J]. 应用与环境生物学报, 2009, 15(3):308-312. GUO Xiao-yin, YAN Chong-ling, YE Bin-bin. Effect of Cd Zn combined stress on contents of osmotic substances in Kandelia candel(L.)druce seedlings[J]. Chinese Journal of Applied and Environmental Biology, 2009, 15(3):308-312. |
 2015, Vol. 34
2015, Vol. 34