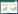文章信息
- 唐皓, 李廷轩, 张锡洲, 余海英, 陈光登
- TANG Hao, LI Ting-xuan, ZHANG Xi-zhou, YU Hai-ying, CHEN Guang-deng
- 水稻镉高积累材料不同生育期镉积累变化特征研究
- Cadmium Accumulation in High Cadmium-Accumulating Rice Cultivars at Different Growth Stages
- 农业环境科学学报, 2015, 34(3): 471-477
- Journal of Agro-Environment Science, 2015, 34(3): 471-477
- http://dx.doi.org/10.11654/jaes.2015.03.008
-
文章历史
- 收稿日期:2014-09-29
重金属污染是中国乃至全球所面临的严重环境问题,其中镉(Cd)以高毒性和易于被植物吸收积累而备受关注。植物修复技术是当前治理Cd污染土壤的重要手段,其修复前提是寻找Cd富集能力较强的种质资源,但现有的Cd富集植物在环境适应、病虫害防治以及机械化栽培均存在一定缺陷。水稻Cd高积累材料具有生物量大、适应性强、遗传稳定等优势,是一种较理想的土壤Cd污染修复植物,国外已对其Cd富集能力进行了相关研究[1, 2]。水稻各生育期Cd的积累能力将直接决定对Cd污染土壤的修复效果,明确水稻Cd修复的最佳时期,对提高农田Cd污染修复效率具有重要的参考价值。有关水稻Cd高积累材料富集特性的研究已有相关报道[3, 4, 5]。Takahashi等[6]研究发现,水稻Cd高积累材料根系质膜上的OsNRAMP1显著高于Cd低积累材料,能够将更多的Cd转运到地上部,促进水稻对Cd的吸收和积累。Ishimaru等[7]也得到一致结论,认为水稻Cd高积累材料中OsNRAMP5能够促进对Mn、Cd、Fe的转运,同时促进水稻地上部的生长。Venkataramaiah等[8]研究发现,水稻Cd高积累材料Cd积累能力与其自身植物螯合肽合成酶的过量表达有关,其主要与Cd螯合形成半胱氨酸-Cd的多肽,减轻Cd对植物的毒害。Sebastian等[9]研究发现,Cd耐性较强的水稻品种在Cd胁迫下自身光合特性变化不大,且能正常吸收N、P、S等营养元素。也有研究认为,Cd高积累水稻品种与普通品种的耐Cd差异与体内抗氧化能力有关[10]。在正常情况下,植物细胞内自由基的产生和清除处于动态平衡,而Cd会破坏此平衡,导致植物体内O2-·、OH-和H2O2的产生[11],而植物通过SOD、CAT和POD等保护酶类在植物体内的协同作用,维持活性氧代谢平衡、保护膜结构,从而使植物在一定程度上减缓或抵御逆境胁迫伤害[12]。Cd积累能力较强的水稻品种体内 SOD、CAT、POD 活性高于低Cd品种[13]。此外,关于Cd胁迫诱导的植物生理生化特征及Cd污染土壤的生态修复也有相应报道[14, 15]。水稻Cd积累能力因耐性机制和代谢旺盛程度的不同而在各生育期有所差异[16]。然而,当前对水稻Cd高积累材料在高Cd条件下各生育期Cd富集能力的研究还鲜见报道。本研究在高Cd条件下,分析水稻Cd高积累材料生物量、Cd积累量、Cd积累速率等指标,旨在探明水稻Cd高积累材料各生育期Cd富集能力的变化,找出水稻Cd高积累材料修复的最佳生育期。 1 材料与方法 1.1 供试材料
供试品种:水稻Cd高积累材料Lu17-9和Lu527-8,普通材料Lu527-4。生育期基本一致且均为籼稻。
供试土壤:渗育型水稻土,采自四川省成都市温江区万春镇正宗村。基本理化性质:pH 6.50、有机质17.60 g·kg-1、全氮 1.12 g·kg-1、碱解氮 227.25 mg·kg-1、有效磷 9.64 mg·kg-1、速效钾 49 mg·kg-1、全Cd含量0.31 mg·kg-1。
供试肥料:尿素(N 46%)、磷酸二氢钾(P2O5 52%、K2O 34%)、氯化钾(K2O 63%),均为分析纯。 1.2 试验设计与处理
试验设Cd添加量为20 mg·kg-1土,氮(N)、磷(P2O5)、钾(K2O)肥用量分别为150、100、105 mg·kg-1土,每个材料重复18次,完全随机排列。Cd(CdCl2·2.5H2O,分析纯)以溶液形式施入过筛后的风干土,装入容积为12 L黑色塑料盆,每盆装土10 kg,充分混匀后陈化4周待用(全Cd含量为16.36 mg·kg-1,有效态Cd含量为7.68 mg·kg-1)。水稻种子消毒、浸种后,在恒温恒湿箱中催芽24 h,待水稻破胸后经光照培养室育苗,待生长到三叶一心时移栽,移栽前一天将氮、磷、钾肥以溶液形式施入土壤并混匀。选择长势一致的秧苗移栽至盆中,每盆种2株,采用自然光照,并进行常规水肥管理。试验于2013年6—9月在四川农业大学教学科研园区有防雨设施的网室中进行。
于分蘖期(64 d)、拔节期(78 d)、抽穗期(92 d)、灌浆期(106 d)和成熟期(120 d)进行土样和植物样的采集(表 1),每次采3个重复。样品采集后先用自来水冲洗再用20 mmol·L-1 EDTA缓冲液浸泡15 min,最后经去离子水洗净后用吸水纸擦干,植株分为地上部和地下部,装袋后在105 ℃杀青30 min,75 ℃烘干至恒重,粉碎备用。
 |
土壤理化性质采用常规方法分析;植株Cd含量采用HNO3-HClO4(V/V,5∶1)消化;土壤Cd全量采用HNO3-HClO4-HF(V/V/V,5∶1∶1)消化;有效态Cd含量采用DTPA提取,原子吸收分光光度计测定[17]。 1.4 数据处理
生物富集量系数=单位面积植株吸收的Cd总量/土壤Cd含量[28];Cd积累速率=植株Cd积累量/时间;净化率=植株Cd积累量/土壤有效Cd总量×100% [17]。
数据统计分析在DPS(11.0)中进行;图表制作采用Origin8.0。 2 结果与分析 2.1 高Cd条件下水稻Cd高积累材料各生育期生物量和Cd含量的变化 2.1.1 生物量
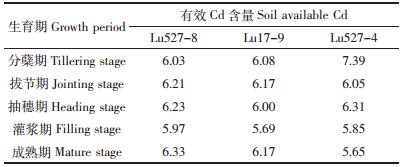
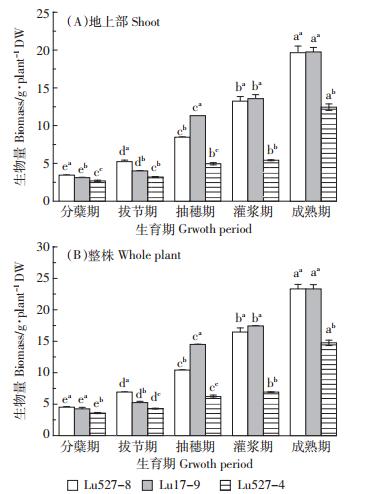
由图 1可知,两类水稻材料地上部和整株生物量均随生育期的延长呈上升趋势且差异显著。水稻Cd高积累材料Lu527-8和Lu17-9生物量均显著高于普通材料Lu527-4。Lu527-8和Lu17-9均表现为在分蘖-拔节期上升幅度较小,拔节-成熟期上升幅度较大。这表明在高Cd条件下水稻Cd高积累材料具有较强的耐Cd胁迫能力,且在拔节期后水稻Cd高积累材料生物量显著增加。
|
| 不同小写字母表示同一材料不同生育期间 P<0.05 水平上显著, 上标不同小写字母表示同一生育期不同材料间 P<0.05 水平上显著 Different letters indicate significant difference between different growth stages of the same cultivar at P<0.05; while different superscript letters indicate significant difference between different cultivars at the same growth stage at P<0.05图 1 两类水稻材料各生育期地上部和整株生物量的变化 Figure 1 Biomass of shoot and whole plant of different rice cultivars at each growth stage under high Cd treatment |
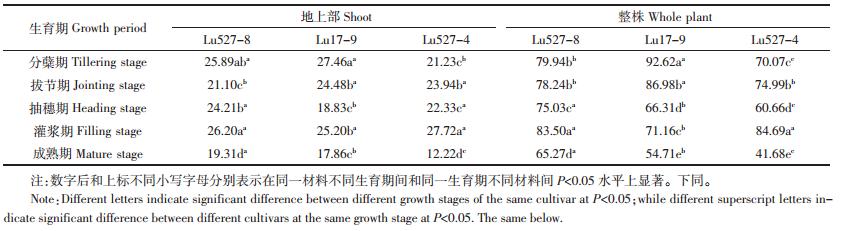
由表 2可知,两类水稻材料地上部和整株Cd含量在各生育期之间差异不显著。水稻Cd高积累材料Lu527-8和Lu17-9地上部Cd含量分别在灌浆期和分蘖期达最大,分别为26.20、27.46 mg·kg-1;整株生物量分别在灌浆期和分蘖期达最大,分别为83.50、92.62 mg·kg-1。这表明水稻Cd高积累材料在分蘖期和灌浆期对土壤中Cd具有较强的吸收能力。
 |
生物富集量系数不仅能够较好地指示植物对Cd的富集能力,也能反映植物对Cd的适应性。由表 3可知,两类水稻材料地上部和整株生物富集量系数在拔节-灌浆期显著上升,灌浆期后变化不显著。水稻Cd高积累材料Lu527-8和Lu17-9生物富集量系数显著高于普通材料Lu527-4。Lu527-8和Lu17-9地上部生物富集量系数在灌浆期达6.22、5.76 t·hm-2,分别为Lu527-4的2.44倍和2.26倍;整株生物富集量系数在灌浆期达23.78、21.47 t·hm-2,分别为Lu527-4的2.33倍和2.10倍。这表明水稻Cd高积累材料对Cd的富集能力显著高于普通材料。
 |
Cd积累速率是反映植物各生育期Cd积累能力的指标。由表 4可知,两类水稻材料地上部和整株Cd积累速率随生育期的延长呈先升高后降低的变化趋势,且在灌浆期达最大值。水稻Cd高积累材料Lu527-8和Lu17-9 Cd积累速率显著高于普通材料Lu527-4。在灌浆期,Lu527-8和Lu17-9地上部Cd积累速率达3.82、3.53 μg·株-1·d-1,整株Cd积累速率达14.62、13.20 μg·株-1·d-1,均显著高于Lu527-4。这表明水稻Cd高积累材料在灌浆期对Cd具有较强的积累能力。
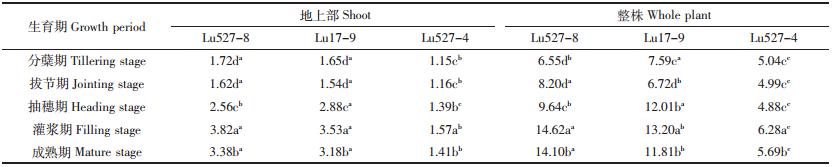 |
由表 5可知,随生育期的延长,两类水稻材料地上部和整株Cd积累量均呈上升趋势且在拔节-灌浆期显著上升。水稻Cd高积累材料Lu527-8和Lu17-9各生育期Cd积累量均显著高于普通材料Lu527-4。Lu527-8和Lu17-9地上部Cd积累量在灌浆期达359.28、331.22 μg·株-1,分别为Lu527-4的2.44倍和2.25倍;其整株Cd积累量在灌浆期达1 374.35、1240.72 μg·plant-1,分别为Lu527-4的2.33倍和2.10倍。同时,Lu527-8和Lu17-9阶段性Cd积累量显著高于Lu527-4,且在拔节-抽穗期和抽穗-灌浆期上升幅度显著。Lu527-8地上部阶段性Cd积累量拔节-抽穗期和抽穗-灌浆期分别占整个生育期的26.56%和40.80%,为Lu527-4的2.88倍和1.34倍;Lu17-9地上部阶段性Cd积累量在拔节-抽穗期和抽穗-灌浆期分别占整个生育期的36.92%和32.14%,为Lu527-4的3.79倍和2.68倍。Lu527-8整株阶段性Cd积累量在拔节-抽穗期和抽穗-灌浆期占整个生育期的15.30%和40.45%;Lu17-9整株阶段性Cd积累量在拔节-抽穗期和抽穗-灌浆期分别占整个生育期的39.70%和20.74%。这表明水稻Cd高积累材料对Cd具有较强的积累能力且在灌浆期后对Cd的积累能力达稳定。
 |
植物修复重金属污染土壤的综合指标是净化率。由表 6可知,两类水稻材料地上部和整株净化率在分蘖-灌浆期呈显著上升趋势,灌浆-成熟期后差异不显著。水稻Cd高积累材料Lu527-8和Lu17-9地上部和整株净化率均显著高于普通材料Lu527-4。Lu527-8和Lu17-9灌浆期时地上部净化率分别为0.82%和1.25%,分别是Lu527-4的1.67倍和2.55倍;其整株净化率在灌浆期时分别为4.88%和4.42%,分别是Lu527-4的2.44倍和2.21倍。这表明在高Cd条件下,水稻Cd高积累材料对Cd污染土壤净化能力强于普通材料且在灌浆期水稻修复效果最佳。
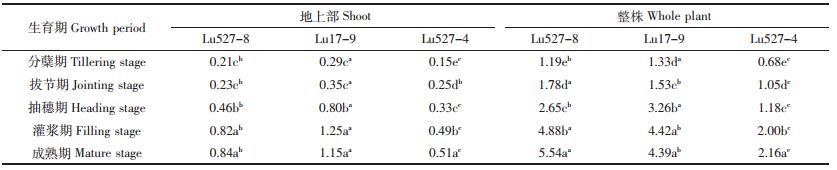 |
作为土壤重金属污染修复植物,水稻Cd高积累材料具有被利用为植物修复材料的基础[17]。水稻Cd高积累材料不同生育期生物量和Cd富集能力存在较大差异。因此,研究水稻Cd高积累材料各生育期的Cd富集能力,将直接决定水稻Cd高积累材料对重金属污染土壤的修复效率和效果[18]。诸多研究表明,水稻在扬花期对Cd的积累能力相对较高。Rodda等[19]研究三种供Cd时间对水稻Cd积累的影响,表明在扬花期水稻对Cd的耐受能力较强且植株体内Cd含量相对较高。胡莹等[20]研究发现,水稻对Cd的吸收能力表现为中期>后期>前期,且抽穗-扬花期之前植物Cd积累量占整个生育时期的91%。本研究表明,水稻Cd高积累材料生物量随生育期的延长显著上升,且显著高于普通材料(图 1),表明水稻Cd高积累材料在高Cd胁迫下具有较强的耐性。同时,随生育期的延长,水稻Cd高积累材料Cd积累量呈显著上升趋势且在灌浆期后差异不显著(表 5),与Fujimaki等[21]、Uraguchi等[22]的研究结果相似。
有研究指出,Cd在不同生育期对水稻生长发育的影响主要体现在两个方面:(1)水稻在不同生育期的代谢特征不同,水稻植株在生育前期以蛋白质合成为主,而在生育后期主要以碳代谢、碳积累为主[23]。由于Cd较易与含巯基的蛋白质结合,干扰蛋白质功能,所以其在生育前期对水稻植株生长毒害作用更大。(2)水稻根系能够通过向周围土壤中分泌氧使得根系周围的土壤氧化还原电位升高,土壤氧化还原电位的升高能够增加Cd溶解度,但由于水稻根系活力在分蘖期最高,且随生育期逐渐下降,最终表现为水稻在生育后期对Cd的耐性增强[24]。从本研究来看,水稻Cd高积累材料不同生育时期Cd积累能力主要体现在3个方面。一是生物富集量系数的变化。水稻Cd高积累材料各生育期Cd生物富集量系数均显著高于普通材料,且在灌浆期地上部Cd生物富集量系数达6.22、5.76 t·hm-2,而在灌浆期后生物富集量系数差异不显著(表 3),可见水稻Cd高积累材料具有较强的Cd富集能力,且在分蘖-灌浆期对土壤中Cd具有较强的富集能力。二是Cd积累速率的差异。水稻Cd高积累材料随生育期的延长地上部和整株Cd积累速率呈先升高后降低的变化趋势,且在灌浆期达最大值(表 4),与龙小林等[25]对水稻的研究结果相似,说明在分蘖-灌浆期水稻Cd积累速率均显著增加,对土壤中Cd的吸收积累能力也逐渐增强。三是阶段性Cd积累量的差异,研究表明水稻Cd高积累材料在拔节-抽穗期和抽穗-灌浆期阶段性Cd积累量达最大,其Cd积累能力占整个生育期的50%~60%,说明在生育后期水稻Cd高积累材料对Cd具有较强的积累能力。可见,水稻Cd高积累材料对Cd具有较强的富集能力,且在拔节-灌浆期的Cd积累能力最强,同时在灌浆期水稻Cd高积累材料Cd积累能力达最大,可以断定灌浆期是水稻Cd高积累材料的最佳收获时期。
目前,对于Cd富集植物的研究已取得一定的进展,但多集中于草本植物且多分布在矿区或金属冶炼厂附近,地域局限性和遗传的不稳定性导致其并不适合大面积的农田污染修复[17]。相关研究指出,国内外比较认可的Cd超富集植物的定义为地上部Cd含量达100 mg·kg-1,但这种评价方法在反映植物修复提取能力时存在明显不足,如主要从浓度角度考虑植物对重金属的富集和转运能力,往往忽略植物积累总量与生物量的关系[26]。除了植物吸收及转运能力外,植物在污染环境中的抗性和生长能力是植物修复的一个决定性因素[27]。本研究中水稻Cd高积累材料具有生物量大、适应性强、遗传性状稳定等特点[17],其生物富集量系数随生育期的延长呈先升高后稳定的趋势,水稻Cd高积累材料地上部生物富集量系数在灌浆期分别达6.00、5.76 t·hm-2(表 3)。据吴双桃等的报道,Cd超富集植物地上部最低生物富集量系数为4.2 t·hm-2,表明水稻Cd高积累材料具有作为Cd富集植物修复农田Cd污染的潜力[28]。净化率可用于评价植株在Cd污染土壤中的修复潜力。本研究中,水稻Cd高积累材料地上部和整株Cd净化率均显著高于普通材料,且在灌浆期达最大值,其地上部Cd净化率为0.82%和1.25%,其整株净化率达4.88%和4.42%(表 6)。此外,范洪黎等[29]发现,镉超富集植物苋菜在Cd浓度为25 mg·kg-1时,其整株和地上部净化率分别为1.1%和0.9%。艾蒿(Artemisia vulgaris)在土壤Cd浓度分别为10、50、100 mg·kg-1时,其地上部净化率最高达0.33%[30]。Zhuang等[31]研究8种Cd富集植物在Cd污染土壤中的净化能力发现,其净化率最大仅为0.88%。因此,与其他Cd富集植物相比,水稻Cd高积累材料具有更强的Cd富集能力。这表明在利用水稻Cd高积累材料Lu527-8和Lu17-9进行Cd污染农田修复时,其具有更好的修复能力且在拔节-灌浆期对Cd具有较强的富集能力,能够最大程度地将土壤中的Cd转移到植物体内,使水稻Cd高积累材料对Cd污染土壤修复效率达最大。 4 结论
高Cd条件下水稻Cd高积累材料Lu527-8和Lu17-9生物量随生育期的延长逐渐上升,在拔节-成熟期上升幅度较大且各生育期之间差异显著。水稻Cd高积累材料地上部和整株Cd积累量、生物富集量系数、净化率在灌浆期前均显著上升,且地上部和整株Cd积累速率在灌浆期达最大值。水稻Cd高积累材料阶段性Cd积累量在拔节-抽穗期和抽穗-灌浆期增幅显著。与普通材料相比,水稻Cd高积累材料对Cd具有较强的适应能力,其在拔节-灌浆期对Cd的富集能力显著上升且在灌浆期时富集能力达最大。各生育期相比较,灌浆期为本研究中水稻Cd高积累材料的最佳收获时期。
| [1] | Ibaraki T, Fujitomi S, Ishitsuka A, et al. Phytoextraction by high-Cd-accumulating rice to reduce Cd in wheat grains grown in Cd-polluted fields[J]. Soil Science and Plant Nutrition, 2014, 60(2):266-275. |
| [2] | Mousa W M, Soliman S I, El-Bialy A B, et al. Removal of some heavy metals from aqueous solution using rice straw[J]. Journal of Applied Sciences Research, 2013, 9(3):1696-1701. |
| [3] | Poniedziałek M, Sekara A, Jedrszczyk E, et al. Phytoremediation efficiency of crop plants in removing cadmium, lead and zinc from soil[J]. Folia Horticulturae, 2010, 22(2):25-31. |
| [4] | Murakami M, Arao T, Ae N, et al. Phytoextraction of Cd polluted paddy fields by rice capable of accumulating Cd at high levels[J]. Research Journal of Food and Agriculture, 2010, 3:1-7. |
| [5] | Ibaraki T, Kuroyanagi N, Murakami M. Practical phytoextraction in cadmium-polluted paddy fields using a high cadmium accumulating rice plant cultured by early drainage of irrigation water[J]. Soil Science and Plant Nutrition, 2009, 55(3):421-427. |
| [6] | Takahashi R, Ishimaru Y, Nakanishi H, et al. Role of the iron transporter OsNRAMP1 in cadmium uptake and accumulation in rice[J]. Plant Signal Behav, 2011, 6(11):1813-1816. |
| [7] | Ishimaru Y, Takahashi R, Bashir K, et al. Characterizing the role of rice NRAMP5 in manganese, iron and cadmium transport[J]. Scientific Reports, 2012, 2:1-8. |
| [8] | Venkataramaiah N, Ramakrishna S V, Sreevathsa R. Overexpression of phytochelatin synthase(AtPCS) in rice for tolerance to cadmium stress[J]. Biologia, 2011, 66(6):1060-1073. |
| [9] | Sebastian A, Prasad M N V. Photosynthesis mediated decrease in cadmium translocation protect shoot growth of Oryza sativa seedlings up on ammonium phosphate-sulfur fertilization[J]. Environmental Science and Pollution Research, 2014, 21(2):986-997. |
| [10] | Liang Y C, Chen Q, Liu Q, et al. Exogenous silicon(Si) increases antioxidant enzyme activity and reduces lipid peroxidation in roots of salt-stressed barley(Hordeum vulgare L. )[J]. Journal of Plant Physiology, 2003, 160(10):1157-1164. |
| [11] | Dai H P, Shan C J, Lu C, et al. Response of antioxidant enzymes in Populus× canescens under cadmium stress[J]. Pakistan Journal of Botany, 2012, 44(6):1943-1949. |
| [12] | Thounaojam T C, Panda P, Mazumdar P, et al. Excess copper induced oxidative stress and response of antioxidants in rice[J]. Plant Physiology and Biochemistry, 2012, 53:33-39. |
| [13] | Srivastava R K, Pandey P, Rajpoot R, et al. Cadmium and lead interactive effects on oxidative stress and antioxidative responses in rice seedlings[J]. Protoplasma, 2014, 251(5):1047-1065. |
| [14] | Li S, Yu J, Zhu M, et al. Cadmium impairs ion homeostasis by altering K+ and Ca2+ channel activities in rice root hair cells[J]. Plant, Cell and Environment, 2012, 35(11):1998-2013. |
| [15] | Arao T, Ishikawa S, Murakami M, et al. Heavy metal contamination of agricultural soil and countermeasures in Japan[J]. Paddy and Water Environment, 2010, 8(3):247-257. |
| [16] | 彭世彰, 乔振芳, 徐俊增. 控制灌溉模式对稻田土壤-植物系统镉和铬累积的影响[J]. 农业工程学报, 2012, 28(6):94-99. PENG Shi-zhang, QIAO Zhen-fang, XU Jun-zeng. Effect of controlled irrigation on accumulation of heavy metal Cd, Cr in soil-plant system in rice paddy[J]. Transactions of the Chinese Society of Agricultural Engineering, 2012, 28(6):94-99. |
| [17] | 郑 陶, 李廷轩, 张锡洲, 等. 水稻镉高积累品种对镉的富集特性[J]. 中国农业科学, 2013, 46(7):1492-1500. ZHENG Tao, LI Ting-xuan, ZHANG Xi-zhou, et al. Accumulation characteristics of cadmium-accumulated rice cultivars with high cadmium accumulation[J]. Scientia Agricultura Sinica, 2013, 46(7):1492-1500. |
| [18] | Wei S, Zhou Q X. Phytoremediation of cadmium-contaminated soils by Rorippa globosa using two-phase planting[J]. Environmental Science and Pollution Research, 2006, 13(3):151-155. |
| [19] | Rodda M S, Li G, Reid R J. The timing of grain Cd accumulation in rice plants:The relative importance of remobilisation within the plant and root Cd uptake post-flowering[J]. Plant and Soil, 2011, 347(1-2):105-114. |
| [20] | 胡 莹, 黄益宗, 黄艳超, 等. 不同生育期水稻根表铁膜的形成及其对水稻吸收和转运Cd的影响[J]. 农业环境科学学报, 2013, 32(3):432-437. HU Ying, HUANG Yi-zong, HUANG Yan-chao, et al. Formation of iron plaque on root surface and its effect on Cd uptake and translocation by rice(Oryza sativa L.) at different growth stages[J]. Journal of Agro-Environment Science, 2013, 32(3):432-437. |
| [21] | Fujimaki S, Suzui N, Ishioka N S, et al. Tracing cadmium from culture to spikelet:Noninvasive imaging and quantitative characterization of absorption, transport, and accumulation of cadmium in an intact rice plant[J]. Plant Physiology, 2010, 152(4):1796-1806. |
| [22] | Uraguchi S, Mori S, Kuramata M, et al. Root-to-shoot Cd translocation via the xylem is the major process determining shoot and grain cadmium accumulation in rice[J]. Journal of Experimental Botany, 2009, 60(9):2677-2688. |
| [23] | Lin A, Zhang X, Chen M, et al. Oxidative stress and DNA damages induced by cadmium accumulation[J]. Journal of Environmental Sciences, 2007, 19(5):596-602. |
| [24] | Wang C X, Mo Z, Wang H, et al. The transportation, time-dependent distribution of heavy metals in paddy crops[J]. Chemosphere, 2003, 50(6):717-723. |
| [25] | 龙小林, 向珣朝, 徐艳芳, 等. 镉胁迫下籼稻和粳稻对镉的吸收, 转移和分配研究[J]. 中国水稻科学, 2014, 28(2):177-184. LONG Xiao-lin, XIANG Xun-chao, XU Yan-fang, et al. Absorption, transfer and distribution of Cd in indica and japonica rice under Cd stress[J]. Chinese Journal of Rice Science, 2014, 28(2):177-184. |
| [26] | Liu W T, Zhou Q X, An J, et al. Variations in cadmium accumulation among Chinese cabbage cultivars and screening for Cd-safe cultivars[J]. Journal of Hazardous Cultivars, 2010, 173(1-3):737-743. |
| [27] | 黄 铮, 徐力刚, 徐南军, 等. 土壤作物系统中重金属污染的植物修复技术研究现状与前景[J]. 农业环境科学学报, 2007, 26(增刊):58-62. HUANG Zheng, XU Li-gang, XU Nan-jun, et al. Current status and expectation of phytoremediation of heavy metals in soil-crop system[J]. Journal of Agro-Environment Science, 2007, 26(Suppl):58-62. |
| [28] | 吴双桃. 镉污染土壤超富集植物选择和镉-锌复合污染实验研究[D]. 长沙:中南林学院,2003. WU Shuang-tao. The screening of cadmium huperaccumulator plants in Cd-pollated soil and the Cd-Zn compound pollution experiment[D]. Changsha: Central South Forestry University, 2003. |
| [29] | 范洪黎, 周 卫. 镉超富集苋菜品种(Amaranthus mangostanus L.)的筛选[J]. 中国农业科学, 2009, 42(4):1316-1324. FAN Hong-li, ZHOU Wei. Screening of amaranth cultivars(Amaranthus mangostanus L.) for cadmium hyperaccumulation[J]. Scientia Agricultura Sinica, 2009, 42(4):1316-1324. |
| [30] | Rebele F, Lehmann C. Phytoextraction of cadmium and phytostabilisation with mugwort(Artemisia vulgaris)[J]. Water, Air, and Soil Pollution, 2011, 216(1-4):93-103. |
| [31] | Zhuang P, Yang Q W, Wang H B, et al. Phytoextraction of heavy metals by eight plant species in the field[J]. Water, Air, and Soil Pollution, 2007, 184(1-4):235-242. |
 2015, Vol. 34
2015, Vol. 34