文章信息
- 袁传卫, 姜兴印, 殷万元, 芦勇, 李向东, 张吉旺
- YUAN Chuan-wei, JIANG Xing-yin, YIN Wan-yuan, LU Yong, LI Xiang-dong, ZHANG Ji-wang
- 吡唑醚菌酯对土壤微生物呼吸作用及土壤酶活性的影响
- Effects of Pyraclostrobin on Soil Microbial Respiration and Enzymatic Activities
- 农业环境科学学报, 2015, 34(5): 897-903
- Journal of Agro-Environment Science, 2015, 34(5): 897-903
- http://dx.doi.org/10.11654/jaes.2015.05.012
-
文章历史
- 收稿日期:2014-12-25
2. 山东农业大学农学院, 山东 泰安 271018;
3. 山东小麦玉米周年高产高效生产协同创新中心, 山东 泰安 271018
2. College of Agronomy, Shandong Agricultural University, Tai'an 271018, China;
3. Cooperative Innovation Center of Efficient Production with High Annual Yield of Wheat and Corn in Shandong, Shangdong Agricultural University, Tai'an 271018, China
土壤微生物是土壤生态系统的主要组成部分,也是土壤肥力的一个重要指标[1]。由于农药进入土壤后会对土壤微生物和土壤酶活性产生一定的影响[2],Babich等[3]提出一种化学污染物对某一生态系统中微生物的影响,可以间接反映出该化学品对该生态系统的影响,所以化学农药在农田施用后对土壤微生物的影响程度已成为评价其生态安全性的一个重要指标[4, 5]。目前,农药对土壤微生物的影响通常用土壤呼吸强度、土壤酶的活性等表示[6]。
吡唑醚菌酯是巴斯夫公司1993年开发的一种甲氧基丙烯酸酯类杀菌剂,它是一种线粒体呼吸抑制剂,它通过阻止细胞色素b和c1间电子传递而抑制线粒体呼吸作用,使线粒体不能产生和提供细胞正常代谢所需要的能量(ATP),最终导致细胞死亡。吡唑醚菌酯对作物具有保护作用、治疗作用、内吸传导性和耐雨水冲刷性能,持效期较长,应用范围较广。主要用于玉米、小麦等作物,防治子囊菌、担子菌、半知菌和卵菌纲真菌等真菌引起的多种病害[7, 8]。目前,关于吡唑醚菌酯在田间的应用、土壤中的残留以及在作物上的防治效果已有大量的报道[9, 10, 11, 12],但关于吡唑醚菌酯对土壤微生物影响的报道比较少。嘧菌酯是一种甲氧基丙烯酸酯类杀菌剂,作用方式和吡唑醚菌酯一样,嘧菌酯自问世以来,以其抑菌活性高、与其他化学类杀菌剂无交互抗性,以及对人类低毒、与环境相容性好等特点,在全球各国农药市场的份额迅速扩大[13]。
本试验以嘧菌酯为对照药剂,主要研究了吡唑醚菌酯对土壤微生物呼吸强度的影响,以及吡唑醚菌酯对四种土壤活性酶的影响,明确了吡唑醚菌酯对土壤微生物的安全性,为吡唑醚菌酯在土壤中的安全应用及施用提供参考。 1 材料和方法 1.1 试验材料
原药:95%嘧菌酯购自江苏耕耘化学有限公司,97.5%吡唑醚菌酯购自巴斯夫(中国)有限公司。供试土壤采自山东农业大学试验田,采集5~20 cm 深的土壤,剔除石块、植物根及其他杂物,风干,过 60目筛,测定土壤理化性质,其结果为:棕壤,pH值6.9,有机质含量 12.5 g·kg-1、全氮0.79 g·kg-1、速效氮 67.02 mg·kg-1、速效磷 64.11 mg·kg-1、速效钾 105.36 mg·kg-1。 1.2 试验方法 1.2.1 土壤预培养
称取200 g土样加入500 mL烧杯,加入一定量蒸馏水调节土样的含水量至田间持水量的60%左右。用保鲜膜封住瓶口以减少水分挥发,并用针在保鲜膜上刺30个左右小孔保持瓶内的通气。土样放于25 ℃恒温培养箱中预培养7 d,培养箱光照设定每天12 h光照,每3 d依称量记录补加损失水分。 1.2.2 土壤处理
采用直接吸收法测定土壤微生物呼吸强度[14]。称取预培养后的土样20 g,加入一定剂量的农药,充分混匀,吡唑醚菌酯、嘧菌酯的设计浓度为1、10、100 mg·kg-1,各处理均设3个重复。待溶剂挥发后,加蒸馏水调节土壤含水量为最大含水量的60%,与盛有20 mL 0.1 mol·L-1氢氧化钠的小烧杯一起置于2.5 L广口瓶中,置人工培养箱中继续培养。处理后第2、5、7、9、10、12、15 d,取出装有氢氧化钠标准溶液的小烧杯,用0.2 mol·L-1盐酸进行滴定,同时更换新的20 mL 0.1 mol·L-1氢氧化钠的小烧杯,继续培养测定。 1.3 酶活性测定方法
土壤脲酶、中性磷酸酶、蔗糖酶、过氧化氢酶活性测定方法采用关松荫[15]的方法。 1.3.1 脲酶活性的测定方法
称取5 g土置于50 mL容量瓶中,加1 mL甲苯处理,封口轻摇15 min;往瓶中加入5 mL 10%尿素液和10 mL的柠檬酸盐缓冲液(pH 6.7),混匀。在37 ℃恒温箱中培养24 h。然后用38 ℃的去离子水稀释至刻度,摇荡,过滤。取滤液1 mL置于50 mL容量瓶中,用去离子水稀释至10 mL,然后加入4 mL苯酚钠溶液,并立即加入3 mL次氯酸钠溶液,摇匀,20 min后,用去离子水定容至刻度,在波长578 nm处测定吸光值。以24小时后1 g土壤中NH3-N的质量(mg)表示脲酶活性。 1.3.2 过氧化氢酶活性的测定方法
取2 g风干土,置于100 mL三角瓶中,并注入40 mL蒸馏水和5 mL 0.3%过氧化氢溶液。同时设置对照,即三角瓶中注入40 mL蒸馏水和5 mL 0.3%过氧化氢溶液,不加土样。将三角瓶振荡20 min后,加入5 mL 3 mol·L-1硫酸,以终止反应。再将瓶中悬液用慢速滤纸过滤。吸取滤液25 mL,用0.1 mol·L-1高锰酸钾滴定至淡粉红色终点。以每小时每克干土所消耗的 KMnO4体积(mL)表示土壤过氧化氢酶活性。 1.3.3 中性磷酸酶活性的测定方法
称取5 g土于50 mL容量瓶中,加1 mL甲苯,加塞塞紧轻摇15 min。再加入5 mL磷酸苯二钠和5 mL pH7.0的柠檬酸缓冲液,同时对每一土样都设置用5 mL水代替基质的对照。摇匀,在37 ℃恒温箱中培养24 h。用38 ℃的去离子水定容至刻度(甲苯浮在刻度以上),再用致密滤纸过滤。取1 mL滤液于100 mL容量瓶中,加5 mL pH9.0硼酸盐缓冲液,再加入3 mL 2.5%的铁氰化钾和3 mL 0.5%的4-氨基安替吡啉溶液,摇匀,溶液呈粉红色,然后去离子水定容。待颜色稳定时(约20~30 min),在波长570 nm处测定吸光值。磷酸酶活性以每天每千克土壤的酚毫克数表示。 1.3.4 蔗糖酶活性测定方法
称取5 g风干土置于50 mL三角瓶中,加入15 mL 8%蔗糖溶液,5 mL pH5.5磷酸缓冲液和5滴甲苯。摇匀后,在37 ℃恒温箱中培养24 h。然后迅速过滤,吸取滤液1 mL,注入50 mL容量瓶中,加3 mL 3,5-二硝基水杨酸,沸水中加热5 min,然后立即用流动的自来水冷却3 min。溶液变为橙黄色,去离子水定容至刻度,于508 nm波长下测定吸光度。以每天每克干土所产生的葡萄糖量(mg)表示土壤蔗糖酶活性。 1.4 数据分析
数据采用Excel 2003处理、DPS进行差异性分析处理、SPSS进行相关性分析。根据空白与处理的滴定盐酸之差,计算二氧化碳释放量;影响率=(处理组CO2释放量-对照组CO2释放量)/对照组CO2释放量×100%;危害系数=抑制强度(%)×抑制时间(月)/达到一定水平时的农药含量(mg·kg-1)。 2 结果分析 2.1 吡唑醚菌酯、嘧菌酯对土壤微生物呼吸强度的影响
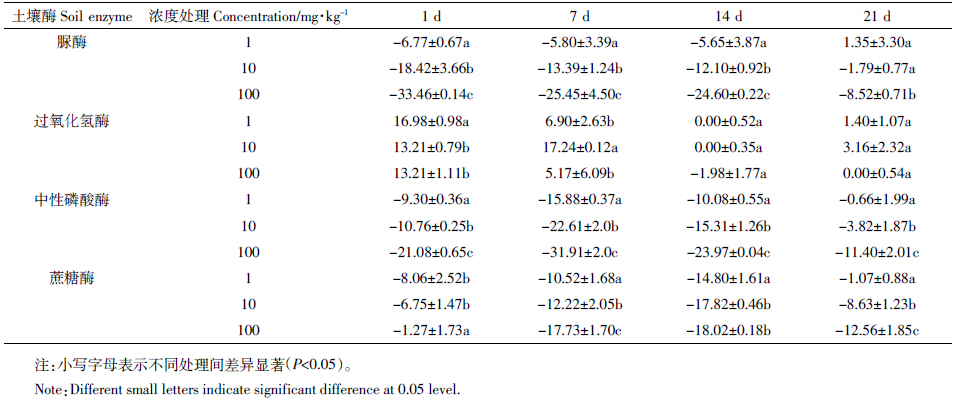
吡唑醚菌酯、嘧菌酯对土壤微生物呼吸强度的影响见表 1、图 1和图 2。由图 1可以看到,吡唑醚菌酯处理对土壤微生物呼吸均呈现激活-抑制的趋势。处理后的第2 d,10 mg·kg-1和100 mg·kg-1吡唑醚菌酯处理呈现显著激活作用,达到99.4%和30.2%,1 mg·kg-1吡唑醚菌酯处理对土壤呼吸作用无影响。而后随处理时间延长,激活率逐渐增高,第7 d达到最大值,其中10、100 mg·kg-1处理分别为247.3%、200.0%。此后,随着培养时间的延长,激活作用减弱,到处理第15 d时,出现抑制的现象,抑制率分别为17.2%、9.9%、2.6%。
 |
| 图 1 吡唑醚菌酯对土壤微生物呼吸作用的影响 Figure 1 Effect of pyraclostrobin on soil microbial respiration |
 |
| 图 2 嘧菌酯对土壤微生物呼吸作用的影响 Figure 2 Effect of azoxystrobin on soil microbial respiration |
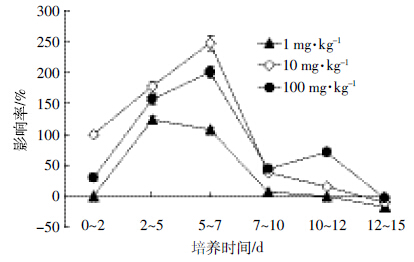
由图 2可以看到,嘧菌酯处理对土壤微生物呼吸均呈现激活-抑制-激活的趋势。处理的第2 d,嘧菌酯各浓度处理均表现明显的激活作用,激活率分别为42.05%、104.55%、54.55%。处理后的第5、7、10 d,嘧菌酯处理以抑制作用为主,而且抑制率随着处理浓度的升高而增加,最大抑制率分别为53.54%、50.87%、26.36%。此后,随着处理时间的延长,嘧菌酯对土壤微生物的抑制作用逐渐减弱;处理至第12、15 d,嘧菌酯处理以激活作用为主,第15 d达到最大,100 mg·kg-1处理的激活率为125.49%。
 |
目前评价农药对土壤微生物呼吸的影响一般采用3种方法:安全系数法、田间用量等级划分法和危害系数法[16],本研究采用危害系数法。危害系数分为三级:>200为严重危害,20~200为中等危害,<20为无实际危害。吡唑醚菌酯、嘧菌酯对土壤微生物呼吸的影响见表 2。由表 2可知,吡唑醚菌酯、嘧菌酯对土壤微生物无实际危害。
 |
由图 3、表 3可以看出,吡唑醚菌酯处理对土壤脲酶活性有较为明显的抑制作用,吡唑醚菌酯处理第1 d对土壤脲酶的抑制率最大,并且受抑制程度与吡唑醚菌酯浓度呈正相关,浓度越高,脲酶活性越低,抑制率最高为33.46%。但是随着处理时间的推移,抑制作用逐渐降低。吡唑醚菌酯处理第21 d,低浓度(1 mg·kg-1)和中浓度(10 mg·kg-1)处理已经基本恢复至对照的水平,高浓度(100 mg·kg-1)处理对脲酶的抑制作用有所恢复,但仍低于对照的水平,抑制率为8.52%。
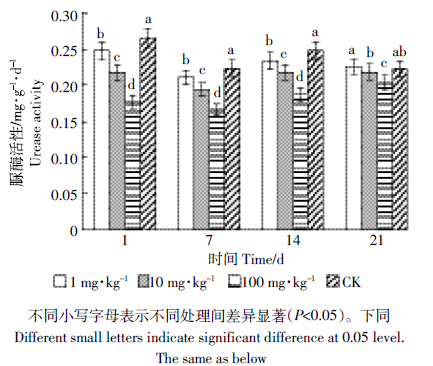 |
| 图 3 吡唑醚菌酯对土壤脲酶活性的影响 Figure 3 Effect of pyraclostrobin on soil urease activity |
由图 4、表 3可知,吡唑醚菌酯各浓度处理第1 d均对土壤过氧化氢酶产生明显的促进作用,激活率分别为16.98%、13.21%、13.21%。随后促进作用逐渐增大,处理第7 d,激活率最大达到17.24%(10 mg·kg-1)。此后,促进作用随处理时间的延长而逐渐减弱,处理第14、21 d,各浓度处理对土壤过氧化氢酶活性没有显著影响,说明吡唑醚菌酯处理对土壤过氧化氢酶的影响基本恢复到对照的水平。
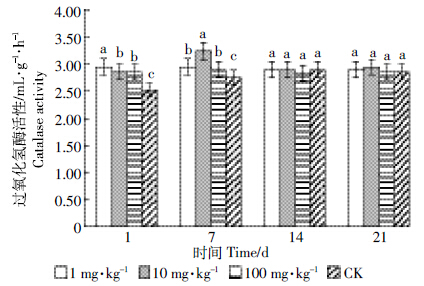 |
| 图 4 吡唑醚菌酯对土壤过氧化氢酶活性的影响 Figure 4 Effect of pyraclostrobin on soil catalase activity |
由图 5、表 3可以看出,处理第1 d,吡唑醚菌酯各处理对土壤磷酸酶活性也会产生一定的抑制作用,并且处理浓度越大,抑制率越高,最大为21.08%;第7 d各浓度处理对土壤磷酸酶抑制程度达到最大,为31.91%;随着处理时间的延长,抑制作用逐渐减弱,处理第14 d,土壤磷酸酶活性有所恢复,第21 d,浓度为1 mg·kg-1吡唑醚菌酯的处理已基本恢复至对照的水平。
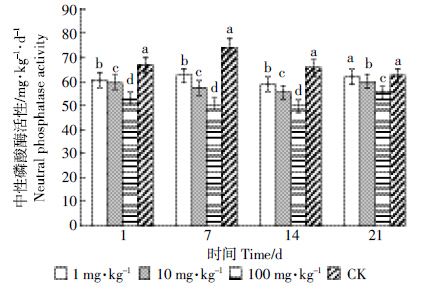 |
| 图 5 吡唑醚菌酯对土壤中性磷酸酶活性的影响 Figure 5 Effect of pyraclostrobin on soil neutral phosphatase activity |
由图 6、表 3可知,处理第1 d,浓度为100 mg·kg-1的吡唑醚菌酯对土壤蔗糖酶活性抑制作用不明显,1、10 mg·kg-1的吡唑醚菌酯处理抑制率分别为8.06%、6.75%;处理第7、14 d,吡唑醚菌酯对土壤蔗糖酶的抑制作用逐渐增加,并且浓度越大,抑制率越大。处理第21 d,1 mg·kg-1的吡唑醚菌酯处理恢复至对照的水平,10 mg·kg-1和100 mg·kg-1处理的土壤蔗糖酶活性有所恢复,但是仍低于对照的水平。
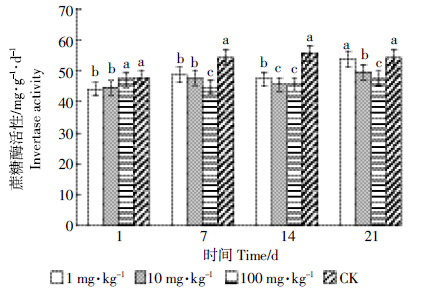 |
| 图 6 吡唑醚菌酯对土壤蔗糖酶活性的影响 Figure 6 Effect of pyraclostrobin on soil invertase activity |
本试验发现,吡唑醚菌酯和嘧菌酯施入对土壤微生物呼吸均产生激活作用,可能是有机农药作为碳源和能源被微生物吸收利用的结果[17],另外药剂施入后,破坏了土壤微生物群体的种群平衡,增强了“非靶标微生物”耐受性和活性[18],促进非靶标微生物在土壤中的定殖和繁殖,从而刺激了微生物总量的增加,增加CO2的释放量。浓度为1 mg·kg-1嘧菌酯处理对土壤微生物呼吸产生了抑制作用,可能是嘧菌酯杀死土壤中“靶标微生物”后,土壤中非靶标微生物数量恢复较慢,从而CO2的释放量会减少。
试验发现这两种甲氧基丙烯酸酯类杀菌剂对土壤微生物呼吸作用的影响有一定的差异,吡唑醚菌酯对土壤微生物的影响持续时间有限,处理15 d后基本恢复到对照水平,而嘧菌酯处理对土壤微生物的影响持续时间较长,15 d后影响率仍然比较高,可能是因为嘧菌酯在土壤中消解的时间长于吡唑醚菌酯。另外,由试验结果可知,吡唑醚菌酯对土壤微生物呼吸作用的影响率明显大于嘧菌酯,可能是因为杀菌剂的活性及土壤中微生物的种类不同造成的。 3.2 吡唑醚菌酯对土壤酶活性的影响
土壤脲酶主要作用于尿素分子中的酰胺碳键使其水解生成氨,对尿素的转化起着重要的作用[19]。冯波等[20]研究百菌清发现,浓度为1.5、3.0、7.5 mg·kg-1的百菌清均对脲酶产生抑制作用,但是1.5 mg·kg-1的百菌清处理下土壤脲酶活性恢复较快,闫晓阳等[21]研究发现,吡唑醚菌酯处理前期,土壤脲酶对吡唑醚菌酯作用较为敏感,随着时间的推移,吡唑醚菌酯对脲酶活性的抑制减弱,脲酶活性逐渐恢复到对照水平。本研究与上述研究结果基本一致,但是本试验发现1 mg·kg-1的吡唑醚菌酯即可对土壤脲酶产生较高的抑制率,但是这种抑制恢复的较快,处理21 d左右土壤脲酶恢复至对照水平,中等浓度与高浓度前期对土壤脲酶影响效果较低浓度轻,但是脲酶活性的恢复较慢。
过氧化氢酶是土壤中一种重要的氧化还原酶,广泛存在于土壤和生物体内,通过促进过氧化氢的分解,可以有效防止土壤中过氧化氢对生物体的毒害作用[22]。闫晓阳等[21]研究发现,吡唑醚菌酯低浓度处理对过氧化氢酶有持续的促进作用,谢显传等[23]研究发现,阿维菌素处理对土壤过氧化氢酶有激活作用,并且表现出明显的剂量-效应关系,本试验发现吡唑醚菌酯各浓度处理对土壤过氧化氢酶活性的影响是先激活再恢复的趋势,说明吡唑醚菌酯可以提高土壤微生物分泌过氧化氢的能力,从而清除过氧化氢对生物体产生的毒害作用,随着处理时间的推移,这种促进作用也随之减弱,21 d时各浓度处理会产生轻微的抑制作用,可能是土壤中“反馈抑制”效应导致的。
土壤磷酸酶在土壤磷素循环中起重要作用,研究表明,磷酸酶与土壤含碳量、含氮量、有效磷含量及pH 均相关,其活性可以作为评价土壤磷元素生物转化方向和强度的指标[24, 25]。闫晓阳等[21]发现吡唑醚菌酯处理对土壤中性磷酸酶前期抑制不明显,7 d后高浓度吡唑醚菌酯处理会产生明显的抑制作用,21 d处理组与空白对照组之间没有显著性差异。本试验发现吡唑醚菌酯各浓度处理前期均对中性磷酸酶产生明显的抑制作用,并且表现出一定的剂量-效应关系,吡唑醚菌酯处理第21 d对土壤中性磷酸酶仍有较明显的抑制作用,可能是本试验选用的药剂浓度以及土壤类型差异导致的。
土壤蔗糖酶是表征土壤生物活性的一种重要水解酶,也可作为评价土壤熟化程度和土壤肥力水平的重要指标[23]。冯波等[20]研究发现百菌清低浓度处理会表现出微弱的刺激作用,高浓度则明显抑制蔗糖酶活性,并且恢复更慢。仉欢等[26]研究发现,磷化铝低浓度处理对蔗糖酶活性影响不明显,高浓度处理在试验期内对蔗糖酶活性始终有显著抑制作用。单敏等[27]研究发现,低浓度的丁草胺在整个试验期内对蔗糖酶活性影响很小,没有表现出显著差异,高浓度的丁草胺处理对土壤中蔗糖酶的活性表现出明显的抑制作用。本试验发现,处理第7 d后,吡唑醚菌酯各浓度均对土壤蔗糖酶活性产生明显的抑制作用,并且浓度越大抑制作用越明显,这说明土壤蔗糖酶对吡唑醚菌酯更加敏感。 4 结论
与嘧菌酯相比,吡唑醚菌酯对土壤微生物影响的时间有限,15 d后吡唑醚菌酯处理基本恢复至对照水平,而嘧菌酯处理则对土壤微生物仍有明显的激活作用。吡唑醚菌酯对土壤微生物呼吸作用的激活率明显高于嘧菌酯处理;通过危害系数法评价可知,吡唑醚菌酯、嘧菌酯对土壤微生物均无实际危害。
吡唑醚菌酯处理对土壤脲酶、蔗糖酶、中性磷酸酶均产生了一定的抑制作用,这种抑制作用随着时间的延长逐渐消失,但是高浓度处理对土壤酶影响较为明显,且恢复缓慢。吡唑醚菌酯对土壤过氧化氢酶具有一定的刺激作用,但是这种促进作用在第14 d基本恢复到对照水平。
| [1] | 赵 华, 徐 浩, 叶兴祥. 甲胺磷等三种农药对土壤微生物的影响及安全性评价[J]. 浙江农业学报, 2004, 16(5):313-316. ZHAO Hua, XU Hao, YE Xing-xiang. Effects and safety evaluation of methamidophos, triazophos and buprofezin on respiration of soil microbe[J]. Acta Agriculturae Zhejiangensis, 2004, 16(5):313-316. |
| [2] | Min H, Ye Y F, Chen Z Y, et al. Effects of butachlor on microbial populations and enzyme activities in paddy soil[J]. J Environ Sci Health, Parb B, 2001, 36(5):581-595. |
| [3] | Babich H, Stotzky G. Developing standard for environmental toxicants:The need to consider abiotic environmental factors and microbe mediated ecological processes[J]. Environ Health Perspect, 1983, 49:345-353. |
| [4] | MarxM C, Wood M, Jarvis S C. A microplate fluorimetricassay for the study of enzyme diversity in soils[J]. Soil Biology & Biochemistry, 2001, 33:1633-1640. |
| [5] | Trasar-Cepeda C, Leiros M C, Seoane S, et al. Limitations of soil enzymes as indicators of soil pollution[J]. Soil Biology & Biochemistry, 2000, 32:1867-1875. |
| [6] | 周新文, 陈鹤鑫, 陆贻通, 等. 化学农药对土壤微生物的影响[J]. 上海环境科学, 1997, 16(12):35-38. ZHOU Xin-wen, CHEN He-xin, LU Yi-tong, et al. Effects of chemical pesticides on soil microbes[J]. Shanghai Environmental Sciences, 1997, 16(12):35-38. |
| [7] | 张亦冰. 新颖甲氧基丙烯酸酯类杀菌剂: 唑菌胺酯[J]. 世界农药, 2007, 29(3):47-48. ZHANG Yi-bing. The new strobilurin fungicides:Pyraclostrobin[J]. World Pesticides, 2007, 29(3):47-48. |
| [8] | 侯春青, 李志念, 刘长令. 新型Strobin类杀菌剂唑菌胺酯[J]. 农药, 2002, 41(6):41-43. HOU Chun-qing, LI Zhi-nian, LIU Chang-ling. The new strobilurin fungicides:Pyraclostrobin[J]. Agrochemicals, 2002, 41(6):41-43. |
| [9] | 李亮亮, 王明林, 于建垒, 等. 60%唑醚·代森联WG在大蒜及土壤中的残留[J]. 农药, 2013, 52(2):116-118. LI Liang-liang, WANG Ming-lin, YU Jian-lei, et al. Residue of pyraclostrobin·metiram 60% WG in garlic and soil[J]. Agrochemicals, 2013, 52(2):116-118. |
| [10] | 彭埃天, 李 鑫, 刘景梅, 等. 25%吡唑醚菌酯乳油对香蕉黑星病毒力测定与防治试验[J]. 植物保护, 2008, 34(2):134-137. PENG Ai-tian, LI Xin, LIU Jing-mei, et al. The toxicity test and control experiments of pyraclostrobin 25% EC on black spot disease in banana[J]. Plant Protection, 2008, 34(2):134-137. |
| [11] | 张少军, 郑振山, 陈勇达, 等. 杀菌剂吡唑醚菌酯在大白菜上的残留动态[J]. 中国蔬菜, 2011(18):77-80. ZHANG Shao-jun, ZHENG Zhen-shan, CHEN Yong-da, et al. Residue dynamics of fungicide pyraclostrobin on Chinese cabbages[J]. China Vegetables, 2011(18):77-80. |
| [12] | 范子耀, 王文桥, 孟润杰, 等. 吡唑醚菌酯与苯醚甲环唑混合物对茄链格孢的联合毒力及其对马铃薯产量的影响[J]. 农药学学报, 2011, 13(6):591-596. FAN Zi-yao, WANG Wen-qiao, MENG Run-jie, et al. Joint-toxicity of mixtures of pyraclostrobin with difenoconazole against Alternaria solani and effect of their synergistic mixture on potato yield[J]. Chinese Journal of Pesticide Science, 2011, 13(6):591-596. |
| [13] | 薄海波, 毕 阳, 马凌云, 等. 苹果和甜瓜中嘧菌酯残留量测定及其在贮藏期间变化的研究[J]. 农药, 2005, 44(1):28-30. BO Hai-bo, BI Yang, MA Ling-yun, et al. Determination and change during storage of azoxystrobin residue levels in muskmelon and apple after a dip treatment[J]. Agrochemicals, 2005, 44(1):28-30. |
| [14] | 王金花, 朱鲁生, 王 军, 等. 4种典型抗生素对土壤农生物呼吸的影响[J]. 农业环境科学学报, 2011,30(11):2232-2236. WANG Jin-hua, ZHU Lu-sheng, WANG Jun, et al. Effects of four typical antibiotics on soil microbial respiration[J]. Journal of Agro-Environment Science, 2011,30(11):2232-2236. |
| [15] | 关松荫. 土壤酶及其研究方法[M]. 北京:农业出版社, 1986. GUAN Song-yin. Soil enzyme and research method[M]. Beijing:China Agricultural Press, 1986. |
| [16] | 冯秀斌, 杨 瑞, 刘慧君, 等. 3种地下害虫杀虫剂对蚯蚓和土壤微生物的影响[J]. 农药, 2009, 48(3):208-210. FENG Xiu-bin, YANG Rui, LIU Hui-jun, et al. Effects of three underground pesticides on earthworm and soil microorganism[J]. Agrochemicals, 2009, 48(3):208-210. |
| [17] | Tu C M. Effect of four organophosphorus in secticides on microbial activities in soil[J]. Applied Microbiol, 1970, 19:479-484. |
| [18] | 刘 锋, 应光国, 周启星, 等. 抗生素类药物对土壤微生物呼吸的影响[J]. 环境科学, 2009, 30(5):1280-1285. LIU Feng, YING Guang-guo, ZHOU Qi-xing, et al. Effects of antimicrobial drugs on soil microbial respiration[J]. Environmental Science, 2009, 30(5):1280-1285. |
| [19] | 卜东欣, 张 超, 张 鑫, 等. 熏蒸剂威百亩对土壤微生物数量和酶活性的影响[J]. 中国农学通报, 2014, 30(15):227-233. BU Dong-xin, ZHANG Chao, ZHANG Xin, et al. Effects of fumigant metham-sodium on soil microbial population and enzyme activities[J]. Chinese Agricultural Science Bulletin, 2014, 30(15):227-233. |
| [20] | 冯 波, 单 敏, 方 华, 等. 百菌清对土壤微生物数量和酶活性的影响[J]. 农业环境科学学报, 2006, 25(3):674-677. FENG Bo, SHAN Min, FANG Hua, et al. Effects of chlorothalonil on soil microbial populations and enzyme activities[J]. Journal of Agro-Environment Science, 2006, 25(3):674-677. |
| [21] | 闫晓阳. 吡唑醚菌酯在烟叶和土壤中降解行为及影响因子研究[D]. 北京:中国农业科学院, 2014. YAN Xiao-yang. Degradation behaviors and influencing factors of pyraclostrobin in tocacco leaves and soil[D]. Beijing:Chinese Academy of Agricultural Sciences, 2014. |
| [22] | 马吉平, 陈庆隆, 王洪秀, 等. 除草剂氯嘧磺隆对6种土壤酶活性影响研究[J]. 江西农业学报, 2014, 26(6):29-33. MA Ji-ping, CHEN Qing-long, WANG Hong-xiu, et al. Effects of herbicide chlorimuron-ethyl on activities of 6 kinds of enzymes in soil[J]. Acta Agriculturae Jiangxi, 2014, 26(6):29-33. |
| [23] | 谢显传, 张少华, 王冬生, 等. 阿维菌素对蔬菜地土壤微生物及土壤酶的生态毒理效应[J]. 土壤学报, 2007, 44(4):740-743. XIE Xian-chuan, ZHANG Shao-hua, WANG Dong-sheng, et al. Eco-toxicological effect of abamectin on vegetable soil microbes and soil enzyme[J]. Acta Pedologica Sinica, 2007, 44(4):740-743. |
| [24] | 郭 明, 张小萍, 曹 玉, 等. 3种杀虫剂对土壤磷酸酶活性的影响[J]. 西北农林科技大学学报:自然科学版, 2001, 29(2):69-72. GUO Ming, ZHANG Xiao-ping, CAO Yu, et al. Effects of three insecticides on soil phosphatase activities[J]. Journal of Northwest A&F University:Natural Science Edition, 2001, 29(2):69-72. |
| [25] | Boero G, Thien S. Phosphatase activity and phosphorus availability in the rhizosphere of corn roots[M]//Harley J L and Scott R R. The soil root interface. London: Academic Press, 1979:231-242. |
| [26] | 仉 欢, 朱玉坤, 乔 康, 等. 磷化铝对土壤微生物数量和酶活性的影响[J]. 农业环境科学学报, 2012, 31(1):143-148. ZHANG Huan, ZHU Yu-kun, QIAO Kang, et al. Effects of aluminum phosphide on soil microbial and enzyme activities[J]. Journal of Agro-Environment Science, 2012, 31(1):143-148. |
| [27] | 单 敏, 虞云龙, 方 华, 等. 丁草胺对土壤微生物数量和酶活性的影响[J]. 农药学学报, 2005, 7(4):383-386. SHAN Min, YU Yun-long, FANG Hua, et al. Effect of butachlor on soil microbial populations and enzyme activities[J]. Chinese Journal of Pesticide Science, 2005, 7(4):383-386. |
 2015, Vol. 34
2015, Vol. 34