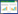文章信息
- 张文萍, 王全胜, 徐吉洋, 朱国念, 李少南
- ZHANG Wen-ping, WANG Quan-sheng, XU Ji-yang, ZHU Guo-nian, LI Shao-nan
- 呋虫胺原药及两种剂型对三种甲壳纲生物的毒性与风险评价
- Toxicity and Risk of Different Formulations of Dinotefuran to Three Crustaceans
- 农业环境科学学报, 2015, 34(8): 1478-1485
- Journal of Agro-Environment Science, 2015, 34(8): 1478-1485
- http://dx.doi.org/10.11654/jaes.2015.08.007
-
文章历史
- 收稿日期:2015-05-25
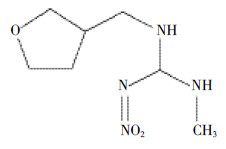
呋虫胺(Dinotefuran),即(RS)-1-甲基-2-硝基-3-(四氢-3-呋喃甲基)胍(图 1),是日本三井化学公司研发的第三代新烟碱类杀虫剂。它可作用于乙酰胆碱受体使昆虫麻痹致死,对半翅目、鳞翅目、直翅目等很多害虫均具有极好的防效[1, 2]。呋虫胺具有高效内吸性,土壤处理及茎叶喷雾均能发挥其杀虫活性,自2002年呋虫胺首次登记以来,人们已开发出了呋虫胺颗粒剂、水溶性粒剂等多种剂型,其也被广泛应用于水稻等作物上。
|
| 图 1 呋虫胺的化学结构 Figure 1 Chemical structure of dinotefuran |
农药施用后会通过雨水冲刷、漂移等方式进入水体,危害水生生物的安全。由于呋虫胺在水中的溶解度大(40 g·L-1,20 ℃)、土壤吸附性较弱[3],因而更易流失进入水体,从而对水生生物造成危害。因此,研究呋虫胺对水生生物的毒性显得极为重要。此外,还有研究表明不同农药剂型对生物的毒性有所不同。如,李华等[4]研究发现高效氯氟氰菊酯加工成多种剂型后对大型溞的毒性相对原药均增大;韩志华等[5]的研究表明二嗪磷原药及不同剂型对鹌鹑的毒性差异较大;陈爱梅等[6]的研究表明吡虫啉不同剂型对蚯蚓和斑马鱼各自的毒性不同。因此,进一步研究农药不同剂型的毒性差别,有助于了解农药使用后的真实风险,更具实际意义。
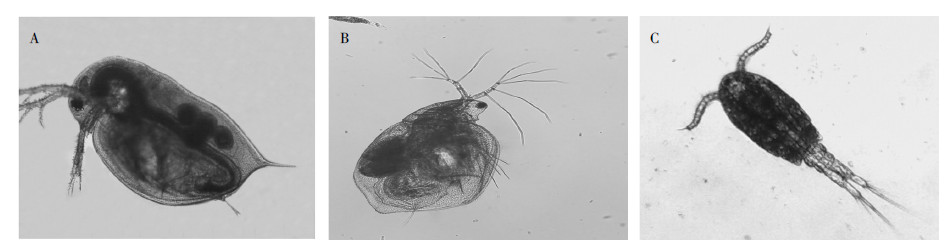
然而,目前呋虫胺的研究主要集中在代谢、残留分析方法等方面,生态毒性研究较少。因此,本文参照经济合作与发展组织(OECD)的“化学品测试准则”,以大型溞、老年低额溞、锯缘真剑水蚤三种甲壳纲生物为受试生物(图 2),开展呋虫胺原药、20%可溶性粉剂(Soluble powder,SP)及1%颗粒剂(Granules,G)的急性毒性试验,并对呋虫胺20%可溶性粉剂及1%颗粒剂于稻田使用后的急性生态风险进行了初步评估。
|
|
A大型溞;B老年低额溞;C锯缘真剑水蚤 A:Daphnia magna;B:Simocephalus vetulus;C:Eucyclops serrulatus 图 2 受试生物形貌特征示意图 Figure 2 Images of three tested crusteceas |
UPLC-MS/MS液质联用仪及C18色谱柱;UPWS-1-50D 超纯水制备机;XW-80A 涡旋仪;Fresco 21高速离心机及天平、烧杯、离心管(2 mL和10 mL)等。
呋虫胺(Dinotefuran)原药(纯度97.5%),购买自Dr. Ehrenstorfer(Augsburg,Germany);20%呋虫胺可溶性粉剂及1%呋虫胺颗粒剂,浙江天一农化有限公司提供;乙腈、PSA、无水MgSO4、氯化钠、七水硫酸镁等。
受试生物:大型溞(Daphnia magna)来源于中国疾病预防控制中心环境与健康相关产品安全所,属于62DM 生物株;老年低额溞(Simocephalus vetulus)和锯缘真剑水蚤(Eucyclops serrulatus)均采自浙江大学华家池校区人工湖,经过物种分离纯化后,于实验室内培养一年以上,并由天津南开大学鉴定。大型溞和老年低额溞培养在M4培养液中,锯缘真剑水蚤培养在曝气自来水中。
1.2 急毒试验方法试验方法参照“OECD化学品测试准则202”[7],采用静态法进行。溞类试验和剑水蚤分别以M4培养液和曝气自来水为稀释水。呋虫胺原药先用丙酮配成母液,再用稀释水配成不同浓度的试验液。各浓度组中丙酮的终浓度不超过0.1 mL·L-1。设空白和溶剂(丙酮)两组对照。溶剂对照中丙酮的终浓度与最高浓度组相同。呋虫胺20%可溶性粉剂和1%颗粒剂则直接用稀释水溶解,配制成相应的试验浓度。
溞类采用出生0~24 h的幼体,锯缘真剑水蚤采用未怀卵的成虫。试验历时48 h,试验水温为22~24 ℃,每日光照16 h,每处理组分成4组,每组含5 只受试生物。
在获得的毒性数据,建立“剂量-反应”方程并计算出LC50的基础上,参照我国农业部“化学农药环境安全评价试验准则[8]”对受试农药做毒性分级:LC50≤0.1 mg·L-1为剧毒,0.1 mg·L-1 < LC50≤1 mg·L-1为高毒,1 mg·L-1 < LC50≤10 mg·L-1为中毒,LC50>10 mg·L-1为低毒。
在获得环境暴露浓度,求得风险熵值(Risk quotient,RQ)的基础上,参照美国环保署(USEPA)给出的“关注水平(Level of concern,LOC)”,对于受试农药的生态风险进行评估[9]。按照USEPA的LOC,急性风险熵值RQ被划分为4个区间 [10]:RQ < 0.05,无风险;0.05≤RQ < 0.1,可能对濒危物种有不利影响;0.1≤RQ < 0.5,产生急性风险的可能性较高;RQ≥0.5,急性高风险。RQ越大,风险越大。
1.3 呋虫胺含量测定 1.3.1 提取净化分别吸取5 mL 不同组中的培养液于10 mL塑料离心管中,加入5 mL乙腈,涡旋1 min后,加入2 g NaCl和4 g MgSO4,再涡旋1 min,静置分层,吸取约2 mL上层溶液于塑料离心管中,加入0.15 g PSA和0.2 g无水MgSO4,涡旋1 min后,于12 000 r·min-1转速下离心3 min,上清液过0.22 μm滤膜于进样瓶中,待测。
1.3.2 UPLC-MSMS分析条件样品采用UPLC-MSMS法检测,UPLC采用梯度洗脱,柱温25 ℃,进样体积5 μL。质谱采用ESI(电喷雾离子源)正源多重反应检测(MRM)模式,毛细管电压2.5 kV,离子源温度120 ℃,脱溶剂温度350 ℃,脱溶剂气流量650 L·h-1,锥孔气流量50 L·h-1;此条件下,呋虫胺的保留时间约为1.76 min。
1.3.3 标准曲线和添加回收率以乙腈为溶剂,配成浓度为1000 mg·L-1的呋虫胺标准母液,再梯度稀释为100、10、1、0.1 mg·L-1的系列标准溶液,之后以空白样品提取液稀释至0.01、0.05、0.1、0.5、1 mg·L-1作为标准工作液,于上述UPLC-MSMS条件下检测。以浓度为横坐标,峰面积为纵坐标绘制标准曲线,得到标准曲线方程为y=122 356x + 1 299.9(R2=0.998 4)。
将不同浓度的呋虫胺标准溶液分别添加至不含药的M4培养液和曝气自来水中,进行回收率试验。结果表明(表 1),添加回收率为90.9%~98.8%,RSD为2.2%~7.0%。
 |
以用药剂量的对数值为自变量(x),受试生物在相应剂量下的死亡百分率的几率值为因变量(y),应用 DPS数据处理软件,求得“剂量-反应”关系、LC50及其 95%置信限等。
应用DPS系统中的致死中浓度比率测定方法对呋虫胺原药及不同剂型在致死中浓度方面的差异进行检验,当比率的95%置信区间包含1时,说明药剂致死中浓度之间的差异不显著;反之,差异显著[11]。
1.4.2 呋虫胺暴露期间的实测浓度平均值在农药消解率未知的情况下,以实测浓度平均值计算LC50,用于计算RQ。假定呋虫胺在试验过程中的浓度下降符合指数曲线,采用“时间加权平均法[12]”计算呋虫胺在整个试验过程中的实测浓度。将指数曲线“面积”除以时间间隔“t”(单位:h),即得到受试物在整个试验周期内的“时间加权平均浓度”(单位: mg·L-1)。指数降解曲线的“面积”计算公式为:
面积= t(C0-Ct)/(lnC0-lnCt)
式中C0和Ct分别为受试物在“0”时间和“t”时间的实测浓度,mg·L-1;t为时间间隔,h。
1.4.3 RQ利用USEPA颁布的一般环境暴露浓度估算模型(GENEEC)计算环境暴露浓度(EEC)。RQ计算公式如下[10]:
RQ=EEC/LC50
2 结果与分析 2.1 呋虫胺原药及其两种剂型对大型溞的急性毒性与对照组相比,经呋虫胺处理后的大型溞在实验初期表现兴奋,主要表现为在水中快速游动或打转,然后游动逐渐缓慢,最终沉于水底不动,并出现侧翻于水底的中毒现象,部分大型溞尾部拖着细丝状附着物,不灵活。
试验结束时,空白对照组和丙酮对照组均无死亡情况。染毒试验结果表明(表 2),以实测浓度计,呋虫胺原药、可溶性粉剂和颗粒剂对大型溞的24 h-LC50分别为4.89、30.52、1.34 mg·L-1,48 h-LC50分别为1.08、22.96、0.36 mg·L-1。可见,随着时间的延长,呋虫胺的急性毒性增强。差异性分析结果表明(表 5),原药、20%可溶性粉剂和1%颗粒剂对大型溞的48 h-LC50急性毒性差异显著,毒性大小顺序为1%颗粒剂>原药>20%可溶性粉剂。根据48 h-LC50,呋虫胺1%颗粒剂、原药和20%颗粒剂对大型溞的毒性分别为高毒、中毒和低毒。按实测浓度计算出的LC50与理论浓度计算出的相应值的差别在-25.5%~-4.1%之间,但毒性类别相同。
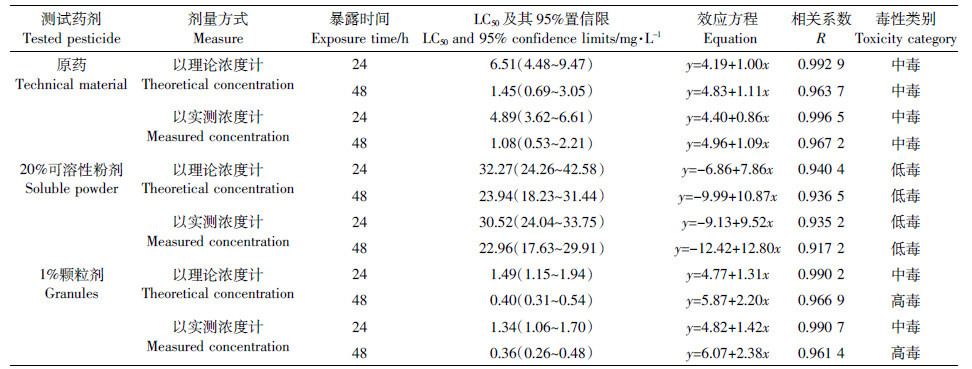 |
试验结束时,空白对照组和丙酮对照组均无死亡情况。受呋虫胺的毒害后,老年低额溞在水体中出现打转现象,应激反应迟钝,出现沉于水底或漂浮于水面的中毒症状。
从表 3中可以看出,1%颗粒剂对老年低额溞的毒性最大,为高毒,以实测浓度计算的48 h-LC50为0.40 mg·L-1;其次为呋虫胺原药,以实测浓度计,48 h-LC50为1.21 mg·L-1,对低额溞毒性为中毒;20%可溶性粉剂对老年低额溞的毒性最小,48 h-LC50为10.65 mg·L-1,毒性为低毒。同一处理组的24 h-LC50均大于48 h-LC50,表明随着暴露时间的延长,呋虫胺原药及其不同剂型对老年低额溞的毒性逐渐增大。以实测浓度和理论浓度计算的LC50差值在-28.2%~-11.5%之间,但二者毒性类别相同。差异性分析结果表明(表 5),呋虫胺原药、20%可溶性粉剂和1%颗粒剂对老年低额溞的48 h-LC50毒性差异显著。
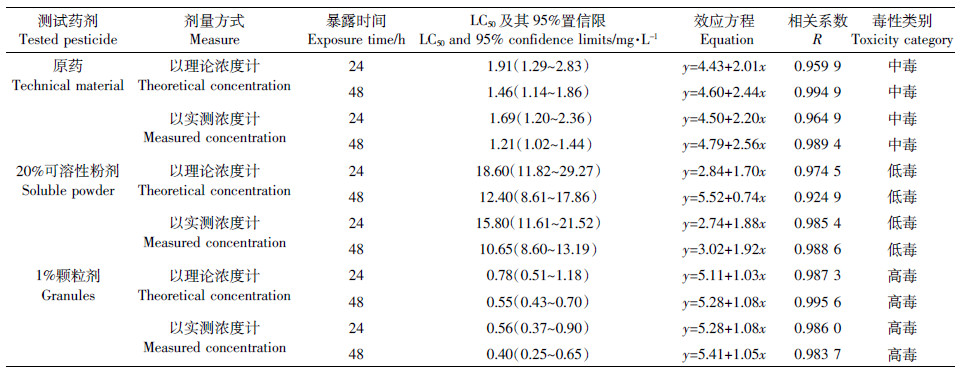 |
试验结束时,空白对照组和丙酮对照组的锯缘真剑水蚤均无死亡情况。与正常的剑水蚤相比,呋虫胺处理后的锯缘真剑水蚤的上下游动没有节奏感,跳跃时上时下、时前时后、如醉酒状;且中毒的剑水蚤跳跃频率明显减慢,反应迟缓,缓慢跳跃后逐渐下沉至水体中下部。
由表 4可以看出,三组处理中剑水蚤受到的毒害作用均很大,以实测浓度计,24 h-LC50为0.06~0.14 mg·L-1,毒性为高毒至剧毒;随着时间的延长,毒害作用进一步增大,呋虫胺原药、20%可溶性粉剂和1%颗粒剂对剑水蚤的48 h-LC50分别达到0.08、0.04、0.04 mg·L-1,毒性均为剧毒。无论以理论浓度计,还是以实测浓度计,呋虫胺原药及其剂型对锯缘真剑水蚤均有很高的毒性。差异性分析结果表明(表 5),原药与20%可溶性粉剂和1%颗粒剂两种剂型对剑水蚤的48 h-LC50毒性差异显著,但两种剂型之间的毒性差异不显著。
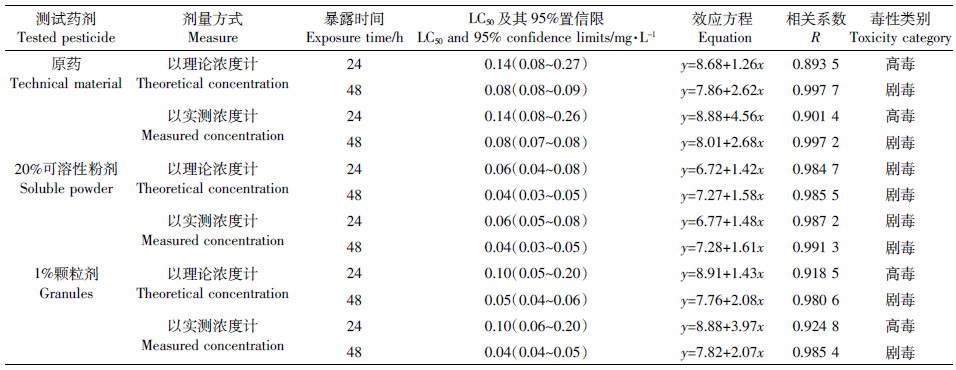 |
 |
鉴于毒性分级的结果显示呋虫胺对受试生物大多为高毒或剧毒,本文进一步采用RQ值对该农药的生态风险进行表征。
文中的EEC采用GENEEC估算得到。GENEEC以特定场景(即农药施用于一块面积为10 hm2的农田,经一场降雨后,农药流进一个面积为1 hm2,水深为2 m的池塘)为基础进行环境暴露浓度估算[13],最终得到水体中的峰值暴露浓度和4、21、60、90 d的平均暴露浓度。输入如表 6所示的参数,得到呋虫胺不同剂型在不同时间内的EEC值(表 7)。再以EEC峰值浓度与以实测浓度计算得到的48 h-LC50作比,得到RQ(表 8)。
 |
 |
参照USEPA给出的关注水平(Level of concern,LOC)对得到的RQ进行评估。结果表明,呋虫胺可溶性粉剂对大型溞和低额溞的RQ值均小于0.05,说明其对两种生物均无急性毒性风险,对剑水蚤的RQ为0.31,说明对剑水蚤产生急性风险的可能性较高。颗粒剂对大型溞、低额溞的RQ分别为0.070、0.063,无急性风险,但据此推断可能会对濒危物种有不利影响。颗粒剂对剑水蚤的RQ为0.63,存在急性高风险。总体而言,对同一受试生物,颗粒剂RQ高于可溶性粉剂,急性风险更高,在田间使用时应予以关注。
3 讨论最初的毒性研究[1, 4]表明,呋虫胺对鲤鱼、鹌鹑和大型溞的急性LC50>1000 mg·L-1(48 h),对蜜蜂安全且不影响采蜜。但在近年却发现,呋虫胺对蜜蜂有较高的毒性:美国俄勒冈州于2013年发生的蜜蜂群体死亡事件被证明与呋虫胺施用有关,由此还引发了呋虫胺一定范围内的禁用[14];刘佳霖等[15]的研究发现,呋虫胺对小峰熊蜂(Bombus hypocrita)的48 h-LC50为0.54 mg·L-1(工蜂)和1.47 mg·L-1(雄蜂),属于高毒;还有研究表明,呋虫胺可能通过植物体内运输进入到花粉等,进而引起传粉昆虫的死亡[16]。由此可见,最初的数据未能全面反映呋虫胺施用后对蜜蜂的毒性,其原因可能是受试生物之间存在一定的差异,或是由于最初的研究主要针对呋虫胺原药,与实际使用的剂型产品的毒性存在差异。但无论何种原因,随着呋虫胺逐步登陆我国市场,有必要对其生态毒性做进一步研究。
Beketov等[17-18]的研究发现,大型溞对烟碱类杀虫剂的毒害作用不敏感。因此仅仅利用大型溞毒性试验可能无法真实地反映其他水生生物所受的影响。故本文初步以大型溞、老年低额溞和锯缘真剑水蚤三种较为常见的甲壳纲生物为研究对象,研究了呋虫胺原药对三种生物的24 h和48 h急性毒性,结果表明,以实测浓度计算,呋虫胺原药对大型溞、低额溞、剑水蚤的24 h-LC50和48 h-LC50为0.08~4.89 mg·L-1,具有较高毒性。其中剑水蚤对呋虫胺的毒害最为敏感,大型溞和低额溞次之并且二者的48 h-LC50差别较小,这可能是由于二者同属于枝角类,体征和生活习性差别相对较小。呋虫胺对三种生物的48 h毒性高于24 h,说明存在毒性累积效应。整体而言,呋虫胺对三种生物的毒性都较高,这可能是由于呋虫胺主要作用于乙酰胆碱受体且易溶于水,而乙酰胆碱在三种生物的生长繁殖过程中起着极为重要的作用。不同生物之间由于对农药的生物可利用性以及吸收机制等不同,受到的毒害作用会有所不同[6]。
本文还研究了呋虫胺可溶性粉剂和颗粒剂两种剂型的急性毒性。结果表明,两种剂型对大型溞和低额溞的48 h毒性均为颗粒剂>原药>可溶性粉剂,由于颗粒剂有效成分含量低且加工过程中需加入粘着剂、着色剂、包衣剂、稳定剂等助剂,因此,相同处理浓度下,颗粒剂处理组中助剂含量远大于有效成分含量,由于部分表面活性剂等助剂能够间接影响有效成分的毒性或其本身即具有一定的毒性[19, 20],因此会增加受试生物受到的毒害作用。而可溶性粉剂通常由水溶性较大的农药和无机盐、吸附剂等组成,能在水中形成真溶液,所含助剂较少,因此其毒性相对较小。由于高导电性的无机离子可能会对浮游动物的种群产生影响[21],因此其毒性较原药有所降低,但这还需要进一步试验研究。剑水蚤对呋虫胺的毒害相对敏感,两种剂型对其毒性差异不显著。综上,与原药相比,呋虫胺加工成制剂后(SP和G)的毒性并无绝对的增大或减小,这与剂型加工过程以及不同生物的敏感性有关。
呋虫胺可溶性粉剂和颗粒剂在稻田使用后的急性风险评估结果表明,可溶性粉剂和颗粒剂对大型溞和低额溞的急性风险熵值为0.000 54~0.070,均无急性风险。但二者对剑水蚤的急性风险均较高。对同一种生物,颗粒剂的急性风险比可溶性粉剂更大,这除了与颗粒剂复杂的组成成分有关外,还与其施药方式有关,颗粒剂在撒施后直接进入稻田水体中,而可溶性粉剂茎叶喷雾后受水稻植株的阻挡,故进入水体的量相对较少,由此产生的急性风险较小。因此,应关注呋虫胺对水生生物的急性毒性风险,尤其是颗粒剂剂型的急性风险。在使用过程中可采取适当的措施降低其急性风险,如稻田用药后短期内不要排水、适当降低施药量、无风条件下喷雾以减少飘移等。
本文研究了呋虫胺原药及可溶性粉剂、颗粒剂两种剂型对三种甲壳纲生物的毒性,并初步评估了两种剂型的急性风险,为合理用药提供参考。但不同农药助剂、呋虫胺代谢物等对呋虫胺毒性的影响尚不明确,还有待进一步研究。
4 结论(1)呋虫胺原药对大型溞、老年低额溞、锯缘真剑水蚤三种生物的24 h和48 h急性毒性均较高;三种生物的敏感性顺序为剑水蚤>低额溞≈大型溞。加工成剂型后毒性有所改变,颗粒剂对低额溞、大型溞的毒性相似且均增大,但可溶性粉剂对二者的毒性均明显降低。两种剂型对剑水蚤的毒性均略高于原药,但两种剂型之间对其毒性差异不显著。此外,暴露时间的延长会导致毒性累积。
(2)呋虫胺两种剂型对大型溞和低额溞的RQ均低于0.1,表明无急性风险。呋虫胺对剑水蚤产生急性毒害的可能性较大,RQ分别为0.31和0.63。对同一种受试生物,呋虫胺颗粒剂的急性风险高于可溶性粉剂。因此,在实际用药时应对呋虫胺在水生生态系统中的急性风险予以关注。施药后短期内勿放水、适当降低施药量等措施能够降低其风险。
| [1] | 张亦冰. 新内吸杀虫剂: 呋虫胺[J]. 世界农药, 2003, 25(5): 46-47. ZHANG Yi-bing. New systemic insecticide: Dinotefuran[J]. World Pesticides, 2003, 25(5): 46-47. |
| [2] | Ghosh A, Samanta A, Chatterjee M L. Dinotefuran: A third generation neonicotinoid insecticide for management of rice brown planthopper[J]. African Journal of Agricultural Research, 2014, 9(8):750-754. |
| [3] | Kurwadkar S T, Dewinne D, Wheat R, et al. Time dependent sorption behavior of dinotefuran, imidacloprid and thiamethoxam[J]. Journal of Environmental Science and Health, Part B, 2013, 48(4): 237-242. |
| [4] | 李华, 李秀环, 张大侠, 等. 不同剂型高效氯氟氰菊酯对大型溞的毒性效应[J]. 环境科学学报, 2014, 34(6): 1615-1620. LI Hua, LI Xiu-huan, ZHANG Da-xia, et al. The toxicity effect of different formulations of lambda-cyhalothrin against Daphnia magna[J]. Acta Scientiae Circumstantiae, 2014, 34(6): 1615-1620. |
| [5] | 韩志华, 周军英, 程燕, 等. 不同剂型二嗪磷制剂及原药对鸟类的毒性评价[J]. 农业环境科学学报, 2008, 27(5): 2033-2038. HAN Zhi-hua, ZHOU Jun-ying, CHENG Yan, et al. Toxicity assessment of different formulations of diazinon to avian[J]. Journal of Agro-Environment Science, 2008, 27(5): 2033-2038. |
| [6] | 陈爱梅, 王金花, 夏晓明, 等. 不同剂型吡虫啉对蚯蚓和斑马鱼的急性毒性评价[J]. 农业环境科学学报, 2013, 32(9): 1758-1763. CHEN Ai-mei, WANG Jin-hua, XIA Xiao-ming, et al. Acute toxicity of imidacloprid with different formulation on earthworm and zebrafish[J]. Journal of Agro-Environment Science, 2013, 32(9): 1758-1763. |
| [7] | OECD. Guideline for Testing of Chemicals No. 202 Daphnia sp.: Acute Immobilisation Test[S]. 2004. |
| [8] | 中华人民共和国农业部. GB/T 31270.13—2014化学农药环境安全评价试验准则第13部分:溞类急性活动抑制试验[S]. 北京:中国标准出版社, 2015. Ministry of Agriculture of the People's Republic of China. GB/T 31270. 13—2014 Test guidelines on environmental safety assessment for chemical pesticides-Part 13: Daphnia sp. acute immobilization test[S]. Beijing: China Standards Press, 2015. |
| [9] | 程燕, 周军英, 单正军. 美国农药水生生态风险评价研究进展[J]. 农药学学报, 2005, 7(4): 293-298. CHENG Yan, ZHOU Jun-ying, SHAN Zheng-jun. Progress of study on aquatic ecological risk assessment of pesticide in USA[J]. Chinese Journal of Pesticide Science, 2005, 7(4): 293-298. |
| [10] | USEPA. Appendix-E: Risk quotient and LOCs.[2015-5-23]. http://www.epa.gov/espp/litstatus/effects /bss-appendix-e.pdf. |
| [11] | 唐启义. DPS数据处理系统: 实验设计、统计分析及数据挖掘[M]. 2版. 北京:科学出版社, 2010:369-371. TANG Qi-yi. DPS data processing system: Experimental design, statistical analysis and data mining[M]. Second edition. Beijing: Science Press, 2010:369-371. |
| [12] | OECD. Guideline for Testing of Chemicals No. 211 Daphnia magna.: Acute Immobilisation Test[S]. 2012. |
| [13] | USEPA. GENEEC User's Manual.[2015-05-23]. http://www.epa.gov/pesticides/science/efed/models/water/archives/geneec/geneec2_users_manual.htm. |
| [14] | 段丽芳. 出现蜜蜂死亡后呋虫胺在美国俄勒冈州被禁[J]. 农药科学与管理, 2013, 34(10): 54. DUAN Li-fang. Dinotefuran was disabled in Orego of USA after the death of bees[J]. Pesticide Science and Administration, 2013, 34(10): 54. |
| [15] | 刘佳霖, 伍翔, 廖秀丽. 四种杀虫剂对小峰熊蜂工蜂和雄性蜂的急性经口毒性测定[J]. 农药, 2012, 51(6): 436-438. LIU Jia-lin, WU Xiang, LIAO Xiu-li. Evaluation the oral toxicity of four pesticides to Bombus hypocrite workers and drones[J]. Pesticides, 2012, 51(6): 436-438. |
| [16] | Dively G P, Kamel A. Insecticide residues in Pollen and Nectar of a cucurbit crop and their potential exposure to pollinators[J]. Journal of Agricultural and Food Chemistry, 2012, 60(18): 4449-4456. |
| [17] | Van der Sluijs J P, Amaral-Rogers V, Belzunces L P, et al. Conclusions of the Worldwide Integrated Assessment on the risks of neonicotinoids and fipronil to biodiversity and ecosystem functioning[J]. Environmental Science and Pollution Research, 2015, 22(1): 148-154. |
| [18] | Beketov M A, Liess M. Acute and delayed effects of the neconicotinoid insecticide thiacloprid on seven freshwater arthropods[J]. Environmental Toxicology and Chemistry, 2008, 27(2): 461-470. |
| [19] | 曹慧. 农药助剂的环境毒理研究进展[J]. 农药研究与应用, 2011, 15(2):8-11. CAO Hui. Research progress on environmental toxicology of pesticide adjuvants[J]. Agrochemicals Research and Application, 2011, 15(2):8-11. |
| [20] | 李秀环. 常用农药助剂对大型溞的毒性研究[D]. 泰安: 山东农业大学, 2013. LI Xiu-huan. The toxicity study of pesticide adjuvant to Daphnia magna[D]. Tai'an: Shandong Agricultural University, 2013. |
| [21] | Wokem G N, Udonsi J K. Studies on physico-chemical properties of pond water in relation to zooplanktonic organisms of the ponds of Oso-Edda in Afikpo, Ebonyi State Nigeria[J]. Global Journal of Environmental Sciences, 2003, 2(2): 82-87. |
 2015, Vol. 34
2015, Vol. 34