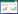文章信息
- 姬朋朋, 尹光彩, 陈志良, 周兵, 林亲铁, 刘千钧, 刘德玲
- JI Peng-peng, YIN Guang-cai, CHEN Zhi-liang, ZHOU Bing, LIN Qin-tie, LIU Qian-jun, LIU De-ling
- 两种AMF对巨菌草根际土壤Cd生物可利用性以及Cd积累的影响
- Impacts of two kinds of arbuscular mycorrhizal fungi on rhizospheric bio-available Cd and accumulation of Cd for Pennisetum sp.
- 农业环境科学学报, 2016, 35(12): 2306-2313
- Journal of Agro-Environment Science, 2016, 35(12): 2306-2313
- http://dx.doi.org/10.11654/jaes.2016-0878
文章历史
- 收稿日期: 2016-07-03
2. 环境保护部华南环境科学研究所, 广州 510655;
3. 广州日之建土壤修复科技有限公司, 广州 511450
2. South China Institute of Environmental Science, MEP, Guangzhou 510655, China;
3. GZ HNK Soil Remediation Technology CO., LTD, Guangzhou 511450, China
我国的土壤污染问题一直存在,20世纪90年代以来,Cd污染耕地面积已达到1.3×104 hm2,2014年在环境保护部、国土资源部联合发布的全国土壤污染状况调查公报中显示,Cd是所有采样点超标率最高的重金属污染物[1-3]。2010年由我国水稻研究所与农业部稻米及制品质量监督检验测试中心发布的《稻米质量安全现状及发展对策研究》指出,我国约有1/5耕地受重金属污染,其中Cd污染的耕地涉及11个省25个地区。Cd不是植物必需的微量元素,但是却极易被植物吸收并通过食物链在人和动物体内富集,从而对植物、动物和人体造成危害,甚至导致生物体死亡[4-6]。
巨菌草(Pennisetum sp.)为多年生禾本科直立丛生型植物,原产地为非洲,由我国学者于1983年从南非引进,经过20多年培育成为适合我国气候、土壤环境的草种[7]。巨菌草具有较强的分蘖能力及很强的环境适应性和抗胁迫能力,同时还具有一定的生态正效应。林占熺等[8-9]研究发现,巨菌草对盐渍地具有一定的适应能力,可以增加土壤微生物群落功能多样性,在一定程度上提高土壤肥力,荒坡地种植巨菌草能产生一定的环境效益;王丽萍等[10]通过盆栽实验发现,巨菌草可以在20 mg·kg-1的Cd浓度下正常生长;徐磊等[11]通过小区实验发现,巨菌草与石灰联合对Cu、Cd复合污染土壤表现出一定的修复潜力。
丛枝菌根真菌(AMF,Arbuscular mycorrhizal fungi)是一类重要的土壤微生物,在土壤中分布十分广泛,能与地球上90%的维管束植物形成丛枝菌根(AM),具有促进植物生长、增强植物抗逆能力、改善土壤微生物区系等功能[12-14]。近年来许多关于利用AMF辅助植物修复重金属污染土壤的成果已有发表[14-16]。Neagoe等[17]通过对苜蓿、向日葵、芥菜、中穗花等植物接种AMF进行研究,结果表明AMF与不同的植物表现出了不同的作用特征,但是一致的结果是AMF促进了植物在重金属污染土壤中的生长,或一定程度增加了植物对重金属的吸收。
目前,国内外对植物修复研究主要集中在超富集植物以及其相关的强化技术等方面[18-24]。已发现Cd超富集植物20余种,但大多存在生长过慢、生物量小等缺点,导致植株对Cd的绝对累积量并不明显,极大限制了其应用,故利用AMF强化那些具有多种重金属抗性、生长迅速、重金属绝对累积量大的非超富集植物,具有广泛的应用前景[25]。为此,本研究通过向巨菌草接种AMF的方式,寻找一种快速、有效的Cd污染土壤修复方法。
1 材料和方法 1.1 实验材料供试菌剂为摩西斗管囊霉(Funneliformis mosseae,BGC HEB02,缩写为Fm)和根内根孢囊霉(Rhizophagus intraradices,BGC BJ09,缩写为Ri),购自北京市农林科学研究院植物营养与资源研究所,为商品菌种。两种接种剂均为含有寄主植物根段、相应菌根真菌孢子及根外菌丝体的根际土壤。
供试植物为巨菌草(Pennisetum sp.),采于广东番禺巨菌草种植基地。
供试土壤采自某蔬菜地表层土(0~20 cm),土样在阴凉通风处风干,研磨后过筛保存,以2 kg每份用聚乙烯塑料袋盛装。土壤基本理化性质见表 1。
模拟土壤制备:将配置的CdCl2溶液均匀加入供试土样,使基质Cd浓度为T0空白、T1 5 mg·kg-1、T2 10 mg·kg-1、T3 15 mg·kg-1。制得模拟土壤,避光老化3个月后测量土壤中Cd的总量依次为0.003 2、4.89、9.27、14.59 mg·kg-1。所有土壤经120 ℃高压蒸汽灭菌2 h,风干1周后备用。
1.2 实验方法巨菌草茎段使用10%H2O2表面消毒10 min,再用去离子水洗净,削成10 cm左右的长度,每段至少一个叶芽,于0.2%的尿素浸泡30 min催芽,室温下放置过夜,备用。用容积为3 L左右的塑料花盆盛装土壤,每盆装土2 kg,接种剂25 g。预先装入1.5 kg的土样,巨菌草茎以45°(叶芽向上)插入土壤中,将菌剂均匀铺在叶芽周围再覆土,保证巨菌草茎最上方有2~3 cm厚度的土壤。一次浇水淋透,以盆底有少许水浸出为宜。非接种处理加入等量的灭菌土壤,其他处理相同,整个实验过程保持土壤适宜湿度。实验设置不接种AMF对照(CK)和接种处理(T0,T1,T2,T3)。每5 d随机变换位置,每30 d施肥一次,所有实验组均施加N[CO(NH2)2] 600 mg·kg-1、P(KH2PO4)400 mg·kg-1和K(K2SO4)200 mg·kg-1作为养分,保障植物的正常生长。植物自然生长4个月后,分地上、地下部分进行收获,依次用自来水、去离子水清洗植物样品,晾干水分之后,存放于4 ℃冰箱中备用。
1.3 分析方法侵染率的测定[26]:取新鲜根样,剪成约5 mm小段,随机选取100个根样用醋酸墨水染色法[27],并在正置显微镜下观察丛枝菌根侵染状况。侵染率=AMF侵染的根段数/观察的总根段数×100%。
Cd形态分析:以改进的European Community Bureau of Reference(BCR)连续提取法中Cd的可交换态和可还原态作为Cd生物可利用性的评价指标[28]。植物收获后,将盆中的土壤风干,研磨混匀,采用4分法取样50 g,35 ℃烘干至恒重,用改进的BCR连续提取法[29]进行Cd形态分析。①可交换态:称取0.500 0 g样品于50 mL聚丙烯离心管中,加入0.11 mol·L-1 HAc提取液20 mL,室温下振荡16 h(250 r·min-1,管内混合物处于悬浮状态),振荡结束之后进行离心分离(4000 r·min-1,20 min),倾出上层清液于聚乙烯瓶中,保存于4 ℃冰箱中待测。加入10 mL高纯水清洗残余物,振荡20 min,离心,弃去清洗液。每组实验设置2组试剂空白组。②可还原态:向以上提取后的残余物中加入0.5 mol·L-1 NH2OH·HCl提取液40 mL,振荡16 h,离心分离。其余操作同①。使用AAS进行测量。
生物量测定:将采集的整株植物样品在105 ℃杀青处理30 min后,于70 ℃下烘干至恒重,分别称量地上部分和地下部分干重(沿地面剪取,分地上部分和地下部分)。
植物样品Cd元素分析:植物样品用粉碎机粉碎,称取0.200 0 g样品置于50 mL聚四氟乙烯坩埚中,HNO3+H2O2(V/V=5:1)混合液浸泡过夜,电热板150 ℃消解2.5 h,消解完全后用质量分数为1%的HNO3清洗并定容到25 mL比色管中。采用AAS石墨炉测定消化液中Cd的浓度,并计算出植物样品中Cd的含量。
土壤基本理化性质测定方法参考土壤农化分析[30]。
1.4 统计分析所有试验数据用Excel 2013进行均值和标准差计算,并使用Origin 9.1进行统计分析,通过5%水平下LSD多重比较检验各处理平均值之间的差异显著性。富集系数(Bioaccumulation factor)=植物体内重金属含量/土壤中重金属含量;转移系数(Translocation factor)=植株地上部分重金属含量/植株地下部分重金属含量。
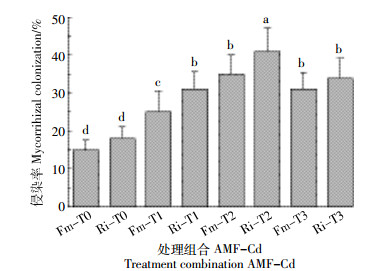
2 结果与讨论 2.1 Cd浓度对AMF侵染率的影响植物生长4个月后收获,测得真菌侵染率介于15%~41%之间。如图 1所示,侵染率随Cd浓度的增加先有显著的提高,在T2浓度下达到最大值,在T3浓度时略有下降。接种Ri、Fm在T2浓度下侵染率分别达到了35%、41%。
|
| 图 1 不同AMF-Cd组合下AMF的侵染率 Figure 1 Colonization of AMF at different AMF-Cd 图中不同字母表示各处理间差异显著性(P < 0.05).下同 Indicate significant difference (P < 0.05) among different treatments. The same below |
许多研究表明,重金属的浓度可以显著影响AMF对宿主植物的侵染率,一般情况下侵染率随着重金属浓度的升高而降低。也有研究表明,只有在一定浓度的重金属胁迫下,表现出更好的侵染关系[31]。Liu等[14]通过不同的Cd浓度对龙葵接种AMF进行研究,在25、50 mg·kg-1浓度下侵染率没有显著差别,在100 mg·kg-1浓度下AMF侵染率有显著的降低。Turnau等[32]调查表明,重金属耐性较强的植物Oxalis acetosella用含镉和锌的工业灰尘处理后,菌根侵染率不仅未降低反而升高。目前有关巨菌草及其亲缘关系相近的王草、巴草对Cd耐性的相关研究较少,但是结果一般表现为在Cd浓度10~20 mg·kg-1会出现生长受到抑制的情况[10, 32-34]。本实验组侵染率的变化趋势可能是由于在较低的Cd处理浓度下没有产生足够的胁迫,导致侵染率较低,当Cd浓度达到15 mg·kg-1后可能达到巨菌草的Hormesis点,又产生了抑制作用的结果。
2.2 接种AMF对土壤Cd的生物有效性影响重金属的生物有效性主要与重金属的生物可利用态和生物潜在可利用态有关。生物可利用态主要包括水溶态和可交换态,与BCR连续提取法中的可交换态对应;生物潜在可利用态主要包括碳酸盐结合态、铁锰氧化态、有机结合态,与BCR法中的可还原态对应[28],相对来说有机物结合态释放过程缓慢,而残渣态与沉积物结合最牢固,基本不能被生物所利用,故本实验不做考虑[35],取可交换态和可还原态作为Cd生物有效性的评价。本实验中通过Tessier提取法对碳酸盐结合态进行分析,由于其含量很低,不作为主要影响因素。
2.2.1 接种AMF土壤中可交换态Cd的含量由图 2可知,与CK处理相比,T1、T2、T3浓度下接种AMF后,土壤可交换态Cd含量均显著降低(P < 0.05),在T1、T2浓度下降幅更大。T1、T2浓度处理效果表现为Ri>Fm>CK,T3浓度下接种Fm和Ri之间并没有显著性差异;在T1和T2浓度下,接种Fm、Ri可交换态Cd的浓度分别降低了18.65%、20.51%和12.54%、16.64%,在T3浓度下接种Fm、Ri分别降低了6.53%和6.66%。
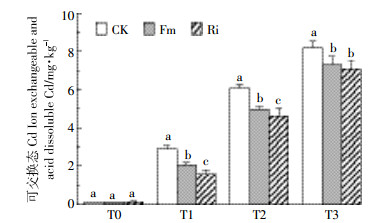
|
| 图 2 不同AMF处理下土壤中可交换态Cd含量 Figure 2 Ion exchangeable and acidic dissoluble soil Cd content inoculated by AMF |
研究表明,接种AMF可以通过影响重金属的化学形态或减弱其迁移性能而改变其生物有效性。Cornejo等[36]研究发现,AMF形成的菌丝表面存在大量重金属结合的位点,能够结合土壤中重金属离子,使土壤中可交换态Cu含量显著减少,当AMF定殖在植物根系上时,可以通过菌丝磷酸盐、巯基等化合物的络合作用,将重金属固持在根内菌丝和孢子中,从而降低重金属的移动能力[36]。此外,Wu等[37]研究表明在重金属胁迫条件下,AMF菌丝可以分泌大量与球囊霉素相关的土壤蛋白(Glomalin-related soil protein,GRSP)、低分子量有机酸等化合物结合土壤中重金属离子,改变根际土壤重金属的形态,导致土壤中可交换态重金属含量变化。当然,接种AMF对土壤的根际环境也有一定的影响,由于本实验并没有对植物根际微观环境做出更进一步的分析,巨菌草与AMF共生体系的微观作用研究将会进一步进行。
2.2.2 接种AMF土壤中可还原态Cd的含量由图 3可知,与CK相比,接种AMF对可还原态Cd变化表现出不同结果。在T1、T2浓度下,接种Fm、Ri均显著降低了可还原态的Cd的浓度(P < 0.05),在T3浓度下可还原态Cd的浓度有显著升高(P < 0.05);在T1和T2浓度下,Fm、Ri处理土壤中可还原态Cd的浓度分别降低了10.32%、19.58%和28.92%、14.1%,在T3浓度下Fm、Ri土壤可还原态Cd分别升高了32.28%和35.36%。
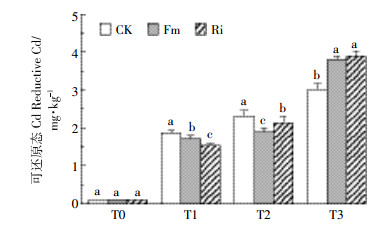
|
| 图 3 不同AMF处理下土壤中可还原态Cd含量 Figure 3 Reductive Cd content in the soil inoculated by AMF |
在BCR连续提取法中,可还原态主要为铁锰氧化态和碳酸盐结合态。铁锰氧化矿物在土壤重金属迁移过程中起着重要的作用。吴曼等[38]通过对比施加有机质对红壤和黑土中外源Cd的稳定化过程进行了研究,结果表明红壤中有效态Cd平均浓度比黑土增加了65.4%,有效态Pb平均浓度则为黑土的4.7倍;同时有研究表明侵染率与土壤有机质的含量成正比[39]。在本试验中随着侵染强度的增加,有机质的含量也相应增加,这也对可还原态Cd的增加有一定促进作用。铁锰氧化物对重金属元素的专性吸附作用,不仅对痕量金属的生物可利用性具有控制作用,而且对许多重金属污染物在自然界中的迁移与富集也起重要控制作用[40]。本实验选取的土壤为砖红壤,Fe的含量高达4.76 g·kg-1,可能对Cd的形态迁移有着明显影响,在Cd处理浓度为15 mg·kg-1,铁锰氧化物的吸收量逐渐趋于饱和,在接种真菌的情况下,可还原态的增加量显著高于对照组。
2.3 接种AMF对巨菌草生物量的影响由图 4可知,与CK处理相比,在T0浓度下接种Fm、Ri巨菌草地上、地下部分的生物量没有显著的区别;T1浓度下地上部分有显著差别,而地下部差异不显著;在T2、T3浓度下地上部分均有显著的增加,结果表现为Ri>Fm>CK;地下部分也有增加,但两种真菌间没有一致规律性。在T2、T3浓度下,相对于CK组,Fm处理、Ri处理巨菌草的地上部分生物量分别增加了20.98%、36.94%和36.54%、43.88%,地下部分生物量分别增加了14.31%、21.79%和25.78% 12.8%。在较高的Cd浓度胁迫下,两种AMF均显著增加了地上部分和地下部分的生物量,且对地上部分生物量的影响优于对地下部分。
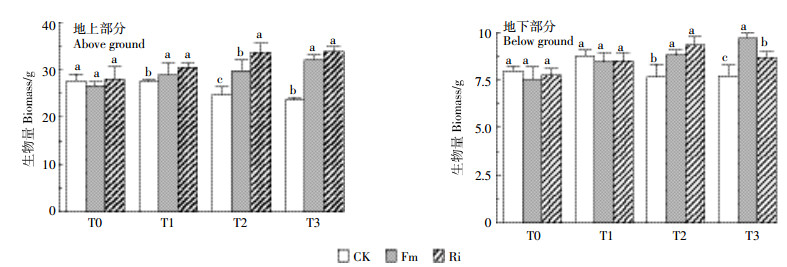
|
| 图 4 不同真菌处理巨菌草地上和地下部分的生物量 Figure 4 Above-and below-ground biomass of Pennisetum sp. inoculated by AMF |
植物在一定重金属环境下其生理活动会受到抑制,这与重金属生物可利用性的强度有直接关系[32]。巨菌草具有很高的Cd耐性,王丽萍等[10]研究表明,在20 mg·kg-1以上浓度的Cd污染土壤才会显著抑制巨菌草的生长,但是作者并未对土壤中Cd生物可利用性强度进行评价。结合上文2.1叙述可知,巨菌草可能在Cd为10~20 mg·kg-1时生长受到抑制,由于AMF对植物强化作用的选择性和有限性[41],在本试验较低Cd浓度下AMF并没有与巨菌草发生较强的共生作用,从而未对巨菌草的生物量造成显著的影响;T2、T3浓度下,接种AMF对巨菌草生物量有显著的提高。在足够的Cd胁迫下,AMF与植物形成大量的AM[42],可显著提高宿主植物根系的吸收范围,增加植物对N、P等矿质元素、水分的吸收量[43]以及增强植物抗旱等性能,这些因素都有助于植物的生长[44]。但有研究表明,盆栽实验中用土的量对植物的生长和生物量有重要的影响[45],用土量较少时对植物的生长有较大的抑制作用。本研究中盆栽用土相对较少,可能导致本试验中巨菌草的生物量在较低的Cd浓度下受到影响。
2.4 接种AMF对巨菌草Cd积累的影响由图 5可知,接种AMF显著提高了巨菌草对Cd的吸收。T1、T2、T3浓度下,相对于CK,Fm处理、Ri处理巨菌草地上部分Cd吸收量分别增加了28.95%、13.75%、23.69%和25.88%、33.71%、19.88%,地下部分Cd的吸收量分别增加了132.91%、69.23%、13.96%和87.35%、75.41%、13.19%,增幅随着处理浓度的增高呈递减趋势。
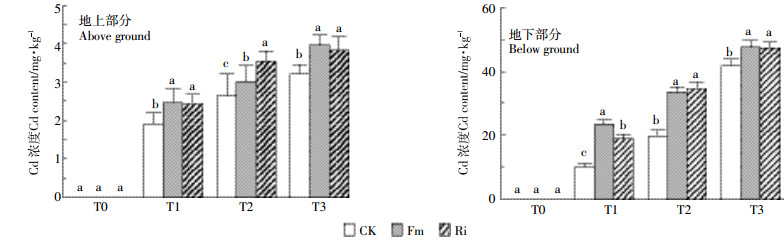
|
| 图 5 不同真菌处理巨菌草地上和地下部分的Cd浓度 Figure 5 Cd content of Pennisetum sp. for the above ground portion (leaves and stem) and the root inoculated by AMF |
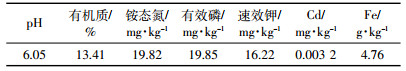
植物富集系数(BCF)和转移系数(TF)是衡量植物修复能力的主要指标。由表 2可知,AMF处理组在T1、T2、T3浓度下均可显著提高植物的BCF,其中在T1浓度下接种真菌Ri的BCF达到了0.77,在王丽萍等[10]的研究中巨菌草富集系数在0.55左右,相比有较大的提高,单株最高富集量达到0.98 mg,而且浓度越低的情况下BCF提升越大。巨菌草TF系数则没有明显的差异。
AMF应用于植物提取的研究都证实,接种AMF能够显著提高植物对重金属的吸收能力,但是重金属积累的部分随着植物的不同存在部分差异。黄晶等[46]通过对紫花苜蓿接种AMF进行研究,发现接种AMF的紫花苜蓿根部Cd、Zn含量和积累量明显增加,但地上部Cd、Zn的含量降低,地上部Zn的积累量减小,表明AMF可降低Cd、Zn由根部向地上部的转运。也有研究发现丛枝菌根同时增加了植物地上部和地下部的Cd富集量。Liu等[14]通过对龙葵接种AMF研究发现,AMF显著增加了龙葵地上、地下部分对Cd的吸收量,且地下部分的增幅高于地上部分。这与本实验的结果一致,也可能是巨菌草BCF增大的原因。由于形成的AM可以固持大量的Cd,减少了对地上部分的危害,导致巨菌草的TF并没有提高,甚至有一定的减少。
巨菌草为多年生植物,有非常强的再生能力,但是TF系数相对较低。为了达到对Cd绝对富集量的最大值,可以通过多次收刈的方式去除植物已经富集的重金属。因此,进行长时间的田间实验,收刈处理是具有一定意义的,对于植物根际的分析也是很有必要的。由于时间和工作量的制约,我们并没有做出更加细致的分析,这也是后期研究需要改进加强之处。
3 结论(1)接种AMF显著降低了土壤中可交换态和可还原态Cd含量及其生物可利用性。在Cd浓度为5、10 mg·kg-1处理接种两种真菌的效果表现为Ri>Fm,而在15 mg·kg-1浓度下接种两种真菌之间并没有表现出明显的差异。
(2)接种两种AMF显著增加了10、15 mg·kg-1浓度下地上、地下部分的生物量;随着Cd处理浓度的提高,两种真菌处理之间差异不显著,但强化作用有所增强。
(3)接种AMF显著提高了巨菌草的重金属富集系数,提高了巨菌草修复Cd污染土壤的能力,由于地上、地下部分的Cd含量同时增大,巨菌草的TF并未见显著变化。
| [1] | 环境保护部, 国土资源部.全国土壤污染状况调查公报[Z].环境保护部公告[2014] 351号.北京:环境保护部, 2014-04-17. Ministry of Land and Resources of the People's Republic of China, Ministry of Environmental Protection of the People's Republic of China. A national soil survey[Z]. Announcement of the Ministry of Environmental Protection[2014] 351. Ministry of Environmental Protection of the People's Republic of China[2014] 351. Beijing:Ministry of Environmental Protection of the People's Republic of China, 2014-04-17. |
| [2] | He B, Yun Z J, Shi J b, et al. Research progress of heavy metal pollution in China:Sources, analytical methods, status, and toxicity[J]. Chinese Science Bulletin, 2013, 58(2) : 134–140. DOI:10.1007/s11434-012-5541-0 |
| [3] | 张小敏, 张秀英, 钟太洋, 等. 中国农田土壤重金属富集状况及其空间分布研究[J]. 环境科学, 2014, 20(2) : 692–703. ZHANG Xiao-min, ZHANG Xiu-ying, ZHONG Tai-yang, et al. Spatial distribution and accumulation of heavy metal in arable land soil of China[J]. Environmental Science, 2014, 20(2) : 692–703. |
| [4] | Li S, Chen J R, Islam E, et al. Cadmium-induced oxidative stress, response of antioxidants and detection of intracellular cadmium in organs of moso bamboo (Phyllostachys pubescens) seedlings[J]. Chemosphere, 2016, 153 : 107–114. DOI:10.1016/j.chemosphere.2016.02.062 |
| [5] | 陈颖, 刘柿良, 杨容孑, 等. 镉胁迫对龙葵生长、质膜ATP酶活性及氮磷钾吸收的影响[J]. 应用与环境生物学报, 2015, 21(1) : 121–128. CHEN Ying, LIU Shi-liang, YANG Rong-jie, et al. Effects of cadmium on growth, plasma membrane ATPase activity, and absorption of N, P and K in Solanum nigrum L. seedlings[J]. Chinese Journal of Applied and Environmental Biology, 2015, 21(1) : 121–128. |
| [6] | Singh V, Tripathi B N, Sharma V. Interaction of Mg with heavy metals (Cu, Cd) in T.aestivum with special reference to oxidative and proline metabolism[J]. Journal Plant Research, 2016, 129(3) : 487–497. DOI:10.1007/s10265-015-0767-y |
| [7] | 彭露, 杨一帆, 侯有明, 等. 福建省引种巨菌草Pennisetum sp.的生物安全性评价[J]. 福建农业学报, 2014, 29(11) : 1132–1137. PENG Lu, YANG Yi-fan, HOU You-ming, et al. The biosafety assessment of introduced Pennisetum sp. in Fujian Province, China[J]. Fujian Journal of Agricultural Sciences, 2014, 29(11) : 1132–1137. |
| [8] | 林占熺, 林冬梅. 不同类型污渍地对巨菌草生物学特性的影响[J]. 西南农业学报, 2015, 28(2) : 675–680. LIN Zhan-xi, LIN Dong-mei. Effect of different salt-affected soils on biological characteristics of Pennisetum sp.[J]. Southwest China Journal of Agricultural Science, 2015, 28(2) : 675–680. |
| [9] | 林兴生, 林占熺. 5种菌草苗期抗盐性的评价[J]. 福建农林大学学报, 2013, 42(2) : 195–207. LIN Xing-sheng, LIN Zhan-xi. Assessment on salt resistance at seeding stage of 5 species of Juncao under NaCl stress[J]. Journal of Fujian Agricultural and Forestry University (Natural Science Edition), 2013, 42(2) : 195–207. |
| [10] | 王丽萍, 张健, 胡红玲. 巨菌草对镉污染土壤的修复特性[J]. 应用与环境生物学报, 2015, 21(4) : 725–732. WANG Li-ping, ZHANG Jian, HU Hong-ling, et al. The remediation characteristics of Pennisetum spp. on Cd contaminated soil[J]. Chinese Journal of Applied & Environmental Biology, 2015, 21(4) : 725–732. |
| [11] | 徐磊, 周静, 梁家妮, 等. 巨菌草对Cu、Cd污染土壤的修复潜力[J]. 生态学报, 2014, 34(18) : 5342–5348. XU Lei, ZHOU Jing, LIANG Jia-ni, et al. The remediation potential of Pennisetum sp. on Cu, Cd contaminated soil[J]. Acta Ecologica Sinica, 2014, 34(18) : 5342–5348. |
| [12] | Bradley R, Burt A J, Read D J. Mycorrhizal infection and resistance to heavy metal toxicity in Callun valgavris[J]. Nature, 1981, 292 : 336–337. |
| [13] | Wang B, Qiu Y L. Phylogenetic distribution and evolution of mycorrizas in land plants[J]. Mycorrhiza, 2006, 16(5) : 299–363. DOI:10.1007/s00572-005-0033-6 |
| [14] | Liu H, Yuan M, Tan S Y. Enhancement of arbuscular mycorrhizal fungus (Glomus versiforme) on the growth and Cd uptake by Cd-hyperaccumulator Solanum nigrum[J]. Applied Soil Ecology, 2015, 89 : 44–49. DOI:10.1016/j.apsoil.2015.01.006 |
| [15] | Ogar A, Sobczyk L, Turnau K. Effect of combined microbes on plant tolerance to Zn-Pb contaminations[J]. Environmental Science Pollution Research, 2015, 22(23) : 19142–19156. DOI:10.1007/s11356-015-5094-2 |
| [16] | 罗鹏程, 李航, 王曙光. 湿生环境中丛枝菌根(AM)对香蒲耐Cd胁迫的影响[J]. 环境科学, 2016, 37(2) : 750–756. LUO Peng-cheng, LI Hang, WANG Shu-guang. Effect of arbuscular mycorrhiza (AM) on tolerance of cattail to Cd stress in aquatic environment[J]. Environmental Science, 2016, 37(2) : 750–756. |
| [17] | Neagoe A, Iordache V, Bergmann H, et al. Patterns of effects of arbuscular mycorrhizal fungi on plants grown in contaminated soil[J]. Journal Plant Nutrition and Soil Science, 2013, 176(2) : 273–286. DOI:10.1002/jpln.v176.2 |
| [18] | Yang W H, Zhang T X, Li S L, et al. Metal removal from and microbial property improvement of a multiple heavy metals contaminated soil by phytoextraction with a cadmium hyperaccumulator Sedum alfredii H[J]. Journal of Soils and Sediments, 2014, 14(8) : 1385–1396. DOI:10.1007/s11368-014-0875-7 |
| [19] | Wang Y B, Yan A L, Dai J, et al. Accumulation and tolerance characteristics of cadmium in Chlorophytum comosum:A popular ornamental plant and potential Cd hyperaccumulator[J]. Environmental Monitoring Assessment, 2012, 184(2) : 929–937. DOI:10.1007/s10661-011-2010-1 |
| [20] | Kashem M A, Singh B R, Kubota H, et al. Zinc tolerance and uptake by Arabidopsis halleri ssp. Gemmifera grown in nutrient solution[J]. Environmental Science Pollution Research, 2010, 17(5) : 1174–1176. DOI:10.1007/s11356-009-0193-6 |
| [21] | Liu P, Tang X M, Gong C F, et al. Manganese tolerance and accumulation in six Mn hyperaccumulators or accumulators[J]. Plant and Soil, 2010, 335(12) : 385–395. |
| [22] | Denise R F, Ian E W, Alan J, et al. Plant homeostasis of foliar manganese sinks:Specific variation in hyperaccumulators[J]. Planta, 2012, 236(5) : 1459–1470. DOI:10.1007/s00425-012-1699-6 |
| [23] | Ding Y Z, Song Z G, Feng R W, et al. Interaction of organic acids and pH on multi-heavy metal extraction from alkaline and acid mine soils[J]. International Journal of Environmental Science and Technology, 2014, 11(1) : 33–42. DOI:10.1007/s13762-013-0433-7 |
| [24] | Cook R L, Hesterberg D. Comparison of trees and grasses for rhizoremediation of petroleum hydrocarbons[J]. International Journal of Phytoremediation, 2013, 15(9) : 844–860. DOI:10.1080/15226514.2012.760518 |
| [25] | 聂亚平, 王晓维, 万进荣, 等. 几种重金属(Pb、Zn、Cd、Cu)的超富集植物种类及增强植物修复措施研究进展[J]. 生态科学, 2016, 35(2) : 174–182. NIE Ya-ping, WANG Xiao-wei, WAN Jin-rong, et al. Research progress on heavy metal (Pb, Zn, Cd, Cu) hyperaccumulating plants and strengthening measures of phytoremediation[J]. Ecological Science, 2016, 35(2) : 174–182. |
| [26] | 童琳, 唐旭利, 张静, 等. 菌根真菌侵染对植物生物量累积的影响[J]. 生态环境学报, 2014, 23(9) : 1520–1525. TONG Lin, TANG Xu-li, ZHANG Jing, et al. Influence of mycorrhizal colonization on plant biomass accumulation[J]. Ecology and Environmental Sciences, 2014, 23(9) : 1520–1525. |
| [27] | 杨亚宁, 巴雷, 白晓楠, 等. 一种改进的丛枝菌根染色方法[J]. 生态学报, 2010, 30(3) : 774–779. YANG Ya-ning, BA Lei, BAI Xiao-nan, et al. An improved method to stain arbuscular mycorrhizal fungi in plant roots[J]. Acta Ecologica Sinica, 2010, 30(3) : 774–779. |
| [28] | 雷鸣, 廖柏寒, 秦普丰. 土壤重金属化学形态的生物可利用性评价[J]. 生态环境, 2007, 16(5) : 1551–1556. LEI Ming, LIAO Bo-han, QIN Pu-feng. Assessment of bioavailability of heavy metal in contaminated soils with chemical fractionation[J]. Ecology and Environment, 2007, 16(5) : 1551–1556. |
| [29] | Nemati K, Abu Bakar N K, Abas M R. Investigation of heavy metals mobility in shrimp aquaculture sludge-comparison of two sequential extraction procedures[J]. Microchemical Journal, 2009, 91(2) : 227–231. DOI:10.1016/j.microc.2008.12.001 |
| [30] | 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2008. BAO Shi-dan. Agricultural chemical analysis of soil[M]. Beijing: Agriculture Scientech Press, 2008. |
| [31] | Sudová R, Jurkiewicz A, Turnau K, et al. Persistence of heavy metal tolerance of the arbuscular mycorrhizal fungus Glomus intraradices under different cultivation regimes[J]. Symbiosis, 2007, 43(2) : 71–81. |
| [32] | Turnau K, Kottke I, Dexheimer J. Toxic element filtering in Rhizopogon roseolus/Pinus sylvestris mycorrhizas collected from calamine dumps[J]. Mycological Research, 1996, 100 : 16–22. DOI:10.1016/S0953-7562(96)80094-3 |
| [33] | Zhang X F, Gao B, Xia H P. Effect of cadmium on growth, photosynthesis, mineral nutrition and metal accumulation of bana grass and vetiver grass[J]. Ecotoxicology and Environmental Safety, 2014, 106 : 102–108. DOI:10.1016/j.ecoenv.2014.04.025 |
| [34] | Zhang X F, Zhang X H, Gao B. Effect of cadmium on growth, photosynthesis, mineral nutrition and metal accumulation of an energy crop, king grass (Pennisetum americanum×P.purpureum)[J]. Biomass and Bioenergy, 2014, 67 : 179–187. DOI:10.1016/j.biombioe.2014.04.030 |
| [35] | 郭观林, 周启星. 污染黑土中重金属的形态分布与生物活性研究[J]. 环境化学, 2005, 4(7) : 384–387. GUO Guan-lin, ZHOU Qi-xing. Speciation distribution and bioactivity of heavy metals in contaminated phaiozem[J]. Environmental Chemistry, 2005, 4(7) : 384–387. |
| [36] | Cornejo P, Pérez-Tienda J, Meier S, et al. Copper compartmentalization in spores as a survival strategy of arbuscular mycorrhizal fungi in Cu-polluted environments[J]. Soil Biology & Biochemistry, 2013, 57 : 925–928. |
| [37] | Wu Z, McGrouther K, Huang J, et al. Decomposition ion and the contribution of glomalin-related soil protein (GRSP) in heavy metal sequestration:Field experiment[J]. Soil Biology & Biochemistry, 2014, 68 : 283–290. |
| [38] | 吴曼, 徐明岗, 徐绍辉, 等. 有机质对红壤和黑土中外源铅镉稳定化过程的影响[J]. 农业环境科学学报, 2011, 30(3) : 461–467. WU Man, XU Ming-gang, XU Shao-hui, et al. Effects of organic matter on the stabilization process of added cadmium and lead in red soil and black soil[J]. Journal of Agro-Environment Science, 2011, 30(3) : 461–467. |
| [39] | 岳英男, 杨春雪. 松嫩盐碱草地土壤理化特性与丛枝菌根真菌侵染的相关性[J]. 草业科学, 2014, 31(8) : 1437–1444. YUE Ying-nan, YANG Chun-xue. Relationship between soil properties and the colonization of arbuscular mycorrhizae in Songnen Saline-alkaline Grassland[J]. Pratacultural Science, 2014, 31(8) : 1437–1444. |
| [40] | 姜薇.重金属污染物在红壤中迁移规律及修复技术研究[D].武汉:华中科技大学, 2012. JIANG Wei. A dissertation submitted in partial fulfillment of the requirements for the degree of doctor of biochemistry and molecular biology[D]. Wuhan:Huazhong University of Science and Technology, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10487-1013014550.htm |
| [41] | Lenoir I, Fontaine J, Lounès-Hadj A, et al. Arbuscular mycorrhizal fungal responses to abiotic stresses:A review[J]. Phytochemistry, 2016, 123 : 4–15. DOI:10.1016/j.phytochem.2016.01.002 |
| [42] | Hildebrandt U, Regvar M, Bothe H. Arbuscular mycorrhiza and heavy metal tolerance[J]. Phytochemistry, 2007, 68 : 139–146. DOI:10.1016/j.phytochem.2006.09.023 |
| [43] | 张中峰, 张金池, 黄玉清, 等. 丛枝菌根真菌对植物耐旱性的影响研究进展[J]. 生态学杂志, 2013, 32(6) : 1607–1612. ZHANG Zhong-feng, ZHANG Jin-chi, HUANG Yu-qing, et al. Effects of arbuscular mycorrhizal fungi on plant drought tolerance:Research progress[J]. Chinese Journal of Ecology, 2013, 32(6) : 1607–1612. |
| [44] | 师长海, 李玉欣, 董宝娣, 等. 盆栽用土量对玉米生长发育的影响[J]. 西北农业学报, 2010, 19(5) : 71–75. SHI Chang-hai, LI Yu-xin, DONG Bao-di, et al. Effect of pot soil weight on the development and growth of maize[J]. Agriculture Borealio-ccidentalis Sinica, 2010, 19(5) : 71–75. |
| [45] | 黄晶, 凌婉婷, 孙艳媂, 等. 丛枝菌根真菌对紫花苜蓿吸收土壤中镉和锌的影响[J]. 农业环境科学学报, 2012, 31(1) : 99–105. HUANG Jing, LING Wan-ting, SUN Yan-di, et al. Impacts of arbuscular mycorrhizal fungi inoculation on the uptake of cadmium and zinc by alfalfa in contaminated soil[J]. Journal of Agro-Environment Science, 2012, 31(1) : 99–105. |
 2016, Vol. 35
2016, Vol. 35