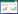文章信息
- 王莉, 陈晓明, 肖伟, 张祥辉, 罗学刚
- WANG Li, CHEN Xiao-ming, XIAO Wei, ZHANG Xiang-hui, LUO Xue-gang
- 氧化亚铁硫杆菌(Thiobacillus ferrooxidans)对重金属富集植物腐蚀作用研究
- The corrosive effects of Thiobacillus ferrooxidans on heavy metal-enriched plant
- 农业环境科学学报, 2016, 35(12): 2420-2430
- Journal of Agro-Environment Science, 2016, 35(12): 2420-2430
- http://dx.doi.org/10.11654/jaes.2016-0826
文章历史
- 收稿日期: 2016-06-20
2. 西南科技大学核废物与环境安全国防重点实验室, 四川 绵阳 621010
2. State Defense Key Laboratory of the Nuclear Waste and Enviromental Security, Southwest University of Science and Technology, Mianyang 621010, China
随着经济的发展,重金属污染日趋严重。植物修复技术以其成本低廉、对环境干扰小等优点成为当前环境科学和污染生态学等领域的研究热点[1-7]。但是,该技术在处理环境问题的同时会产生大量的重金属富集生物质,一旦处理不当,重金属很可能重新释放到环境中造成“二次污染”[1]。目前对重金属富集生物质的资源化利用仍存在高成本和低效率等问题,其中原料预处理技术的不成熟成为了限制其资源化利用的瓶颈之一。
生物质预处理方法可以大体上分为物理法、物理-化学法、化学法和生物法4大类[8-10]。前三类中应用较多的包括酸碱预处理技术、离子液体预处理技术、臭氧预处理技术等[11-14],虽然能够脱除生物质中大量的纤维素、半纤维素和木质素,具有一定的研究价值,但其主要受限于两点:一是对反应温度要求较高,二是需要较高的合成和制备成本。而微生物法预处理技术[15-16]具有作用条件温和、能耗低、处理成本少等优点,成为生物质预处理的一个重要发展方向和研究热点。近年来,微生物法预处理技术研究领域对白腐菌、软腐菌等产酶真菌研究较多[16],而对细菌的研究却鲜见。
半纤维素和纤维素对酸、碱溶液及氧化剂较敏感,在适当的氢离子浓度、氧化条件和温度作用下化学结构能够被破坏。氧化亚铁硫杆菌属专性化能自养菌,能够通过氧化底物添加剂(Fe2+、S0、S2-等)获得生长、扩增所需的能量,同时产生硫酸及其他代谢产物,已广泛应用于金属和土壤的腐蚀作用、污泥重金属生物淋滤和其他重金属回收利用的研究中,但在生物质方面的应用极少[17-20]。与现有微生物法预处理技术不同,试验以重金属富集植物黑麦草为材料,利用氧化亚铁硫杆菌破坏黑麦草结构,通过投入底物添加剂加速反应,提高黑麦草中纤维素的降解效率并分析最佳腐蚀条件下重金属的浸出情况。该研究对于黑麦草中重金属的进一步回收及固体废弃物的资源化利用具有重要意义。
1 材料与方法 1.1 菌种氧化亚铁硫杆菌(Thiobacillus ferrooxidans,ATCC 53990),购于中国微生物菌种中心。
1.2 黑麦草预处理黑麦草(Lolium perenne)是我国各地常见的优质牧草,具有生长速度快、生物量大、可多次刈割等优点,在重金属植物修复、水土保持等方面具有较大优势[3-7, 21-22]。本试验黑麦草采用土培盆栽方式种于西南科技大学国防重点实验室温室,待种子发芽后52 d,株高约30 cm,植株处于旺盛生长期时收获,经过清水去除泥土等杂质,截取其地上部分,105 ℃条件下干燥30 min,65 ℃烘干至恒重,最后利用植物粉碎机(RT-02A)将其粉碎后备用。黑麦草中初始成分如表 1所示。
种子液按照10%的接种量接入9K培养基,于140 r·min-1、30 ℃条件下振荡培养3 d,再按照1%、3%、5%、10%、15%的接种量分别培养3 d,并按照固液比1:30加入黑麦草,30 ℃条件下培养,分别在2、4、6、8、10 d反应后取样分析,每个处理组重复三次,其中以9K培养基为对照组。9K培养基配方如下:
A液:(NH4)2SO4 3.0 g,K2HPO4 0.5 g,KCl 0.1 g,MgSO4·7H2O 0.5 g,Ca(NO3)2 0.01 g,去离子水800 mL,pH2.0,121 ℃高压灭菌30 min。B液:FeSO4·7H2O 44.78 g,去离子水200 mL,pH2.0,0.22 μm的微孔滤膜过滤除菌。将灭菌后的A液与B液混匀。
1.3.2 底物添加剂对腐蚀作用的影响取5组250 mL锥形瓶,每组25个,按照固液比1:30加入黑麦草和10%氧化亚铁硫杆菌。然后分别添加不同浓度的5组底物添加剂(S0、Na2S2O3、FeSO4、FeS、Fe0),每组浓度分别为2.0、4.0、6. 0、10. 0、14.0 g·L-1,30 ℃条件下培养,在2、4、6、8、10 d反应后取样分析。每个处理组重复三次,其中以9K培养基为对照组1,以只含相应的底物添加剂为对照组2,以10%氧化亚铁硫杆菌为对照组3。
1.4 样品分析方法 1.4.1 含量分析纤维素、半纤维素、木质素含量分析:从第2 d起每隔1 d取样并离心(8000 r·min-1,15 min)后,上清液采用玻璃电极法测定其pH值,过滤弃其上清液,将剩余固体水洗3次,75 ℃烘干至恒重,称重,并分析其成分变化。样品中纤维素含量采用蒽酮比色法测定[23],半纤维素含量采用DNS比色法测定[23],木质素含量采用乙酰溴比色法测定[24]。纤维素、半纤维素、木质素降解率计算公式如下:
纤维素降解率=(样品初始纤维素含量×样品质量-处理后样品纤维素含量×处理后样品质量)/(样品初始纤维素含量×样品质量)×100%
将上述公式的纤维素含量换成半纤维素含量或木质素含量,其他不变,计算出半纤维素和木质素的降解率。
1.4.2 腐蚀前后形貌及重金属分析黑麦草样品采用日本电子光学公司JSM-5600LV型扫描电镜(SEM)对腐蚀前后的表面形貌进行分析,利用电感耦合等离子体质谱仪(ICP-MS)测定样品中重金属含量。
1.4.3 数据统计方法运用SPSS 22.0和Oringe 8.5软件对测定数据进行统计分析,图中数据为3次重复的平均值±标准差(SE),并采用单因素方差分析(One-way ANOVA)和最小显著差异法(LSD)比较不同数据组间的差异。
2 结果与讨论 2.1 氧化亚铁硫杆菌接种量对黑麦草腐蚀作用的影响以9K培养基为对照组,分析并研究了氧化亚铁硫杆菌接种量对黑麦草腐蚀作用的影响,结果如图 1所示。由图 1A可以看出,氧化亚铁硫杆菌在腐蚀过程中pH值先上升至2.2再逐步下降,最后稳定在1.37,主要原因为起初Fe2+被氧化亚铁硫杆菌氧化而消耗酸,导致pH值上升,之后Fe3+水解产生酸, 致使pH值下降。同时可以看出,不同接种量的pH值变化情况相似,此研究结果与Wen等[25]和Gan等[26]的相似;对照组中pH值的变化可能是腐蚀过程中产生的一些有机化合物所导致。图 1B、图 1C表明,随着时间的推移,各处理组和对照组中黑麦草的纤维素、半纤维素降解率逐渐增加,且各处理组的结果明显大于对照组,而5%~15%接种量各处理组之间差异较小。图 1D显示各处理组的木质素降解率均略大于对照组,但差异不显著(P > 0.05),且各处理组之间差异较小。
|
|
图 1
氧化亚铁硫杆菌不同接种量对黑麦草腐蚀作用的影响
Figure 1
The effects of corrosion behavior of ryegrass under different inoculation amount of Thiobacillus ferrooxidans
相同字母表示不同接种量各处理组之间在0.05水平上差异不显著(P > 0.05)
The same small letters indicates no significant difference among different treatments in inoculation amount of Thiobacillus ferrooxidans at 0.05 level |
通过综合分析可知,10%接种量效果最佳,反应第10 d,其纤维素降解率达40.97%,半纤维素降解率达77.49%,木质素降解率达19.33%。
研究结果表明,氧化亚铁硫杆菌对黑麦草具有较好的腐蚀作用,且10%接种量效果最佳,因而选择以10%接种量的氧化亚铁硫杆菌进行下一步研究。
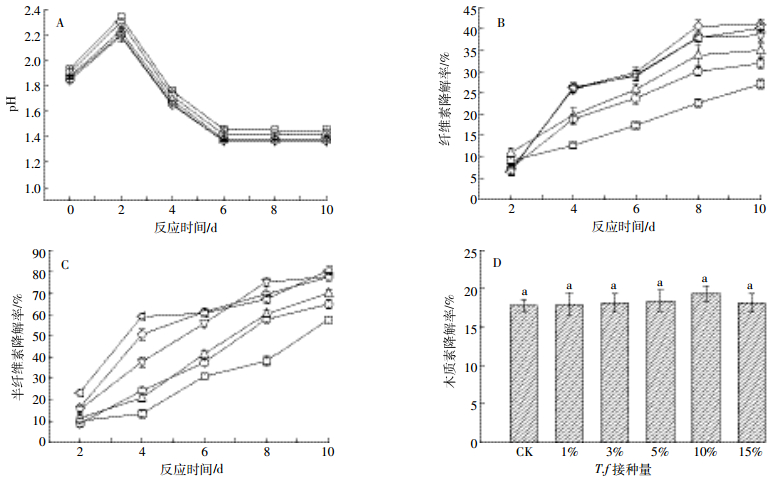
2.2 底物添加剂对腐蚀过程中pH值的影响以10%氧化亚铁硫杆菌为对照组,分析其在加入5种底物添加剂后对腐蚀过程中pH值的影响,结果如图 2所示。
|
| 图 2 5种底物添加剂对氧化亚铁硫杆菌pH值的影响 Figure 2 The effects of pH of Thiobacillus ferrooxidans under five kinds of substrates |
加入底物添加剂后,随着腐蚀的进行,除硫化亚铁和单质铁外,其他各处理组的pH值总体呈逐步下降趋势,其中单质硫pH值下降幅度最大。反应第2 d,所有处理组pH值均小于对照组;到第4 d,硫化亚铁与单质铁各处理组的pH值开始迅速上升,且浓度较高时其pH值也较高,经分析推测,这与溶液中生成H2S和S2-在短时间内的不完全氧化有关;到第10 d,因单质硫被氧化成硫酸,单质硫各处理组的pH值均下降至1.0左右。此研究结果与张军等[27]和陈丽璇等[28]的相似。由于硫代硫酸钠为强酸弱碱性盐,当浓度较高(大于6 g·L-1)时水解产生OH-的速率大于酸化速率,致使pH值高于对照组。硫酸亚铁各处理组的pH值与对照组相差不大。
综上分析,单质硫致酸效果最佳,而硫化亚铁、单质铁的致酸效果较差。此结果有利于进一步探究pH值是否会影响纤维素、半纤维素、木质素的降解效率。
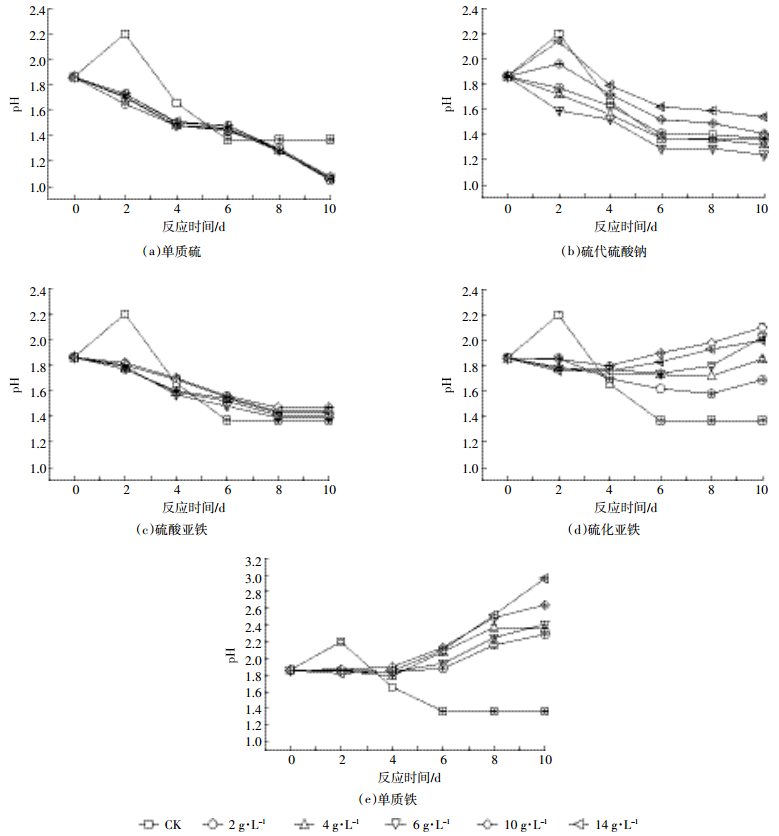
2.3 底物添加剂对黑麦草中纤维素的影响以9K培养基作为对照组1,分别以只含相应的底物添加剂为对照组2(由于9K培养基中投加不同浓度的同一种底物对黑麦草的成分影响几乎一致,本文只给出浓度为2 g·L-1时的结果),以10%氧化亚铁硫杆菌为对照组3,探究5种底物添加剂对黑麦草中纤维素的影响,结果见图 3。
|
| 图 3 5种底物添加剂对黑麦草中纤维素的影响 Figure 3 The effects of content of cellulose in ryegrass under five kinds of substrates |
与3个对照组相比,投加底物添加剂后,黑麦草中纤维素的降解率均有明显提高(P < 0.05)。投加单质硫的氧化亚铁硫杆菌处理组中,浓度对纤维素降解率有一定影响,高浓度时作用效果较好,反应第10 d,浓度为14 g·L-1时,纤维素降解率最大达81.31%,而硫代硫酸钠和硫酸亚铁在低浓度时作用效果较好。投加硫化亚铁和单质铁后浓度对纤维素降解率的影响随着时间的推移逐渐缩小,两种添加剂降解效果均较好。
由于氧化亚铁硫杆菌能够通过氧化底物添加剂(Fe2+、S0、S2-等)促进自身代谢作用,投入的5种底物添加剂均能明显提高黑麦草中纤维素的降解率。反应10 d后,浓度为4 g·L-1的硫化亚铁处理组纤维素降解率最大,达87.26%,比对照组1提高了223.07%,比对照组2提高了175.53%,比对照组3提高了112.99%。Pia-Maria等[29]和Ballesteros等[30]用0.2% H2SO4(200 ℃,10 min)和0.15% H2SO4(154.5 ℃,10 min)处理稻草秸秆,纤维素脱除率分别仅为78%和70%。Oberoi等[31]和Jin-Woo等[32]分别用NaOH和氨水在高温条件下处理稻草,其纤维素脱除率为50%和5%,远低于本试验结果。此外,Sathitsuksanoh等[33]研究发现[BMIM]Cl离子液体(110 ℃,72 h)能够脱除玉米秸秆中92%的纤维素,但成本较高;Davinia等[34]的研究中白腐菌(I. lacteus)经过长达21 d的反应仅能降解小麦秸秆中47%的纤维素。
根据2.2节中对pH值的研究结果,硫化亚铁处理组致酸效果较差,说明酸性的强弱并不是影响纤维素结构破坏的唯一因素,这可能与氧化亚铁硫杆菌的氧化作用或其他因素有关。Antonopoulou等[35]也证实了该结论,其利用不同pH值(5.89、1.89、1.19)的H2SO4处理向日葵秸秆,结果发现随着pH值的降低,向日葵秸秆中半纤维素脱除率逐渐增大,但纤维素的脱除率与对照组并没有明显差异,且pH值最低时,纤维素脱除率并非最高。
2.4 底物添加剂对黑麦草中半纤维素的影响采用与2.3节相同的分析方法,探究5种底物添加剂对黑麦草中半纤维素的影响,结果如图 4所示。
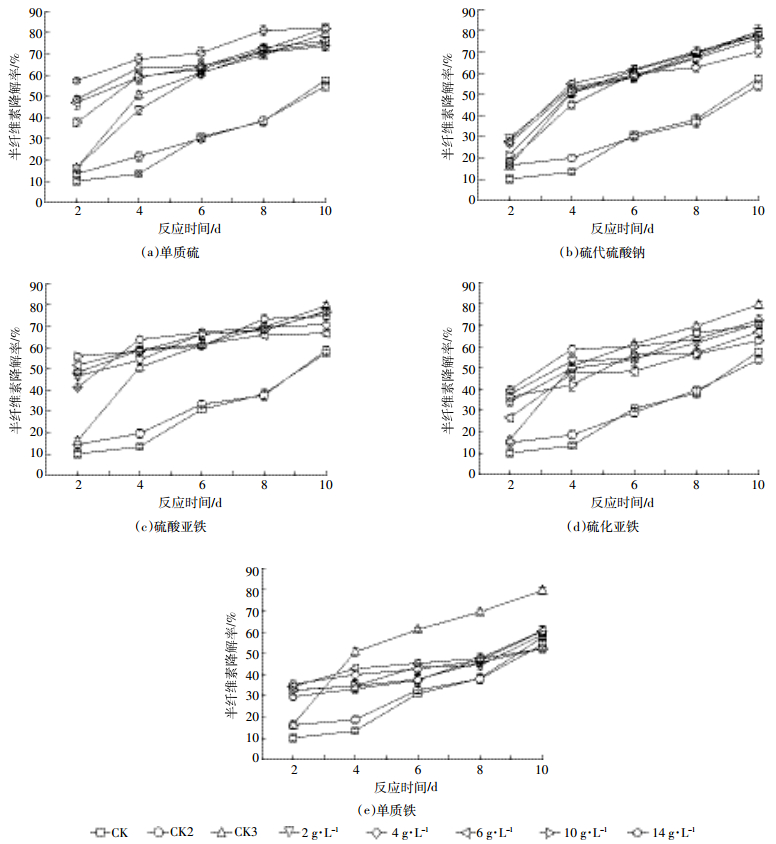
|
| 图 4 5种底物添加剂对黑麦草中半纤维素的影响 Figure 4 The effects of content of hemicellulose in ryegrass under five kinds of substrates |
反应10 d后,相比对照组1和2,除硫化亚铁与单质铁外,其他3种底物添加剂均能显著提高半纤维素降解率(P < 0.05)。相比对照组3,5种底物添加剂中仅单质硫(10 g·L-1和14 g·L-1)和硫代硫酸钠(2 g·L-1)能提高半纤维素降解率。结合2.2节中对pH值的研究结果发现,投加14 g·L-1单质硫的致酸效果最佳,同时其对半纤维素降解率最大,高达82.29%,而投加单质铁的致酸效果较差,其对半纤维素的降解效果也较差。由此说明,半纤维素结构的破坏程度受pH值的影响较大。该研究结果与Guo等[36]和Antonopoulou等[35]的研究结果相符。
氧化亚铁硫杆菌能够充分利用致酸效果较好的底物添加剂对黑麦草进行腐蚀,提高半纤维素降解率,其中降解率最高可达82.29%。Lee等[37]利用15%草酸(168 ℃,26 min)仅能脱除玉米秸秆中75.74%的半纤维素;García-Cubero等[38]和Agudelo等[39]分别采用臭氧和蒸汽爆破技术处理黑麦秸秆,半纤维素的脱除率仅为50%和52%。与前人相比,本试验方法优于一般的生物质预处理技术,能够对半纤维素进行更有效的去除。
2.5 底物添加剂对黑麦草中木质素的影响由图 5可以看出,相比3个对照组,除硫代硫酸钠效果较差外,其余4种底物添加剂均能在一定程度上提高木质素降解率,同一底物的不同浓度之间差异较小(P > 0.05)。5种底物添加剂中,6 g·L-1硫化亚铁处理组中木质素降解率最大,达27.68%,比对照组1提高了55.24%,比对照组2提高了48.90%,比对照组3提高了43.20%。该结果表明氧化亚铁硫杆菌对木质素降解率并不高,与Song等[40]研究结果相似,其主要原因为木质素具有芳香性高聚物的特性,结构非常稳定,在一般的酸碱条件下很难被破坏。Davinia等[34]发现白腐菌(P. tigrinus)经过21 d的反应能够降解小麦秸秆中47%的木质素,Ravichandra等[41]和Rouches等[42]研究结果同样表明白腐菌能够对木质素进行很好的降解。由于腐蚀后的黑麦草中纤维素和半纤维素的降解导致了木质素的暴露。因此,在将来的研究中,可以考虑从白腐菌、褐腐菌、软腐菌等产酶真菌中挑选出对木质素有较好破坏能力的微生物,对腐蚀后的黑麦草进行进一步降解[43]。
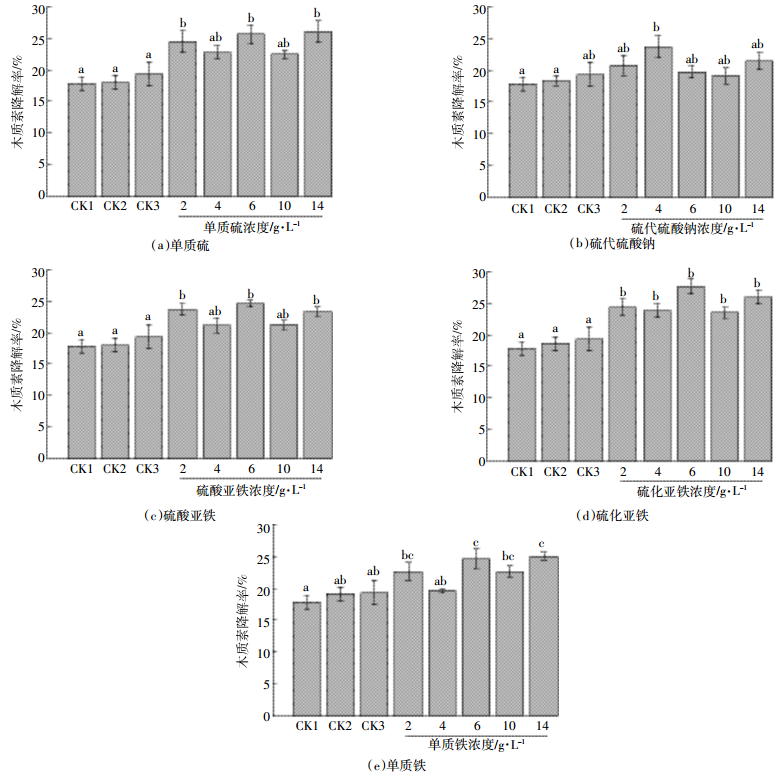
|
| 图 5 5种底物添加剂对黑麦草中木质素的影响 Figure 5 The effects of content of lignin in ryegrass under five kinds of substrates 不同字母表示在同一底物不同处理浓度之间差异显著(P < 0.05) The different small letters indicate significant differences among different concentrations in same substrates treatments at 0.05 level |
为了进一步了解氧化亚铁硫杆菌腐蚀黑麦草过程中黑麦草内部形态学的变化,本研究对腐蚀前后的黑麦草进行了SEM观察,结果如图 6所示。腐蚀前,黑麦草细胞壁由致密的层状结构组成,有较为明显的纹路(表面沾染少许碎片,对观察结果存在一定影响)。经氧化亚铁硫杆菌腐蚀后,黑麦草细胞壁结构疏松多孔,形成大小不等的缺口,一些基本的植物组分(表皮和维管束等结构)也发生了变化,最初连接的组织遭到破坏,可能与氧化亚铁硫杆菌产酸作用和其氧化作用造成细胞壁中纤维素、半纤维素、木质素结构破坏有较大关系。此结果与Antonopoulou等[35]和Martins[44]等利用化学和真菌处理向日葵秸秆和石炭酸灌木叶的研究结果相似。

|
| 图 6 黑麦草经氧化亚铁硫杆菌腐蚀前后SEM图片 Figure 6 SEM pictures of ryegrass before and after corrosion in Thiobacillus ferrooxidans |
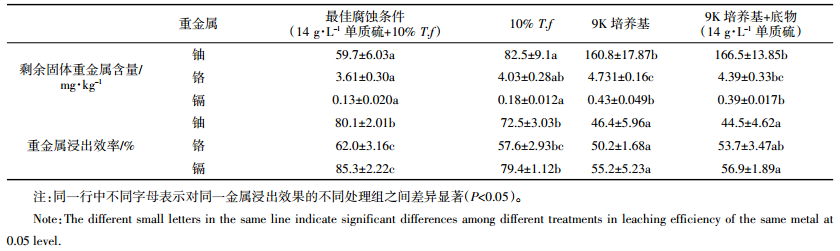
通过上述研究可知,14 g·L-1的单质硫对黑麦草的腐蚀效果最佳,因而对该条件下重金属铀、铬、镉的浸出情况进行了分析,其浸出效率分别高达80.1%、62%、85.3%(表 2)。由此说明,氧化亚铁硫杆菌不仅在污泥重金属生物淋滤中有很好的应用价值[27-28],而且能有效降低黑麦草中重金属的含量,这将有利于黑麦草中重金属的进一步回收和其固体废弃物的资源化利用。
|
(1)氧化亚铁硫杆菌对黑麦草具有较强的腐蚀作用。投加底物添加剂后,氧化亚铁硫杆菌对纤维素降解率有显著提高(P < 0.05)。总体来看,投加14 g·L-1的单质硫对黑麦草的降解效果较好,该试验方法优于一般的生物质预处理技术。
(2)在氧化亚铁硫杆菌及底物添加剂的作用下,单质硫致酸效果最佳。pH值的降低能有效提高半纤维素降解率,但与纤维素及木质素的降解率无明显关系。
(3)氧化亚铁硫杆菌对黑麦草细胞壁结构有较强破坏作用。
(4)在最优腐蚀条件下,纤维素、半纤维素的降解使得重金属浸出效率较高,有利于黑麦草中重金属的进一步回收及固体废弃物的资源化利用。
本课题的试验方法相比于一般的酸、碱等预处理技术,能显著提高纤维素、半纤维素的降解效率,并可在较低温度下完成,对设备要求低,且经济实惠;相比于真菌预处理技术,本方法能缩短反应周期,提高降解效率,具有较高的应用价值。
| [1] | 刘维涛, 倪均成, 周启星, 等. 重金属富集植物生物质的处置技术研究进展[J]. 农业环境科学学报, 2014, 33(1) : 15–27. LIU Wei-tao, NI Jun-cheng, ZHOU Qi-xing, et al. Research progress of disposal technology for heavy metal-enriched plant biomass[J]. Journal of Agro-Environment Science, 2014, 33(1) : 15–27. |
| [2] | 石福贵, 郝秀珍, 周东美, 等. 鼠李糖脂与EDDS强化黑麦草修复重金属复合污染土壤[J]. 农业环境科学学报, 2009, 28(9) : 1818–1823. SHI Fu-gui, HAO Xiu-zhen, ZHOU Dong-mei, et al. Remediation of the combined polluted soil by growing ryegrass enhanced by EDDS/rhamnolipid[J]. Journal of Agro-Environment Science, 2009, 28(9) : 1818–1823. |
| [3] | 郝希超, 陈晓明, 罗学刚, 等. 不同牧草在铀胁迫下生长及铀富集的比较研究[J]. 核农学报, 2016, 30(3) : 548–555. HAO Xi-chao, CHEN Xiao-ming, LUO Xue-gang, et al. Comparative study on the growth and uranium enrichment in different grasses[J]. Journal of Nuclear Agricultural Sciences, 2016, 30(3) : 548–555. |
| [4] | 阮晨, 陈晓明, 刘小玲, 等. 4种草坪植物成苗期Co (Ⅱ)耐受性综合评价[J]. 核农学报, 2015, 29(4) : 777–785. RUAN Chen, CHEN Xiao-ming, LIU Xiao-ling, et al. Comprehensive evaluation of resistance to Co (Ⅱ) of four kinds of lawn plant in adult stage[J]. Journal of Nuclear Agricultural Sciences, 2015, 29(4) : 777–785. |
| [5] | 荣丽杉, 梁宇, 刘迎九, 等. 5种植物对铀的积累特征差异研究[J]. 环境科学与技术, 2015, 38(11) : 33–36. RONG Li-Shan, LIANG Yu, LIU Ying-jiu, et al. Comparative study of uranium accumulation abilities of five herbs[J]. Environmental Science & Technology, 2015, 38(11) : 33–36. |
| [6] | Zou X L. Phytoextraction of heavy metals from contaminated soil by co-cropping solanum nigrum with ryegrass associated with endophytic bacterium[J]. Separation Science and Technology, 2015, 50(12) : 1806–1813. DOI:10.1080/01496395.2015.1014058 |
| [7] | Zhu T Y, Fu D F, Yang F. Effect of saponin on the phytoextraction of Pb, Cd and Zn from soil using Italian ryegrass[J]. Bulletin of Environmental Contamination and Toxicology, 2015, 94(1) : 129–133. DOI:10.1007/s00128-014-1412-5 |
| [8] | Maurya D P, Singla A, Negi S. An overview of key pretreatment processes for biological conversion of lignocellulosic biomass to bioethanol[J]. 3 Biotech, 2015, 5(5) : 597–609. DOI:10.1007/s13205-015-0279-4 |
| [9] | Srivastava N, Rawat R, Oberoi H S, et al. A review on fuel ethanol production from lignocellulosic biomass[J]. International Journal of Green Energy, 2015, 12(9) : 949–960. DOI:10.1080/15435075.2014.890104 |
| [10] | Chaturvedi V, Verma P. An overview of key pretreatment processes employed for bioconversion of lignocellulosic biomass into biofuels and value added products[J]. 3 Biotech, 2013, 3(5) : 122–130. |
| [11] | Singh J, Suhag M, Dhaka A. Augmented digestion of lignocellulose by steam explosion, acid and alkaline pretreatment methods:A review[J]. Carbohydrate Polymers, 2015, 117C : 624–631. |
| [12] | Travaini R, Martín-Juárez J, Lorenzo-Hernando A, et al. Ozonolysis:An advantageous pretreatment for lignocellulosic biomass revisited[J]. Bioresource Technology, 2016, 199 : 2–12. DOI:10.1016/j.biortech.2015.08.143 |
| [13] | Zheng Y, Zhou J, Xu F Q, et al. Pretreatment of lignocellulosic biomass for enhanced biogas production[J]. Progress in Energy and Combustion Science, 2014, 42(1) : 35–53. |
| [14] | Alvira P, Tomás-Pejó E, Ballesteros M, et al. Pretreatment technologies for an efficient bioethanol production process based on enzymatic hydrolysis:A review[J]. Bioresource Technology, 2010, 101(13) : 4851–4861. DOI:10.1016/j.biortech.2009.11.093 |
| [15] | Sindhu R, Binod P, Pandey A. Biological pretreatment of lignocellulosic biomass:An overview[J]. Bioresource Technology, 2016, 199 : 76–82. DOI:10.1016/j.biortech.2015.08.030 |
| [16] | Wan C X, Li Y B. Fungal pretreatment of lignocellulosic biomass[J]. Biotechnology Advances, 2012, 30(6) : 1447–1457. DOI:10.1016/j.biotechadv.2012.03.003 |
| [17] | Wang B, Yuan X Y, Han L, et al. Release and bioavailability of heavy metals in three typical mafic tailings under the action of Bacillus mucilaginosus and Thiobacillus ferrooxidans[J]. Environmental Earth Sciences, 2015, 74(6) : 5087–5096. DOI:10.1007/s12665-015-4521-5 |
| [18] | Vukovic M, Pesic B, Strbac N, et al. Linear polarization study of the corrosion of iron in the presence of Thiobacillus ferrooxidans bacteria[J]. International Journal of Electrochemical Science, 2012, 7(3) : 2487–2503. |
| [19] | Lvanus R C. Bioleaching of metals from electronic scrap by pure and mixed culture of Acidithiobacillus ferrooxidans and Acidithiobacillus thiooxidans[J]. Metalurgia International, 2010, 15(4) : 62–70. |
| [20] | 甘莉, 刘贺琴, 王清萍, 等. 氧化亚铁硫杆菌生物浸出污泥中的重金属离子[J]. 中国环境科学, 2014, 34(10) : 2617–2623. GAN Li, LIU He-qin, WANG Qing-ping, et al. Bioleaching of heavy metals in sewage sludge using Acidithiobacillus ferrooxidans[J]. China Environmental Science, 2014, 34(10) : 2617–2623. |
| [21] | Zalewska M. Response of perennial ryegrass (Lolium perenne) to soil contamination with zinc[J]. Journal of Elementology, 2012, 17(2) : 329–343. |
| [22] | Wang K, Huang H G, Zhu Z Q, et al. Phytoextraction of metals and rhizoremendiation of PAHs in co-contaminated soil by co-planting of Sedum alfredii with ryegrass (Lolium perenne) or castor (Ricinus communis)[J]. International Journal of Phytoremediation, 2013, 15(3) : 283–298. DOI:10.1080/15226514.2012.694501 |
| [23] | 王金主, 王元秀, 李峰, 等. 玉米秸秆中纤维素、半纤维素和木质素的测定[J]. 山东食品发酵, 2010(3) : 44–47. WANG Jin-zhu, WANG Yuan-xiu, LI Feng, et al. Determination of cellulose, hemicellulose and lignin in corn stalk[J]. Shandong Food Fermentation, 2010(3) : 44–47. |
| [24] | 王建庆, 曹佃元, 张玉. 乙酰溴法测定棉籽壳中木质素的含量[J]. 纺织学报, 2013, 34(9) : 12–16. WANG Jian-qing, CAO Tian-yuan, ZHANG Yu. Acetyl bromide test method for determining amount of lignin in cottonseed coat[J]. Journal of Textile Research, 2013, 34(9) : 12–16. |
| [25] | Wen Y, Qing P W, Cai X T, et al. Bioleaching of heavy metals from sewage sludge by Acidithiobacillus thiooxidans:A comparative study[J]. Journal of Soils and Sediments, 2012, 12(6) : 900–908. DOI:10.1007/s11368-012-0520-2 |
| [26] | Gan M, Zi B S, Zhu J Y, et al. Efficient bioleaching of heavy metals from contaminated sediment in batch method coupled with the assistance of heterotrophic microorganisms[J]. Environ Earth Science, 2016, 75(6) : 457–467. DOI:10.1007/s12665-016-5307-0 |
| [27] | 张军, 徐浚洋, 王敦球, 等. 含硫底物种类与浓度对污泥重金属生物沥滤的影响[J]. 环境工程, 2015, 4(9) : 39–57. ZHANG Jun, XU Jun-yang, WANG Dun-qiu, et al. Effects of types and concentrations of sulfur substrate on bioleaching heavy metals from sewage sludge[J]. Environmental Engineering, 2015, 4(9) : 39–57. |
| [28] | 陈丽璇, 陈菲, 蔡晓东, 等. 底物种类和浓度对污泥重金属生物淋滤效果的影响[J]. 亚热带植物科学, 2013, 42(4) : 337–341. CHEN Li-xuan, CHEN Fei, CAI Xiao-Dong, et al. Effects of substrates on bioleaching of heavy metals from sewage sludge[J]. Subtropical Plant Science, 2013, 42(4) : 337–341. |
| [29] | Pia-Maria B, Mats G, Guido Z. Ethanol and biogas production after steam pretreatment of corn stover with or without the addition of sulphuric acid[J]. Biotechnology for Biofuels, 2013, 6(1) : 1–11. DOI:10.1186/1754-6834-6-1 |
| [30] | Ballesteros I, Ballesteros M, Manzanares P, et al. Dilute sulfuric acid pretreatment of cardoon for ethanol production[J]. Biotechnology for Biofuels, 2008, 42(1) : 84–91. |
| [31] | Oberoi H S, Babbar N, Sandhu S K, et al. Ethanol production from alkali-treated rice straw via simultaneous saccharification and fermentation using newly isolated thermotolerant Pichia kudriavzevii HOP-1[J]. Journal of Industrial Microbiology & Biotechnology, 2012, 39(4) : 557–566. |
| [32] | Jin-Woo K, Seob K K, Jin-Suk L, et al. Two-stage pretreatment of rice straw using aqueous ammonia and dilute acid[J]. Bioresource Technology, 2011, 102(19) : 8992–8999. DOI:10.1016/j.biortech.2011.06.068 |
| [33] | Sathitsuksanoh N, Zhu Z G, Zhang Y H. Cellulose solvent-based pretreatment for corn stover and avicel:Concentrated phosphoric acid versus ionic liquid[BMIM]C[J]. Cellulose, 2012, 19(4) : 1161–1172. DOI:10.1007/s10570-012-9719-z |
| [34] | Davinia S, Alicia P, María L A, et al. Fungal pretreatment:An alternative in second-generation ethanol from wheat straw[J]. Bioresource Technology, 2011, 102(16) : 7500–7506. DOI:10.1016/j.biortech.2011.05.027 |
| [35] | Antonopoulou G, Dimitrellos G, Beobide A S, et al. Chemical pretreatment of sunflower straw biomass:The effect on chemical composition and structural changes[J]. Waste and Biomass Valorization, 2015, 6(5) : 733–746. DOI:10.1007/s12649-015-9388-x |
| [36] | Guo P, Mochizuki K, Cheng W, et al. Effects of different pretreatment strategies on corn stalk acidogenic fermentation using a microbial consortium[J]. Bioresource Technology, 2011, 102(16) : 7526–7531. DOI:10.1016/j.biortech.2011.04.083 |
| [37] | Lee J W, Houtman C J, Kim H Y, et al. Scale-up study of oxalic acid pretreatment of agricultural lignocellulosic biomass for the production of bioethanol[J]. Bioresource Technology, 2011, 102(16) : 7451–7456. DOI:10.1016/j.biortech.2011.05.022 |
| [38] | García-Cubero M A, González-Benito G, Indacoechea I, et al. Effect of ozonolysis pretreatment on enzymatic digestibility of wheat and rye straw[J]. Bioresource Technology, 2008, 100(4) : 1608–1613. |
| [39] | Agudelo R A, Garcia-Aparicio M P, Gorgens J F. Steam explosion pretreatment of triticale (×triticosecale wittmack) straw for sugar production[J]. New Biotechnology, 2016, 33(1) : 153–163. DOI:10.1016/j.nbt.2015.10.001 |
| [40] | Song Z L, Gai H Y, Liu X F, et al. Comparison of seven chemical pretreatments of corn straw for improving methane yield by anaerobic digestion[J]. PloS One, 2014, 9(4) : 1–8. |
| [41] | Ravichandra P, Raju B R, Priyanka N, et al. Simultaneous pretreatment and sacchariffication of rice husk by phanerochete chrysosporium for improved production of reducing sugars[J]. Bioresource Technology, 2012, 128C : 113–117. |
| [42] | Rouches E, Zhou J P, Steyer H C. White-rot fungi pretreatment of lignocellulosic biomass for anaerobic digestion:Impact of glucose supplementation[J]. Process Biochemistry, 2016, 51(5) : 555–564. DOI:10.1016/j.procbio.2016.02.010 |
| [43] | 王宏勋, 杜甫佑, 张晓昱. 白腐菌选择性降解秸秆木质纤维素研究[J]. 华中科技大学学报(自然科学版), 2006, 34(3) : 97–100. WANG Hong-xun, DU Fu-you, ZHANG Xiao-yu. Selective degradation of corn straw lignocellulose by white-rot fungi[J]. Huazhong University of Science & Technology (Nature Science Edition), 2006, 34(3) : 97–100. |
| [44] | Martins S, José A T, Solange I M. Solid-state fermentation as a strategy to improve the bioactive compounds recovery from larrea tridentata leaves[J]. Applied Biochemistry and Biotechnology, 2013, 171(5) : 1227–1239. DOI:10.1007/s12010-013-0222-2 |
 2016, Vol. 35
2016, Vol. 35