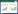文章信息
- 张凤凤, 魏建宏, 罗琳, 张嘉超, 刘玉玲, 唐美珍
- ZHANG Feng-feng, WEI Jian-hong, LUO Lin, ZHANG Jia-chao, LIU Yu-ling, TANG Mei-zhen
- 盐胁迫作用下甲维盐·毒死蜱对小白菜生理生化效应研究
- Effects of combined emamectin benzoate-chlorpyrifos on physiological and biochemical characteristics of non-heading Chinese cabbage under salt stresses
- 农业环境科学学报, 2016, 35(5): 850-857
- Journal of Agro-Environment Science, 2016, 35(5): 850-857
- http://dx.doi.org/10.11654/jaes.2016.05.005
-
文章历史
- 收稿日期: 2015-11-08
2. 湖南农业大学生物科学技术学院, 长沙 410128;
3. 曲阜师范大学南四湖湿地生态与环境保护重点实验室, 山东 曲阜 273165
2. College of Bioscience & Biotechnology, Hunan Agricultural University, Changsha 410128, China;
3. Key Laboratory of Nansihu Lake Wetland Ecosystem & Environment Protection, Qufu Normal University, Qufu 273165, China
盐渍土和土壤次生盐渍化问题出现在世界各地的干旱、半干旱以及半湿润地区,已成为制约土壤生态环境及农业健康发展的一个世界性资源与环境问题[1],引起国内外环境及土壤相关领域学者的广泛关注。Marcum[2]认为,土壤盐分会在耕层大量积聚,高浓度的盐分对植物根系正常的养分吸收及物质交换产生负面影响,因而农作物生长受到严重的抑制,从而造成大面积减产和歉收。盐胁迫下,细胞膜系统的完整性受到破坏,因而抑制植物生长,进而影响其生理健康状况[3]。
在土壤生态系统中,污染源往往多样且复杂,除了盐碱,还有农药等制约因子对作物生长产生胁迫。毒死蜱(Chlorpyrifos,O,O-二乙基-O-3、5、6-三氯-2-吡啶基硫代磷酸酯)作为一种低毒、高效的广谱性有机磷杀虫剂,其复配农药40%甲维盐·毒死蜱不仅能够替代大部分高毒杀虫剂,而且降低生产成本,被大量使用[4]。毒死蜱施入农田后可有效控制作物虫害的发生,同时也易被土壤吸附,消解作用缓慢[5]。正常量农药的使用对病虫害有防治作用,表面上对农作物没有伤害,但其生理指标却发生了明显的变化[6, 7]。已有研究表明,毒死蜱胁迫可显著影响植物的生长及其生理生化过程,如毒死蜱可降低干旱条件下小麦的相对含水量、叶绿素含量[8]、丙二醛含量[9]和青菜植株中可溶性糖含量[10],以及番木瓜幼苗的根系活力等[11]。甲维盐和毒死蜱按不同配比复配后,虽有研究表明其药效增强,可以减少害虫对单一药剂的抗药性风险[12],具有较大的社会效益和经济效益,但其代谢产物3,5,6-三氯吡啶-2-酚(3,5,6-trichloro-2-pyridinol,TCP)具有较强的极性和水溶性,不仅会对环境产生潜在的威胁,也会对植物内部生理代谢产生复合作用。虽然不少学者研究了有关毒死蜱对作物的生理危害,但其复配后对作物的生理影响尚未进行过多探索,尤其缺少在北方盐碱地条件下的研究。在有大面积盐碱地的北方,研究盐胁迫下复配农药甲维盐·毒死蜱对小白菜生理的影响,通过其生理指标(如叶绿素、还原性糖等)的含量来反映盐胁迫与复合农药对作物生长的影响,对盐碱地区域蔬菜种植中农药的合理使用具有重要的指导意义。
1 材料与方法 1.1 供试农药与小白菜40%甲维盐·毒死蜱由成都新朝阳生物化学有限公司生产;小白菜(Brassica campestris L. ssp. chinensis Makino)种子选用永安蔬菜良种繁育中心培育的原种“上海青”,购于苏州寒山种业有限公司。
1.2 供试土壤供试土壤为棕壤,采自曲阜师范大学农场菜地,取0~20 cm表层土,自然风干并剔除石块和植物残体后,磨碎过筛(孔径=1 mm)备用。土样的理化性质[4]见表 1。
盐(NaCl,分析纯)浓度设3个处理水平(干土重):0.3%、0.6%、1.2%,分别表示为A1、 A2、 A3。土壤中盐浓度设定的依据为:根据我国土壤盐渍化标准,土壤含盐总量(干土重)<0.3%,为非盐渍土;土壤含盐总量(干土重)=0.5%~1.0%,为中盐渍土;土壤含盐总量(干土重)=1.0%~2.2%,为强盐渍土[4]。
40%甲维盐·毒死蜱水乳剂是甲维盐与毒死蜱按一定比例的混配农药,其有效成分为甲氨基阿维菌素苯甲酸盐0.5%、毒死蜱39.5%[4]。土壤中甲维盐·毒死蜱的有效浓度设 3 个处理水平:2.5、5.0、10.0 mg·kg-1,分别表示为B1、B2、B3。土壤中甲维盐·毒死蜱浓度设定的依据为:甲维盐·毒死蜱的农药残留田间施药量分为低剂量450 g·hm-2、高剂量675 g·hm-2,农药施用农田后初始浸润土壤深度为0.3~0.4 cm[13],甲维盐·毒死蜱低剂量施用时在土壤中的降解半衰期为5.3 d[14]。
盐和甲维盐·毒死蜱复合污染土样处理采用有交互作用的正交表L9(34)设计安排实验[14, 15],正交实验表及实验结果记录见表 2。同时设空白对照。每个处理做三个平行,分别将风干土3 kg置于5 L塑料盆中,每盆播种20粒左右小白菜种子,在日光温室中培养,控制其含水量为田间持水量的75%±5%,小白菜的萌发率在85%~90%之间,每盆有17~18株小白菜,待小白菜长至三叶后喷洒农药及进行盐胁迫。甲维盐·毒死蜱一次性喷洒,喷洒量为50 mL;盐溶液(约500 mL)均匀浇入盆中,并在花盆下面放置一个塑料小盘,使下渗的溶液得以保留,对照组则浇入自来水(加盐溶液前几天喷水少许,有利于盐分在干燥土壤中迅速扩散)。培养期间进行适当的管护,防病虫害,保证土壤水分充足,使之不会成为植物生长的限制因子。于处理后第5、10、15、25、35 d分别取不同处理下小白菜的叶片,依次用自来水、超纯水冲洗干净后测定小白菜中叶绿素、还原性糖、可溶性蛋白及纤维素的含量。
 |
叶绿素用80%的丙酮提取后分光光度计法测定[16];还原性糖用斐林试剂比色法测定;可溶性蛋白用紫外吸收分光光度法测定;纤维素用处理前后差值法计算[16]。
1.5 数据分析实验数据为3次平行处理的平均值,采用Excel和SPSS 17.0进行统计处理,采用Duncan′s新复极差测验法进行方差分析并绘制残差图。
2 结果与讨论 2.1 甲维盐·毒死蜱对盐胁迫下小白菜幼苗生长的影响40%的甲维盐·毒死蜱和NaCl分别作用及其复合污染对小白菜生长的影响如表 2所示。在盐胁迫下,施加的农药浓度越高对幼苗生长的毒害作用越大。处理后第5 d,小白菜生长状况开始发生变化,逐渐有发黄叶片产生;随着处理时间的延长,其生长状况变化更为显著,发黄叶片增多、叶片脱落、植株矮小等;到第35 d时,其多数叶片已脱落,部分植株已枯死,表明盐胁迫和甲维盐·毒死蜱的共同作用严重影响了小白菜的生长。将小白菜的生长状况划分为好、较好、一般、较差和差五个等级,不同时间下各处理小白菜的生长状况等级见表 2。
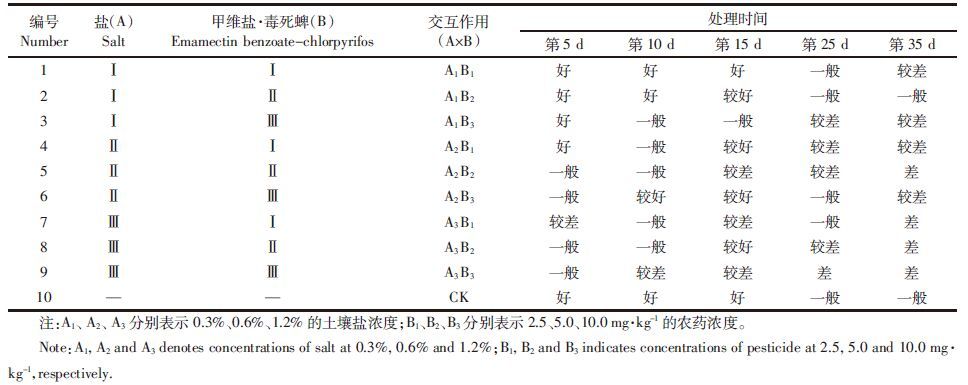
2.2 盐胁迫下甲维盐·毒死蜱对小白菜叶片生理生化指标的影响 2.2.1 对叶绿素和还原性糖含量的影响叶绿素含量的多少在一定程度上反映了植物光合作用强度的高低,从而影响植物的生长,叶绿素含量的降低将直接导致生物量下降[17]。从图 1a中可以看出:在盐和农药处理下,随胁迫作用的增大,小白菜叶片的叶绿素含量呈下降趋势。在低浓度盐(0.3%)处理后第5 d,叶绿素含量下降比较平稳,随农药浓度的升高变化不明显,叶绿素含量在短期低盐刺激下略有上升,之后随着盐胁迫强度的增大和胁迫时间的延长而不断下降,最高下降了近64%;随着盐浓度的升高,叶绿素含量降低,至实验结束叶绿素含量基本稳定。总体来看,处理后第5 d叶绿素含量较高,处理后第25 d叶绿素含量变化幅度较大,且随时间的延长和胁迫强度的增大,叶绿素含量逐渐降低。在第25 d,土壤含盐量为1.2%和农药量为0.09 g·m-2时,小白菜叶片叶绿素含量最低;到35 d时叶片已较少,尤其是高浓度盐和高浓度农药的实验组已基本无叶片可取,整体来说叶绿素含量较低,但较第25 d时略有上升,可能是部分农药挥发导致。以上结果表明,在盐和农药交互胁迫下,小白菜中叶绿素含量降低,盐胁迫对叶绿素具有极显著的破坏作用,且盐和农药共同作用对小白菜中叶绿素的破坏作用更大,均导致叶绿素的合成受到严重破坏,引起植株光合能力减弱[18],说明复合污染加速了小白菜的衰老。
|
| 图 1 小白菜叶绿素和还原性糖含量 Figure 1 Content of chlorophyll and reducing sugar in non-heading Chinese cabbage treated with salt and emamectin benzoate-chlorpyrifos mixture |
还原性糖是很多非盐生植物的主要渗透调节剂[19],也是合成其他有机溶质的碳架保护和能量来源,对细胞膜和原生质胶体也有稳定作用,在细胞内无机离子浓度高时起保护酶类的作用[20]。由图 1b可以看出:盐和农药组合为A1B3时,小白菜叶片中还原性糖含量最低,随着盐浓度的不断增大,还原性糖含量呈缓慢上升趋势,随着农药浓度的不断增大,还原性糖含量呈下降趋势;盐和农药组合为A3 B2时,小白菜叶片中还原性糖含量达最大值,较最低值增加了34%。这与高盐胁迫下生长率降低是由叶片中糖浓度增高产生反馈抑制[21, 22]和毒死蜱降低了青菜植株中糖含量的观点一致,说明在高盐渍条件下还原性糖的积累具有重要意义。但随着盐和农药胁迫时间的延长,还原性糖含量不断降低,可能是呼吸作用的增强和光合作用的衰竭所致[23, 24]。
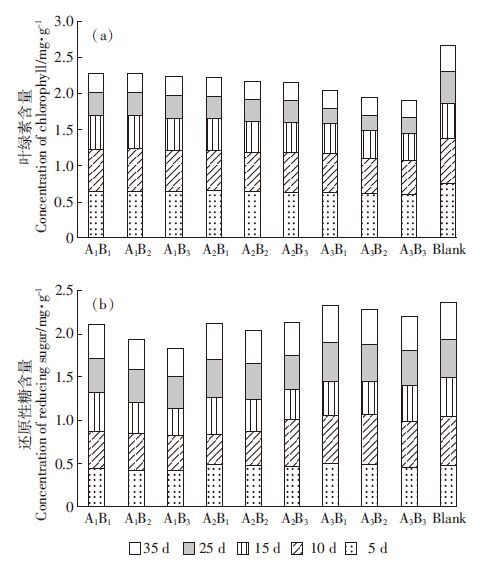
2.2.2 对可溶性蛋白和纤维素含量的影响植物体内的可溶性蛋白质大多数是参与各种代谢的酶类,其含量是植物体总代谢情况的一个重要指标,也是间接测定植物体内代谢强度的一个指标[25]。由图 2a可以看出:处理后第5 d时,在盐浓度一定的情况下,随着农药浓度的升高,小白菜中的蛋白质含量升高;处理后第10 d,盐浓度为0.3%时,随着农药浓度的升高,小白菜中的蛋白质含量降低,盐浓度为0.6%和1.2%时,随着农药浓度的升高,小白菜中的蛋白质含量升高;处理后第15 d和第10 d的变化趋势基本一致,随着处理时间的延长,小白菜中的蛋白质含量均高于对照组,但总体呈下降趋势。在农药浓度一定的情况下,随着盐浓度的升高,蛋白质含量先下降后升高,表明农药对小白菜的蛋白质合成或吸收有所影响。总体来看,在盐和农药胁迫下,小白菜的可溶性蛋白质含量与对照组基本持平,并随胁迫时间的延长而有所降低,表明有机磷农药对小白菜中蛋白质积累有一定的促进作用[26],且盐胁迫后可能产生较多的有害物质,小白菜在逆境条件下需要合成较多的酶类物质以清除这些有害物质。到第25 d后蛋白质含量变化幅度减小,说明农药的残留作用已经较小,只受盐胁迫的影响。
|
| 图 2 小白菜可溶性蛋白及纤维素含量 Figure 2 Concentrations of soluble protein and cellulose in non-heading Chinese cabbage treated with salt and emamectin benzoate-chlorpyrifos mixture |
由图 2b可以看出:在盐浓度一定的情况下,随着农药浓度的升高,小白菜叶片中粗纤维含量有所降低,但影响不大。在农药浓度一定的情况下,随着盐浓度的升高,小白菜叶片中纤维含量随之降低。在盐浓度和农药浓度最高(A3 B3处理)时,小白菜中的纤维素含量降至最低。总体来说,随着胁迫天数的延长,叶片中纤维素的含量有所上升,但仍然低于对照组,说明农药胁迫对叶片中纤维素的含量影响不显著;而随盐胁迫的增强叶片中纤维素含量逐渐降低,则是由盐浓度过高造成植物体内渗透压变化引起的。
2.3 盐胁迫和甲维盐·毒死蜱对小白菜叶片生理生化指标影响的主效应分析 2.3.1 对叶绿素和还原性糖含量的方差分析由表 3可以看出,在单一农药作用下,施药初期,随盐分水平增加,小白菜中叶绿素含量显著降低,表明盐胁迫对叶绿素具有显著的破坏作用;小白菜叶片中还原性糖的含量随农药浓度的升高受影响程度不明显,但仍低于对照组。这说明,盐胁迫对小白菜叶片中还原性糖含量虽有一定的促进作用,但农药胁迫的影响大于盐胁迫。
 |
表 4中F检验结果表明,农药浓度对叶绿素含量有极显著影响,农药与盐交互作用对叶绿素含量影响不显著;盐浓度对还原性糖含量有显著的影响,农药浓度和农药与盐交互作用对还原性糖含量的影响不显著。
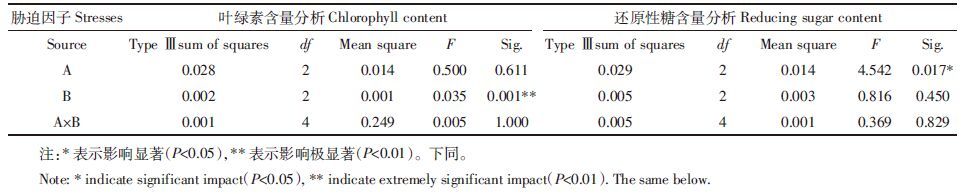 |
由表 5可以看出,在单一农药作用下,随着盐浓度的升高,蛋白质含量先下降后上升,表明农药对小白菜的蛋白质合成或吸收有一定影响。在盐和农药胁迫下,小白菜的可溶性蛋白质含量与对照组基本持平;而随着盐浓度的升高,小白菜叶片中粗纤维含量随之降低,随着胁迫天数的延长,叶片中粗纤维的含量有所上升,但仍然低于对照组。总体来看,农药胁迫对叶片中可溶性蛋白和纤维素的含量没有显著影响。
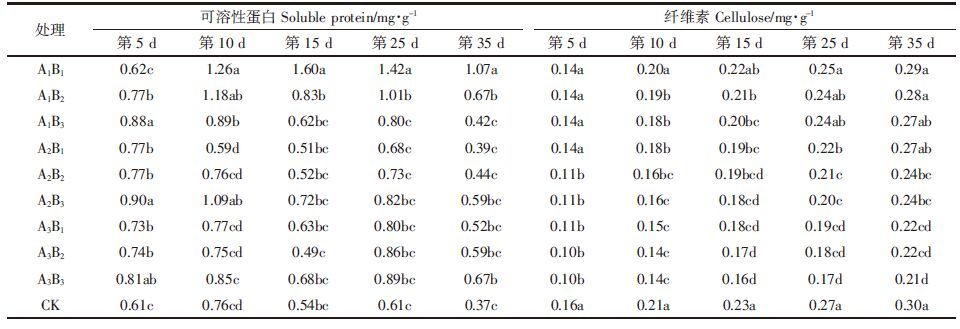 |
表 6中F检验结果表明,盐浓度和农药与盐交互作用均对可溶性蛋白含量有极显著影响,农药浓度对可溶性蛋白含量影响不显著;盐浓度对纤维素含量有显著影响,农药浓度和农药与盐交互作用后对纤维素含量的影响不显著。
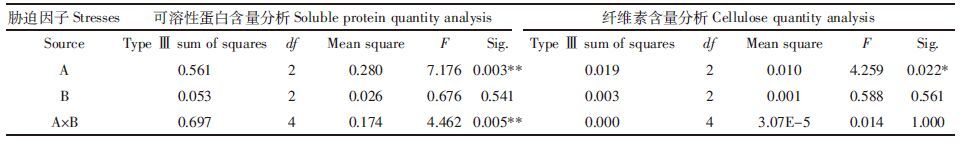 |
由图 3可以看出,盐度对小白菜叶片中还原性糖含量和纤维素含量具有显著影响,并且呈负相关,误差限较小。模型模拟结果与上述结论一致,表明数据准确性与周期性良好;而农药浓度与小白菜叶片中各生理生化指标含量并不呈线性关系,说明随着时间的推移,喷洒的农药有一定的降解,对小白菜的胁迫效应也有所减弱。模型模拟结果亦与上述结论一致。
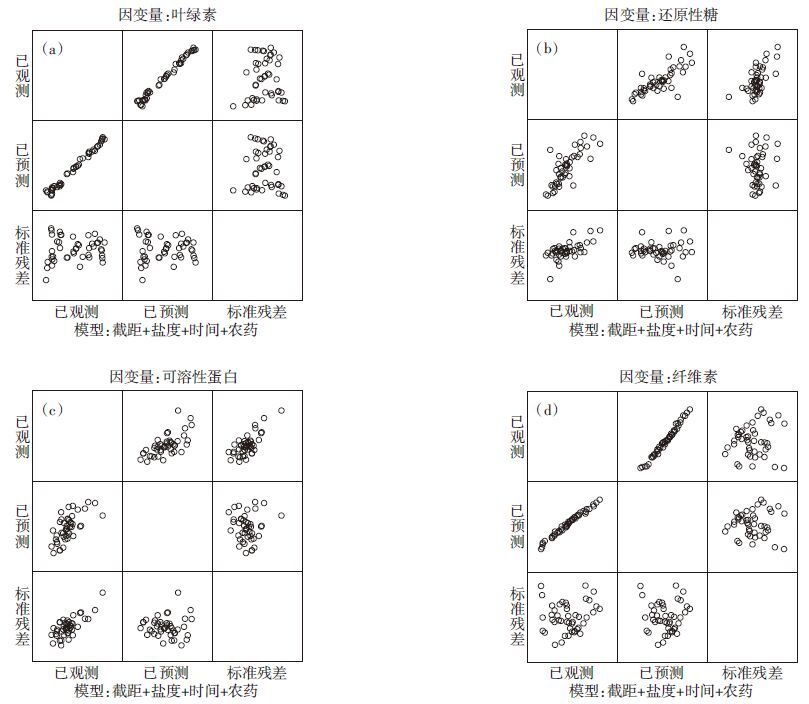
|
| 图 3 盐胁迫和甲维盐·毒死蜱对小白菜生理生化指标影响主效应分析的残差图 Figure 3 General partial residual plot of analysis of characteristics of non-heading Chinese cabbage in vegetable soil |
在盐和农药胁迫下,小白菜叶片叶绿素含量、还原性糖含量、蛋白质含量、纤维素含量均有不同程度的变化。小白菜可以耐受一定范围内的盐和农药胁迫,低浓度的盐和农药胁迫对小白菜的生长反而具有促进作用,但超过一定浓度时会抑制小白菜幼苗的生长。这种随胁迫浓度加大而生物量积累减少的现象在其他植物中也有相似的报道[27, 28]。小白菜细胞的渗透调节作用是有一定限度的,当盐和农药浓度过高时,细胞极度失水,细胞膜受到损伤,细胞产生膜泄露现象,离子和可溶性有机物质失去平衡,叶绿素分解,因此叶绿素含量明显降低,此时渗透调节能力不能阻挡生理上的恶化过程[29]。对于盐胁迫,小白菜可通过增加还原性糖含量进行渗透调节,但农药浓度的升高会使叶片中还原性糖的含量下降,并且农药胁迫对还原性糖含量的影响大于盐胁迫,最终导致还原性糖含量下降。在盐和农药胁迫条件下,小白菜本身会产生抗逆机制,增加体内蛋白质含量以抵制不良环境的危害,所以小白菜叶片中的蛋白质含量在盐和农药胁迫下有所升高。对于小白菜叶片中的纤维素来说,盐和农药对其影响主要表现在对小白菜幼苗的影响上,低浓度的盐和农药胁迫对小白菜的生长具有促进作用,超过一定浓度时会抑制小白菜幼苗的生长,导致纤维素含量降低。随着农药在土壤中的降解,纤维素的含量有所回升,但当盐和农药超过一定浓度时会对小白菜造成不可逆影响,纤维素含量很少甚至没有。
3 结论(1)盐和农药均对小白菜生理指标产生了一定的影响。在胁迫初期负面效应较大,但在胁迫后期其含量上升并基本恢复到对照水平,表明作物体在受到农药胁迫后需要有一个较长的时间才能修复因农药对作物植株本身造成的伤害。
(2)在高盐和不同浓度的甲维盐·毒死蜱分别胁迫及其复合胁迫作用下,小白菜能够抵抗一定程度的盐和农药胁迫,并且小白菜对农药的耐受程度更强一些。
今后应重点研究小白菜对盐和农药的抗性机制,探索小白菜或其他植物体内发挥耐受作用的大分子,以及胁迫因子如何在代谢层面影响植物生长,这对引导植物规避污染及调控植物生长有重要意义。
| [1] | 房 朋, 任丽丽, 张立涛, 等.盐胁迫对杂交酸模叶片光合活性的抑制作用[J]. 应用生态学报, 2008, 19(10):2137-2142. FANG Peng, REN Li-li, ZHANG Li-tao, et al. Inhibition effects of salt stress on photosynthetic activity of Rumex K-1[J]. Chinese Journal of Applied Ecology, 2008, 19(10):2137-2142. |
| [2] | Marcum K B. Salinity tolerance mechanisms of grasses in the subfamily Chloridoideae[J]. Crop Science, 1999, 39(4):1153-1160. |
| [3] | Cramer G R, Lauchli A. Polito V S. Displacement of Ca2+ by Na+ from the plasmalemma of root ceels:A primary response to salt stress?[J]. Plant Physiol, 1985, 79(1):207-211. |
| [4] | 袁 敏, 唐美珍, 罗彦鹤, 等. 盐胁迫下甲维盐·毒死蜱对菜田土壤微生物生态效应研究[J]. 农业环境科学学报, 2015, 34(10):1936-1942. YUAN Min, TANG Mei-zhen, LUO Yan-he, et al. Effects of salt and emamectin benzoate-chlorpyrifos mix on ecological characteristics of microorganisms in vegetable soil[J]. Journal of Agro-Environment Science, 2015, 34(10):1936-1942. |
| [5] | 吴慧明, 朱国念. 毒死蜱在灭菌和未灭菌土壤中的降解研究[J]. 农药学学报, 2003, 5(4):65-69. WU Hui-ming, ZHU Guo-nian. Study on the degradation of chlorpyrifos in sterilized and nonsterilized soil[J]. Chinese Journal of Pesticide Science, 2003, 5(4):65-69. |
| [6] | 刘井兰, 于建飞, 印建莉, 等. 化学农药对植物生理生化影响的研究进展[J]. 农药, 2006, 45(8):511-514. LIU Jing-lan, YU Jian-fei, YIN Jian-li, et al. Research progress on the effect of chemical pesticides on plant physiology and biochemistry[J]. Agrochemicals, 2006, 45(8):511-514. |
| [7] | 潘 攀, 杨俊诚, 邓仕槐, 等. 土壤-植物体系中农药和重金属污染研究现状及展望[J]. 农业环境科学学报, 2011, 30(12):2389-2398. PAN Pan, YANG Jun-cheng, DENG Shi-huai, et al. Proceedings and prospects of pesticides and heavy metals contamination in soil-plant system[J]. Journal of Agro-Environment Science, 2011, 30(12):2389-2398. |
| [8] | 张守栋, 张同作, 韩晓弟, 等. 褐藻胶寡糖对毒死蜱胁迫下小麦幼苗生理生化指标的影响[J]. 生态学杂志, 2015, 34(5):1277-1281. ZHANG Shuo-dong, ZHANG Tong-zuo, HAN Xiao-di, et al. Alleviation effects of spraying alginate-derived oligosaccharide on physiological indexes of wheat seedlings under chloryrifos stress[J]. Chinese Journal of Ecology, 2015, 34(5):1277-1281. |
| [9] | Gechev T. Willekens H, Montagu M, et al. Different responses of tobacco antioxidant enzymes to light and chilling stress[J]. Journal of Plant Physiology, 2003, 160(5):509-515. |
| [10] | 蒋新宇, 马爱军, 何任红. 毒死蜱胁迫对青菜幼苗生长和抗氧化系统的影响[J] .安徽农业科学, 2010, 38(33):18918-18919. JIANG Xin-yu, MA Ai-jun, HE Ren-hong. Effect of chlorpyrifos stress on seedling growth and activities in antioxidant enzymes of green grocery[J]. Journal of Anhui Agricultural Science, 2010, 38(33):18918-18919. |
| [11] | 谢志南, 林丽仙, 钟赞华.毒死蜱对番木瓜生理生化及植株生长的影响[J]. 热带作物学报, 2009, 30(4):478-484. XIE Zhi-nan, LIN Li-xian, ZHONG Zan-hua. Effects of chlorpyrifos on physio-biochemical characteristics and plant growth of papaya[J].Chinese Journal of Tropical Crops, 2009, 30(4):478-484. |
| [12] | 张战泓, 刘建宇, 戴建平, 等. 甲维盐与毒死蜱复配对水稻稻纵卷叶螟防治效果研究[J]. 湖南农业科学, 2010(9):63-65, 68. ZHANG Zhan-hong, LIU Jian-yu, DAI Jian-ping, et al. Control effect of combination of emamectin-benzoate and chlorpyrifos against Cnap-halocrocis medinalis Guenee[J]. Hunan Agriculture Science, 2010(9):63-65, 68. |
| [13] | 劳家柽. 土壤农化分析手册[M]. 北京:农业出版社, 1988. LAO Jia-cheng. Soil agricultural chemistry analysis manual[M]. Beijing:Agricultural Press, 1988. |
| [14] | 南京农业大学. 田间试验和统计方法[M]. 北京:农业出版社, 1979:163-781. Nanjing Agricultural University. Field trail and statistical method[M].Beijing:Agricultural Press, 1979:163-781. |
| [15] | 杜荣骞. 生物统计学[M]. 北京:高等教育出版社, 2003. DU Rong-qian. Biostatistics[M]. Beijing:Higher Education Press, 2003. |
| [16] | 张志良, 瞿伟箐. 植物生理学实验指导[M]. 三版. 北京:高等教育出版社, 2003. ZHANG Zhi-liang, QU Wei-jing. Plant physiology experiments[M]. Third edition. Beijing:Higher Education Press, 2003. |
| [17] | 汪贵斌, 曹福亮. 盐胁迫对落羽杉生理及生长的影响[J]. 南京林业大学学报(自然科学版), 2003, 27(3):11-14. WANG Gui-bin, CAO Fu-liang. Effects of salinity on growth and physiology of bald cypress seedlings[J]. Journal of Nanjing Forestry University(Natural Sciences Edition), 2003, 27(3):11-14. |
| [18] | 王 伟. 中山杉无性系幼苗耐盐特性及机理研究[D]. 南京:南京林业大学, 2010:6. WANG Wei. Study on salt-resistant characteristics and mechanism of clone seedlings of Taxodium hybrid[D]. Nanjing:Nanjing Forestry University, 2010:6. |
| [19] | 王 敏, 曲存民, 刘晓兰, 等. 温度胁迫下甘蓝型油菜苗期生理生化指标的研究[J]. 作为杂志, 2013(2):53-59. WANG Min, QU Cun-min, LIU Xiao-lan, et al. Studies on physiological and biochemical indexes by temperature stress at seedling stage in Brassica napus L.[J]. Crops, 2013(2):53-59. |
| [20] | Nicolosi R J, Woolfrey B, Wilson T A, et al. Decreased aortic early atherosclerosis and associated risk factors in hypercholesterolemic hamsters fed a high- or mid-oleic acid oil compared to a high-linoleic acid oil[J]. The Journal of Nutritional Biochemistry, 2004, 15(9):540-547. |
| [21] | Munns R. Physiological processes limiting growth in saline soils:Some dogmas and hypothesis[J]. Plant, Cell & Environment, 1993, 16:15- 24. |
| [22] | 肖克脆, 吴普特, 雷金银, 等. 不同类型耐盐植物对盐碱土生物改良研究[J]. 农业环境科学学报, 2012, 31(12):2433-2440. XIAO Ke-cui, WU Pu-te, LEI Jin-yin, et al. Bio-reclamation of different halophytes on saline-alkali soil[J]. Journal of Agro-Environment Science, 2012, 31(12):2433-2440. |
| [23] | 冯立田, 赵可夫. 叶绿体对盐胁迫的某些生理适应机制[J]. 植物学通报, 1998, 15(增刊):62-67. FENG Li-tian, ZHAO Ke-fu. Some physiological adaptive mechanisms of chloroplasts to salt stress[J]. Chinese Bulletin of Botany, 1998, 15(Suppl):62-67. |
| [24] | Thakur M, Sharma A D. Salt-stress-induced proline accumulation in germinating embryos:Evidence suggesting a role of proline in seed germination[J].Journal of Arid Environments, 2005, 62(3):517-523. |
| [25] | Heyser J W, Nabors M W. Growth, water content and solute accumulation of two tobacco cell lines cultured on sodium chloride, dextran and polyethylene glycol[J]. Plant Physiology, 1981, 68(6):1454-1459. |
| [26] | 王丽燕, 赵可夫. 玉米幼苗对盐胁迫的生理响应[J].作物学报, 2005, 31(2):264-266. WANG Li-yan, ZHAO Ke-fu. Some physiological response of zea mays under salt-stress[J]. Acta Agronomica Sinica, 2005, 31(2):264-266. |
| [27] | 王丽萍, 崔美香, 孟艳玲. NaCl胁迫对黄瓜幼苗生长及抗氧化系统的影响[J]. 西北农业学报, 2007, 16(4):170-173. WANG Li-ping, CUI Mei-xiang, MENG Yan-ling. Effects of NaCl strew on growth and antioxidant systems of cucumber seedlings[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2007, 16(4):170-173. |
| [28] | 代莉慧, 蔡 禄, 张鲁刚, 等. NaCl和Na2CO3胁迫对盐爪爪种子萌发过程中生理生化变化的研究[J]. 种子, 2011, 30(11):53-55. DAI Li-hui, CAI Lu, ZHANG Lu-gang, et al. Study on the effect of NaCl and Na2CO3 stress on the physiological and biochemical changes of seed Kalidium foliatum during germination[J]. Seed, 2011, 30(11):53-55. |
| [29] | 唐红枫, 生秀梅, 熊 丽, 等. 有机磷农药对小白菜中可溶性蛋白质及SOD、Mg2+-ATPase、Ca2+-ATPase和CAT的影 [J]. 华中师范大学学报(自然科学版), 2006, 40(1):82-85. TANG Hong-feng, SHENG Xiu-mei, XIONG Li, et al. The impact of organophosphates pesticide to soluble proteins and several oxidant enzymes in vegetable[J]. Journal of Central China Normal University(Natural Science), 2006, 40(1):82-85. |
 2016, Vol. 35
2016, Vol. 35