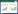文章信息
- 张娟, 魏克强, 赵婷
- ZHANG Juan, WEI Ke-qiang, ZHAO Ting
- Cu2+胁迫对克氏原螯虾(Procambarus clarkii)酚氧化酶原激活系统活性的影响
- Effect of Cu2+ stress on activity of prophenoloxidase activating system in Procambarus clarkii
- 农业环境科学学报, 2016, 35(5): 865-870
- Journal of Agro-Environment Science, 2016, 35(5): 865-870
- http://dx.doi.org/10.11654/jaes.2016.05.007
-
文章历史
- 收稿日期: 2015-11-08
当前,我国水域生态环境的污染状况日益严重,《2012年中国环境状况公报》指出,重金属铜(Cu)已成为内陆渔业水域最主要的污染物之一,其超标范围仍在持续扩大。污染水体中,罗氏沼虾(Macrobrachium rosenbergii)、保罗美对虾(Farfantepenaeus paulensis)、凡纳滨对虾(Litopenaeus vannamei)等甲壳动物的血细胞数减少、血蓝蛋白的合成下调、酚氧化酶的活性降低,进而对病原体的易感性显著升高[1, 2, 3, 4]。作为一种必需微量元素,Cu虽然是甲壳动物血蓝蛋白(Hc)、酚氧化酶原(proPO)、酚氧化酶(PO)、氧化物歧化酶(SOD)等重要免疫因子的组成成分[5, 6],但高浓度Cu2+会导致体内活性氧自由基(ROS)的水平提高,产生毒性效应。研究表明,适量的ROS有助于机体的免疫防御,如对虾血细胞“呼吸暴发”释放的羟自由基(·OH)、超氧阴离子(O2-·)、过氧化氢(H2O2)等活性氧中间产物(ROIs)是吞噬杀灭病原菌的重要屏障[1, 7];大量的ROS则造成氧化损伤,组织蛋白羰基化,显著抑制体液免疫水平[8, 9]。H2O2还能够激活细胞膜上独立的配体,氧化胞内的酪氨酸蛋白激酶(PTK),抑制蛋白酪氨酸磷酸酶(PTP)活性,损伤T淋巴细胞与NK细胞[7]。目前,氧化应激被认为是重金属Cu的主要免疫毒性机制之一。
甲壳动物的免疫防御依赖于天然免疫应答,主要由细胞免疫与体液免疫组成。其中,酚氧化酶原激活系统(Prophenoloxidase activating system,proPO-AS)是重要的识别系统,在血淋巴的小颗粒细胞(SGC)与颗粒细胞(GC)中合成、储存和释放,由proPO、PO、模式识别蛋白(PRP)、丝氨酸蛋白酶(SP)及其抑制剂等多种成分组成,被病原微生物细胞表面的脂多糖、肽聚糖等分子特异性激活后,无活性的proPO形成具有免疫活性的PO,在这一系列的级联反应中丝氨酸蛋白酶发挥着重要的调控作用[10, 11]。甲壳动物的血蓝蛋白是占血淋巴总蛋白90%以上的含铜呼吸蛋白,近年来发现,其具有两种亚基类型:HC1(具有广谱抗菌肽的功能)和HC2(氨基末端被蛋白水解后可表现出PO活性)[12],而Cu浓度升高可增加HC2的mRNA合成 [13]。这表明,甲壳动物血淋巴中的血细胞数、血蓝蛋白含量以及血细胞内的proPO、SP 和PO水平与proPO-AS的活性密切相关,但对重金属污染物Cu是如何调控proPO-AS的机制还不清楚。
克氏原螯虾(Procambarus clarkii)隶属于节肢动物门(Arthropoda)、甲壳纲(Crustacea)、十足目(Decapoda)、螯虾科(Crayfish),原产于墨西哥北部和美国南部[14],目前已成为我国重要的淡水水产养殖品种,2013年产量达50万t。克氏原螯虾对外界环境条件的要求低,富集重金属的能力强,给该产品品质和质量安全带来了潜在的影响。近年来它被广泛应用于甲壳动物免疫学研究以及指示环境污染的模式实验动物[15, 16]。基于此,本实验以Cu2+为胁迫因子,淡水克氏原螯虾为模式生物,通过分析不同浓度和时间暴露下,其血细胞内酚氧化酶原、丝氨酸蛋白酶活性以及血淋巴中酚氧化酶、血蓝蛋白和血细胞水平的变化,为甲壳动物免疫毒理学的研究提供理论依据。
1 材料与方法 1.1 实验材料与试剂 1.1.1 材料健康活泼、螯肢完整的克氏原螯虾,体长(8.3±0.5)cm、体重(18.9±4.9)g,购自太原市五龙口水产市场。实验前,在充分曝气的玻璃水族箱(45 cm × 30 cm × 30 cm)内暂养7 d,每日定时换水、投喂饵料,水温为(26±2)℃,实验前24 h停止饲喂。
1.1.2 试剂硫酸铜CuSO4·5H2O为分析纯(天津市登峰化学试剂厂),实验前用蒸馏水配制10 g·L-1的Cu2+母液备用;L-DOPA、LPS、BAPNA等购自Sigma公司。
1.2 试验方法 1.2.1 染毒与采样采用静态水质接触染毒法。在前期测得的96 h半致死浓度(LC50=22.14 mg·L-1)的基础上,将Cu2+浓度分别设置为1.0、3.0、5.0、10.0 mg·L-1(近似于96 h-LC50的1/20、1/7、1/4和1/2)4个处理组,并设不添加Cu2+的对照组。每组处理15尾螯虾,同时设置3个重复。分别于染毒24、48、72、96 h随机抽取3尾,每个处理组共取9尾螯虾,置于冰上麻醉15 min后,用含抗凝剂(葡萄糖2.05 g、柠檬酸盐0.8 g、NaCl 0.2 g,双蒸水稀释到100 mL)的1.0 mL注射器围心腔抽取血淋巴液。
1.2.2 血细胞裂解液的制备参考Hernández-López等[17]的方法制备血细胞裂解液(HLS)。将抽取的血淋巴液700×g、4 ℃离心15 min(ZONKIA KDC-140HR,中国),上清液作为血清样品-80 ℃保存备用;沉淀用同体积生理盐水重悬后,700×g、4 ℃离心15 min,弃上清,再次用同体积的生理盐水重悬混匀,之后转移到超声波细胞破碎仪(Scientz-ID,中国)处理1 min,再经15 000×g、4 ℃离心20 min后,上清液即为血细胞裂解液,-80 ℃保存备用。
1.2.3 血细胞数量的测定参考Nicosia等[18]的方法,取20 μL血淋巴液甲醛固定,然后滴加到血细胞计数板中,在光学显微镜(Olympus BX51,日本)下计数。
1.2.4 血蓝蛋白含量的测定参考Qiu等[19]的方法,将血清稀释为10%的溶液,在酶标仪(Spectra Max M5,美国)上测定334 nm处的吸光度值。血蓝蛋白含量(mmol·L-1)=(所测吸光度值×反应液总体积)/(消光系数2.69×待测样品体积)。
1.2.5 酚氧化酶原系统活性的测定以L-DOPA为底物,参考Ashida[20]和Perazzolo等[21]的方法进行测定。酚氧化酶活性:取100 μL血清与100 μL 20 mg·mL-1的L-DOPA混匀,在490 nm下读取吸光度值(Spectra Max M5,美国),每隔30 s读取一次,共读取10 min。酚氧化酶原活性:取100 μL HLS加入50 μL的胰蛋白酶(1 mg·mL-1)作为激活剂,25 ℃放置10 min,之后加入50 μL L-DOPA,5 min后加入800 μL磷酸缓冲液(pH7),于490 nm处每隔30 s读取吸光度值,共读取10 min。均以1 mL血清每分钟OD490增加0.001为一个酶活单位(U·mL-1)。
参考Pan等[22]的方法,以BAPNA为底物进行丝氨酸蛋白酶活性检测。取100 μL HLS与1 mg·mL-1 LPS进行混合,室温放置15 min,加入500 μL Tris-HCl缓冲液,30 ℃孵育30 min,随后加入200 μL 50%乙酸终止反应。对照组用TBS取代HLS。用酶标仪(Spectra Max M5,美国)在405 nm下读取光密度值。
1.3 数据统计分析实验结果均以平均数±标准差(Means±SD)表示。利用SPSS16.0对数据进行单因素方差分析,P<0.05为差异性显著(图中以*表示)。
2 结果与分析 2.1 Cu2+胁迫对血细胞数的影响如图 1所示,整个实验期间对照组的总血细胞数(THC)无明显变化。随染毒时间的延长,Cu2+(1.0~10 mg·L-1)胁迫下,螯虾的THC明显降低(P<0.05),以10 mg·L-1Cu2+胁迫尤为显著。低浓度(1.0~3.0 mg·L-1)处理组染毒48 h THC呈现出适应性调整的趋势,而高浓度(5.0~10.0 mg·L-1)保持着对THC的抑制。
|
| 图 1 同浓度Cu2+胁迫对克氏原螯虾血细胞数的影响 Figure 1 Effects of different Cu2+ concentrations on total haemocyte count(THC) in hemolymph of P. clarkii |
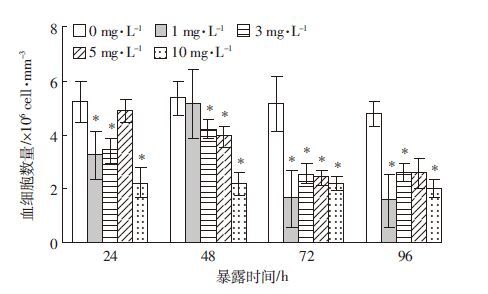
在96 h 暴露期间,以1.0 mg·L-1与10 mg·L-1 Cu2+对血清血蓝蛋白(Hc)含量的抑制尤为明显(P<0.05)。随着染毒时间的延长,3.0 mg·L-1与5.0 mg·L-1 Cu2+胁迫下,Hc含量与对照组相比差异不显著(P>0.05),呈现出先降低后增加并逐步恢复到正常水平的趋势(图 2)。
|
| 图 2 不同浓度Cu2+胁迫对克氏原螯虾血清中 血蓝蛋白含量的影响 Figure 2 Effects of different Cu2+ concentrations on hemocyanin content in serum of P. Clarkii |
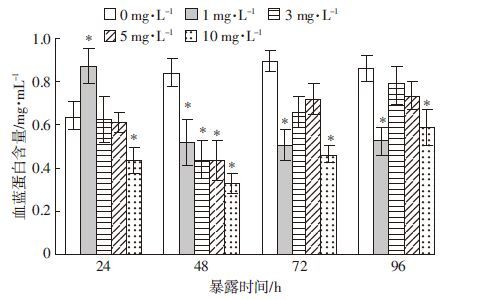
由图 3可见,不同浓度的Cu2+对血清酚氧化酶(PO)活性均有显著的抑制作用(P<0.05)。随着暴露时间的延长,1.0、3.0 mg·L-1 Cu2+处理组PO活性逐渐下降,5.0、10.0 mg·L-1 Cu2+处理组PO活性逐渐上升。在染毒96 h后,低浓度Cu2+(1.0~3.0 mg·L-1)比高浓度Cu2+(5.0~10 mg·L-1)的影响更为显著。
|
| 图 3 不同浓度Cu2+胁迫对克氏原螯虾血清中 酚氧化酶活性的影响 Figure 3 Effects of different Cu2+ concentrations on PO activity in serum of P. Clarkii |
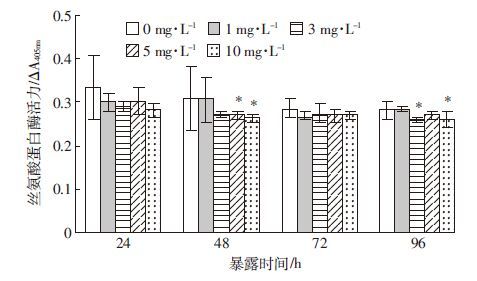
与对照组相比,5.0 mg·L-1与10 mg·L-1 Cu2+染毒48 h显著抑制了丝氨酸蛋白酶(SP)活性(P<0.05)。96 h后,3.0 mg·L-1与10 mg·L-1处理组的SP活性显著下降(P<0.05)。整个实验期间,10 mg·L-1 Cu2+对SP活性的影响最为明显(图 4)。
|
| 图 4 不同浓度Cu2+胁迫对克氏原螯虾血清中丝氨酸蛋白酶 酶活性的影响 Figure 4 Effects of different Cu2+ concentrations on serine proteinase activity in HLS of P. Clarkii |
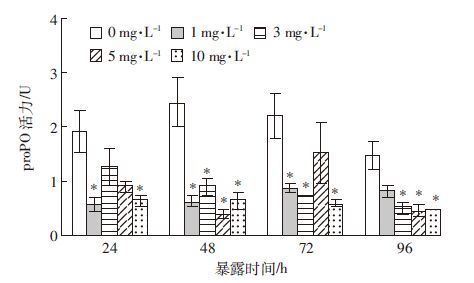
如图 5所示,与对照组相比,不同浓度的Cu2+对血细胞内酚氧化酶原(proPO)活性均有抑制作用(P<0.05)。在不同的染毒时间,分别以1.0 mg·L-1(24 h)、5.0 mg·L-1(48 h)、10 mg·L-1(72 h和96 h)Cu2+对proPO活性的影响最显著。这与PO活性随Cu2+浓度梯度的变化规律不太一致,似乎表明在由无活性的酶原转换为有活性酶的过程中某些因素起着调控作用。
|
| 图 5 不同浓度Cu2+胁迫对克氏原螯虾HLS中酚氧化酶原 活性的影响 Figure 5 Effects of different Cu2+ concentrations on proPO activity in HLS of P. Clarkii |
综合上述结果,染毒96 h,高浓度Cu2+(10 mg·L-1)对血淋巴血细胞数、血蓝蛋白含量、酚氧化酶活性以及血细胞内酚氧化酶原、丝氨酸蛋白酶水平的抑制效应最为明显。暴露48~72 h,低浓度Cu2+(3.0、5.0 mg·L-1)染毒对各指标也有不同程度的抑制作用。同时发现,在染毒24 h时,1.0 mg·L-1 Cu2+对血蓝蛋白含量和酚氧化酶活性具有增强作用。可见,Cu2+暴露72 h导致的血细胞数目减少、血细胞中proPO水平下降可能是造成血清中PO活性下降的主要原因。随着暴露时间延长至96 h,proPO、SP的活性受到抑制,但血蓝蛋白的含量逐渐上升,PO活性也明显上升,表明部分血蓝蛋白可能表现出了PO活性。
3 讨论一些研究显示,低浓度的Cu2+会降低螯虾的摄食能力,10 mg·L-1 Cu2+染毒3 h后其心跳速率明显下降[23, 24]。在96 h染毒期间,随着暴露时间的延长和浓度的增加,螯虾的活动性明显减弱甚至静止于水底,有的因呼吸困难浮在水面,机体的生理机能逐渐降低。
免疫系统对外部环境的扰动极其敏感,是研究污染物毒性效应的理想靶位点。稳定的血细胞数和血蓝蛋白水平可以反映甲壳动物的健康状况,因此PO活性是评价其免疫功能的重要标志[10]。克氏原螯虾的血细胞有三种类型(透明细胞、小颗粒细胞和颗粒细胞),在天然免疫防御中发挥着吞噬、包囊、黑化等重要作用。在污染物胁迫下,罗氏沼虾(Macrobrachium rosenbergii)、保罗美对虾(Farfantepenaeus paulensis)、凡纳滨对虾(Litopenaeus vannamei)、斑节对虾(Penaeus monodon)等虾类的血细胞总数(THC)显著下降[1, 3, 4, 25],与螯虾的观察结果基本一致。这可能是由于Cu2+产生的过量ROS会导致血细胞凋亡或坏死[26],鳃、肝胰腺等组织的氧化损伤使大量的血细胞从血淋巴向组织器官迁移[1, 8, 27]。甲壳动物血蓝蛋白的氨基酸序列、蛋白结构与酚氧化酶具有高度的相似性,推测它们可能起源于共同的祖先蛋白[6]。血蓝蛋白的亚基类型HC2,其氨基末端被蛋白水解后能够表现出PO活性[12]。在Cu2+胁迫下,克氏原螯虾肝胰腺中血蓝蛋白HC2的mRNA表达升高,合成的血蓝蛋白释放进入循环血淋巴中[13]。本实验还表明,1.0 mg·L-1 Cu2+暴露24 h,可以促进螯虾血蓝蛋白的合成,与Osuna-Jimenéz等[13]的研究结果一致;但当Cu2+浓度达到3.0 mg·L-1以上时,血蓝蛋白含量显著低于对照组。这可能是由于高浓度的Cu2+会造成蛋白质、核酸等大分子的氧化损伤,产生蛋白质羰基化、DNA-蛋白质交联等效应,从而抑制其合成、降低其载氧功能和PO活性,影响机体的健康状况[8, 27]。也有研究认为,血蓝蛋白含量先上升后下降的变化可能是由于其mRNA 表达序列标记的多态位点不同所造成的[13]。由此可见,Cu2+胁迫对血淋巴中的血细胞数与血蓝蛋白可能具有不同的调控机制。
在血细胞内,无活性的proPO通过丝氨酸蛋白酶参与调控的级联反应转变为有活性的PO。研究显示,低剂量的Cu2+可以激活甲壳动物的proPO,Cu2+浓度增加后又显著抑制proPO和PO的水平[8, 28]。本研究中,随着染毒浓度和暴露时间(如5.0 mg·L-1 Cu2+,48 h;10 mg·L-1 Cu2+,96 h)的增加,丝氨酸蛋白酶的活性明显下降,同时血细胞中的proPO与血清中的PO活性也受到了显著抑制。这提示我们,Cu2+可能参与了血细胞内proPO-AS的调控,这3种酶活性的变化可能都与氧化应激有关[1, 7, 8, 9, 29]。
甲壳动物的proPO-AS的组成复杂,激活路径涉及多种成分,PO活性受多种因素影响,研究结果可能与染毒剂量、暴露时间、受试动物、环境条件等因素有关,其确切机制还有待于进一步研究。在96 h的染毒期间,与血蓝蛋白、丝氨酸蛋白酶相比,血细胞数和proPO、PO活性对水体1.0~10.0 mg·L-1 Cu2+更为敏感,可以作为评价Cu2+免疫毒性的标志物。
4 结论(1)低浓度(1.0 mg·L-1)的Cu2+也具有免疫毒性,在染毒96 h后,随着浓度的增加,Cu2+能够抑制血淋巴中的血细胞数、血蓝蛋白含量与酚氧化酶活性,三者的变化规律基本一致,以10 mg·L-1 Cu2+最为显著。
(2)当浓度最高达10 mg·L-1时,Cu2+还会抑制proPO-AS中的酚氧化酶原、酚氧化酶、丝氨酸蛋白酶活性,Cu2+可能参与了proPO-AS的调控。
(3)螯虾血细胞及其胞内外的蛋白成分,如血蓝蛋白、丝氨酸蛋白酶、酚氧化酶及其酶原,具有不同的生理作用与理化性质,Cu2+诱导的氧化应激可能通过不同的机制对其进行调控。
| [1] | Cheng W,Wang C H. The susceptibility of the giant freshwater prawn Macrobrachium rosenbergii to Lactococcus garvieae and its resistance under copper sulfate stress[J]. Diseases of Aquatic Organisms, 2001, 47(2):137-144. |
| [2] | Chang C C, Rahmawaty A, Chang Z W. Molecular and immunological responses of the giant freshwater prawn, Macrobrachium rosenbergii, to the organophosphorus insecticide, trichlorfon[J]. Aquatic Toxicology,2013,130:18-26. |
| [3] | Perazzolo L M, Gargioni R, Ogliari P, et al. Evaluation of some hemato-immunological parameters in the shrimp Farfantepenaeus paulensis submitted to environmental and physiological stress[J]. Aquaculture, 2002, 214(1-4):19-33. |
| [4] | Yeh S T, Liu C H, Chen J C. Effect of copper sulfate on the immune response and susceptibility to Vibrio alghiolyticus in the white shrimp Litopenaeus vannamei[J]. Fish & Shellfish Immunology, 2004, 17(5):437-446. |
| [5] | Li Y H, Zheng F L, Chen H Q,et al. Cloning and sequence analysis of prophenoloxidase from haemocytes of the Red Swamp Crayfish, Procambarus clarkii[J]. Agricultural Sciences in China, 2009, 8(3):369-379. |
| [6] | Jaenicke E, Decker H. Conversion of crustacean hemocyanin to catecholoxidase[J]. Micron, 2004, 35(1/2):89-90. |
| [7] | Roch P. Defense mechanisms and disease prevention in farmed marine invertebrates[J]. Aquaculture, 1999, 172(1/2):125-145. |
| [8] | Wei K Q, Yang J X. Oxidative damage of hepatopancreas induced by pollution depresses humoral immunity response in the freshwater crayfish Procambarus clarkii[J]. Fish & Shellfish Immunology, 2015, 43(2):510-519. |
| [9] | Xian J A, Wang A L, Ye C X, et al. Phagocytic activity,respiratory burst,cytoplasmic free-Ca2+ concentration and apoptotic cell ratio of haemocytes from the black tiger shrimp, Penaeus monodon under acute copper stress[J]. Comparative Biochemistry and Physiology, Part C, 2010, 152(3):182-188. |
| [10] | Wang W F, Yang H, Liu F, et al. A novel effect of imidazole derivative KK-42 on increasing survival of Aeromonas hydrophila challenged prawn Macrobrachium nipponense[J]. Fish & Shellfish Immunology,2013, 34(1):167-172. |
| [11] | Söderhäll I, Bangyeekhun E, Mayo S, et al. Hemocyte production and maturation in an invertebrate animal; proliferation and gene expression in hematopoietic stem cells of Pacifastacus leniusculus[J]. Developmental & Comparative Immunology, 2004, 97(8):661-672. |
| [12] | Lee S Y, Lee B L, Söderhäll K, et al. Processing of crayfish hemocyanin subunits into phenoloxidase[J]. Biochemical and Biophysical Research Communications, 2004, 322(2):490-496. |
| [13] | Osuna-Jimenéz I, Abril N, Vioque-Fernández A, et al. The environmental quality of Donana surrounding areas affects the immune transcriptional profile of inhabitant crayfish Procambarus clarkii[J]. Fish & Shellfish Immunology, 2014, 40(1):136-145. |
| [14] | Francesca G. Crayfish invading Europe:The case study of Procambarus clarkii[J]. Marine and Freshwater Behaviour and Physiology, 2006,39(3):175-191. |
| [15] | Alcorlo P, Otero M, Crehuet M, et al. The use of the red swamp crayfish(Procambarus clarkii Girard) as indicator of the bioavailability of heavy metals in environmental monitoring in the River Guadiamar(SW,Spain)[J]. Science of the Total Environment, 2006, 366(1):380-390. |
| [16] | Schilderman P A E L, Moonen E J C, Maas L M, et al. Use of crayfish in biomonitoring studies of environmental pollution of the river Meuse[J]. Ecotoxicology and Environmental Safety, 1999, 44(3):241-252. |
| [17] | Hernández-López J, Gollas-Galván T, Vargas-Albores F. Activation of the prophenoloxidase system of the brown shrimp(Penaeus californiensis Holmes)[J]. Comparative Biochemistry and Physiology C-Pharmacology Toxicology & Endocrinology, 1996, 113(1):61-66. |
| [18] | Nicosia A, Celi M, Vazzana M, et al. Profiling the physiological and molecular response to sulfonamidic drug in Procambarus clarkii[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2014, 166:14-23. |
| [19] | Qiu R J, Cheng Y X, Huang X X, et al. Effect of hypoxia on immunological, physiological response, and hepatopancreatic metabolism of juvenile Chinese mitten crab Eriocheir sinensis[J]. Aquaculture International, 2011, 19(2):283-299. |
| [20] | Ashida M. Purification and characterization of pre-phenoloxidase from hemolymph of the silkworm Bombyx mori[J]. Archives of Biochemistry and Biophysics, 1971, 144(2): 749-762. |
| [21] | Perazzolo L M, Barracco M A. The prophenoloxidase activating system of the shrimp Penaeus paulensis and associated factors[J]. Developmental and Comparative Immunology, 1997, 21(5):385-395. |
| [22] | Pan L Q, Hu F W, Zheng D B. Effect of dopamine injection on the hemocyte count and prophenoloxidase system of the white shrimp Litopenaeus vannamei[J]. J Ocean Univ China, 2011, 10(3):280-286. |
| [23] | Lahman S E, Trent K R, Moore P A, et al. Sublethal copper toxicity impairs chemical orientation in the crayfish, Orconectes rusticus[J]. Ecotoxicology and Environmental Safety, 2015, 113:369-377. |
| [24] | Giada B, Giacomo S, Guido C. Pre-exposure to cadmium or zinc alters the heart rate response of the crayfish Procambarus clarkii towards copper[J]. Bulletin of Environmental Contamination and Toxicology,2015, 95(1):12-17. |
| [25] | An J, Li X B, Guo H, et al. Haemocyte apoptosis of the tiger shrimp Penaeus monodon exposed to cadmium[J]. Bull Environ Contam Toxicol, 2014, 92(5):525-528. |
| [26] | Brown R J, Galloway T S, Lowe D, et al. Differential sensitivity of three marine invertebrates to copper assessed using multiple biomarkers[J]. Aquatic Toxicology, 2004, 66(3):267-278. |
| [27] | 魏克强, 庞胜喜, 赵 辉, 等. Cu2+对克氏原螯虾(Procambarus clarkii)肝胰腺的蛋白质氧化损伤效应[J]. 农业环境科学学报, 2004, 33(7):1310-1315. WEI Ke-qiang, PANG Sheng-xi, ZHAO Hui, et al. Oxidative damages of proteins in hepatopancreas of Procambarus clarkii exposed to Cu2+[J]. Journal of Agro-Environment Science, 2004, 33(7):1310-1315. |
| [28] | Lacoue-Labarthe T, Bustamante P, Hoerlin E, et al. Phenoloxidase activation in the embryo of the common cuttlefish Sepia officinalis and responses to the Ag and Cu exposure[J]. Fish & Shellfish Immunology,2009, 27(3):516-521. |
| [29] | Yang Y H, Bazhin A V, Werner J, et al. Reactive oxygen species in the immune system[J]. Internetional Reviews of Immunology, 2013, 32(3): 249. |
 2016, Vol. 35
2016, Vol. 35