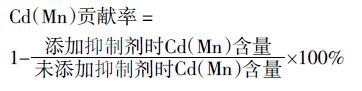文章信息
- 徐莜, 杨益新, 李文华, 陈蕊, 赵艳玲, 唐琦, 刘仲齐
- XU You, YANG Yi-xin, LI Wen-hua, CHEN Rui, ZHAO Yan-ling, TANG Qi, LIU Zhong-Qi
- 锰离子浓度及其转运通道对水稻幼苗镉吸收转运特性的影响
- Effects of manganese concentrations and transporters on uptake and translocation of cadmium in rice seedlings
- 农业环境科学学报, 2016, 35(8): 1429-1435
- Journal of Agro-Environment Science, 2016, 35(8): 1429-1435
- http://dx.doi.org/10.11654/jaes.2016-0133
文章历史
- 收稿日期: 2016-01-26
2. 湖南省湘阴县农业局, 湖南 湘阴 414600 ;
3. 东北农业大学资源与环境学院, 哈尔滨 150030
2. Xiangyin Bureau of Agriculture, Xiangyin 414600, China ;
3. School of Resources and Environmental Sciences, Northeast Agricultural University, Harbin 150030, China
近些年我国工农业发展迅猛,伴随着工业“三废”的大量排放,其中的部分Cd 通过各种途径进入农田土壤,致使全国土壤Cd 点位超标率高达7%,农田Cd污染问题日益显露和突出[1]。水稻是我国第一大粮食作物,农田土壤中大量Cd 可被水稻根系富集,部分转移至籽粒中,从而进入食物链积累于人体[2],对人体肝、肾、骨骼等组织造成严重的损害[3]。
Mn是人类与植物所必需的微量营养元素。在人体中,Mn 主要参与脂肪代谢与造血过程,与钙、磷代谢有关[4]。在水稻中,Mn参与光合作用中的放氧阶段,负责水的光解过程,并且Mn 与众多酶促反应有关,是许多酶的活化剂[5]。此外,水稻还是一种高耐Mn 作物。一些水稻品种即使叶片中Mn 含量高达5000 mg·kg-1时,也不会出现Mn 毒症状[6]。有研究表明,Mn2+具有缓解Cd 对水稻的生长抑制作用,提高Mn2+浓度可显著降低Cd在水稻根系中的含量[7]。
土壤中的Cd 和Mn 主要以离子形态进入水稻根系[8],一部分Cd2+与Mn2+吸附于根细胞壁或进入根细胞内,另一部分则通过共质体与质外体两种运输途径,先横向运输至根系维管束组织,然后通过木质部纵向运输至地上部组织[9-10]。水稻根系内外皮层间有一条木质化与栓质化加厚的凯式带阻止根外溶液进入维管束,金属离子需要±靠根细胞膜上的转运通道进行跨膜运输,才得以进入细胞内[11]。P-型ATP酶是一类位于质膜上利用ATP 水解产生的能量使离子进行跨膜运输的载体蛋白,负责主动转运环境中微量的金属元素,可同时参与Mn2+、Cd2+、Fe2+、Zn2+等多种阳离子的吸收转运过程[12]。Laurent 等[13]发现在拟南芥中,位于细胞膜上的P-型ATP酶家族成员AtHMA4可转运Zn2+、Cd2+等多种阳离子,其序列N 段具有富含半胱氨酸和组氨酸的重金属结合域(MBDs),多种阳离子需竞争MBDs的结合位点,才得以通过AtH原MA4 进入胞内。钒酸钠(Na3VO4)是一类能有效抑制植物细胞P-型ATP酶活性的抑制剂,用Na3VO4抑制P-型ATP酶的活性能显著降低芦蒿中Cd 和Pb 的积累量[14]。
水稻细胞膜上还存在一些能同时转运多种离子的通道蛋白,它们主要是通过化学门控或电压门控机制对离子进行被动运输。如K+通道和非选择性阳离子通道(NSCCs)等通道蛋白也能进行Cd2+的跨膜运输[15-17]。NSCCs是泛指一类对于多种阳离子具有很低辨别力的离子通道集合体[18],Gd3+、La3+、奎宁、焦磷酸二乙酯等可显著抑制NSCCs的活性[19]。
本研究以水稻幼苗为材料,对Mn2+浓度与水稻幼苗Cd、Mn 积累及亚细胞分布特征的关系进行了研究,并应用P-型ATP 酶抑制剂与NSCCs抑制剂对载体蛋白和离子通道在水稻Cd、Mn 吸收转运过程中的贡献率进行分析,以期为应用Mn调控水稻Cd 的吸收与积累提供理论±据。
1 材料与方法 1.1 供试材料与培养条件以早熟籼稻(Oryza sativa L.)品种T 优705 为供试材料,在人工气候室内进行试验。挑选均一饱满的水稻种子,在装有100 mL 5%NaClO 溶液的器皿中浸泡20 min,用超纯水反复清洗其上残留的NaClO,洗净后均匀地播撒于育苗盘上,在去离子水中进行第一阶段培养。待水稻幼苗长至两叶一心期,将其转移至盛有1/10 Hoagland营养液的8 L培养箱中,进行第二阶段培养。待水稻幼苗长至三叶一心期,挑选长势一致的幼苗,在去离子水中缓苗1 d后,放置于以1/10Hoagland 营养液为基础的不同处理液中进行5 d处理(由于1/10 Hoagland 营养液自身含有约1 μmol·L-1MnCl2,处理液中实际Mn2+浓度为外源施加Mn2+浓度加营养液中自身Mn2+浓度)。水培实验的整个过程均在人工气候室内完成。人工气候室条件参数:昼夜时间为16 h/8 h,昼夜温度为25℃/20℃,白天光照105μmol·m-2·s-1,相对湿度为60%[20]。
1.2 培养与处理方法设定处理液镉(CdCl2)浓度为4.5 μmol·L-1,3 个锰(MnSO4)水平设定为:0(Mn0)、0.8(Mn1)、1.6 mmol·L-1(Mn2)。GdCl3(NSCCs抑制剂)和Na3VO4(P-型ATP酶抑制剂)浓度均设定为0.1 mmol·L-1。处理液用HNO3和KOH调节pH至5.5~6.0。每个处理重复3次,每个重复中有15株水稻幼苗。
1.3 样品采集与处理处理好的水稻幼苗先用5 mmol·L-1 的CaCl2 浸泡漂洗20 min,以去除根系表面吸附的Cd2+,再用去离子水将根系冲洗干净。用剪刀将一部分水稻幼苗的根部与地上部分开,装入信封,放入烘箱105℃杀青15 min,再置于75℃下烘干至恒重,用于全Cd 含量的测定。另一部分直接用于亚细胞测定。
1.4 Cd、Mn含量测定Cd、Mn含量测定主要参照潘瑶等[21]的方法。用剪刀将烘至恒重后的样品剪碎,称取根系0.1 g、地上部0.25 g,将称好后的样品放入消煮管中,加入7 mLHNO3浸泡过夜。次日将消煮管放入消解仪ED54上,在110℃下消煮1.5 h。待消解液冷却后,加入1 mLH2O2,再在150益下消煮2.5h,最后取下管盖,在180益下赶酸至体积为0.5mL左右。消解完成后用去离子水将赶酸后的消解液转移至25 mL 容量瓶中并定容,用原子吸收光谱仪(AASZEEnit700)测定样品Cd含量。
Cd 的亚细胞分布方法主要±照Wang 等[22]的方法。称取新鲜的水稻幼苗根系或叶片0.5 g,置于研体中,加入20 mL 预冷的提取缓冲溶液(250 mmol·L-1蔗糖,1 mmol·L-1 二硫赤藓醇,50 mmol·L-1Tris-HCl,pH7.4),将样品充分研磨至匀浆,倒入50 mL 离心管中。将装有匀浆液的离心管放入4℃离心机中,3000r·min-1离心15 min,沉淀即为细胞壁组分(F1)。将上清液转入新50 mL离心管,15 000 r·min-1离心30 min,沉淀部分为细胞器组分(F2),上清液部分为胞液组分(F3)。将所得各组分转移至消解管中后放入烘箱,待烘干水分后加酸消解,测定Cd 和Mn 含量。
1.5 数据统计及分析采用Excel 与SPSS17.0 软件进行数据处理及显著性分析,并用Origin8.6软件作图。
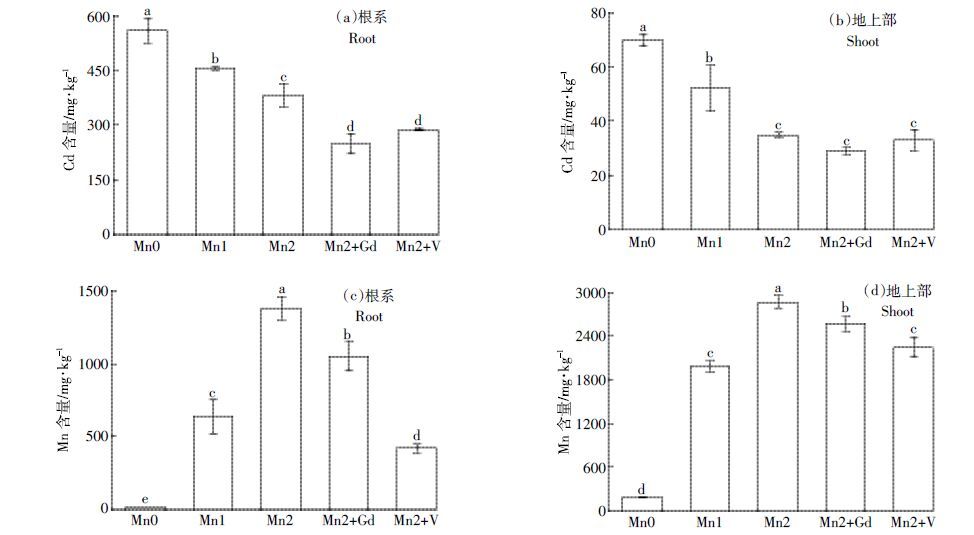
2 结果与分析 2.1 Mn2+浓度和抑制剂对水稻幼苗Cd 和Mn 积累量的影响Mn2+浓度对水稻根系和地上部Cd 积累量有显著影响。施加0.8 mmol·L-1 和1.6 mmol·L-1 外源Mn 可使水稻根系中Cd 的积累量分别下降18.4%和31.4%(图 1a),使地上部Cd 的积累量分别下降25.7%和50.1%(图 1b)。NSCCs与P-型ATP 酶抑制剂对水稻根系Cd 积累量的影响比1.6 mmol·L-1 外源Mn 还明显。0.1 mmol·L-1 Gd3+和 0.1 mmol·L-1 VO43-能使水稻根系的Cd 积累量分别下降35.0%和24.7%,使地上部的Cd含量分别下降17.1%和7.6%。由此说明,增加根际环境Mn2+浓度和添加转运通道抑制剂均有利于降低水稻幼苗根系与地上部对Cd的吸收与积累。
|
| 图 1 Mn和抑制剂对水稻幼苗Cd 及Mn 积累量的影响 Figure 1 Effects of Mn and inhibitors on Cd concentrations and Mn concentrations of rice seedlings 图中不同小写字母表示各处理间差异显著(P<0.05)。下同 |
水稻幼苗中Mn 的含量随处理液中Mn2+浓度的增加而大幅升高。施加0.8 mmol·L-1外源Mn 使水稻根系Mn 含量增加33 倍(图 1c),使地上部Mn 含量增加近9 倍(图 1d);施加1.6 mmol·L-1 Mn 使水稻根系Mn 含量增加72 倍,地上部Mn 含量增加14 倍。0.1 mmol·L-1 Gd3+能使水稻根系与地上部Mn 含量分别下降24.0%和 10.3%,0.1 mmol·L-1VO43-能使水稻根系与地上部Mn 含量分别下降69.5%和20.3%。这说明水稻对Mn 具有很高的富集能力,其地上部的Mn含量显著高于根系。
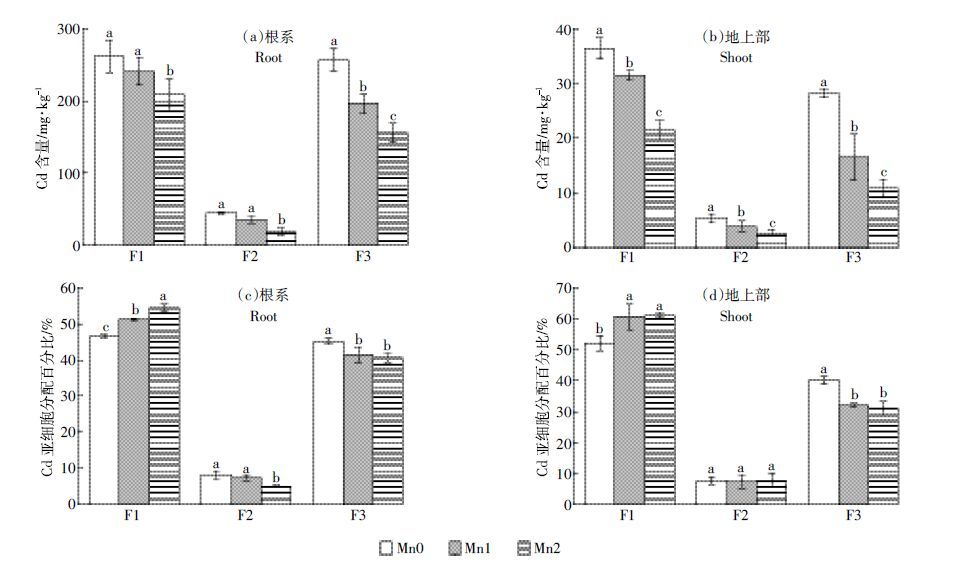
2.2 Mn2+对水稻幼苗内Cd 亚细胞分布的影响水稻Cd 主要分布于细胞壁(F1)与胞液(F3)两部分中,细胞器(F2)中Cd含量很少。施加外源Mn 可显著降低水稻幼苗亚细胞各组分Cd 含量,其中对F3组分的抑制效果最为显著(图 2)。施加0.8 mmol·L-1和1.6 mmol·L-1 外源Mn 使水稻根系F1 组分中Cd含量分别下降8.3%和20.0%,地上部F1 中分别下降13.6%和41.3%,根系F2 中分别下降21.8%和58.5%,地上部F2 中分别下降27.7%和49.8%,根系F3 中分别下降23.6%和39.4%,地上部F3 组分中分别下降41.1%和61.3%。
|
| 图 2 Cd 水稻幼苗内的根系与地上部亚细胞分布及其亚细胞分布百分比 Figure 2 Amount and percentages of Cd subcellular distribution in roots and shoots of rice seedlings |
Mn不仅有助于降低水稻幼苗根系和地上部亚细胞组分中Cd 的积累量,而且改变了各组分中Cd 的分配比率。施加0.8~1.6 mmol·L-1外源Mn 可使根系F1 中Cd 的分配比率提高4.7%~7.9%,使地上部F1中Cd的分配比率提高8.5%~9.1%;与此同时,根系F3 中Cd 的分配比率下降了3.9%~4.7%,地上部F3中Cd 的分配比率下降了8.3%~9.2%。这说明Mn 有助于提升Cd 在细胞壁组分的积累,并减少Cd 在胞液中的积累。
2.3 NSCCs 和P-型ATP 酶对水稻幼苗Cd、Mn 积累量的贡献率NSCCs 和P-型ATP 酶对水稻幼苗根系Cd 和Mn 积累量的贡献率均大于对地上部积累量的贡献率,且相互间存在显著性差异(图 3)。NSCCs对水稻根系与地上部Cd贡献率分别为34.9%和17.0%,均大于P-型ATP酶的24.7%和7.6%,说明Cd进入根系细胞以及向地上部分转运的过程主要±靠离子通道来完成。NSCCs 对水稻根系与地上部Mn 贡献率分别为24.0%和10.3%,而P-型ATP酶对水稻根系Mn积累量的贡献率高达69.5%,是NSCCs 贡献率的2.9 倍;P-型ATP 酶对水稻地上部Mn 积累量的贡献率为20.3%,是NSCCs贡献率的2.0倍。这说明Mn进入根系细胞和向地上部转运的过程主要±靠载体蛋白,P-型ATP酶对水稻根系Mn的积累发挥了决定性作用。
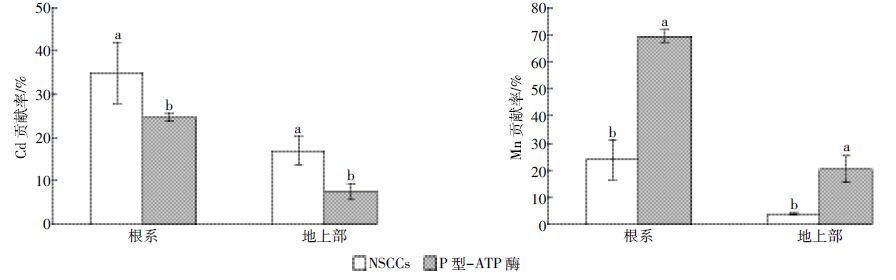
|
| 图 3 NSCCs与P型-ATP酶对水稻Cd 和Mn积累量的贡献率 Figure 3 Percentages of NSCCs and P-ATPase contributions to Cd and Mn accumulation in rice seedlings |
Mn 是植物与人体必需的微量元素之一,应用其治理水稻Cd污染具有安全无污染的特点。本研究发现0.8~1.6 mmol·L-1外源Mn 能显著降低水稻根系与地上部Cd 含量的18.4%~31.4%和25.7%~50.1%(图 1)。这与杨国治[23]发现Mn 能抑制水稻对Cd 吸收的规律一致,说明增加根际环境中的Mn 能够有效抑制Cd的吸收积累。
在水稻根际Mn2+随水势向根系迁移的过程中,水稻根系可将地上部吸收的O2通过疏导组织输送到根系并释放到环境中,使根际的Mn2+发生氧化,形成高价态Mn 氧化物胶膜附着于根表,这部分胶膜对阻控Cd具有一定作用[24-26]。此外,水稻细胞壁中含有多种能与Cd 产生螯合作用的糖类与蛋白质,有助于降低Cd的移动性,部分Mn2+进入根系质外体途径后被输送的O2氧化,形成的高价态Mn 氧化物附着于细胞壁,增强了细胞壁对Cd 的固定[27]。在本研究中,加入外源Mn 后细胞壁组分中Cd 含量显著降低,但细胞壁组分中镉的分配比率显著升高(图 2)。这很可能是由于Mn2+浓度的提升增加了根表Mn 胶膜厚度与细胞壁固持作用所致。
Cd2+与Mn2+均为二价阳离子,表现出相似的理化性质。因此,植物吸收转运Cd2+与Mn2+常常涉及相同的运输蛋白,它们对相关离子通道和载体蛋白的结合存在竞争关系[28]。本研究发现,加入外源Mn 后胞液组分中Cd 含量锐减,并且胞液组分中Cd 的分配比率显著降低,表明在水稻细胞中Mn2+和Cd2+对相关转运蛋白的结合存在显著的拮抗作用。胞液是维持植物细胞生命活动的重要场所,也是对Cd 毒害最为敏感的部分之一,其组分中Cd 含量的降低会减缓Cd 对细胞代谢造成的毒害。
水稻中绝大部分Mn 位于叶绿体,参与光合作用过程,地上部是水稻进行光合作用的主要场所[10],水稻中含有大量的载体蛋白,例如OsNRAMP5[28]、Os原NRAMP3[29]、OsYSL2[30]、OsMTP8.1[31]等,可将根系中的Mn2+转运至维管束后运输至地上部。非选择性阳离子通道和金属耐性蛋白(Metal tolerance protens,MTPs)等通道蛋白普遍存在于植物原生质、液泡膜和其他内膜系统中,对阳离子的选择性很低,既可以转运Mn2+和Ca2+、Mg2+、Zn2+等植物必需的营养元素,同时也参与Cd2+进入水稻体内的过程[32-34]。载体蛋白和通道蛋白的共同作用,保证了植物各种代谢活动对Mn 的需求。而Cd 作为植物的非必需元素,至今未在水稻中发现专属于Cd 的载体蛋白。Cd 更多是通过对离子专一性较低的一些离子通道进入水稻胞液。例如,转运Mn和Ca的载体蛋白及离子通道几乎都能转运Cd[34]。本研究发现,NSCCs 对Cd 积累量的贡献率显著大于P-型ATP 酶,而P-型ATP 酶对水稻根系和地上部Mn 积累量的贡献率显著大于对Cd 的贡献率(图 3)。这说明Cd 主要通过非选择性阳离子通道进入水稻根系细胞,而Mn 主要通过载体蛋白进入根系细胞和向地上部转运。因此,在Mn 和Cd 共存的条件下,Mn2+通过优先结合细胞膜上的载体蛋白和通道蛋白对Cd2+产生拮抗作用,从而抑制Cd2+的跨膜运输,减少根系细胞胞液中的Cd 含量和向地上部的转运量,缓解Cd2+的生理毒害作用。
4 结论(1)增加根际Mn2+浓度能显著升高水稻中Mn 含量和降低Cd 含量,1.6 mmol·L-1 Mn 能使水稻根系与地上部的Cd积累量分别下降31.4%和50.1%。
(2)水稻幼苗细胞壁与胞液是富集Cd 的主要组分,细胞器组分中Cd含量很少。施加外源Mn 有助于提高水稻细胞壁中Cd 的分配比率和降低细胞液中Cd的分配比率。
(3)Cd 主要通过非选择性阳离子通道进入水稻根系细胞,而Mn 主要通过载体蛋白进入水稻根系细胞。Mn通过竞争离子通道和载体蛋白来抑制水稻幼苗对Cd 的吸收和转运。
| [1] | Liu Z Q. Research advance on the mechanism of cadmium transport in rice[J]. Meteorological and Environmental Research , 2014, 5 (5) : 48–52. |
| [2] | 宋建, 金凤媚, 薛俊, 等. 镉胁迫对植物生长及生理生态效应的研究进展[J]. 天津农业科学 , 2014, 20 (12) : 19–22. SONG Jian, JIN Feng-mei, XUE Jun, et al. Advances of cadmium stress on plants growth and physiological and ecological effects[J]. Tianjin Agricultural Sciences , 2014, 20 (12) : 19–22. |
| [3] | Méndez-Armenta M, Ríos C. Cadmium neurotoxicity[J]. Environmental Toxicology and Pharmacology , 2007, 23 (3) : 350–358. DOI:10.1016/j.etap.2006.11.009 |
| [4] | 牛芸民, 杨天林. 若干重要微量金属元素的生物化学功能及其与人体健康的关系[J]. 微量元素与健康研究 , 2014, 31 (2) : 78–80. NIU Yun-min, YANG Tian-lin. A number of important biochemical function of trace metal elements and its relationship to human health[J]. Studies of Trace Elements and Health , 2014, 31 (2) : 78–80. |
| [5] | Williams L E, Pittman J K. Dissecting pathways involved in manganese homeostasis and stress in higher plant cells[J]. Plant Cell Monographs , 2010, 17 : 95–117. DOI:10.1007/978-3-642-10613-2 |
| [6] | Vlamis J, Williams D E. Iron and manganese relations in rice and barley[J]. Plant and Soil , 1964, 20 (2) : 221–231. DOI:10.1007/BF01376451 |
| [7] | 覃都, 陈铭学, 周蓉, 等. 锰-镉互作对水稻生长和植株镉、锰含量的影响[J]. 中国水稻科学 , 2010, 24 (2) : 189–195. QIN Du, CHEN Ming-xue, ZHOU Rong, et al. Effects of interaction between manganese and cadmium on plant growth and contents of cadmium and manganese in rice[J]. Chinese Journal Rice Science , 2010, 24 (2) : 189–195. |
| [8] | Marschner H. Mineral nutrition of higher plants[J]. Mineral Nutrition of Higher Plants , 1995, 46 (1) : 681–861. |
| [9] | Uraguchi S, Mori S, Kuramata M, et al. Root-to-shoot Cd translocation via the xylem is the major process determining shoot and grain cadmium accumulation in rice[J]. Journal of Experimental Botany , 2009, 60 (9) : 2677–2688. DOI:10.1093/jxb/erp119 |
| [10] | Pittman J K. Managing the manganese:Molecular mechanisms of manganese transport and homeostasis[J]. New Phytologist , 2005, 167 (3) : 733–742. DOI:10.1111/j.1469-8137.2005.01453.x |
| [11] | Kobayashi T, Nishizawa N K. Iron uptake, translocation, and regulation in higher plants[J]. Annual Review of Plant Biology , 2012, 63 (3) : 131–152. |
| [12] | 张玉秀, 张媛雅, 孙涛, 等. 植物重金属转运蛋白P1B-ATPase结构和功能研究进展[J]. 生物工程学报 , 2010, 26 (6) : 715–725. ZHANG Yu-xiu, ZHANG Yuan-ya, SUN Tao, et al. Structure and function of heavy metal transporter P1B-ATPase in plant:A review[J]. Chinese Journal of Biotechnology , 2010, 26 (6) : 715–725. |
| [13] | Laurent C, Lekeux G, Ukuwela A A, et al. Metal binding to the N-terminal cytoplasmic domain of the PIB ATPase HMA4 is required for metal transport in Arabidopsis[J]. Plant Molecular Biology , 2016 . DOI:10.1007/S11103-016-0429-2 |
| [14] | 薛艳, 王超, 王沛芳, 等. 外源添加抑制剂对芦蒿吸收Cd和Pb的影响[J]. 农业环境科学学报 , 2009, 28 (11) : 2255–2258. XUE Yan, WANG Chao, WANG Pei-fang, et al. Effect of additive inhibitor on the Cd and Pb uptake of Artemisia seleirgensis[J]. Journal of Agro-Environment Science , 2009, 28 (11) : 2255–2258. |
| [15] | Zhou Y, Xia X M, Lingle C J. Cadmium-cysteine coordination in the BK inner pore region and its structural and functional implications[J]. Proceedings of the National Academy of Sciences , 2015, 112 (16) : 5237–5242. DOI:10.1073/pnas.1500953112 |
| [16] | 王玉倩, 汪晓丽, 单玉华, 等. 环境因素对小麦根系非选择性阳离子通道(NSCCs)转运钾的影响[J]. 植物营养与肥料学报 , 2010, 16 (4) : 913–917. WANG Yu-qian, WANG Xiao-li, SHAN Yu-hua, et al. Effects of environmental factors on nonselective cation channels-mediated potassium uptake of wheat roots[J]. Plant Nutrition and Fertilizer Science , 2010, 16 (4) : 913–917. |
| [17] | 张参俊, 尹洁, 张长波, 等. 非选择性阳离子通道对水稻幼苗镉吸收转运特性的影响[J]. 农业环境科学学报 , 2015, 34 (6) : 1028–1033. ZHANG Shen-jun, YIN Jie, ZHANG Chang-bo, et al. Effects of nonselective cation channels on accumulation and transfer of Cd in rice seedlings[J]. Journal of Agro-Environment Science , 2015, 34 (6) : 1028–1033. |
| [18] | Zhang W H, Skerrett M, Walker N A, et al. Nonselective currents and channels in plasma membranes of protoplasts from coats of developing seeds of bean[J]. Plant Physiology , 2002, 128 (2) : 388–399. DOI:10.1104/pp.010566 |
| [19] | 戴松香, 陈少良. 植物根细胞离子通道研究进展[J]. 北京林业大学学报 , 2005, 27 (3) : 98–103. DAI Song-xiang, CHEN Shao-liang. Research review on root ion channels of plants[J]. Journal of Beijing Forestry University , 2005, 27 (3) : 98–103. |
| [20] | 陆仲烟, 刘仲齐, 宋正国, 等. 大麦中镉的亚细胞分布和化学形态及PCs合成的基因型差异[J]. 农业环境科学学报 , 2013, 32 (11) : 2125–2131. LU Zhong-yan, LIU Zhong-qi, SONG Zheng-guo, et al. Subcellular distribution and chemical forms of Cd and the synthesis of phytochelatins(PCs) in different barley genotypes[J]. Journal of Agro-Environment Science , 2013, 32 (11) : 2125–2131. |
| [21] | 潘瑶, 尹洁, 高子平, 等. 硫对水稻幼苗镉积累特性及亚细胞分布特征的影响[J]. 农业资源与环境学报 , 2015, 32 (3) : 275–281. PAN Yao, YIN Jie, GAO Zi-ping, et al. Effects of sulfur on the accumulation and subcellular distribution of cadmium in rice seedlings[J]. Journal of Agricultural Resources and Environment , 2015, 32 (3) : 275–281. |
| [22] | Wang X, Liu Y G, Zeng G M, et al. Subcellular distribution and chemical forms of cadmiun in Bechmeria nivea(L.) Gaud[J]. Environmental and Experimental Botany , 2008, 62 (1) : 389–395. |
| [23] | 杨国治. 锰能抑制水稻对镉的吸收[J]. 土壤 , 1986, 57 (1) : 77–80. YANG Guo-zhi. Manganese can inhibit the uptake of cadmium in rice[J]. Soil , 1986, 57 (1) : 77–80. |
| [24] | Wang M Y, Chen A K, Wong M H, et al. Cadmium accumulation in and tolerance of rice(Oryza sativa L.) varieties with different rates of radial oxygen loss[J]. Environmental Pollution , 2011, 159 (6) : 1730–1736. DOI:10.1016/j.envpol.2011.02.025 |
| [25] | Liu W J, Zhu Y G, Smith F A. Effects of iron and manganese plaques on arsenic uptake by rice seedlings(Oryza sativa L.) grown in solution culture supplied with arsenate and arsenite[J]. Plant and Soil , 2005, 277 (1/2) : 127–138. |
| [26] | 王丹, 李鑫, 王代长, 等. 硫素对水稻根系铁锰胶膜形成及吸收镉的影响[J]. 环境科学 , 2015, 36 (5) : 65–76. WANG Dan, LI Xin, WANG Dai-zhang, et al. Effects of nonselective cation channels on accumulation and transfer of Cd in rice seedlings[J]. Journal of Agro-Environment Science , 2015, 36 (5) : 65–76. |
| [27] | Fu X, Dou Chen Y, et al. Subcellular distribution and chemical forms of cadmium in Phytolacca Americana L[J]. Journal of Hazard Material , 2011, 186 (1) : 103–170. DOI:10.1016/j.jhazmat.2010.10.122 |
| [28] | Ishimaru Y, Takahashi R, Bashir K, et al. Characterizing the role of rice NRAMP5 in manganese, iron and cadmium transport[J]. Scientific Reports , 2012 . DOI:10.1038/Srep00286 |
| [29] | Yamaji N, Sasaki A, Xia J X, et al. A node-based switch for preferential distribution of manganese in rice[J]. Nature Communications , 2013, 4 (9) : 2442–2442. |
| [30] | Yasuhiro I, Hiroshi M, Khurram B, et al. Rice metal-nicotianamine transporter, OsYSL2, is required for the long-distance transport of iron and manganese[J]. Plant Journal for Cell & Molecular Biology , 2010, 62 (3) : 379–390. |
| [31] | Chen Z, Fujii Y, Yamaji N, et al. Mn tolerance in rice is mediated by MTP8.1, a member of the cation diffusion facilitator family[J]. Journal of Experimental Botany , 2013, 64 (14) : 4375–4387. DOI:10.1093/jxb/ert243 |
| [32] | Emmanuel D, Gruber B D, Pittman J K, et al. A role for the AtMTP11 gene of Arabidopsis in manganese transport and tolerance[J]. Plant Journal for Cell & Molecular Biology , 2007, 51 (2) : 198–210. |
| [33] | 刘胜浩, 刘晨临, 黄晓航, 等. 植物细胞的非选择性阳离子通道[J]. 植物生理学通讯 , 2006, 42 (3) : 523–528. LIU Sheng-hao, LIU Chen-lin, HUANG Xiao-hang, et al. Nonselective cation channels in plant cells[J]. Plant Physiology Communications , 2006, 42 (3) : 523–528. |
| [34] | Pinto E, Isabel M P L V O. Ferreira. Cation transporters/channels in plants:Tools for nutrient biofortification[J]. Journal of Plant Physiology , 2015, 179 : 64–82. DOI:10.1016/j.jplph.2015.02.010 |
 2016, Vol. 35
2016, Vol. 35