文章信息
- 廖若星, 赖金龙, 李月琴, 付倩, 陶宗娅
- LIAO Ruo-xing, LAI Jin-long, LI Yue-qin, FU Qian, TAO Zong-ya
- 蚕豆对土壤中锶的累积及其器官分配特征分析
- Characteristics of strontium accumulation and redistribution in organs of Vicia faba grown on Sr-contaminated soils
- 农业环境科学学报, 2017, 36(10): 1953-1959
- Journal of Agro-Environment Science, 2017, 36(10): 1953-1959
- http://dx.doi.org/10.11654/jaes.2017-0448
文章历史
- 收稿日期: 2017-03-28
- 接受日期: 2017-06-09
2. 四川师范大学附属中学, 成都 610066;
3. 四川省绵阳实验高级中学, 四川 绵阳 621051
2. The Middle School Attached to Sichuan Normal University, Chengdu 610066, China;
3. Mianyang Experimental Middle School of Sichuan, Mianyang 621051, China
锶(Strontium,Sr)作为第二主族碱土金属,环境中存在84Sr、86Sr、87Sr和88Sr四种稳定同位素,主要分布在天青石、菱锶矿等矿物中,其中88Sr约占总量的82.58%[1-2]。随着核工业的发展、核试验以及突发性核事故(如2011年日本福岛核事故),导致大量放射性核素释放到环境中,其中90Sr是主要的放射性核素,具有半衰期长(28.78 a)、辐射能高(0.546 MeV)、危害大(释放β粒子)等特点[3-6]。然而,Sr化学性质与钙(Calcium,Ca)类似,被释放到环境中的90Sr易被动植物吸收、转移,并沿食物链累积到人体骨骼、牙齿等部位,造成长期电离辐射,损伤骨、肾脏等器官,诱发癌变[7-9]。
近年来,90Sr的环境生物学效应,尤其是Sr在农产品中的累积特性已成为研究热点。研究表明,90Sr在土壤中主要分布在5~15 cm的表层土(垂直迁移),但受天气影响(如风、雨及地表水流),90Sr可发生水平迁移,造成低洼地90Sr污染浓度升高[10]。当90Sr进入土壤后,与土壤组分相互作用,形成易交换或易迁移的化合物,易被植物根系吸收、累积[11-12]。近年来,采用88Sr模拟90Sr污染(植物对88Sr、90Sr吸收能力无显著差异),评估植物对90Sr的累积、转移及器官分配特征已取得一些成果,如水培条件下,Sr主要累积在印度芥菜[13]、蚕豆[14]、向日葵[15]等植物的地上部分,但在油菜、玉米、豌豆等植物的根部Sr累积量较高[14];在春油菜、春小麦各器官中的分配规律为叶、茎>壳>籽粒[16]。同时,植物对Sr的累积特性易受植物种类、生育时期以及土壤理化性质(有机质含量、pH、Ca含量等)等因素的影响[17-18],如豆科植物对土壤中Sr的累积能力明显强于十字花科和禾本科,植物在开花期前后对Sr的累积量达最高等[10]。此外,提高培养介质中Ca浓度,可明显降低植物对Sr的累积量[19]。然而,现有研究大多是在水培或短期土培条件下,评估植物在某一特定生育时期对Sr的累积、转移特性,关于植物各生育时期对土壤中Sr的累积效应与器官分配特征却鲜有报道。
蚕豆(Vicia faba L.)作为广泛种植的豆科植物,是重要的蔬菜、饲料和绿肥作物,对Sr具有很强的累积、转移能力[14]。因此,本研究以蚕豆为试材,采用外源施加SrCl2·6H2O(稳定同位素88Sr)模拟放射性核素90Sr污染,通过盆栽试验,分析蚕豆各生育时期(苗期、现蕾期、开花期、结荚期、成熟期)对土壤Sr的累积效应与器官分配特征,为解释植物对土壤Sr的累积、迁移模式提供理论依据。
1 材料与方法 1.1 试验材料蚕豆(Vicia faba L.)品种为“七粒胡豆”,购自成都市农佳裕种业有限公司。挑选大小均匀、无虫眼的健康蚕豆种子,蒸馏水浸种24 h。通过在供试土壤中外源施加88SrCl2·6H2O(分析纯)来模拟放射性核素90Sr污染,采用土壤逐步稀释法制备外源Sr污染土壤[20-21],具体操作为:第1步,向干净土壤(壤土,过2 mm土壤筛)中外源施加88SrCl2·6H2O,配制高浓度的88Sr老化土壤,将土壤含水量维持在最大持水量,并置于黑暗、通风环境,老化6个月,保证Sr与土壤微粒充分作用,使盆栽模拟试验更接近自然污染状态;第2步,使用干净土壤将老化土壤稀释至外源Sr浓度为25、50、100 mg·kg-1的污染水平(目前Sr污染水平较低,介于2.5~40 mg·kg-1之间),即在供试土壤Sr本底值的基础上,外源施加的Sr浓度为25~100 mg·kg-1;以不添加Sr老化土壤作为对照组(CK,Sr本底值为15.68 mg·kg-1)。每盆装土2 kg(塑料盆规格:高15 cm,直径20 cm)。干净土壤的基础理化性质为:有机质42.04 g·kg-1,总N、P、K分别为4.16、1.21、4.34 g·kg-1,速效N、P、K分别为207.1、361.4、495.2 mg·kg-1,全Ca 2.24 g·kg-1,Sr本底值15.68 mg·kg-1,土壤pH 7.02。
1.2 试验方法盆栽试验采用两因素(4个Sr外源污染水平、5个生育时期)随机全组合试验,外源Sr污染水平分别为0(CK)、25、50、100 mg·kg-1,蚕豆各生育时期分别为苗期(播种第46 d)、现蕾期(第87 d)、开花期(第136 d)、结荚期(第151 d)和成熟期(第176 d)。每组3次重复。
采集各时期的蚕豆植株,小心去除根系附着的土壤颗粒,依次用自来水、蒸馏水冲洗干净,滤纸吸干多余水分。将蚕豆植株分割为根、茎、叶、花、荚、荚壳、种子(已成熟)等不同部位,并将根系置于20 mmol·L-1 Na2-EDTA中交换20 min,去除根系表面吸附的Sr。将样本置于80 ℃烘干,待用。
当所有的植物样本采集完成后,将烘干的样本用粉碎机研磨,称取约0.500 g的样品,采用湿法消解法[HNO3+HClO4(3:1,V/V)]消解植物样品,火焰原子吸收分光光度法检测样品中Sr含量,测试重复3次。
1.3 数据分析植株中Sr的累积总量(mg·kg-1干重)=[Sr]根+[Sr]茎+[Sr]叶+[Sr]花+[Sr]荚/荚壳+[Sr]种
地上部分Sr含量(mg·kg-1干重)=[Sr]总-[Sr]根
生物富集系数(BCF)=[Sr]总/[Sr]土壤
转移系数(TF)= [Sr]地上/[Sr]根
器官间分配系数(DF)表示相邻器官间Sr的转移能力,包括:茎-根(DF[茎/根])、叶-茎(DF[叶/茎])、花-茎(DF[花/茎])、豆荚-茎(DF[豆荚/茎])、荚壳-茎(DF[荚壳/茎])、种子-茎(DF[种子/茎])之间的分配系数。
Sr在各器官中的分布百分比=[Sr]器官/[Sr]总×100%
Sr吸收速率(mg·kg-1·d-1干重)=[Sr]总/[生长时间]
采用SPSS 18.0软件对数据进行方差分析,LSD多重比较,Origin 9.0作图。
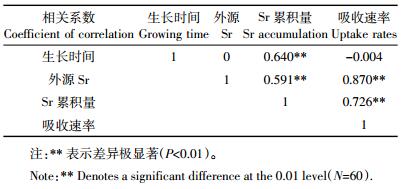
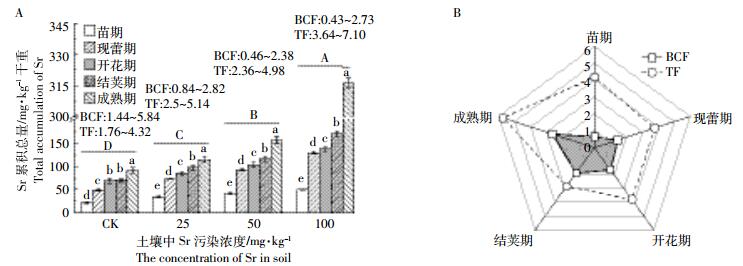
2 结果与分析 2.1 蚕豆各生育时期对Sr的累积及转移特性当外源Sr浓度为0~100 mg·kg-1时,蚕豆各生育时期对Sr的累积量和转移系数(TF)均逐渐增加,但生物富集系数(BCF)却呈下降趋势(图 1A),分别为1.44~5.84(CK)、0.84~2.82(25 mg·kg-1)、0.46~2.38(50 mg·kg-1)和0.43~2.73(100 mg·kg-1)。当外源Sr为100 mg·kg-1时,蚕豆各生育时期对Sr的累积量分别达到50.25 mg·kg-1(苗期)、128.98 mg·kg-1(现蕾期)、137.40 mg·kg-1(开花期)、170.40 mg·kg-1(结荚期)和316.28 mg·kg-1(成熟期)。当土壤中外源Sr污染浓度为25~100 mg·kg-1时,各生育时期对Sr的累积量呈现为成熟期>结荚期>开花期>现蕾期>苗期(图 1A),呈明显的“累积效应”。同时,随蚕豆生育时期的延长,BCF和TF平均值呈“上升”趋势(图 1B)。这表明,蚕豆根系对土壤Sr具有较强的吸收、转移能力,且蚕豆对土壤Sr的累积、转移特征与外源Sr污染水平、生育时期密切相关。
|
| 图A中不同小写字母表示相同外源Sr污染浓度, 不同生育时期间差异显著(P < 0.05);不同大写字母表示相同生育时期、不同外源Sr污染浓度间差异显著(P < 0.05)。图B (雷达图)反映Sr在各生育时期的富集系数(BCF)和转移系数(TF)的平均值 In 1A, different lower-case letters indicate significant difference (P < 0.05) between the different growth stages in the same Sr treatment groups. Different capital letters indicate significant difference (P < 0.05) between the different Sr treatment groups in the same growth stage. In 1B (Radar chart) show that the bioaccumulation factor (BCF) and the transfer factor (TF) of Sr in the different growth periods 图 1 蚕豆不同生育时期对土壤中Sr的累积、转移特性 Figure 1 Accumulation and transfer characterization of Sr in the different growing periods of V. faba |
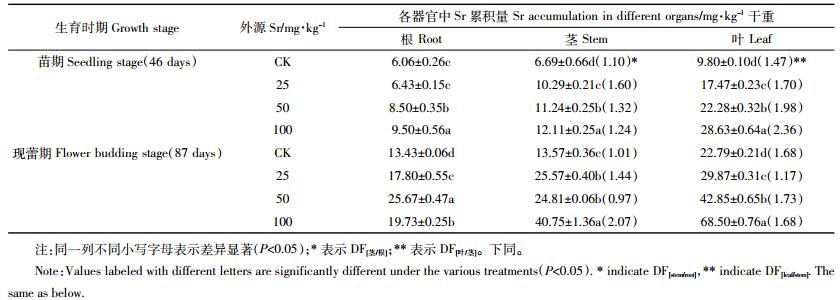
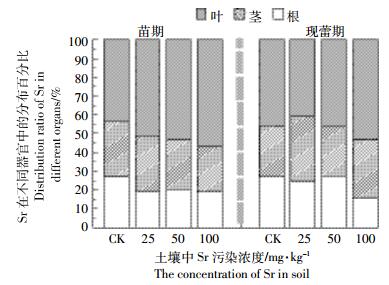
随土壤中外源Sr污染浓度的增加,蚕豆苗期(生长46 d)和现蕾期(生长87 d)根、茎、叶中Sr的累积量显著增加(P < 0.05),Sr在各器官间的转移能力总体呈现为:DF[叶/茎]>DF[茎/根]。随着生育时期的延长,现蕾期各器官中Sr的累积量明显高于苗期,当外源Sr为100 mg·kg-1时,现蕾期根、茎、叶中Sr的累积量分别达到19.73、40.75、68.50 mg·kg-1(表 1)。Sr在蚕豆苗期各器官中的累积百分比分别达到18.81%~26.90%(根)、24.11%~30.10%(茎)和43.48%~56.99%(叶),在现蕾期分别为15.30%~25.67%(根)、13.57%~40.75%(茎)和40.79%~53.11%(叶),说明Sr在各器官中分配规律表现为叶>茎>根(图 2)。
|
|
| 图 2 Sr在蚕豆苗期和现蕾期各器官中的分配百分比 Figure 2 Distribution ratio of Sr in the different organs of V. faba in the seedling and flower budding stage |
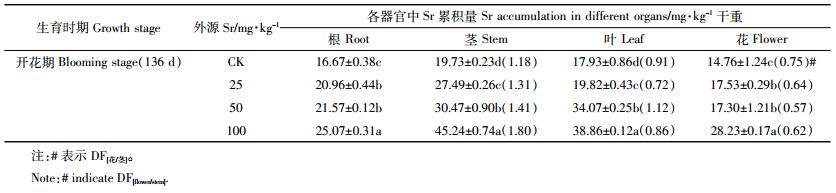
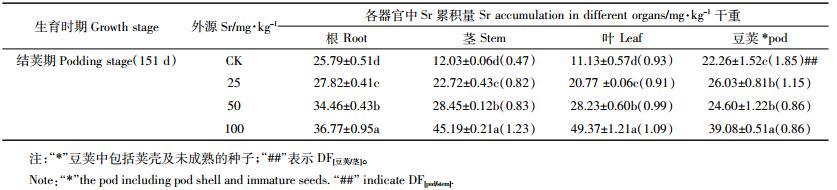
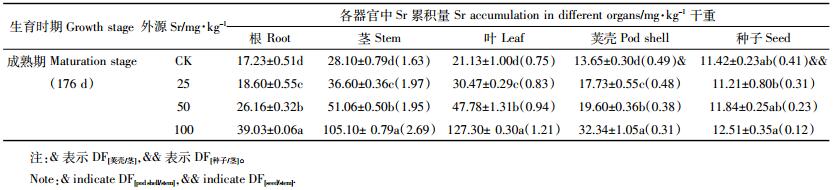
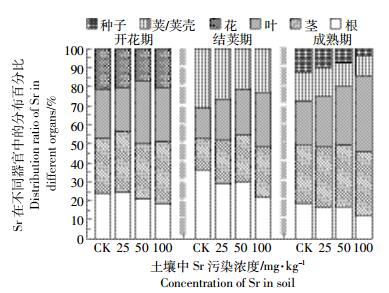
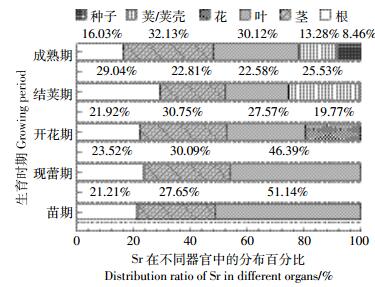
在开花期(生长136 d),蚕豆各器官(根、茎、叶和花)中Sr的累积量也显著增加(P < 0.05),器官间的分配系数呈现为:DF[茎/根]>DF[叶/茎]>DF[花/茎]。与前两个时期对比发现,蚕豆各器官中累积的部分Sr(16.73%~21.35%)被转移到花中,当外源Sr为100 mg·kg-1时,蚕豆花中Sr的累积量达到28.23 mg·kg-1(约占Sr总量的20.55%),DF[花/茎]达到0.62(表 2)。在结荚期(生长151 d),豆荚(包括荚壳和未成熟种子)中Sr的累积量显著增加(P < 0.05),达到22.26~39.08 mg·kg-1(占总量的21.25%~31.24%)、DF[豆荚/茎]达0.86~1.85,明显高于开花期花中Sr的累积量和分配系数(表 3)。当蚕豆处于成熟期时,根、茎、叶中Sr的累积量最高,分别为39.03 mg·kg-1(12.34%)、105.10 mg·kg-1(33.23%)和127.30 mg·kg-1(40.25%)。同时,随土壤中外源Sr污染浓度的增加,蚕豆荚壳中Sr的累积量显著增加,达到13.65~32.34 mg·kg-1(占总量的10.22%~15.47%),与结荚期对比,成熟期豆荚(包括荚壳和成熟种子)中Sr的累积量增加了11.18%~27.80%(表 4),但成熟种子中Sr累积量无明显变化(P>0.05)。此外,Sr在蚕豆各器官中的累积百分比(图 3)表现为:茎>叶>根>花(开花期)、根>豆荚>茎>叶(结荚期)和茎>叶>根>荚壳>种子(成熟期)。Sr在蚕豆全生育时期各器官中的平均累积百分比也显示,被蚕豆根系吸收的Sr可转移、分配到幼嫩器官中(如花、荚壳),导致这些器官中Sr的累积量显著增加(图 4)。
|
|
|
|
| 图 3 Sr在蚕豆开花期、结荚期和成熟期各器官中的分配百分比 Figure 3 Distribution ratio of Sr in the different organs of V. faba in the blooming, podding and maturation stage |
|
| 图 4 Sr在蚕豆不同生育时期各器官中的累积百分比 Figure 4 Distribution ratio of Sr in different organs of V. faba in different growth stages |
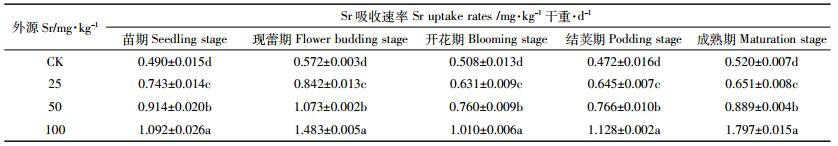
随土壤中Sr污染浓度的增加,在蚕豆各生育时期,蚕豆根系对土壤中Sr的吸收速率均显著增加(P < 0.05),当外源Sr为100 mg·kg-1时,各时期的最大吸收速率分别达到1.092 mg·kg-1·d-1(苗期)、1.483 mg·kg-1·d-1(现蕾期)、1.010 mg·kg-1·d-1(开花期)、1.128 mg·kg-1·d-1(结荚期)和1.767 mg·kg-1·d-1(成熟期),是对照组的0.99~2.46倍(表 5)。Pearson′s相关分析结果显示(表 6),外源Sr污染浓度、Sr累积量与吸收速率均呈极显著正相关(P < 0.01)。此外,蚕豆生长时间与Sr累积量也呈极显著正相关(P < 0.01)。结果表明,蚕豆生长时间可显著影响Sr的累积量,根系对Sr的吸收速率与土壤中外源Sr污染浓度相关。
|
植物对环境中Sr的吸收途径主要是根系吸收和叶面吸收,且根系吸收是最主要的吸收方式,其吸收量是叶面吸收量的200倍[22-23],进入根系的Sr可进一步转移至地上部,如印度芥菜叶中Sr的累积量明显高于茎、根等营养器官[13]。本研究显示,蚕豆根系对土壤Sr具有较强的吸收、转移能力(TF>1),地上部Sr累积量明显高于根部(图 1)。研究表明,植物根系对Sr的吸收机理与Ca相似,包括载体(Carriers)、泵(Pumps)及离子通道(Ionic channels)运输等途径[24],如玉米(Zea mays)根系对溶液中Sr的运输速率表现出典型载体运输动力学特征(外源Sr 0.04~1 mmol·L-1)、泵动力学特征(外源Sr 1~25 mmol·L-1)及离子通道介导的被动扩散特征(外源Sr 25~100 mmol·L-1)[19]。本试验中外源Sr污染水平为25~100 mg·kg-1(0.28~1.14 mmol·L-1),推测蚕豆根系对土壤中Sr的吸收主要由转运载体或泵介导,如ZIP family、ABC family、CPx-ATPase family、Cation Diffusion Facilitator family、Ca泵等转运蛋白可能参与了根系对土壤中Sr的吸收[19]。
当大量Sr进入植物体内,植物可通过区室化作用,将Sr再分配到细胞壁、液泡等生物活性较低的亚细胞区域,降低细胞器中Sr的累积量,缓解了Sr对细胞器的功能性损伤[13, 25-26]。同时,植物根系中Sr主要以果胶酸盐、蛋白质结合态和吸附态等形态暂时贮存,但可转换为水溶性有机酸盐或磷酸盐等形态,在茎的木质部中转移,导致植物地上部Sr累积量明显增加[13]。本研究显示,蚕豆各生育时期对Sr的累积总量均显著增加,且成熟期累积量最高,地上部Sr的累积量也明显高于根部(图 1),说明Sr在蚕豆中的转移能力较强,并具有明显的“累积效应”,推测根中累积的Sr可转化为易转移的水溶态,并沿茎迁移到地上部。然而,蚕豆根中Sr的累积量随生育时期的延长呈“先升后降”的变化趋势,推测是因为蚕豆进入成熟期后,根系逐渐老化,对土壤中Sr的吸收能力降低,但根部累积的Sr仍能转移至地上部,导致根中Sr累积量降低。同时,由于Sr化学性质与Ca相似,在叶部属于难迁移元素(Immobile elements),叶中贮存的Sr仅少部分可沿木质部再转移到其他器官[22]。本研究显示,蚕豆叶中Sr的累积量呈现“双峰”的变化趋势,当蚕豆处于开花期时,叶中Sr累积量明显降低。这主要是因为蚕豆在营养生长阶段,其生物量快速增加,生物量的稀释效应是导致叶中Sr累积量降低的主要因素。当蚕豆进入生殖生长阶段(开花期后),其生物量的稀释效应不明显,但Sr能沿茎转移至叶中,导致蚕豆在开花期后,叶中Sr累积量逐渐增加。
通常,Sr在植物各器官中的分配规律与Ca相似,主要累积在植物各营养器官中(如根、茎、叶),在植物各器官中的分配规律表现为:叶>茎>壳>种子(即Sr在幼嫩部位分配较少)[16]。本研究也显示,Sr在蚕豆各生育时期主要分配在茎、叶中,Sr的分配系数DF[叶/茎]和DF[茎/根]明显高于DF[花/茎]、DF[荚壳/茎]及DF[种子/茎]。此外,蚕豆根系对土壤Sr的吸收速率受外源Sr污染浓度的影响,主要是因为随外源Sr污染浓度的增加,可能造成土壤中可吸收态Sr含量升高,导致根系对Sr的吸收速率增加。
4 结论(1)Sr在蚕豆体内具有明显的累积效应,并可转移到蚕豆茎、叶、花、荚壳等器官中,导致这些器官或组织中Sr累积量显著增加。
(2)Sr在蚕豆各器官中的累积百分比表现为:叶>茎>根(苗期和现蕾期)、茎>叶>根>花(开花期)、根>豆荚>茎>叶(结荚期)和茎>叶>根>荚壳>种子(成熟期)。
(3)蚕豆根系对Sr的吸收速率与外源Sr污染浓度正相关,且蚕豆生长时间可显著影响Sr的累积量。
| [1] |
Pilkey O H, Hower J. The effect of environment on the concentration of skeletal magnesium and strontium in dendraster[J]. The Journal of Geology, 1960, 68(2): 203-214. DOI:10.1086/626653 |
| [2] |
West H K, Davies M S, Morgan A J, et al. The relationship between Sr and Ca accumulation in the major constituents of a terrestrial community resident on a celestitic(SrSO4) soil in S. W. England[J]. European Journal of Soil Biology, 2001, 37(4): 333-336. DOI:10.1016/S1164-5563(01)01110-4 |
| [3] |
Stamoulis K C, Assimakopoulos P A, Ioannides K G, et al. Strontium-90 concentration measurements in human bones and teeth in Greece[J]. Science of the Total Environment, 1999, 229(3): 165-182. DOI:10.1016/S0048-9697(99)00052-2 |
| [4] |
Steinhauser G, Schauer V, Shozugawa K. Concentration of strontium-90 at selected hot spots in Japan[J]. Plos One, 2012, 8(3): e57760. |
| [5] |
Maderich V, Jung K T, Bezhenar R, et al. Dispersion and fate of 90Sr in the northwestern pacific and adjacent seas:Global fallout and the Fukushima Dai-ichi accident[J]. Science of the Total Environment, 2014, 494/495: 261-271. DOI:10.1016/j.scitotenv.2014.06.136 |
| [6] |
Kavasi N, Sahoo S K, Sorimachi A, et al. Measurement of 90Sr in soil samples affected by the Fukushima Dai-ichi Nuclear Power Plant accident[J]. Journal of Radioanalytical and Nuclear Chemistry, 2015, 303(3): 2565-2570. |
| [7] |
Gärdenäs A I, Berglund S L, Bengtsson S B, et al. The grain storage of wet-deposited caesium and strontium by spring wheat:A modeling study based on a field experiment[J]. Science of the Total Environment, 2016, 574: 1313-1325. |
| [8] |
Katayama H, Banba N, Sugimura Y, et al. Subcellular compartmentation of strontium and zinc in mulberry idioblasts in relation to phytoremediation potential[J]. Environmental & Experimental Botany, 2013, 85(1): 30-35. |
| [9] |
付倩, 刘聪, 赖金龙, 等. 锶对蚕豆根尖细胞的遗传毒性效应[J]. 农业环境科学学报, 2015, 34(9): 1646-1652. FU Qian, LIU Cong, LAI Jin-long, et al. Genotoxic effects of strontium on root tip cells of Vicia faba[J]. Journal of Agro-Environment Science, 2015, 34(9): 1646-1652. DOI:10.11654/jaes.2015.09.003 |
| [10] |
姜晓燕, 刘淑娟, 闫冬, 等. 植物对核素锶的吸附与富集作用研究现状[J]. 癌变·畸变·突变, 2014, 26(6): 463-466. JIANG Xiao-yan, LIU Shu-juan, YAN Dong, et al. The research status of uptake and bioaccumulation of strontium in plants[J]. Carcinogenesis, Teratogenesis & Mutagenesis, 2014, 26(6): 463-466. |
| [11] |
Padilla K L, Anderson K A. Trace element concentration in tree-rings biomonitoring centuries of environmental change[J]. Chemosphere, 2002, 49(6): 575-585. DOI:10.1016/S0045-6535(02)00402-2 |
| [12] |
Miller O L, Solomon D K, Fernandez D P, et al. Evaluating the use of strontium isotopes in tree rings to record the isotopic signal of dust deposited on the Wasatch Mountains[J]. Applied Geochemistry, 2014, 50(3): 53-65. |
| [13] |
赖金龙, 杨垒滟, 付倩, 等. Sr2+在印度芥菜幼苗中的富集、亚细胞分布及贮存形态研究[J]. 农业环境科学学报, 2015, 34(11): 2055-2062. LAI Jin-long, YANG Lei-yang, FU Qian, et al. Bioaccumulation, subcellular distribution and chemical forms of strontium in Brassica juncea[J]. Journal of Agro-Environment Science, 2015, 34(11): 2055-2062. DOI:10.11654/jaes.2015.11.003 |
| [14] |
张晓雪, 王丹, 张志伟, 等. 水培条件下十种植物对88Sr和133Cs的吸收和富集[J]. 北方园艺, 2009(10): 65-67. ZHANG Xiao-xue, WANG Dan, ZHANG Zhi-wei, et al. Uptake and accumulation of 88Sr and 133Cs in ten plants of green manure and flower[J]. Northern Horticulture, 2009(10): 65-67. |
| [15] |
闻方平, 王丹, 徐长合, 等. 向日葵(Helianthus annuus L.)对133Cs、88Sr的吸收和分布[J]. 植物研究, 2009, 29(5): 592-596. WEN Fang-ping, WANG Dan, XU Chang-he, et al. Uptake and distribution of 133Cs and 88Sr in sunflower(Helianthus annuus L.)[J]. Bulletin of Botanical Research, 2009, 29(5): 592-596. |
| [16] |
Bengtsson S B, Eriksson J, Gärdenäs A I, et al. Accumulation of wet-deposited radiocaesium and radiostrontium by spring oilseed rape(Brássica napus L.) and spring wheat(Tríticum aestívum L.)[J]. Environmental Pollution, 2013, 182: 335-342. DOI:10.1016/j.envpol.2013.07.035 |
| [17] |
Sasmaz A, Sasmaz M. The phytoremediation potential for strontium of indigenous plants growing in a mining area[J]. Environmental & Experimental Botany, 2009, 67(1): 139-144. |
| [18] |
Tsialtas J T, Matsi T, Barbayiannis N, et al. Strontium absorption by two trifolium, species as influenced by soil characteristics and liming[J]. Water, Air, & Soil Pollution, 2003, 144(1): 363-373. |
| [19] |
Moyen C, Roblin G. Uptake and translocation of strontium in hydroponically grown maize plants, and subsequent effects on tissue ion content, growth and chlorophyll a/b ratio:Comparison with Ca effects[J]. Environmental & Experimental Botany, 2010, 68(3): 247-257. |
| [20] |
Lai J L, Fu Q, Tao Z Y, et al. Analysis of the accumulation and redistribution patterns of cesium in Vicia faba, grown on contaminated soils[J]. Journal of Environmental Radioactivity, 2016, 164: 202-208. DOI:10.1016/j.jenvrad.2016.07.036 |
| [21] |
赖金龙, 付倩, 陶宗娅, 等. 3种农作物可食用部分对铯的蓄积特性[J]. 食品科学, 2016, 37(9): 87-91. LAI Jin-long, FU Qian, TAO Zong-ya, et al. Characteristics of cesium accumulation in edible portion of three crops[J]. Food Science, 2016, 37(9): 87-91. DOI:10.7506/spkx1002-6630-201609017 |
| [22] |
Brambilla M, Fortunati P, Carini F. Foliar and root uptake of 134Cs, 85Sr and 65Zn in processing tomato plants Lycopersicon esculentum Mill[J]. Journal of Environmental Radioactivity, 2002, 60(3): 351-363. DOI:10.1016/S0265-931X(01)00109-6 |
| [23] |
Malek M A, Hinton T G, Webb S B. A comparison of 90Sr and 137Cs uptake in plants via three pathways at two Chernobyl-contaminated sites[J]. J Environ Radioact, 2002, 58(2/3): 129-141. |
| [24] |
Beresford N A, Broadley M R, Howard B J, et al. Estimating radionuclide transfer to wild species——data requirements and availability for terrestrial ecosystems[J]. Journal of Radiological Protection Official Journal of the Society for Radiological Protection, 2004, 24(4A): A89-103. DOI:10.1088/0952-4746/24/4A/006 |
| [25] |
Kozhevnikova A D, Seregin I V, Bystrova E I, et al. Effects of heavy metals and strontium on division of root cap cells and meristem structural organization[J]. Russian Journal of Plant Physiology, 2007, 54(2): 257-266. DOI:10.1134/S1021443707020148 |
| [26] |
Seregin I V, Kozhevnikova A D. Strontium transport, distributio n, and toxic effects on maize seedling growth[J]. Russian Journal of Plant Physiology, 2004, 51(2): 215-221. DOI:10.1023/B:RUPP.0000019217.89936.e7 |
 2017, Vol. 36
2017, Vol. 36