文章信息
- 王庆海, 李翠, 陈超, 陈洁, 马雪菊, 却晓娥
- WANG Qing-hai, LI Cui, CHEN Chao, CHEN Jie, MA Xue-ju, QUE Xiao-e
- 芦苇对阿特拉津胁迫的生理响应及其与耐受性的关系
- Physiological responses of Phragmites australis to atrazine exposure and their relevance for tolerance
- 农业环境科学学报, 2017, 36(10): 1968-1977
- Journal of Agro-Environment Science, 2017, 36(10): 1968-1977
- http://dx.doi.org/10.11654/jaes.2017-0461
文章历史
- 收稿日期: 2017-03-29
- 接受日期: 2017-06-21
2. 中国林业科学研究院荒漠化研究所, 北京 100091
2. Institute of Desertification Studies, Chinese Academy of Forestry, Beijing 100091, China
阿特拉津是目前世界各国应用最广泛的化学除草剂之一,我国也有近40年的应用历史。阿特拉津具有较强的水溶性,很容易进入地表径流和地下水,是水体残留检出频率最高的除草剂之一,曾经大量使用阿特拉津的国家在地表水和地下水中均发现阿特拉津的残留[1]。我国长江流域、黄河流域、太湖流域和松花江流域等重点流域地表水中阿特拉津的样点检出率为100%,具有潜在生态风险[2]。地表水的除草剂污染已成为继水体富营养化之后,又一个导致水生生态系统植物种群退化和消亡的主要因素[3]。
水生植物作为水生生态系统的初级生产者,在维持水生态系统的结构和功能,以及生物多样性方面具有不可替代的作用。挺水植物是水生植物的一种重要生活型,是通过长期适应水环境而形成的趋同性生态适应类型[4]。挺水植物种类繁多,景观丰富,用于污染环境修复植物的筛选空间更为广阔。已有研究表明,一些挺水植物对阿特拉津具有较强的耐受性[5-7]。黄花鸢尾(Iris pseudacorus)能在阿特拉津浓度高达32 mg·L-1的营养液中存活[8],还能适应干湿和中度荫蔽的环境,可作为恢复湿地的先锋植物[9]。香蒲(Typha latifolia)在阿特拉津浓度不超过3 mg·L-1时,种子萌发不受影响,而且胚芽鞘生长得更快[10]。水稻(Oryza sativa)则对阿特拉津较为敏感,苗期的安全浓度仅为0.5 mg·L-1 [11-12]。一般而言,敏感植物在阿特拉津胁迫下,生物量累积会受到显著抑制。因此,植物的相对生长率是反映植物耐受性的重要指标之一[5]。研究发现阿特拉津可显著降低水生植物的叶绿素含量[13],但植物会通过改变叶绿素的组分比例来应对胁迫。此外,植物还可以通过活性氧等信号分子调控自身超氧化物歧化酶(SOD)、过氧化物酶(POD)等抗氧化酶的活性来缓解阿特拉津造成的伤害,以增强对阿特拉津胁迫的耐受性[14]。耐受性不同的植物,抗氧化酶对污染物胁迫的响应也有较大差异[15]。还有,测定叶绿素荧光也是评价阿特拉津对植物生态毒性的快速、有效方法[16-17]。
水体农药污染对水生植物的生态毒性以及植物的耐受性报道较多。但现有研究未对这些能够减轻植物毒害的途径与植物耐受性的关系进行分析,也就无法确定这些变化对耐受机制的重要性。这些信息的缺乏直接影响修复植物快速准确的筛选,在一定程度上延长了修复周期,限制了该技术的推广应用。芦苇(Phragmites australis)是禾本科多年生挺水草本植物,扩繁能力强,分布广泛,可在除森林生境外的各种有水源的空旷地带形成连片的群落,对水体中的重金属[18]、氨氮[19]和有机污染物[20]等具有较好的去除效果。本实验以芦苇作为主要材料,研究了阿特拉津浓度和培养时间对芦苇叶绿素含量、抗氧化酶活性和叶绿素荧光动力学参数等方面的影响,明确芦苇对阿特拉津的生理响应,并分析这些生理变化与植物耐受性的关系,为阿特拉津污染水体治理选择修复植物提供依据。
1 材料与方法 1.1 实验材料实验所用植物材料芦苇为北京市农林科学院温室营养钵培育。挑选长势一致的幼苗进行移栽(平均鲜重18.0±3.1 g),移栽前清洗幼苗根部泥土,置于10% Hoagland营养液中培养1周进行缓苗,将预培养后的幼苗移入塑料培养桶(直径30 cm,高26 cm)中进行实验。塑料桶外用锡箔纸包裹遮光。每个培养桶中放入3株幼苗。实验所用阿特拉津为380 g·L-1阿特拉津悬浮剂(山东滨农科技有限公司生产)。
1.2 实验设计阿特拉津在我国重点流域地表水中最高浓度为1 289.5 ng·L-1[2],为保证阿特拉津对芦苇保持高浓度的逆境胁迫,快速得到阿特拉津对芦苇生理毒性效应的相关数据,按倍数法设置浓度梯度依次为0.5、1、2、4、8 mg·L-1,空白对照不添加阿特拉津。先利用380 g·L-1阿特拉津悬浮剂配制16 mg·L-1母液,然后利用10% Hoagland营养液稀释至目标浓度,添加完后每桶培养液的总体积为10 L。培养液为保持水体中阿特拉津浓度的相对稳定,在每个培养桶上标记水位线,每日添加营养液至水位线。每周更换含有相应阿特拉津浓度的培养液,使得整个实验周期阿特拉津对芦苇的胁迫浓度保持相对稳定。每个处理设置6个重复(用于2次取样,每次取3个重复),每个重复含有3株幼苗。所有处理均置于日光温室培养,培养期间温室内温度为21~35 ℃,光强约为自然光强的60%。试验共进行2周,每周取一批植物样,分为两部分:一部分用于植物生理指标测定,另一部分烘干至恒重,精确称量后计算植物的相对生长率(Relative Growth Rate,RGR),公式如下:
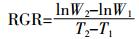
式中:W1和W2分别是在时间T1和T2时植物样的干重。
1.3 取样和生理指标的测定分别于培养1周和2周后进行取样。第1周每个处理随机取3个重复,共计18个样(6处理×3重复);第2周取剩下的3个重复。每次取样先原位测定叶绿素荧光后,再将幼苗从培养液中取出,用自来水冲洗后带回实验室进行生理指标的测定。叶绿素a(Chla)和叶绿素b(Chlb)含量测定采用丙酮-乙醇浸泡提取法[21];超氧化物歧化酶(SOD)采用氮蓝四唑法,过氧化物酶(POD)采用愈创木酚法[22]。叶绿素荧光参数采用IMAGING-PAM(Walz,德国)测定,测定前先将叶片暗适应20 min,照射检测光后测得初始荧光F0,照射饱和激发光后测得Fm。每个重复选取芦苇3株,每株选择倒数第5片功能叶片中部进行测定,则每个处理共计9个测定位点。
实验期间,每天从培养容器中取100 mL水样,按照Wang等[23]的方法测定阿特拉津残留水平。水样由乙酸乙酯提取并经弗罗里硅土柱净化。净化后样品采用岛津GC2010气相色谱仪结合ECD检测器及石英毛细管柱RTX 1701 AOC 20i(30.0 m×0.32 mm× 0.25 μm)检测。柱温采用变温程序:初始温度100 ℃保持3 min,以30 ℃·min-1的速率升至230 ℃,保持5 min。载气为氮气,流速为1.09 mL·min-1。检出限为0.001 mg·L-1。
1.4 数据分析使用SAS 9.0统计分析软件进行方差分析,不同阿特拉津浓度处理间差异显著性检验采用新复极差法(Duncan’s法),胁迫1周和2周间差异显著性检验采用t检验法;以RGR为依变量,对应的生理指标(Chla,Chlb,POD、SOD活性,F0,Fm和qN)为自变量,进行逐步回归分析。采用Origin9.2绘图,图中误差线表示标准差。
2 结果与讨论 2.1 培养液中阿特拉津的浓度变化培养液中阿特拉津残留浓度随时间延长而下降。初始浓度为0.5、1、2、4、8 mg·L-1时,有植物处理浓度开始出现显著低于无植物对照的时间分别为4、2、5、7、7 d。至第7 d,有植物处理的浓度均显著低于无植物对照。各处理培养液中阿特拉津残留浓度与时间的关系,可用一级动力学反应方程y=ae-Kx(y为阿特拉津残留浓度,x为时间,a为阿特拉津初始浓度,K为消除速率常数)很好地拟合(图 1A~图 1E);阿特拉津在水培系统中的消除速率,随其浓度的升高而降低(图 1F)。有植物条件下,8 mg·L-1处理显著低于0.5、1、2 mg·L-1处理,与4 mg·L-1处理差异不显著;无植物条件下,8 mg·L-1处理则显著低于其他各浓度处理。有植物的大于无植物的,这种差异除0.5 mg·L-1处理外,其他浓度处理均达到显著水平(P < 0.05),可见植物有助于培养液中阿特拉津的去除。研究表明大须芒草(Andropogon gerardii)和柳枝稷(Panicum vergatum)21 d可吸收培养液中约40%的阿特拉津[24];而且在植物修复系统中,阿特拉津的半衰期明显缩短,植物的去除贡献占主导作用[23]。
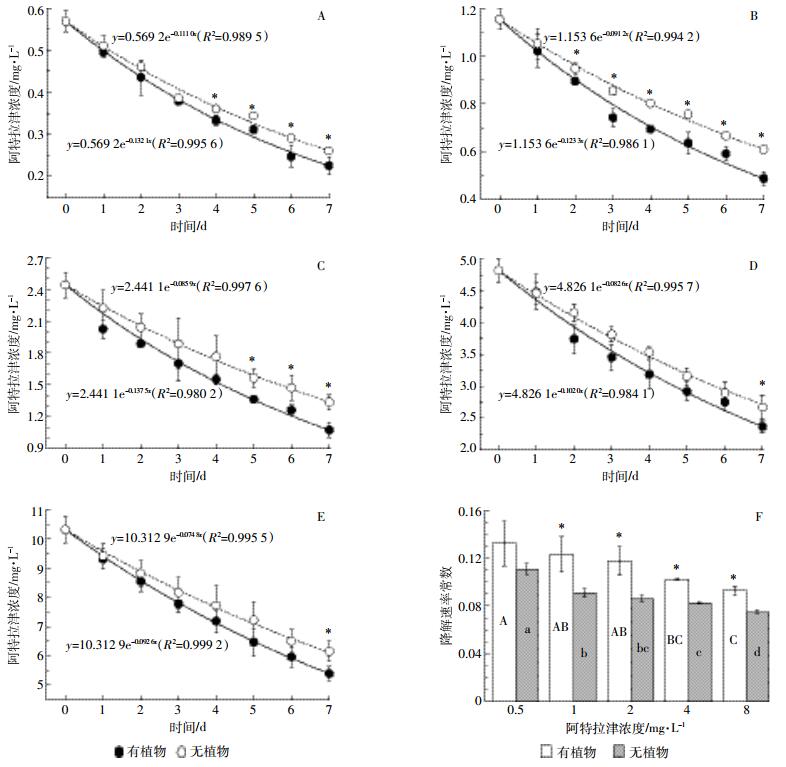
|
| 图A~E中,*表示有植物和无植物处理间阿特拉津浓度差异显著;图F中不同大写字母表示有植物条件下不同浓度阿特拉津的消除速率常数差异显著,不同小写字母表示无植物条件下不同浓度阿特拉津的消除速率常数差异显著,*表示相同浓度条件下有植物和无植物处理间差异显著(P < 0.05) * represents significant difference between with and without plant treatment in figure A~E; Different uppercase lettersrepresent significant differences among treatments with plants, different lowercase letters represent significant differences among treatments without plants, * represents significant difference between with and without plant treatment(P < 0.05) in figure F 图 1 培养液中阿特拉津1周内的浓度变化[0.5 mg·L-1(A),1 mg·L-1(B),2 mg·L-1(C),4 mg·L-1(D),and 8 mg·L-1(E)]及消除速率常数(F) Figure 1 Atrazine disappearance in culture solution at the level of 0.5 mg·L-1(A), 1 mg·L-1(B), 2 mg·L-1(C), 4 mg·L-1(D), and 8 mg·L-1(E), and its disappearance rate constant(F) during the experimental period |
芦苇用含有阿特拉津的培养液培养2周内,各浓度处理较初始生物量均在增加,增加的量随浓度的增加而下降;但培养2周时,阿特拉津各浓度处理芦苇部分叶片失绿发黄,并出现枯斑,生物量较培养1周时下降(表 1)。阿特拉津各浓度处理芦苇的相对生长率(RGR)均显著低于空白对照。培养1周,最高浓度8 mg·L-1处理的RGR显著低于其他浓度处理;培养2周,4 mg·L-1处理亦与8 mg·L-1处理处于同一水平。与培养1周相比,培养2周各处理的RGR均下降。可见阿特拉津胁迫会显著抑制芦苇生物量的增加,而且随着胁迫时间的延长,阿特拉津对芦苇生物量的抑制作用加强。特别是胁迫2周时芦苇部分叶片枯落,生物量下降,生长停止。叶片失绿变黄,产生大面积锈色枯斑,继而全叶枯死脱落,生长受抑制,是敏感植物产生的典型药害特征[25]。由此可见,此时芦苇已处于严重胁迫状态。研究表明美人蕉(Canna indica)在0.1~15 mg·L-1的阿特拉津中暴露14 d,生物量增加也受到抑制,而且具有明显的剂量效应[26];但是菖蒲(Acorus calamus)在30 mg·L-1阿特拉津胁迫下生物量仍可增加。综合这些研究结果可以看出芦苇对阿特拉津比较敏感。另有研究表明,阿特拉津胁迫早期植物的生长变化显著,是植物耐受性评价的合适指标[5]。
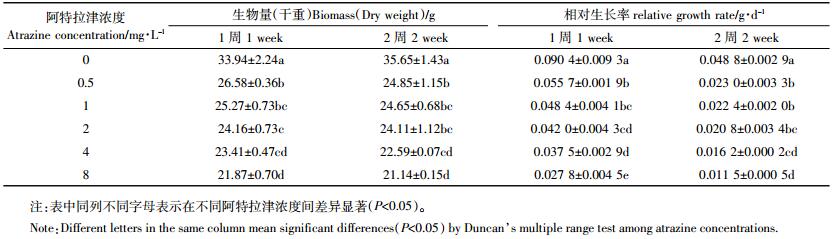
|
芦苇叶绿素a(Chla)和叶绿素b(Chlb)含量随阿特拉津剂量的升高而降低(图 2)。各浓度处理胁迫1周,Chla含量均显著低于对照,2、4、8 mg·L-1处理Chlb亦显著(P<0.05)低于对照(图 2A);胁迫2周,除0.5 mg·L-1处理外,其他浓度处理Chla和Chlb均显著低于对照。与胁迫1周相比,胁迫2周Chlb无显著变化,而Chla包括对照在内的各个处理均显著下降(图 2B)。由此可见,随着培养时间延长,除阿特拉津胁迫外,还有其他原因引起Chla下降。研究证实类囊体膜的完整性受损、叶绿素合成途径中关键酶活性的降低和降解途径中酶活性的升高等是叶绿素浓度降低的主要原因[27]。阿特拉津胁迫1周后,0.5、1、2、4 mg·L-1处理Chla/b显著降低(P<0.05),8 mg·L-1处理与对照处于同一水平。然而,胁迫2周后(图 2C),各浓度处理Chla/b与对照差异不显著(P>0.05)。叶绿素是高等植物进行光合作用的物质基础,许多研究表明阿特拉津能够使植物叶绿素含量下降,并使其组分发生改变[13, 26]。但Schwarzschild等[28]发现阿特拉津对沉水植物Zosteru marina的叶绿素含量无显著影响。可见,阿特拉津对叶绿素含量的影响因水生植物的生态型不同而不同。一般来说,对阿特拉津耐受的植物的Chla/b比值较低[29]。阿特拉津胁迫后期,在叶绿素含量降低的情况下,植株通过调整Chla/b比值来提高叶片的光合能力,这也是其对阿特拉津胁迫的一种适应性保护机制。对阿特拉津敏感的植物由于叶绿素含量降低,光合作用受到抑制而表现出叶片黄萎,因此Lytle等[30]认为叶绿素含量可作为评价植物对阿特拉津胁迫的耐受性的一个生理指标。
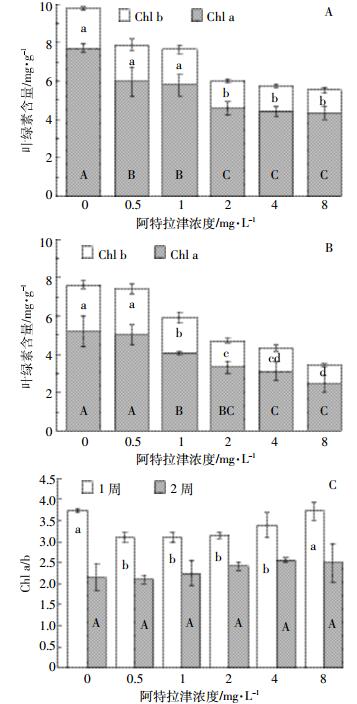
|
| 图A和图B分别为胁迫1周和2周时芦苇叶绿素含量,图柱中不同大写字母表示不同阿特拉津浓度处理间chla差异显著,不同小写字母表示不同阿特拉津浓度处理间chlb差异显著(P < 0.05);图C为胁迫1周和2周芦苇叶绿素含量a和b比值,图柱中不同小写和大写字母分别表示胁迫1周和2周时不同阿特拉津浓度处理间差异显著(P < 0.05)。下同 Figure A and B represent chlorophyll content of P. australis with 1-week and 2-week exposure to atrazine stress, respectively, and different uppercase and lowercase letters represent significant differences of Chla and Chlb among atrazine treatments, respectively; figure C represents Chla/b, and different lowercase and uppercase letters represent significant differences among atrazine treatments with 1-week and 2-week exposure to atrazine stress, respectively. The same below 图 2 阿特拉津胁迫下芦苇叶绿素含量的变化 Figure 2 Effects of atrazine at different levels on chlorophyll content of P. australis |
芦苇叶绿素荧光参数变化与阿特拉津浓度密切相关。初始荧光(F0)随阿特拉津浓度升高而升高,其中2、4、8 mg·L-1处理显著高于空白对照(图 3A);最大荧光产量(Fm)则随浓度的升高而下降,各浓度处理均显著(P < 0.05)低于空白对照(图 3B)。叶绿体光系统Ⅱ(PSⅡ)潜在活性(Fv/F0)和最大光化学效率(Fv/Fm)随阿特拉津浓度的增加而降低(图 3C,图 3D),各浓度处理显著低于空白对照,而且浓度间也表现出显著差异(P < 0.05)。非光化学淬灭系数(qN)胁迫1周时随阿特拉津浓度的增加而增加,胁迫2周时随阿特拉津浓度的增加呈现先增加后降低的趋势;整个胁迫期间各浓度处理均显著(P < 0.05)高于空白对照(图 3E)。可以看出,阿特拉津对芦苇PSⅡ的影响随阿特拉津剂量的增加而加剧。这与阿特拉津的作用机理是一致的,该除草剂正是通过阻碍光合作用中光系统Ⅱ中的电子转移而抑制植物的光化合成反应[31]。qN是PSⅡ天线色素吸收的光能不能用于光合电子传递而以热的形式耗散掉的光能部分,及时地耗散过量的光能是对光合机构的保护[32]。芦苇qN值显著升高,表明其对阿特拉津具有一定的耐受性,芦苇植株可以通过增大热耗散来减轻过剩光能对PSⅡ的影响。但胁迫2周较1周时qN值的显著降低表明芦苇对阿特拉津仅是短期耐受。
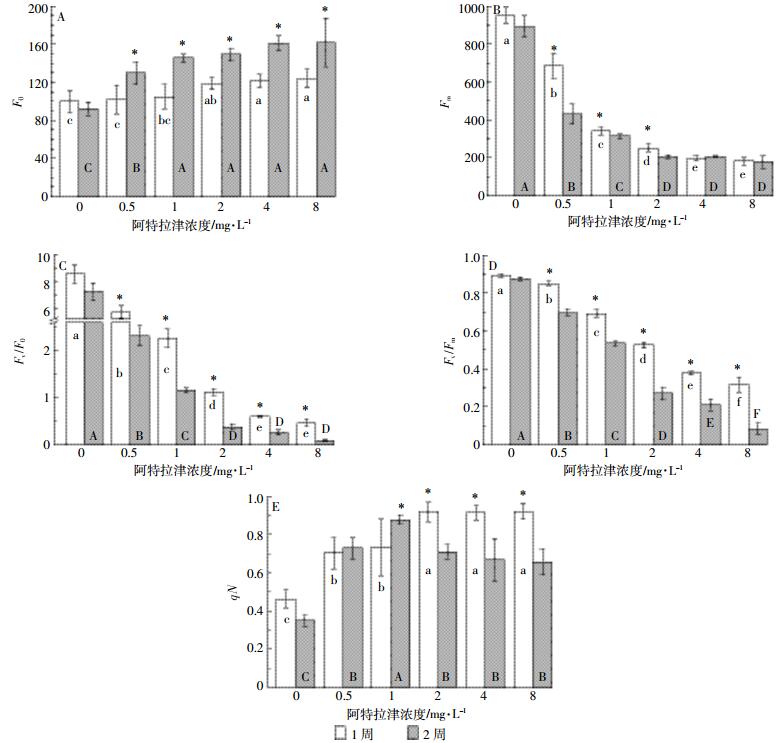
|
| 图中不同小写和大写字母分别表示胁迫1周和2周时不同阿特拉津浓度处理间差异显著,*表示同一浓度处理胁迫1周和2周间差异显著(P < 0.05)。下同 Different lowercase and uppercase letters represent significant differences among atrazine treatments with 1-week and 2-week exposure to atrazine stress, respectively, * represents significant difference between 1-week and 2-week exposure to atrazine stress(P < 0.05). The same below 图 3 阿特拉津胁迫下芦苇叶绿素荧光参数F0(A)、Fm(B)、Fv/F0(C)、Fv /Fm(D)和qN(E)的变化 Figure 3 Effects of atrazine at different levels on F0(A), Fm(B), Fv/F0(C), Fv /Fm(D), and qN(E) of P. australis |
芦苇叶绿素荧光参数变化也受阿特拉津胁迫时间的影响。胁迫2周后,各浓度处理的F0显著高于1周(图 3A);0.5、1 mg·L-1和2 mg·L-1处理的Fm显著低于1周,而高浓度处理4 mg·L-1和8 mg·L-1则与1周无显著差异(图 3B);Fv/F0和Fv/Fm较胁迫1周也显著降低(图 3C,图 3D);1、2、4 mg·L-1和8 mg·L-1处理的qN显著低于1周,而低浓度处理0.5 mg·L-1则与1周无显著差异(图 3E)。qN值2周后的显著降低,说明持续的阿特拉津胁迫已造成光合机构失活或破坏。可见,随着胁迫时间延长,阿特拉津对芦苇的抑制作用进一步增强。胁迫1周,0.5 mg·L-1处理Fv/F0和Fv /Fm分别降低了33%和5%,而8 mg·L-1处理降幅达到95%和65%(图 4)。胁迫1周和2周期间,Fv /F0和Fv /Fm均随着阿特拉津浓度的增加而下降,Fv /F0和Fv /Fm抑制率与阿特拉津浓度的对数有很好的剂量效应关系。Fv /F0和Fv /Fm下降主要是由于Fm下降,高浓度处理光合效率急剧下降的原因还有F0升高。F0与叶片叶绿素浓度有关,而Fm则反映通过PSⅡ的电子传递情况[32]。F0增加和Fm下降也表明植物在阿特拉津胁迫下电子传递链受阻,光合机构被破坏,叶绿素含量降低。
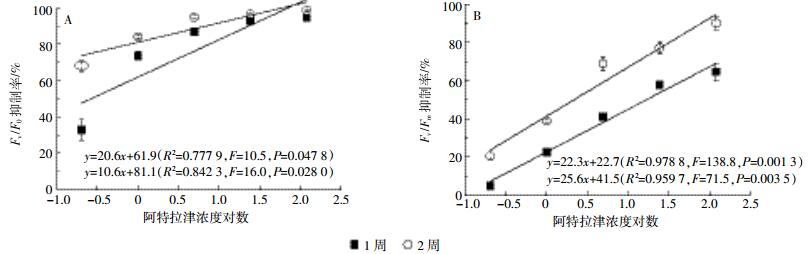
|
| 图 4 阿特拉津对Fv /F0和Fv /Fm的抑制作用 Figure 4 Linear regression relation of atrazine concentrations to Fv /F0 and Fv /Fm inhibition percent |
阿特拉津胁迫1周后,各浓度处理芦苇POD活性显著高于空白对照。其中0.5~4 mg·L-1处理,POD活性随阿特拉津浓度的升高而呈逐渐增强的趋势;但8 mg·L-1处理与4 mg·L-1处理相比,又出现显著下降(图 5A)。胁迫2周后,芦苇POD活性随阿特拉津浓度的升高而呈先增强后减弱的趋势。1、2、4 mg·L-1处理的POD活性显著高于对照;0.5、4、8 mg·L-1处理的POD活性显著低于胁迫1周。POD是植物抗氧化系统中重要的酶,可催化植物体内自由基、活性氧等的氧化分解,是一种对环境因子比较敏感的酶。本研究中,阿特拉津胁迫下植物体内POD活性呈增加趋势,POD活性随阿特拉津浓度变化存在先扬后抑的过程:即在轻度胁迫下,植物体本身能提高POD等保护酶的活性,以清除有害物质;但随着胁迫的加强,植物受害加重,POD活性下降。张坤等[14]发现皇竹草叶片POD活性在阿特拉津胁迫下也呈现出类似的变化,胁迫持续时间是影响POD活性的最主要因素。但芦苇SOD活性随阿特拉津浓度和胁迫时间的变化与POD活性有较大差异。各浓度阿特拉津胁迫1周和2周,芦苇SOD活性均与空白对照无显著差异(图 5B),但1、2、4 mg·L-1处理的SOD活性胁迫2周显著高于胁迫1周。这种差异可能体现了植物在逆境条件下对不同抗氧化酶应对胁迫的调控。
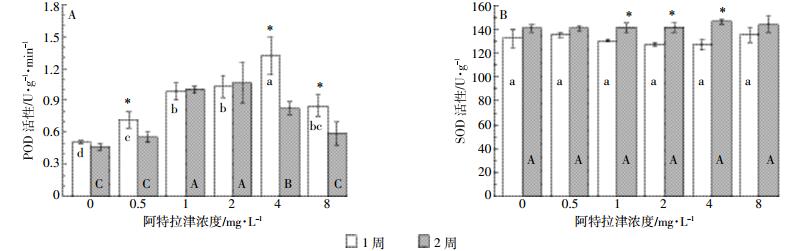
|
| 图 5 阿特拉津胁迫对芦苇POD(A)和SOD(B)活性的影响 Figure 5 Effects of atrazine at different levels on POD(A) and SOD(B) activities of P. australis |
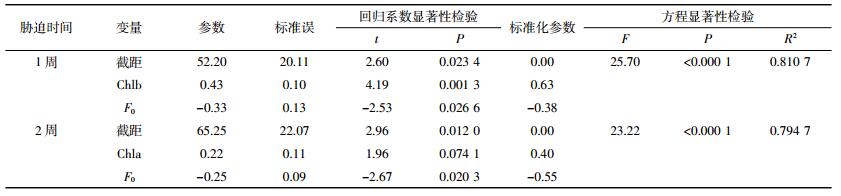
植物的生长状况是植物在逆境胁迫下的综合反映,而且生长指标(生物量、株高、根长等)直观、易得,因此常用来作为耐受性判断的依据。在此,以RGR为依变量,对应的生理指标(Chla、Chlb、POD、SOD、F0、Fm和qN)为自变量,利用逐步回归分析方法分别筛选胁迫1周和2周对芦苇RGR影响较大的变量(α=0.10水平进入模型),分析生理指标与植物耐受性的关系。分析结果显示回归方程均达到极显著水平(表 2)。胁迫1周,Chlb和F0对芦苇RGR的影响较大而被引入方程;胁迫2周,Chla和F0对芦苇RGR的影响较大而被引入方程。由此可见,在胁迫的不同阶段,植物生理响应与生长发育的关系存在差异。胁迫早期,除了F0与RGR关系密切外,植物的Chlb也对RGR有较大影响;从标准化参数可以看出,Chlb对RGR的直接作用大于F0。Chlb不仅具有吸收和传递光能的作用,而且在调控光合机构天线的大小、维持捕光天线复合体的稳定性及对各种环境的适应等过程中都起作用[33]。可见胁迫早期,植物对阿特拉津的耐受性主要体现为Chlb在植物维持天线系统大小和捕光效率方面的功能。随着胁迫时间的延长,Chlb对RGR的影响减弱,Chla成为影响RGR的主要因素。F0在胁迫的2个时间段均为RGR的重要影响因素。这说明在整个胁迫期间,叶绿素浓度与芦苇响应阿特拉津胁迫的关系均较为密切,植物通过多种调节方式耗散多余的能量,以减少活性氧的累积及其对叶绿体膜的氧化伤害,进而减少了叶绿素降解,这样就可以保持一定浓度的叶绿素来保证对光能的利用,维持必要的光合效率。
(1)阿特拉津浓度≤8 mg·L-1时,暴露1周时芦苇仍能生长,但相对生长率受到显著抑制;暴露2周时芦苇生长停止并出现了营养物质的消耗,处于严重胁迫状态。
(2)阿特拉津对芦苇生理指标的影响具有明显的剂量效应和时间效应。芦苇叶绿素含量、Fm、Fv/F0和Fv /Fm随阿特拉津剂量的升高而降低,F0随阿特拉津浓度升高而升高。暴露2周时高浓度处理qN的显著下降表明芦苇耐受阿特拉津胁迫的短期性。
(3)芦苇对阿特拉津比较敏感,F0与其响应胁迫的关系最为密切。植物通过增加耗散多余能量减小叶绿体损伤,从而保持一定浓度的叶绿素来维持必要的光合作用,应对阿特拉津胁迫。
| [1] |
Chalifour A, LeBlanc A, Sleno L, et al. Sensitivity of Scenedesmus obliquus and Microcystis aeruginosa to atrazine:Effects of acclimation and mixed cultures, and their removal ability[J]. Ecotoxicology, 2016, 25(10): 1822-1831. DOI:10.1007/s10646-016-1728-5 |
| [2] |
徐雄, 李春梅, 孙静, 等. 我国重点流域地表水中29种农药污染及其生态风险评价[J]. 生态毒理学报, 2016, 11(2): 347-354. XU Xiong, LI Chun-mei, SUN Jing, et al. Residue characteristics and ecological risk assessment of twenty-nine pesticides in surface water of major river-basin in China[J]. Asian Journal of Ecotoxicology, 2016, 11(2): 347-354. |
| [3] |
Knauert S, Singer H, Hollender J, et al. Phytotoxicity of atrazine, isoproturon, and diuron to submersed macrophytes in outdoor mesocosms[J]. Environmental Pollution, 2010, 158(1): 167-174. DOI:10.1016/j.envpol.2009.07.023 |
| [4] |
刘建康. 高级水生生物学[M]. 北京: 科学出版社, 1999. LIU Jian-kang. Advanced hydrobiology[M]. Beijing: Science Press, 1999. |
| [5] |
Wang Q H, Que X E, Zheng R L, et al. Phytotoxicity assessment of atrazine on growth and physiology of three emergent plants[J]. Environmental Science and Pollution Research, 2015, 22(13): 9646-9657. DOI:10.1007/s11356-015-4104-8 |
| [6] |
王庆海, 张威, 李翠, 等. 水体阿特拉津残留对千屈菜的毒性效应[J]. 应用与环境生物学报, 2011, 17(6): 814-818. WANG Qing-hai, ZHANG Wei, LI Cui, et al. Phytotoxicity of atrazine residue in water to Lythrum salicaria[J]. Chinese Journal of Applied and Environmental Biology, 2011, 17(6): 814-818. |
| [7] |
王庆海, 张威, 却晓娥, 等. 水体阿特拉津残留对水葱生物量及生理特性的影响[J]. 植物生态学报, 2011, 35(2): 223-231. WANG Qing-hai, ZHANG Wei, QUE Xiao-e, et al. Effects of atrazine residue in water on biomass and physiological characteristics of Scirpus tabernaemontani[J]. Chinese Journal of Plant Ecology, 2011, 35(2): 223-231. |
| [8] |
Wang Q H, Que X E, Li C, et al. Phytotoxicity of atrazine to emergent hydrophyte, Iris pseudacorus L.[J]. Bulletin of Environmental Contamination and Toxicology, 2014, 92(3): 300-305. DOI:10.1007/s00128-013-1178-1 |
| [9] |
Pai A, McCarthy B C. Suitability of the medicinal plant, Acorus calamus L., for wetland restoration[J]. Natural Areas Journal, 2010, 30(4): 380-386. DOI:10.3375/043.030.0402 |
| [10] |
Moore M T, Locke M A. Phytotoxicity of atrazine, S-Metolachlor, and permethrin to Typha latifolia(Linneaus) germination and seedling growth[J]. Bulletin of Environmental Contamination and Toxicology, 2012, 89(2): 292-295. DOI:10.1007/s00128-012-0682-z |
| [11] |
Jun Z J, Chen L Y, Jin Z J, et al. Accumulation and toxicological response of atrazine in rice crops[J]. Ecotoxicology and Environmental Safety, 2014, 102: 105-112. DOI:10.1016/j.ecoenv.2013.12.034 |
| [12] |
米长虹, 蔡思义. 水田环境中阿特拉津允许浓度研究[J]. 农业环境保护, 1996, 15(2): 89-90. MI Chang-hong, CAI Si-yi. Study on adopted concentration of atrazine in paddy field[J]. Agro-environmental Protection, 1996, 15(2): 89-90. |
| [13] |
李翠, 温海峰, 郑瑞伦, 等. 阿特拉津胁迫对菖蒲的生理毒性效应[J]. 农业环境科学学报, 2016, 35(10): 1895-1902. LI Cui, WEN Hai-feng, ZHENG Rui-lun, et al. Phytotoxicity of atrazine to Acorus calamus L.[J]. Journal of Agro-Environment Science, 2016, 35(10): 1895-1902. DOI:10.11654/jaes.2016-0301 |
| [14] |
张坤, 李元, 祖艳群, 等. 皇竹草活性氧代谢对阿特拉津胁迫的响应特征[J]. 西北植物学报, 2013, 33(12): 2479-2485. ZHANG Kun, LI Yuan, ZU Yan-qun, et al. Response characteristics of reactive oxygen metabolism in Pennisetum hydridum to atrazine stress[J]. Acta Botanica Boreali-Occidentalia Sinica, 2013, 33(12): 2479-2485. |
| [15] |
Mitton F M, Ribas F J L, Gonzalez Mariana, et al. Antioxidant responses in soybean and alfalfa plants grown in DDTs contaminated soils:Useful variables for selecting plants for soil phytoremediation?[J]. Pesticide Biochemistry and Physiology, 2016, 130: 17-21. DOI:10.1016/j.pestbp.2015.12.005 |
| [16] |
Iriel A, Novo J M, Cordon G B, et al. Atrazine and methyl viologen effects on chlorophyll-a fluorescence revisited-implications in photosystems emission and ecotoxicity assessment[J]. Photochemistry and Photobiology, 2014, 90(1): 107-112. DOI:10.1111/php.2013.90.issue-1 |
| [17] |
Küster A, Altenburger R. Development and validation of a new fluorescence-based bioassay for aquatic macrophyte species[J]. Chemosphere, 2007, 67(1): 194-201. DOI:10.1016/j.chemosphere.2006.08.023 |
| [18] |
黄淑萍, 陈爱侠, 常亚飞, 等. 皂河湿地植物对多种重金属污染湿地的修复研究[J]. 环境工程, 2016, 34(6): 177-181, 154. HUANG Shu-ping, CHEN Ai-xia, CHANG Ya-fei, et al. Phytoremediation on wetland in Zaohe river watershed contaminated with multi heavy matels[J]. Environmental Engineering, 2016, 34(6): 177-181, 154. |
| [19] |
仝欣楠, 王欣泽, 何小娟, 等. 人工芦苇湿地氨氮污染物去除及氨氧化菌群落多样性分析[J]. 环境科学研究, 2014, 27(2): 218-224. TONG Xin-nan, WANG Xin-ze, HE Xiao-juan, et al. Ammonia nitrogen removal and analysis of the ammonia-oxidizing bacterial community in horizontal subsurface flow constructed wetlands[J]. Research of Environmental Sciences, 2014, 27(2): 218-224. |
| [20] |
杨红军, 谢文军, 陆兆华. 芦苇湿地对造纸废水中有机污染物的去除效果及机理[J]. 环境工程学报, 2012, 6(7): 2201-2206. YANG Hong-jun, XIE Wen-jun, LU Zhao-hua. Efficiency and mechanism of reed wetlands to organic pollutants removal from papermaking wastewater[J]. Chinese Journal of Environmental Engineering, 2012, 6(7): 2201-2206. |
| [21] |
沈伟其. 测定水稻叶片叶绿素含量的混合液提取法[J]. 植物生理学通讯, 1988, 3(3): 62-64. SHEN Wei-qi. Extraction of mixed solution for determination of chlorophyll content in rice leaf blade[J]. Plant Physiology Communications, 1988, 3(3): 62-64. |
| [22] |
邹琦. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2000. ZOU Qi. The experimental guide for plant physiology[M]. Beijing: China Agriculture Press, 2000. |
| [23] |
Wang Q H, Zhang W, Li C, et al. Phytoremediation of atrazine by three emergent hydrophytes in a hydroponic system[J]. Water Science & Technology, 2012, 66(6): 1282-1288. |
| [24] |
Khrunyk Y, Schiewer S, Carstens K L, et al. Uptake of C14-atrazine by prairie grasses in a phytoremediation setting[J]. International Journal of Phytoremediation, 2017, 19(2): 104-112. DOI:10.1080/15226514.2016.1193465 |
| [25] |
陈乐, 赵莹莹, 王媛媛, 等. 细菌SnebYK诱导大豆抗阿特拉津的效果评价[J]. 中国油料作物学报, 2014, 36(5): 641-647. CHEN Le, ZHAO Ying-ying, WANG Yuan-yuan, et al. Evaluation of bacterial strain SnebYK induced soybean against atrazine[J]. Chinese Journal of Oil Crop Sciences, 2014, 36(5): 641-647. DOI:10.7505/j.issn.1007-9084.2014.05.013 |
| [26] |
Dong J, Wang L, Ma F, et al. Effects of Funnelliformis mosseae inoculation on alleviating atrazine damage in Canna indica L. Var. Flava Roxb[J]. International Journal of Phytoremediation, 2017, 19(1): 46-55. DOI:10.1080/15226514.2016.1216079 |
| [27] |
王颖, 郭世荣, 束胜, 等. 外源亚精胺对盐胁迫下菠菜叶绿素合成前体含量的影响[J]. 西北植物学报, 2015, 35(10): 2026-2034. WANG Ying, GUO Shi-rong, SHU Sheng, et al. Effects of exogenous spermidine on chlorophyll precursors content of spinach plants under salt stress[J]. Acta Botanica Boreali-Occidentalia Sinica, 2015, 35(10): 2026-2034. |
| [28] |
Schwarzschild A C, MacIntyre W G, Moore K A, et al. Zostera marina L. growth response to atrazine in root-rhizome and whole plant exposure experiments[J]. Journal of Experimental Marine Biology and Ecology, 1994, 183(1): 77-89. DOI:10.1016/0022-0981(94)90158-9 |
| [29] |
Burke J J, Wilson R F, Swafford J R. Characterization of chloroplasts isolated from triazine-susceptible and triazine-resistant biotypes of Brassica campestris L.[J]. Plant Physiology, 1982, 70(1): 24-29. DOI:10.1104/pp.70.1.24 |
| [30] |
Lytle J S, Lytle T F. Atrazine effects on estuarine macrophytes Spartina alterniflora and Juncus roemerianus[J]. Environmental Toxicology and Chemistry, 1998, 17(10): 1972-1978. DOI:10.1002/etc.v17:10 |
| [31] |
Al-Khatib K, Boydston R, Parker R, et al. Atrazine phytotoxicity to common bean and redroot pigweed under different temperatures[J]. Weed Science, 1992, 40(3): 364-370. |
| [32] |
张守仁. 叶绿素荧光动力学参数的意义及讨论[J]. 植物学通报, 1999, 16(4): 444-448. ZHANG Shou-ren. A discussion on chlorophyll fluorescence kinetics parameters and their significance[J]. Chinese Bulletin of Botany, 1999, 16(4): 444-448. |
| [33] |
郭春爱, 刘芳, 许晓明. 叶绿素b缺失与植物的光合作用[J]. 植物生理学通讯, 2006, 42(5): 967-973. GUO Chun-ai, LIU Fang, XU Xiao-ming. Chlorophyll-b deficient and photosynthesis in plants[J]. Plant Physiology Communications, 2006, 42(5): 967-973. |
 2017, Vol. 36
2017, Vol. 36