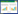文章信息
- 庞海东, 贺卓, 燕传明, 盛下放, 何琳燕
- PANG Hai-dong, HE Zhuo, YAN Chuan-ming, SHENG Xia-fang, HE Lin-yan
- 耐重金属的植物促生芽孢杆菌筛选及其强化香蒲去除Cd的作用
- Isolation of heavy metal resistant and plant growth promoting Bacillus strains and effects on cadmium removal by Typha angustifolia
- 农业环境科学学报, 2017, 36(11): 2314-2321
- Journal of Agro-Environment Science, 2017, 36(11): 2314-2321
- http://dx.doi.org/10.11654/jaes.2017-0648
文章历史
- 收稿日期: 2017-05-04
- 接受日期: 2017-07-24
近年来随着经济的迅速发展,矿业开发、工业生产、城市生活产生的废水排入水体,使水质逐渐恶化,其中重金属是主要的污染物。大量重金属的存在给水体生物造成了严重危害,甚至威胁着人体健康[1-3]。因此,水体重金属污染已经成为国内外亟需解决的环境问题。
水生植物修复技术是利用水生植物或其与微生物的共生关系清除污染物的一种环境生物技术,有学者认为来自禾本科、水葵科、金鱼藻科、香蒲科和小二仙草科的水生植物显示出相对强的重金属吸收能力[4-7]。目前被用于水体重金属处理的水生植物有:菖蒲、水葱、芦苇、香蒲、眼子菜、凤眼莲[8-10],其中香蒲对环境胁迫耐性较强,是国内外公认的湿地水生植物优势品种[11-12]。但是水生植物修复效果受到各种因素(如温度、植物株龄和生物量等)的影响而不稳定,且研究认为这种修复作用是水生植物和根际微生物的耦合作用,因此,微生物强化措施可能会用于提升系统去除重金属的整体功能。
微生物修复重金属污染水体的作用已有很多报道[13-14],但在受重金属污染的湖泊、湿地等自然水体中微生物难以附着,修复效率较低。植物根际或内生微生物能在健康植物根际或组织内栖居而对植物不造成实质性危害,并可以通过产生吲哚-3-乙酸(Indole Acetic Acid,IAA)和铁载体等促生物质促进植物生长、提高植物对重金属的耐受性和富集能力,而植物能够为附生的微生物提供生长所需的空间、空气和养分,有效增强根系微生物的活性。由此建立的微生物-植物联合修复技术已经成为土壤重金属修复领域的研究热点[15-16],但在水体重金属污染修复方面的应用还刚刚起步[17-19]。芽孢杆菌为革兰氏阳性菌,在缺乏营养或不良环境时能产生芽孢,抗逆性强,在工业、农业以及医疗卫生等领域都有着重要的应用价值。本研究通过筛选耐重金属的植物促生芽孢杆菌,考察菌株对香蒲生长和富集Cd的影响,以期为建立微生物强化水生植物联合修复体系提供菌种资源和技术途径,为发展重金属污染水域生态修复提供理论基础。
1 材料与方法 1.1 材料样品为南京市栖霞某矿区(32.07°~32.08°N,119.08°~119.10°E)湿地植物柳树、芦苇、香蒲的根和根际土壤。
LB培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,水1000 mL,固体培养基中再添加20 g琼脂。
供试植物为多年生水生或沼生草本植物狭叶香蒲(T. angustifolia),幼苗购自南京艺莲苑水生花卉公司。幼苗采回后用自来水清洗根部,选择长势、大小相同的幼苗用自来水复壮一周,待用。
1.2 芽孢杆菌的分离筛选参考刘炜等[20]和王璐等[21]的方法,采用系列稀释涂布平板培养法在LB固体培养基上分离、纯化植物根际和内生Cd抗性细菌。将采集的柳树幼苗、芦苇、香蒲,带回实验室后立刻进行细菌的分离。根际细菌的分离是将植物根部的大块土壤抖落,剪刀用75%乙醇表面消毒,剪取根部0.1 g装入10 mL无菌水中振荡30 min,将此溶液系列稀释后取0.1 mL涂布于含1 mg·L-1 Cd2+的LB固体培养基上。28 ℃培养72 h后,从中挑选长势良好、菌落形态不同的Cd抗性细菌单菌落,多次划线分离纯化后4 ℃条件下保存。根内细菌的分离是将植物根部用去离子水冲洗干净,用75%的酒精和2.5%的NaClO先后消毒,并用无菌水浸洗数次。将表面消毒的根部0.1 g置于无菌研钵内研磨至匀浆,加5 mL无菌水混匀,取0.1 mL涂布于含1 mg·L-1 Cd2+的LB固体培养基上,同时取最后一遍浸洗的无菌水0.1 mL涂布于LB固体培养基,以检测样品表面消毒是否彻底。28 ℃培养72 h后,若无菌水涂布的平板未长菌,则从Cd抗性平板上挑选长势良好、菌落形态不同的Cd抗性细菌单菌落,多次划线分离纯化后4 ℃条件下保存。然后将纯化后的菌株接种到3 mL液体LB培养基中,30 ℃摇床150 r·min-1振荡培养16~20 h,将菌体发酵液置于75~80 ℃水浴处理15 min,用接种环将菌液划线到LB固体平板上,30 ℃倒置培养24~48 h,能正常生长的视为芽孢杆菌。保存待用。
1.3 菌株的分子鉴定按常规方法提取细菌基因组DNA并以其为模板,用16S rRNA基因通用引物[22-23]27F:5′-AGAGTT-TGATCCTGGCTCAG-3′和1492R:5′-TACGGCTACCTTGTTACGACTT-3′进行PCR扩增。PCR产物用0.8%的琼脂糖凝胶电泳检测。扩增产物送南京金斯瑞生物科技有限公司测序。将所获得序列用BLAST软件与GenBank中已知的16S rRNA基因序列进行比对分析。
1.4 菌株的生物学特性试验菌株产多糖能力测定采用苯酚硫酸法[24],菌株淀粉酶活性测定采用水解圈法[25],菌株产吲哚乙酸(IAA)测定参考Gordon等[26]和Mayer[27]的方法,铁载体能力测定参考Schwyn等[28]的方法,溶磷实验测定参考Liu等[29]的方法。
1.5 菌株对环境条件的抗逆性参考王璐等[21]的方法,将供试菌株制成菌悬液,用灭过菌的牙签点样于不同条件的LB平板上,培养3~5 d,考察菌株对重金属浓度、pH、温度和盐浓度的适应性。其中重金属Pb2+、Zn2+终浓度为50、100、200、300 mg·L-1;Cu2+终浓度为10、20、50、100 mg·L-1;Cd2+终浓度为20、50、100、200、300 mg·L-1。温度设置为5、15、25、35、45 ℃,pH调节为4.0、5.0、6.0、7.0、8.0、9.0、10.0(用1 mol·L-1的HCl和1 mol·L-1的NaOH调节),NaCl质量百分比分别为0.5%、1.0%、2.0%、3.0%、5.0%、7.0%。
1.6 菌株联合香蒲去除水体Cd的作用将供试菌株接种于LB培养基中,30 ℃ 150 r·min-1振荡培养16~20 h至对数生长期,6000 r·min-1离心10 min收集菌体,用无菌去离子水将菌体重悬,调节菌悬液浓度至OD600为1.0。将香蒲幼苗根浸泡于菌悬液中30 min,移种于含Cd 2.5 mg·L-1的Hoagland营养液中,对照(CK)以等量的无菌去离子水处理,每组处理设置3个重复。每桶种植3株香蒲苗,装2 L Hoagland营养液。培养周期为20 d,每5 d用新鲜配制的Hoagland营养液将桶内溶液补充至2 L。
植物收获处理时,小心取出植株,用去离子水将植株清洗干净,将根部浸于浓度为0.01 mol·L-1的EDTA-Na2溶液中10 min,以去除根表的重金属离子。将植株地上部和根部用剪刀分开放置于牛皮纸袋内,于80 ℃烘箱内烘干至恒重,称量香蒲组织地上部和根部干重。植株样品烘干后用粉碎机粉碎,称取干燥的样品于微波消解仪中进行消解,定容后用ICP-OES测定Cd2+含量,计算香蒲组织的重金属含量和重金属总吸收量。取塑料桶内液体测定Cd2+浓度,按照下式计算各处理组的Cd去除率:
去除率=(初始水样Cd浓度-试验后水样Cd浓度)/初始水样Cd浓度×100%
1.7 数据处理所有试验数据均采用Microsoft Office Excel 2013和Prism处理并作图,采用SPSS 20.0对数据进行单因素方差分析,P<0.05表示差异显著。
2 结果与分析 2.1 菌株的生物学和种属确定从南京某矿区湿地中的柳树、芦苇、香蒲根际土壤和根内共分离纯化到63株细菌,这些细菌都对1 mg·L-1 Cd2+具有抗性。采用水浴法处理复筛,获得8株芽孢杆菌,分别编号为P21、P24、P29、P33、P34、P37、P39、P45。由表 1可以看出,这8株芽孢杆菌都能分泌IAA、铁载体、多糖和淀粉酶。菌株的IAA产量范围为1.2~35.6 mg·L-1,多糖产量范围为85.9~943.0 mg·L-1,淀粉水解圈直径与菌落直径比值范围为1.5~2.0。菌株P24和P37能够溶解难溶性磷酸盐,在NBRIP培养基上有透明的溶磷圈产生。经16S rRNA基因序列分析,供试菌株分别属于B. cereus、B. megaterium、B. amyloliquefaciens和B. thuringiensis。供试菌株的系统发育树如图 1所示。
|

|
| 图 1 基于菌株部分16S rRNA基因序列构建的系统发育树 Figure 1 Phylogenetic tree on the basis of partial 16S rRNA gene sequences of the strains |
由表 2可以看出,8株芽孢杆菌对重金属Pb、Zn、Cu和Cd都具有抗性,对Pb和Zn抗性较高,但对Cu和Cd抗性较低。P21、P34和P45对Pb、Zn、Cu和Cd的抗性范围为100~300 mg·L-1,P24、P33和P37能在20 mg·L-1的Cd条件下生长,而P21和P39能在300 mg·L-1 Cd胁迫下生长。

|
8株芽孢杆菌均为中温菌,在15~45 ℃能正常生长,最适生长温度在30 ℃左右。8株芽孢杆菌在pH为4.0的条件下都不能生长,P29和P33的生长pH范围为6.0~8.0,菌株P39和P45生长pH范围为6.0~10.0,其他菌株在pH 5.0~10.0的范围内都能正常生长。8株芽孢杆菌在NaCl浓度为0.5%~3.0%时均能正常生长,且P24和P37在NaCl浓度为7.0%时仍能正常生长,说明其具有耐受高渗的能力。
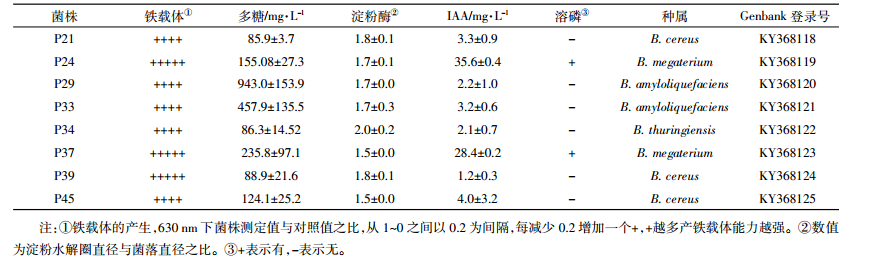
2.3 菌株联合香蒲去除水体重金属的效应 2.3.1 菌株对香蒲生物量的影响研究表明,能够产生IAA、铁载体、胞外多糖及具有溶磷能力的细菌能够促进植物的生长,提高植物对重金属的耐受性。本试验结果表明(图 2),在2.5 mg·L-1 Cd2+的条件下,8株芽孢杆菌均能促进香蒲根部和地上部组织的干重增加,但效果有差异。对根的促生作用表现为P34>P24>P37>P45>P29>P39>P21>P33,对地上部的促生作用表现为P24>P37>P29>P34>P39>P45>P33>P21。P24和P37对香蒲的促生作用较强,与CK相比,接菌处理促进香蒲根干重分别显著增加46.4%和41.8%,地上部干重显著增加41.2%和40.0%(P<0.05)。P34促进香蒲根干重显著增加58.8%,但是对地上部的促生作用不显著。其他菌株的促生作用均不显著。
|
| 图 2 含Cd2+溶液中芽孢杆菌对香蒲干重的影响 Figure 2 Effects of Bacillus stains on the aboveground and root dry weight of T.angustifolia within 2.5 mg·L-1 Cd2+ solution |
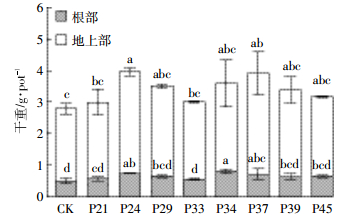
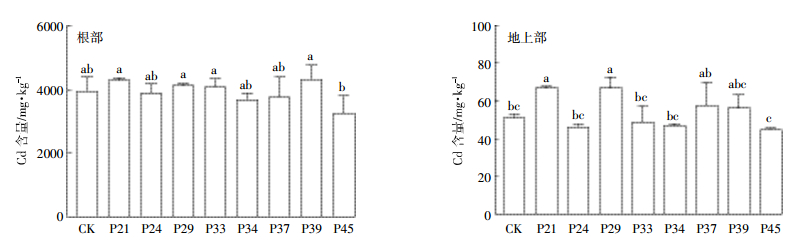
由图 3可知,重金属Cd主要富集在香蒲的根部,香蒲根Cd含量是地上部的62~84倍,接菌处理能够改变香蒲组织中Cd含量。在2.5 mg·L-1 Cd2+的条件中,P21、P29、P33和P39促进香蒲根Cd含量增加,另4株芽孢杆菌减少了香蒲根Cd含量,但所有处理都没有显著差异。与CK相比,接种菌株P21和P29使香蒲地上部Cd含量分别显著增加了31.3%和31.1%(P<0.05),P37和P39对香蒲地上部Cd含量的增加作用没有达到显著差异,其他4株芽孢杆菌减少了香蒲地上部Cd含量,但未达显著性水平。
|
| 图 3 含Cd2+溶液中芽孢杆菌对香蒲根部和地上部Cd含量的影响 Figure 3 Effects of Bacillus stains on the Cd content in the aboveground and root of T.angustifolia within 2.5 mg·L-1 Cd2+ solution |
接菌处理都能增加香蒲根部和地上部Cd总吸收量。由图 4可知,在2.5 mg·L-1 Cd2+的处理中,接菌处理使香蒲根Cd总吸收量增加了5.3%~56.8%,表现为P37>P34>P24>P39>P29>P21>P33>P45,其中P37、P34、P24、P39和P29使香蒲根Cd总吸收量显著增加了56.8%、49.2%、45.3%、37.3%和33.4%(P<0.05);接菌处理使香蒲地上部Cd总吸收量增加了1.7%~63.5%,其中接种菌株P29、P37和P21使香蒲地上部Cd总吸收量分别显著增加了63.5%、55.1%和38.3%(P<0.05)。
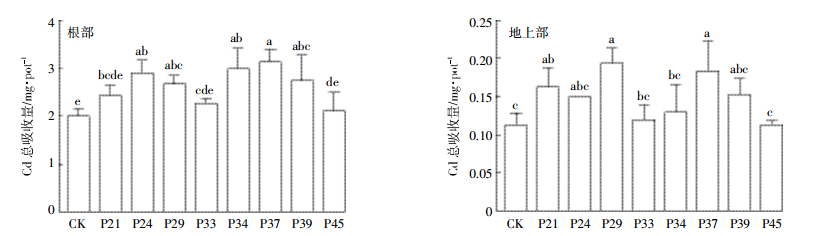
|
| 图 4 Cd2+溶液中芽孢杆菌对香蒲根部和地上部Cd总吸收量的影响 Figure 4 Effects of Bacillus stains on the Cd uptake in the aboveground and root of T.angustifolia within 2.5 mg·L-1 Cd2+ solution |
由图 5可以看出,水生植物香蒲耐受重金属Cd,对水中Cd的去除率可达54.5%。8株芽孢杆菌处理都能强化香蒲对水中重金属的去除效果,但8株芽孢杆菌与香蒲联合去除Cd的作用存在明显差异,联合去除Cd效率表现为P24>P37>P39>P29>P45>P21>P33>P34。P24、P37、P39、P29和P45联合香蒲对Cd的去除率范围为69.1%~79.5%,与CK相比分别显著提高39.6%、32.3%、29.1%、23.4%和21.3%(P<0.05)。P21、P33和P34对香蒲去除Cd的强化作用不显著。

|
| 图 5 芽孢杆菌强化香蒲去除水中Cd的作用 Figure 5 Effects of T. angustifolia associated with Bacillus stains on the removal efficient of Cd |
结合前面的结果分析,推测菌株P24和P37是通过促生作用显著增加香蒲根部和地上部的干重,来增加香蒲对Cd的总吸收量;而P29主要是通过显著增加香蒲地上部Cd含量来提高香蒲Cd总吸收量,从而达到去除水中Cd的作用。P39和P45对香蒲的促生作用和吸收Cd的影响都不显著,但是对Cd的去除作用显著,其机制还不清楚。
3 讨论Cd是水污染中常见也是环境中毒性最强的重金属元素之一[3],由于不能自然降解或生物降解,通常富集在水体中或沉积到水域底部,或被水生植物吸收,并通过食物链积累最终损害人类的健康。利用超积累植物修复重金属污染水体的技术逐步发展,是当前生物修复技术研究的热点[10, 17]。
香蒲对环境胁迫耐性较强,是国内外公认的湿地水生植物优势品种,在我国分布广泛,包括长苞香蒲(T. angustata)、狭叶香蒲(T. angustifolia)、宽叶香蒲(T. latifolia)和东方香蒲(T. orientalis)等11种[30]。一些研究表明,50%以上的Cd富集在香蒲地下部,但不同种类的香蒲根对Cd的富集量存在较大差异,如东方香蒲根Cd含量在0.15~0.18 mg·kg-1之间[31],宽叶香蒲根茎Cd含量范围为0.003~8.99 mg·kg-1[32],但狭叶香蒲根Cd含量可达几百到几千mg·kg-1[33-34]。在本研究中,Cd2+处理浓度为2.5 mg·L-1时,狭叶香蒲根Cd含量可高达4000 mg·kg-1,说明较其他香蒲品种而言,狭叶香蒲在富集Cd含量方面具有更大的优势。同时如何增强湿生植物对重金属污染水体的适应和耐受能力也是有效发挥湿生植物功能和作用的关键。Da Silva等[35]利用原位微生物群接种,强化两种盐沼植物(Juncus maritimus和Phragmites australis)对重金属的吸收,栽培2个月后P. australis茎干中Cd含量增加了7倍,具有植物提取潜力,而J. maritimus地下部总Cd吸收量增加了48%,可以用于植物稳定。罗鹏程等[19]在2.5 mg·L-1和5 mg·L-1 Cd2+胁迫下接种AM真菌,能够促进宽叶香蒲对Cd的吸收,地上和地下部Cd含量最大增加40.2%和56.5%。这些研究说明,通过微生物协同作用来强化水生植物富集重金属是可行的。
植物根际和组织中分布着的多种细菌,在与植物的长期共同进化中,已成为植物微生态系统的天然组成成分,能促进植物对恶劣环境的适应,加强系统的生态平衡。Li等[36]利用16S rDNA克隆文库技术发现,生长于北京翠河湿地的狭叶香蒲根内生细菌多样性丰富。张瑞杰等[37]选用3种培养基从香蒲根组织中分离获得305株内生细菌,主要属于假单胞菌属和拉恩氏菌属,筛选自LB培养基上的内生细菌参与去除有机碳、重金属和有机污染物的菌株比例较高,分别为3.95%、15.13%和8.55%。但这些内生细菌或抗逆性较差,或与植物的相互作用不清楚,还不能用于生产实践。芽孢杆菌是土壤和植物微生态区系的优势生物种群,容易存活繁殖,抗逆性强,对某些植物有很好的防病促生作用,在修复重金属污染土壤上也有应用潜力[38-40]。陈佛保等[41]筛选到芽孢杆菌DBM菌株在水稻受重金属Zn(600 mg·kg-1)胁迫时能显著促进水稻的生长,并由于生物量增加使得水稻地上部和根部Zn总量增加。我们从矿区湿地植物根内和根际土壤中筛选芽孢杆菌,并考察这些菌株的植物促生特性,结果表明筛选到的8株芽孢杆菌都能产生铁载体和IAA,耐受多种重金属,环境适应性强,为联合香蒲原位去除重金属提供了菌种资源。
研究者认为微生物促进水生植物修复的机理主要有两点:一是某些细菌产生的IAA、铁载体等物质能促进植物生长,减少植物组织内重金属相对含量从而降低毒性;二是某些细菌产生的胞外聚合物(Extracellular Polymeric Substances,EPS)能结合重金属,减少其在根际环境中的生物毒性[17]。在本研究中,菌株P24和P37与其他6株细菌相比,产生IAA的量较高,对香蒲根部和地上部干重的增加幅度也较大,另外它们还具有分解无机磷作用,可为植物提供磷素营养。前人认为IAA可以促进植物横向和不定根的发育[42],因此还需进一步研究在重金属胁迫下菌株P24和P37对植物根系发育和磷素养分的影响,从而明确产IAA、溶磷菌株在修复过程中的作用机制。菌株P29促进香蒲根部Cd含量,是否与菌株产生大量多糖改变Cd形态有关,也需要深入探究。
4 结论(1)从南京汤山某矿区废弃地的湿地植物根际和根内共分离纯化到8株具有促生作用的芽孢杆菌,其对Cd、Pb、Cu和Zn多种重金属具有抗性。其中菌株P24和P37(B. megaterium)的IAA产量最高,菌株P29(B. amyloliquefaciens)的多糖产量最高。
(2)水生植物狭叶香蒲主要在根部积累Cd,接种芽孢杆菌P24和P37菌株显著增加香蒲根部和地上部的干重,从而增加香蒲对Cd的总吸收量;而P29显著增加香蒲地上部Cd含量,从而提高香蒲Cd总吸收量。
(3)B. megaterium P24、P37菌株和B. amyloliquefaciens P29菌株联合香蒲对Cd的去除率分别达到79.5%、75.4%和70.3%,具有强化香蒲积累Cd、修复水体Cd污染的应用潜力。
| [1] |
韦丽丽, 周琼, 谢从新, 等. 三峡库区重金属的生物富集、生物放大及其生物因子的影响[J]. 环境科学, 2016, 37(1): 325-334. WEI Li-li, ZHOU Qiong, XIE Cong-xin, et al. Bioaccumulation and biomagnification of heavy metals in Three Gorges Reservoir and effect of biological factor[J]. Environmental Science, 2016, 37(1): 325-334. |
| [2] |
阳金希, 张彦峰, 祝凌燕. 中国七大水系沉积物中典型重金属生态风险评估[J]. 环境科学研究, 2017, 30(3): 423-432. YANG Jin-xi, ZHANG Yan-feng, ZHU Ling-yan. Pollution and risk assessment of typical heavy metals in river sediments of seven major watersheds in China[J]. Research of Environmental Sciences, 2017, 30(3): 423-432. |
| [3] |
谢晓君, 王方园, 王光军, 等. 中国地表水重金属污染的进展研究[J]. 环境科学与管理, 2017, 42(2): 31-34. XIE Xiao-jun, WANG Fang-yuan, WANG Guang-jun, et al. Study of heavy metal pollution in surface water in China[J]. Environmental Science and Management, 2017, 42(2): 31-34. |
| [4] |
Brix H. Functions of macrophytes in constructed wetlands[J]. Water Science and Technology, 1994, 29(4): 71-78. |
| [5] |
王谦, 成水平. 大型水生植物修复重金属污染水体研究进展[J]. 环境科学与技术, 2010, 33(5): 96-102. WANG Qian, CHENG Shui-ping. Review on phytoremediation of heavy metal pollution water by macrophytes[J]. Environmental Science and Technology, 2010, 33(5): 96-102. |
| [6] |
张冬冬, 肖长来, 梁秀娟, 等. 植物修复技术在水环境污染控制中的应用[J]. 水资源保护, 2010, 26(1): 63-65. ZHANG Dong-dong, XIAO Chang-lai, LIANG Xiu-juan, et al. Application of phytoremediation in water environmental pollution control[J]. Water Resources Protection, 2010, 26(1): 63-65. |
| [7] |
Li J, Yu H X, Luan Y N. Meta-analysis of the copper, zinc, and cadmium absorption capacities of aquatic plants in heavy metal-polluted water[J]. International Journal of Environmental Research and Public Health, 2015, 12(12): 14958-149573. DOI:10.3390/ijerph121214959 |
| [8] |
Rezania S, Ponraj M, Talaiekhozani A, et al. Perspectives of phytoremediation using water hyacinth for removal of heavy metals, organic and inorganic pollutants in wastewater[J]. Journal of Environmental Management, 2015, 163: 125-133. DOI:10.1016/j.jenvman.2015.08.018 |
| [9] |
Rezania S, Taib S M, Din M F M, et al. Comprehensive review on phytotechnology:Heavy metals removal by diverse aquatic plants species from wastewater[J]. Journal of Hazardous Materials, 2016, 318: 587-599. DOI:10.1016/j.jhazmat.2016.07.053 |
| [10] |
周桑扬, 杨凯, 吴晓芙, 等. 人工湿地植物去除废水中重金属的作用机制研究进展[J]. 湿地科学, 2016, 14(5): 717-724. ZHOU Sang-yang, YANG Kai, WU Xiao-fu, et al. Advance in mechanism of removing heavy metals from wastewater by plants in wetlands[J]. Wetland Science, 2016, 14(5): 717-724. |
| [11] |
喻理, 许蒙, 叶长城, 等. 香蒲-表面流湿地系统净化灌溉水过程中镉的分布和累积[J]. 农业环境科学学报, 2016, 35(8): 1573-1579. YU Li, XU Meng, YE Chang-cheng, et al. Cadmium distribution and accumulation in surface-flow constructed wetland system with planted Typha angustifolia L[J]. Journal of Agro-Environment Science, 2016, 35(8): 1573-1579. DOI:10.11654/jaes.2016-0443 |
| [12] |
Chen Y L, Hong X Q, He H, et al. Biosorption of Cr(Ⅵ) by Typha angustifolia:mechanism and responses to heavy metal stress[J]. Bioresource Technology, 2014, 160: 89-92. DOI:10.1016/j.biortech.2014.01.022 |
| [13] |
Chaturvedi A D, Pal D, Penta S, et al. Ecotoxic heavy metals transformation by bacteria and fungi in aquatic ecosystem[J]. World Journal of Microbiology and Biotechnology, 2015, 31: 1595-1603. DOI:10.1007/s11274-015-1911-5 |
| [14] |
Wu H Q, Wu Q P, Wu G J, et al. Cd-resistant strains of B. cereus S5 with endurance capacity and their capacities for cadmium removal from cadmium-polluted water[J]. Plos One, 2016, 11(4): e0151479. DOI:10.1371/journal.pone.0151479 |
| [15] |
Wood J L, Tang C X, Franks A E. Microbial associated plant growth and heavy metal accumulation to improve phytoextraction of contaminated soils[J]. Soil Biology & Biochemistry, 2016, 103: 131-137. |
| [16] |
Ma Y, Prasad M N, Rajkumar M, et al. Plant growth promoting rhizobacteria and endophytes accelerate phytoremediation of metalliferous soils[J]. Biotechnology Advances, 2011, 29(2): 248-258. DOI:10.1016/j.biotechadv.2010.12.001 |
| [17] |
Stout L, Nusslein K. Biotechnological potential of aquatic plant-microbe interactions[J]. Current Opinion in Biotechnology, 2010, 21(3): 339-345. DOI:10.1016/j.copbio.2010.04.004 |
| [18] |
胡智勇, 陆开宏, 梁晶晶. 根际微生物在污染水体植物修复中的作用[J]. 环境科学与技术, 2010, 33(5): 75-80. HU Zhi-yong, LU Kai-hong, LIANG Jing-jing. Role of rhizosphere microorganisms of aquatic plants in phytoremediation of wastewater[J]. Environmental Science and Technology, 2010, 33(5): 75-80. |
| [19] |
罗鹏程, 李航, 王曙光. 湿生环境中丛枝菌根(AM)对香蒲耐Cd胁迫的影响[J]. 环境科学, 2016, 37(2): 750-755. LUO Peng-cheng, LI Hang, WANG Shu-guang. Effect of Arbuscular Mycorrhiza(AM) on tolerance of cattail on Cd stress in aquatic environment[J]. Environmental Science, 2016, 37(2): 750-755. |
| [20] |
刘炜, 郭羿宏, 张瑞杰, 等. 北京市白河湿地香蒲根际土壤细菌多样性[J]. 湿地科学, 2016, 14(5): 740-749. LIU Wei, GUO Yi-hong, ZHANG Rui-jie, et al. Bacteria diversity of rhizosphere soils of Typha angustata in Baihe wetlands, Beijing[J]. Wetland Science, 2016, 14(5): 740-749. |
| [21] |
王璐, 何琳燕, 盛下放. 耐铜苏丹草根内生细菌的分离筛选及其生物学特性研究[J]. 土壤, 2016, 48(1): 95-101. WANG Lu, HE Lin-yan, SHENG Xia-fang. Isolation of endophytic bacteria from roots of Cu-tolerant Sorghum sudanense and their biological characteristics[J]. Soils, 2016, 48(1): 95-101. |
| [22] |
Lane D J. 16S/23S rRNA sequencing[M]//Stackebrandt E, Goodfellow M(eds). Nucleic acid techniques in bacterial systematics. Chichester:Wiley, 1991:115-175.
|
| [23] |
郜金荣. 分子生物学实验指导[M]. 武汉: 武汉大学出版社, 2007, 83-85. GAO Jin-rong. Molecular biology experimental guidance[M]. Wuhan: Wuhan University Press, 2007, 83-85. |
| [24] |
Dubois M, Gilles K A, Hamilton J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 1955, 28(3): 350-356. |
| [25] |
曾东方, 陈玢, 杨帆, 等. 淀粉降解圈与酶活力相关性研究[J]. 中国酿造, 2011, 30(9): 132-134. ZENG Dong-fang, CHEN Bin, YANG Fan, et al. Study on the correlation between starch degradation ring and enzyme activity[J]. China Brewing, 2011, 30(9): 132-134. |
| [26] |
Gordon S A, Weber R P. Colorimetric estimation of indoleacetic acid[J]. Plant Physiology, 1951, 26(1): 192-195. DOI:10.1104/pp.26.1.192 |
| [27] |
Mayer A M. Determination of indole acetic acid by the salkowsky reaction[J]. Nature, 1958, 182(4650): 1670-1671. DOI:10.1038/1821670a0 |
| [28] |
Schwyn B, Neilands J B. Universal chemical assay for the detection and determination of siderophores[J]. Analytic Biochemistry, 1987, 160(1): 47-56. DOI:10.1016/0003-2697(87)90612-9 |
| [29] |
Liu Z G, Li Y C, Zhang S A, et al. Characterization of phosphate-solubilizing bacteria isolated from calcareous soils[J]. Applied Soil Ecology, 2015, 96: 217-224. DOI:10.1016/j.apsoil.2015.08.003 |
| [30] |
中国科学院, 中国植物志编辑委员会. 中国植物志第8卷[M]. 北京: 科学出版社, 1992, 2. China flora Editorial Committee, Chinese Academy of Sciences. Flora of China, Volume 8[M]. Beijing: Science Press, 1992, 2. |
| [31] |
高静湉, 杜方圆, 李卫平, 等. 黄河湿地小白河片区优势植物重金属的富集特征[J]. 农业环境科学学报, 2016, 35(11): 2180-2186. GAO Jing-tian, DU Fang-yuan, LI Wei-ping, et al. Accumulation characteristics of heavy metals in dominat plants in Xiaobaihe Area of the Yellow River Wetland[J]. Journal of Agro-Environment Science, 2016, 35(11): 2180-2186. DOI:10.11654/jaes.2016-0335 |
| [32] |
Klink A, Polechonska L, Cegowska A, et al. Typha latifolia(broadleaf cattail) as bioindicator of different types of pollution in aquatic ecosystems-application of self-organizing feature map(neural network)[J]. Environmental Science and Pollution Research, 2016, 23(14): 14078-14086. DOI:10.1007/s11356-016-6581-9 |
| [33] |
张弛, 袁亚光, 钦佩, 等. 香蒲对重金属镉的耐性及吸收途径研究[J]. 南京大学学报(自然科学), 2013, 49(4): 506-511. ZHANG Chi, YUAN Ya-guang, QIN Pei, et al. Characteristics of cadmium tolerant and absorption in Typha angustifolia[J]. Journal of Nanjing University(Natural Sciences), 2013, 49(4): 506-511. |
| [34] |
Zhao H, Jin Q J, Wang Y J, et al. Effects of nitric oxide on alleviating cadmium stress in Typha angustifolia[J]. Plant Growth Regulation, 2016, 78(2): 243-251. DOI:10.1007/s10725-015-0089-z |
| [35] |
Da Silva M N, Mucha A P, Rocha A C, et al. A strategy to potentiate Cd phytoremediation by saltmarsh plants:Autochthonous bioaugmentation[J]. Journal of Environmental Management, 2014, 134: 136-144. DOI:10.1016/j.jenvman.2014.01.004 |
| [36] |
Li Y H, Liu Q F, Liu Y, et al. Endophytic bacterial diversity in roots of Typha angustifolia L[J]. Research in Microbiology, 2011, 162(2): 124-131. DOI:10.1016/j.resmic.2010.09.021 |
| [37] |
张瑞杰, 张琼琼, 黄兴如, 等. 基于分离培养方法的香蒲根内生细菌多样性[J]. 湿地科学, 2016, 14(2): 201-211. ZHANG Rui-jie, ZHANG Qiong-qiong, HUANG Xing-ru, et al. Diversity of endophytic bacteria in roots of Typha orientalis estimated by culture method[J]. Wetland Science, 2016, 14(2): 201-211. |
| [38] |
何琳燕, 李娅, 刘涛, 等. 龙葵根际和内生Cd抗性细菌的筛选及其生物学特性[J]. 生态与农村环境学报, 2011, 27(6): 83-88. HE Lin-yan, LI Ya, LIU Tao, et al. Isolation and characterization of cadmium-resistant endophytic and rhizobacteria from solanum nigrum in orefield[J]. Journal of Ecology and Rural Environment, 2011, 27(6): 83-88. |
| [39] |
王伟, 岳政府, 刘孝文, 等. 低温适应型植物根际促生细菌的筛选及促生效应研究[J]. 南京农业大学学报, 2017, 40(1): 93-100. WANG Wei, YUE Zheng-fu, LIU Xiao-wen, et al. Screening of low temperature adapted plant growth-promoting rhizobacteria and investigation of their promoting effects[J]. Journal of Nanjing Agricultural University, 2017, 40(1): 93-100. DOI:10.7685/jnau.201604022 |
| [40] |
余劲聪, 何舒雅, 曾润颖, 等. 芽孢杆菌修复土壤重金属镉污染的研究进展[J]. 广东农业科学, 2016(1): 73-78. YU Jin-cong, HE Shu-ya, ZENG Run-ying, et al. Research progress in remediation of cadmium contaminated soil with Bacillus[J]. Guangdong Agricultural Sciences, 2016(1): 73-78. |
| [41] |
陈佛保, 柏珺, 林庆祺, 等. 植物根际促生菌(PGPR)对缓解水稻受土壤锌胁迫的作用[J]. 农业环境科学学报, 2012, 31(1): 67-74. CHEN Fo-bao, BAI Jun, LIN Qing-qi, et al. Application of plant growth-promoting rhizobacteria(PGPR) for reducing zinc stress on paddy rice[J]. Journal of Agro-Environment Science, 2012, 31(1): 67-74. |
| [42] |
Spaepen S, Vanderleyden J, Remans R. Indole-3-acetic acid in microbial and microorganism-plant signaling[J]. FEMS Microbiology Reviews, 2007, 31(4): 425-448. DOI:10.1111/j.1574-6976.2007.00072.x |
 2017, Vol. 36
2017, Vol. 36