文章信息
- 洪晓曦, 袁静, 郑现明, 夏梦, 丁爱中, 豆俊峰
- HONG Xiao-xi, YUAN Jing, ZHENG Xian-ming, XIA Meng, DING Ai-zhong, DOU Jun-feng
- 油菜对Cs胁迫的响应及其对Cs富集规律的研究
- Accumulation and physio-biochemical responses of Brassia campestris L. to Cs stress
- 农业环境科学学报, 2017, 36(12): 2394-2400
- Journal of Agro-Environment Science, 2017, 36(12): 2394-2400
- http://dx.doi.org/10.11654/jaes.2017-0688
文章历史
- 收稿日期: 2017-05-11
- 录用日期: 2017-07-24
核电事业的不断发展,导致对核燃料的需求不断增加,铀矿冶的加速致使铀尾矿、铀废石的大量增加,周边土壤中的放射性核素浓度也不断增加。这些放射性核素会带来一系列环境问题,并最终会通过生态系统和食物链进入到人体,导致畸变甚至是癌症的风险[1]。植物修复技术具有投资少、操作简便、效果好、不破坏场地结构、不引起二次污染的特点[2],而Cs作为主要的放射性核素之一,其化学性质与同族元素K相似,能够作为K的类似营养物被植物吸收[3]。因此,放射性核素土壤污染的生物效应及其植物修复技术成为近年来国内外学者研究的重点[4]。
但是目前该领域的研究主要集中在富集植物的筛选及其富集特性和通过加入外源物质或微生物来提高植物的富集量。Tjahaja等[5]将印度芥菜(Brassica juncea L.)种植在经过EDTA修饰的Cs污染土壤中,其根系的Cs吸收量增加了两倍。Yang等[6]发现植物对Ur和Cs的富集方式存在差异,植物通过将Ur固定在根系表面将其富集,而Cs则是被植物吸收利用从而达到富集的效果。Kang等[7]在对象草(Pennisetum purpureum Schum)水培7周后对Cs的最大吸附量达到26.365 mg·kg-1。Aung等[8]发现接种短小芽孢杆菌菌株(Bacillus pumilus)可以增加植物的根体积和根系表面积,从而增加植物对Cs的富集量。Rinaldi等[9]通过将水芋(Calla palustris L.)培养在不同的基质中证实了K+的存在会与Cs+造成竞争吸附,使植物对Cs的富集量降低。但鲜有关于某一种植物对Cs的富集规律和胁迫响应系统的研究。
在进行富集植物的筛选时,应选取生长周期短、耐性高、抗病抗虫害、根系枝叶旺盛的植物[10]。油菜属十字花科,是世界各地广泛种植的一种油料作物,具有根系发达、生长速度快、生物量大的特点。Chou等[11]比较了多种植物对Cs的富集能力,其中油菜具有较高的富集量。植物在对土壤中的Cs进行超富集的同时,自身也会受到一定的损害。唐永金等[12]发现Cs对油菜种子的萌发有一定的抑制作用。Lai等[13]通过实验证实了过量的Cs会引起芥菜(Brassica juncea L.)体内细胞的代谢紊乱,使植物生长发育受到抑制。张晓雪等[14]表明低浓度的Cs对鸡冠花(Celosia cristata L.)的生长无显著影响,但当浓度升高时抑制作用较为显著。
本试验通过对Cs胁迫下油菜的各项生理生化指标及其各器官对Cs的富集量的分析,初步阐明Cs对油菜生长发育的影响以及油菜对Cs的富集规律,旨在为土壤Cs污染的植物修复技术提供一定的参考。
1 材料与方法 1.1 材料供试土壤采自北京师范大学植物园试验场表层土(0~20 cm),其基本理化性质如下:pH 7.47,有机质含量49.23 g·kg-1,全氮1.49 g·kg-1,速效钾0.27 g·kg-1,速效磷0.08 g·kg-1。受试植物为白菜型油菜(Brassia campestris L.),购于中国农科院种子公司。放射性核素134Cs和137Cs与其稳定同位素133Cs的最外层电子数是相同的,决定化学变化性质的是原子的最外层电子数,从而可以用稳定同位素133Cs取代放射性核素134Cs和137Cs做冷化学试验。133Cs的施加形式为133CsCl,为分析纯试剂,由美国Amresco公司提供。
1.2 试验设计采用盆栽实验方式,地点在北京师范大学水科学研究院实验室。将土壤避光风干,剔除植物的根系及茎叶和石块等杂物,研磨过10目筛。采用逐步稀释法配制污染土壤,设置5个Cs浓度梯度,分别为0、100、200、400、600 mg·kg-1,每个浓度3个重复,平衡9周后备用。每盆称重2 kg(干重)土壤,浇施清水至土壤刚好达到饱和持水量,放置过夜后,将种子均匀播种,待出苗后,进行定植以保证每盆中有7株长势大致相同的幼苗。本试验设置了植物管理系统,如图 1所示。
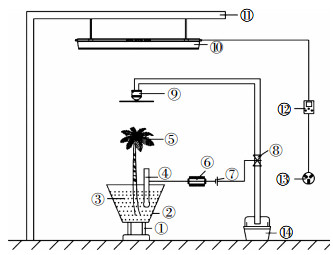
|
| 图 1 植物管理系统 Figure 1 Plant management system |
该系统由反应器支架①、植物修复反应器②、复合污染土壤③、湿度传感器④、超累积植物⑤、单片机⑥、电源⑦、阀门⑧、喷水装置⑨、植物补光灯⑩、补光灯支架⑪、定时器⑫、电源插座⑬、水槽⑭组成。植物管理系统主要分为两部分,一部分是土壤湿度管理系统,另一部分是植物日照时间管理系统。土壤湿度管理系统的喷水装置选取直径为10 cm左右的喷头,距离植物修复反应器顶端为35 cm,植物修复反应器是一个带有底座的上底面直径为25 cm、下底面直径为15 cm、高为30 cm的圆台状容器,反应器内装填2 kg复合污染土壤,湿度传感器插入到距离反应器底端10 cm的位置。单片机分别与湿度传感器和电源相连,电源连接阀门,单片机通过控制电源的开关间接控制阀门的打开和闭合。当湿度低于70%时,开通电源,阀门打开,为植物浇水;当湿度高于70%时,断开电源,阀门关闭,停止浇水,使田间持水量保持在70%左右。植物日照时间管理系统的植物补光灯为全光谱LED灯,长0.9 m,功率70 W,距离植物修复反应器的顶端为70 cm。植物补光灯固定在补光灯支架上,与定时器相连,定时器连接电源插座,设置每天的补光时间为8:00—19:00。
种植90 d后,测量植物的株高,取植物顶端叶片的同一位置用蒸馏水洗净后进行生理生化指标的测定,收获后按根、茎、叶洗净,测量鲜重,烘干至恒重,测量干重,将其磨碎过60目,测量133Cs的含量。
1.3 测定和计算方法 1.3.1 133Cs含量的测定用去离子水洗净后,将油菜分根、茎、叶3部分,分别称其鲜重,然后在105 ℃下杀青0.5 h,75 ℃烘干至恒重,分别称其干重。研磨后的根、茎、叶样品,每个样品3个重复,分别用HNO3和HCl为3:1的混合试剂进行消解,最后用Thermo Scientific火焰原子吸收光谱仪对根、茎、叶的Cs含量分别进行测定。
1.3.2 生理性指标的测定油菜叶绿素总量的测定采用95%乙醇比色法[15](mg·g-1 FW),POD活性测定采用愈创木酚法[16](U·g-1·min-1 FW),试验结果为3次重复结果的平均值。
1.3.3 计算方法转移系数(TF)=植株地上部Cs含量(mg·g-1)/地下部Cs含量(mg·g-1)
富集系数(BCF)=油菜体内Cs含量(mg·g-1)/土壤Cs处理浓度(mg·g-1)
1.4 数据分析数据分析采用Microsoft Excel 2010(美国,Microsoft)和Origin 6.0作图软件(美国,Microcal)。
2 结果与分析 2.1 油菜对Cs的胁迫响应 2.1.1 Cs对油菜生长的影响株高、生物量是综合评价植物生长状况的生理指标,通过比较Cs处理与空白对照组油菜株高和生物量的差异,可以直观地看出Cs对油菜生长的影响程度。由图 2可知,当土壤Cs浓度为100 mg·kg-1时,株高比对照组增高了10.46%,达到最高值;随着土壤Cs浓度的增加,油菜的株高下降,当Cs浓度为200 mg·kg-1时,比对照组降低了0.13%;当Cs浓度为400 mg·kg-1时,比对照组降低了13.41%;当Cs浓度为600 mg·kg-1时,株高急剧下降,达到最低值,比对照组降低了71.22%。
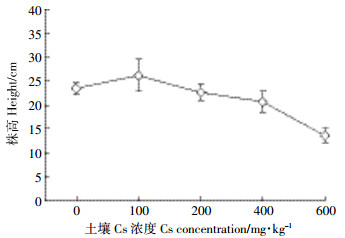
|
| 图 2 Cs对油菜株高的影响 Figure 2 Effects of different concentrations of Cs on the height of Brassia campestris L. |
由图 3可知,油菜生物量的变化趋势与株高基本一致,在Cs浓度为100 mg·kg-1时,生物量达到最高值,比对照组增加了22.19%;在Cs浓度为600 mg·kg-1时,生物量降到最低值,比对照组减少了44.88%。
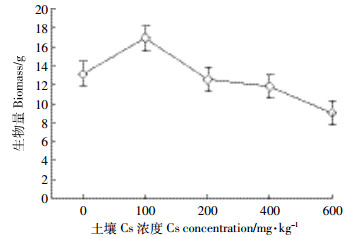
|
| 图 3 Cs对油菜生物量的影响 Figure 3 Effects of different concentrations of Cs on the biomass of Brassia campestris L. |
植物的生长离不开光合作用,叶绿素是植物进行光合作用的主要色素,其中叶绿素a和叶绿素b都可以吸收光能,只是二者吸收的波长范围不同,叶绿素a最大的吸收光的波长在420~663 nm,叶绿素b的最大吸收波长范围在460~645 nm[17]。POD酶是植物体内重要的一类过氧化物酶,其活性高低与呼吸作用、光合作用及生长素的氧化等密切相关,常被作为判断植物老化程度的一项生理指标[18]。
由图 4可知,当土壤Cs浓度一定时,油菜体内叶绿素a的含量始终比叶绿素b含量高,但叶绿素a、叶绿素b、叶绿素总量三者的变化趋势是一致的。当土壤Cs浓度从0变化到100 mg·kg-1时,叶绿素a、叶绿素b、叶绿素总量都随之升高,在100 mg·kg-1时达到最大值,三者的数值比对照组分别增加了21.89%、5.35%、10.11%;随着Cs浓度的不断增加,叶绿素a、叶绿素b、叶绿素总量不断减少,并在600 mg·kg-1时达到最低值,分别比对照组减少了75.93%、50.51%、63.03%。
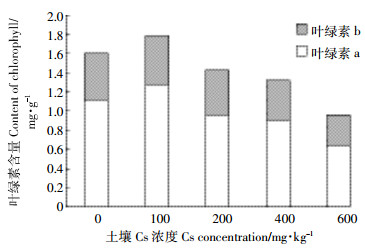
|
| 图 4 Cs对油菜叶绿素含量的影响 Figure 4 The effects of Cs stress on the content of chlorophyll in Brassia campestris L. |
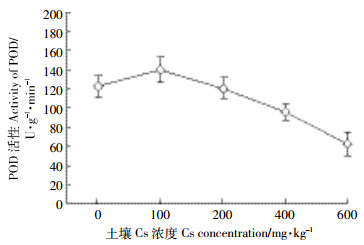
由图 5可知,POD酶活性随着土壤Cs浓度的增加先增加后减小。当土壤Cs浓度由0增加到100 mg·kg-1时,POD酶活性也随之增加,在100 mg·kg-1时达到最大值,比对照组增加了12.51%,而后POD酶活性则随着Cs浓度的增加而降低,在600 mg·kg-1时降到最低值;在200、400、600 mg·kg-1时的POD活性分别比对照组降低了1.46%、27.93%、95.92%。
|
| 图 5 Cs对油菜POD活性的影响 Figure 5 The effects of Cs stress on the activity of POD in Brassia campestris L. |
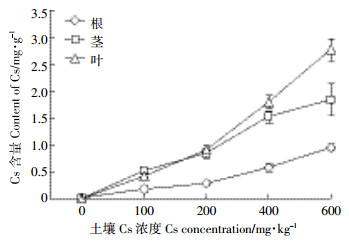
不同的土壤Cs浓度下,油菜不同器官的富集情况也不相同。由图 6可知,随着土壤Cs浓度的增加,油菜的根、茎、叶中Cs含量也随之增加,而根系Cs的富集量始终小于茎部和叶片,当土壤Cs浓度从200 mg·kg-1增加到400 mg·kg-1时,根、茎、叶对Cs的富集量都有明显增加。当土壤Cs浓度小于100 mg·kg-1时,油菜的叶片Cs含量比茎部低;当Cs浓度达到200 mg·kg-1时,叶片中Cs含量基本与茎部持平;当Cs浓度高于200 mg·kg-1时,叶片对Cs的富集量大于茎部,随着浓度的增加,两者富集量的差值增大。
|
| 图 6 Cs在油菜不同器官的富集情况 Figure 6 The content of Cs in different organs |
转移系数反映的是油菜对Cs的转运能力,富集系数则反映的是油菜对土壤中Cs的富集能力。由表 1可知,随着土壤Cs浓度的增加,转移系数先增加后减少,在土壤Cs浓度从100 mg·kg-1到200 mg·kg-1时,转移系数略有增加,在200 mg·kg-1达到最大值3.07,之后呈下降趋势;在土壤Cs浓度为600 mg·kg-1时达到最小值2.46,比在200 mg·kg-1时的富集系数降低了24.99%。富集系数则随着土壤Cs浓度的增加而降低,在土壤Cs浓度为600 mg·kg-1时达到最低值,比土壤Cs浓度在100 mg·kg-1时降低了18.17%。
当植物受到盐胁迫、重金属胁迫等时,其生长会受到抑制,通过判断其胁迫程度可以看出植物对重金属的耐性,为植物修复技术中超累积植物的筛选提供理论依据。本试验选取生物量、株高、叶绿素、过氧化物酶POD活性作为指标来分析油菜对Cs的胁迫响应。
试验表明,低浓度的Cs处理(≤100 mg·kg-1)会促进油菜的生长,其生物量、株高略有增加,但高浓度的Cs会抑制油菜的生长,且Cs浓度越高,抑制程度也会越大。Choi等[19]认为低浓度的Sr可以促进生长,而高浓度生长受到抑制。Xu等[20]发现高粱(Sorghum bicolor L. Moench)在Cs浓度为100 mg·kg-1时生长状况良好,而在400 mg·kg-1时受到了抑制,与本试验得出的结果相似。
叶绿素作为光合作用的主要色素,正常情况下其在植物中的合成和分解处于一个相对平衡的状态,但当受到外界的胁迫时,光合作用显著下降。在本试验中,随着Cs处理水平的增加,叶绿素含量先增加后减小,周璐璐等[21]在研究Sr对油菜幼苗光合作用的影响时也得出了类似的结论。产生这种现象可能的原因是:低浓度的Cs促进了油菜的生长,光合作用增强,使叶绿素含量增加,但高浓度的Cs可能会抑制叶绿素的合成,同时破坏叶绿体的结构和功能,也会使油菜体内的活性氧含量增加,使叶绿素被分解。这两方面的共同作用使得油菜叶片的叶绿素含量降低[22]。
POD是酶促反应的抗氧化剂,它能够有效地清除植物在逆境条件下产生的H2O2,降低重金属对植物的损害。结果表明,POD活性在土壤Cs浓度较低(≤100 mg·kg-1)时并没有降低反而增加,之后逐渐降低,与闻方平等[23]、李清飞等[24]得出的结论一致。由之前的试验可知,低浓度的Cs不仅促进了植物的生长,叶绿素含量也是逐渐增加,说明此时植物所受的胁迫程度并不大,在植物生长状况良好的情况下,低浓度的Cs会调动植物自身的调节机制来应对外界的胁迫,使POD活性增加。对于油菜这种低浓度水平下良好的抗胁迫机制,可以考虑作为低富集植物予以推广种植,在实际应用中种植油菜,可以保证油菜在含Cs土壤中得以正常生长。但当Cs浓度过高时,调节机制被破坏,胁迫作用增强,POD活性降低。关于植物在受到重金属胁迫时的自我调节机制,韩航等[25]发现类芦(Neyraudia reynaudiana)在受到Cd胁迫时可以通过提高根系平均直径和表面积、提高地上部富集转运能力来减少Cd对根系的伤害,也验证了植物确实存在一定的自我调节机制。
3.2 Cs在油菜体内的富集规律植物体内Cs含量、转移系数、转运系数是评价植物富集能力的重要指标。其中转移系数是植株地上部与地下部Cs富集量的比值,它反映的是Cs在植物体内的运输情况;富集系数则是植物总富集量与土壤Cs浓度的比值,它体现了植物从土壤中富集Cs的能力大小[26-27]。
本试验发现当土壤中Cs含量较低(≤100 mg·kg-1)时,油菜各器官Cs的富集情况为茎部>叶片>根系,油菜会将根系中的大部分Cs转移至茎部,此时茎部的Cs含量大于根系和叶片;当Cs含量较高时,则是叶片>茎部>根系。朱靖等[28]、安冰等[29]分别对康定柳和小麦对Cs的富集规律进行了研究,他们的试验结果为根系>茎部>叶片,可能是因为土壤中Cs的浓度、土壤类型、植物种类会影响最终的富集结果。油菜不同于康定柳的这一富集特性,说明高浓度的Cs水平会使油菜根系的Cs大量地转移至地上部。唐永金[30]等比较了13种植物对Cs的富集情况,发现不同植物间的转移系数分布于0.91~2.71之间,且科属间数值差异较大,说明植物类型的不同对最终的富集结果影响较大。从试验结果还可以看出:根系的Cs含量最小,推测可能的原因是根系作为植物-土壤的联系界面,为了降低对根系的损伤,从而更好地从土壤中吸收Cs,油菜将根系的Cs经由茎部,最终转运至叶片中贮藏,说明油菜有较为良好的转运机制。这个推测可以通过油菜的转移系数远大于1得到证实。
此外,随着土壤中Cs浓度的增加,富集系数却在不断减小。富集系数与油菜体内Cs的富集量和总生物量有关,虽然土壤Cs浓度越高,油菜对Cs的富集量也在增大,但随着油菜受胁迫程度的不断增加,生物量也在不断降低,其富集能力也受到了一定的抑制。不同的植物的富集系数差异较大,邹玥[31]等计算木耳菜在紫色土壤中不同Cs浓度下的富集系数,得出的数值分布在2.76~6.04;姚天月等[32]比较了29种植物地上部Ur富集量系数,罐罐菜最大为1.06。与邹玥、姚天月相比,本文得出油菜的富集系数集中在3.31~3.92,处于较高水平,结合转移系数,足以说明油菜对Cs具有较强的富集能力。
3 结论(1) 油菜在低浓度的Cs水平下(≤100 mg·kg-1)存在一定的抗胁迫机制,生长发育得到一定的促进作用,油菜的生物量、株高、叶绿素含量、POD活性都有所提高;但当Cs浓度较高时,其生长发育受到抑制,且浓度越高抑制程度越大,说明该调节机制被打破。
(2) 随着土壤Cs浓度的提高,油菜的富集量也增大,但富集能力略有下降,为了降低Cs对自身的损害,植物会将一部分的Cs由根系向地上部转运,从而更好地吸收Cs。
(3) 该试验表明,油菜在高浓度的Cs土壤中有较好的转运调节机制,也具备一定的抗胁迫能力,可以作为修复受Cs污染土壤的潜力植物。
| [1] |
冯德玉, 代其林, 崔广艳, 等. 油菜对Sr胁迫的生理生态响应[J]. 植物学研究, 2013, 2(5): 125-129. FENG De-yu, DAI Qi-lin, CUI Guang-yan, et al. Sr stress on physiological and ecological responses of Brassica napus L.[J]. Botanical Research, 2013, 2(5): 125-129. |
| [2] |
杨俊诚, 朱永懿, 陈景坚, 等. 植物对137Cs污染土壤的修复[J]. 核农学报, 2005, 19(4): 286-290. YANG Jun-cheng, ZHU Yong-yi, CHEN Jing-jian, et al. Plant remediation of soil contaminated with 137Cs[J]. Acta Agriculturae Nucleatae Sinica, 2005, 19(4): 286-290. |
| [3] |
Vinichuk M, Taylor A F, Rosén K, et al. Accumulation of potassium, rubidium and caesium(133Cs and 137Cs) in various fractions of soil and fungi in a Swedish forest[J]. Science of the Total Environment, 2010, 408(12): 2543-2548. DOI:10.1016/j.scitotenv.2010.02.024 |
| [4] |
Geras'Kin S, Evseeva T, Belykh E, et al. Effects on non-human species inhabiting areas with enhanced level of natural radioactivity in the north of Russia:A review[J]. Journal of Environmental Radioactivity, 2007, 94(3): 151-182. DOI:10.1016/j.jenvrad.2007.01.003 |
| [5] |
Tjahaja P, Sukmabuana P, Roosmini D. The EDTA amendment in phytoextraction of 134Cs from soil by Indian Mustard(Brassica juncea)[J]. International Journal of Phytoremediation, 2013, 17(10): 951-956. |
| [6] |
Yang M, Jawitz J W, Lee M. Uranium and cesium accumulation in bean(Phaseolus vulgaris L. var. vulgaris) and its potential for uranium rhizofiltration[J]. Journal of Environmental Radioactivity, 2015, 140(32): 42-49. |
| [7] |
Kang D J, Seo Y J, Saito T, et al. Uptake and translocation of cesium-133 in napiergrass(Pennisetum purpureum Schum.) under hydroponic conditions[J]. Ecotoxicology & Environmental Safety, 2012, 82(4): 122. |
| [8] |
Aung H, Djedidi S, Oo A, et al. Growth and 137Cs uptake of four Brassica species influenced by inoculation with a plant growth-promoting rhizobacterium Bacillus pumilus in three contaminated farmlands in Fukushima prefecture, Japan[J]. Science of the Total Environment, 2015, 521-522(1): 261-269. |
| [9] |
Rinaldi F, Komínková D, Berchová K, et al. Stable cesium 133Cs uptake by Calla palustris, from different substrates[J]. Ecotoxicology & Environmental Safety, 2017, 139(41): 301-307. |
| [10] |
Couselo J, Corredoira E, Vieitez A, et al. Plant tissue culture of fast-growing trees for phytoremediation research[J]. Methods Mol Biol, 2012, 877(6): 247-263. |
| [11] |
Chou F, Chung H, Teng S, et al. Screening plant species native to Taiwan for remediation of 137Cs-contaminated soil and the effects of K addition and soil amendment on the transfer of 137Cs from soil to plants[J]. Journal of Environmental Radioactivity, 2005, 80(2): 175-181. DOI:10.1016/j.jenvrad.2004.10.002 |
| [12] |
唐永金, 罗学刚, 江世杰, 等. 锶、铯、铀对5种植物种子发芽的影响[J]. 种子, 2013, 32(4): 1-4. TANG Yong-jin, LUO Xue-gang, JIANG Shi-jie, et al. Effects of strontium, cesium and uranium on seed germination of 5 plants[J]. Seed, 2013, 32(4): 1-4. |
| [13] |
Lai J L, Tao Z Y, Fu Q, et al. The chemical toxicity of cesium in Indian mustard(Brassica juncea L.) seedlings[J]. Journal of Environmental Radioactivity, 2016, 160(33): 93-101. |
| [14] |
张晓雪, 王丹, 钟钼芝, 等. 鸡冠花(Celosia cristata Linn)对Cs和Sr的胁迫反应及其积累特征[J]. 核农学报, 2010, 24(3): 628-633. ZHANG Xiao-xue, WANG Dan, ZHONG Mu-zhi, et al. Stress response and accumulation characteristics of Cs and Sr on Celosia cristata Linn[J]. Acta Agriculturae Nucleatae Sinica, 2010, 24(3): 628-633. DOI:10.11869/hnxb.2010.03.0628 |
| [15] |
杨晴, 郭守华. 植物生理生化[M]. 北京: 中国农业科学技术出版社, 2010. YANG Qing, GUO Shou-hua. Plant physiology and biochemistry[M]. Beijing: China Agricultural Science and Technology Press, 2010. |
| [16] |
王学奎, 黄见良. 植物生理生化实验原理与技术[M]. 北京: 高等教育出版社, 2015. WANG Xue-kui, HUANG Jian-liang. Principle and technology of plant physiological and biochemical experiment[M]. Beijing: Higher Education Press, 2015. |
| [17] |
Baryla A, Carrier P, Franck F, et al. Leaf chlorosis in oilseed rape plants(Brassica napus) grown on cadmium-polluted soil:Causes and consequences for photosynthesis and growth[J]. Planta, 2001, 212(5): 696-709. |
| [18] |
万永吉, 郑文教, 方煜, 等. 重金属铬(Ⅲ)胁迫对红树植物秋茄幼苗SOD、POD活性及其同工酶的影响[J]. 厦门大学学报(自然版), 2008, 47(4): 571-574. WAN Yong-ji, ZHENG Wen-jiao, FANG Yu, et al. Cr3+ stress on SOD and POD activities and their isoenzyme in the shoot of Kandelia candel[J]. Journal of Xiamen University(Natural Science), 2008, 47(4): 571-574. |
| [19] |
Choi Y, Kang H, Jun I, et al. Transfer of 90Sr to rice plants after its acute deposition onto flooded paddy soils[J]. Journal of Environmental Radioactivity, 2007, 93(3): 157-169. DOI:10.1016/j.jenvrad.2006.12.008 |
| [20] |
Xu W, Chen C, Wang J. Cs phytoremediation by Sorghum bicolor cultivated in soil and in hydroponic system[J]. International Journal of Phytoremediation, 2016, 19(4): 402-412. |
| [21] |
周璐璐, 唐运来, 陈霞, 等. 锶对油菜幼苗叶片光合作用的影响[J]. 植物学报, 2013, 48(3): 313-319. ZHOU Lu-lu, TANG Yun-lai, CHEN Xia, et al. Sr effect on photosynthesis of Brassica napus L. leaves[J]. Chinese Bulletin of Botang, 2013, 48(3): 313-319. |
| [22] |
Khatun S, Ali M, Hahn E, et al. Copper toxicity in Withania somnifera:Growth and antioxidant enzymes responses of in vitro, grown plants[J]. Environmental & Experimental Botany, 2008, 64(3): 279-285. |
| [23] |
闻方平, 王丹, 徐长合, 等. 133Cs、88Sr单一胁迫对甘蓝生理生化指标的影响[J]. 湖北农业科学, 2009, 27(1): 212-217. WEN Fang-ping, WANG Dan, XU Chang-he, et al. Study on the stress responses and the characteristics of uptake and accumulation of Sorghum sudanense to 133Cs and 88Sr[J]. J Radiat Res Radiat Process, 2009, 27(4): 212-217. |
| [24] |
李清飞, 仇荣亮. 麻疯树对镉胁迫的生理耐性及富集特征研究[J]. 农业环境科学学报, 2012, 31(1): 42-47. LI Qing-fei, QIU Rong-liang. Physiological tolerance and accumulation characteristics of Jatropha curcas L. under cadmium stress[J]. Journal of Agro-Environment Science, 2012, 31(1): 42-47. |
| [25] |
韩航, 陈雪娇, 侯晓龙, 等. Cd胁迫对类芦生长及酶活性的影响[J]. 农业环境科学学报, 2016, 35(4): 647-653. HAN Hang, CHEN Xue-jiao, HOU Xiao-long, et al. Cd stress on growth and enzyme activity of Neyraudia reynaudiana(Kunth) Keng[J]. Journal of Agro-Environment Science, 2016, 35(4): 647-653. DOI:10.11654/jaes.2016.04.006 |
| [26] |
Straczek A, Duquene L, Wegrzynek D. Differences in U root-to-shoot translocation between plant species explained by U distribution in roots[J]. Journal of Environmental Radioactivity, 2010, 101(27): 258-266. |
| [27] |
Sheppard S, Long J, Sanipelli B. Plant/soil concentration ratios for paired field and garden crops, with emphasis on iodine and the role of soil adhesion[J]. Journal of Environmental Radioactivity, 2010, 101: 1032-1037. DOI:10.1016/j.jenvrad.2010.08.001 |
| [28] |
朱靖, 陈珂, 张渊, 等. 康定柳对铯胁迫的生理生化响应及富集能力[J]. 环境工程学报, 2016, 10(3): 1515-1520. ZHU Jing, CHEN Ke, ZHANG Yuan, et al. Cesium stress on physiological and biochemical responses and enrichment ability of Salix paraplesia[J]. Chinese Journal of Environmental Engineering, 2016, 10(3): 1515-1520. DOI:10.12030/j.cjee.20160381 |
| [29] |
安冰, 唐运来, 陈梅, 等. 小麦抗氧化能力对Cs+富集响应的研究[J]. 核农学报, 2011, 25(2): 348-352. AN Bing, TANG Yun-lai, CHEN Mei, et al. Responses of antioxidant capacity to Cs+ bioconcentration in wheat[J]. Journal of Nuclear Agricultural Sciences, 2011, 25(2): 348-352. DOI:10.11869/hnxb.2011.02.0348 |
| [30] |
唐永金, 罗学刚, 曾峰, 等. 不同植物对高浓度Sr、Cs胁迫的响应与修复植物筛选[J]. 农业环境科学学报, 2013, 32(5): 960-965. TANG Yong-jin, LUO Xue-gang, ZENG Feng, et al. Response of different plants to high concentration of Sr and Cs stress and screening of plants[J]. Journal of Agro-Environment Science, 2013, 32(5): 960-965. |
| [31] |
邹玥, 唐运来, 王丹, 等. 木耳菜在4种土壤中对Cs的吸收与转运研究[J]. 西北植物学报, 2016, 36(1): 147-155. ZOU Yue, TANG Yun-lai, WANG Dan, et al. Absorption and transport of Cs in Gynura cusimbua in four types of soil[J]. Acta Botanica Boreali-Occidentalia Sinica, 2016, 36(1): 147-155. |
| [32] |
姚天月. 铀的富集植物筛选及其对Ur、Cd的吸收富集特性和生理生化响应研究[D]. 重庆: 西南科技大学, 2016. YAO Tian-yue. Uranium enrichment plant screening and its physiological and biochemical responses and accumulation characteristics to Uranium and Cadmium[D]. Chongqing:Southwest University of Science and Technology, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10619-1016118932.htm |
 2017, Vol. 36
2017, Vol. 36





