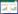文章信息
- 景建元, 孙晓, 杨阳, 李娜, 田肖肖, 吕慎强, 王林权
- JING Jian-yuan, SUN Xiao, YANG Yang, LI Na, TIAN Xiao-xiao, LÜ Shen-qiang, WANG Lin-quan
- 施氮水平对冬小麦冠层氨挥发的影响
- Ammonia volatilization of winter wheat canopy under different nitrogen rates
- 农业环境科学学报, 2017, 36(2): 401-408
- Journal of Agro-Environment Science, 2017, 36(2): 401-408
- http://dx.doi.org/10.11654/jaes.2016-1233
文章历史
- 收稿日期: 2016-09-23
2. 农业部西北植物营养与农业环境重点实验室, 陕西 杨凌 712100;
3. 中国科学院合肥物质科学研究院技术生物与农业工程研究所, 合肥 230031
2. Key Laboratory of Plant Nutrition and the Agri-Environment in Northwest China, Ministry of Agriculture, Yangling 712100, China;
3. Institute of Technical Biology & Agriculture Engineering, Hefei Institutes of Physical Science, Chinese Academy of Sciences, Hefei 230031, China
近年来,大气活性氮含量日益增加,经生物地球化学循环以沉降形式返回陆地生态系统,并对生态系统健康与功能构成巨大威胁[1-3],我国的氮沉降以铵态氮为主[4]。农业系统是氨气排放的主要来源[5],其中29.4%~47.4%的氨气来自化学肥料[6]。受人口增长、有效耕地面积减少等影响,我国农业生产只能持续依靠氮肥[2],这将进一步加剧氨气的排放。
目前针对农田氨挥发的影响因素、控制措施已有大量研究[7-9],但多集中于农田土壤氨挥发,对植物冠层氨挥发研究较少。植物冠层可吸收土壤释放的氨气,捕获量占土壤挥发量的2.5%~76%[10-13],也可向大气释放氨气[14]。冠层氨挥发受叶片谷氨酰胺合成酶(GS)活性、叶片氨气补偿点、质外体NH4+浓度等影响[15-17]。目前对冠层氨挥发的研究多在生长箱内进行,对田间条件下作物冠层氨挥发缺乏连续跟踪,限制了对冠层氨挥发机制的理解。
我国农田施氮量大,具有很高的氨挥发风险。系统研究农田系统与大气氨气交换过程、探讨减少氨挥发的技术措施与作用机制,对减氮增效、提高氮肥利用效率和改善生态环境具有重大的科学价值与现实意义。作为农田氨挥发的变数之一,作物冠层在农田氨挥发中的作用有待深入研究。本研究以我国主要粮食作物--冬小麦为对象,采用改进的通气式氨气捕获装置,对冠层氨挥发动态变化进行原位监测,分析冠层氨挥发规律及其对麦田氨挥发的贡献率,探讨影响冠层氨挥发的生理因素。目的是揭示小麦全生育期的冠层氨挥发特征,进一步加深对农田土壤-冠层-大气之间氨气交换过程的理解,为提高氮肥利用率提供理论依据。
1 材料与方法 1.1 试验设计试验地点位于西北农林科技大学旱地养分高效利用试验园区(34°17′35″N,108°04′12″E,海拔520 m),属半湿润易旱区。小麦生长季239 d,生长季平均气温10.2 ℃,平均空气湿度65%,总降水量为216.3 mm。土壤为土垫旱耕人为土(Earth-cumuli-Orthic Anthrosol),耕层土壤(0~20 cm)主要理化性质为:有机质13.02 g·kg-1,全氮0.92 g·kg-1,矿质氮(NH4+-N和NO-3-N)6.69 mg·kg-1,速效磷4.77 mg·kg-1,速效钾141.35 mg·kg-1,pH 8.5(土水比1:2.5)。
供试冬小麦品种为小偃22(Triticum aestivum L.cv.Xiaoyan22),播种量120 kg·hm-2。供试肥料为尿素(含N 46%)和过磷酸钙(含P2O5 46%)。试验设置3个施氮水平(0、90 kg N·hm-2和180 kg N·hm-2),分别以N0(未施氮处理)、N90(低施氮处理)和N180(高施氮处理)表示。各小区均施磷肥90 kg P2O5·hm-2。小区面积6 m×2.6 m=15.6 m2。各处理随机排列,3次重复。播种前将肥料(各处理2/3尿素+全部磷肥)均匀撒施到地表,翻耕使土肥混匀,平整地面。各小区按25 cm行距开沟播种。剩余1/3尿素于拔节期雨前沟施到各小区。2015年10月19日施肥播种,2016年3月18日追肥。播种施肥当日安放氨气捕获装置进行氨气采集,于10月26日幼苗出土后开始测定冠层氨挥发,2016年6月15日结束测定。
1.2 采样与测定 1.2.1 氨气的采集与测定对Yang等[7]的通气式氨挥发装置进行改进,用于小麦冠层氨挥发原位监测(图 1)。装置由5节有机玻璃管(每节高20 cm,内径15 cm)、2层吸收海绵(厚5 cm,直径15 cm,聚氨基甲酸乙酯材质)、有机玻璃遮雨板(直径25 cm,厚0.5 cm)和3个吸盘(支撑遮雨板于装置上方)构成。吸收海绵采用20~30 mL H3PO4(0.8 mol·L-1)和甘油(0.7 mol·L-1)的混合液预先浸润,其中下层海绵吸收土壤和冠层释放的氨气,上层海绵用于排除外界大气中的氨气对试验的干扰。遮罩冬小麦的装置,其下层海绵距离冬小麦顶部5 cm,捕获冬小麦与土壤释放的氨气(表示为N0、N90、N180);不遮罩冬小麦的装置,其下层海绵捕获土壤释放的氨气(表示为CK-N0、CK-N90、CK-N180)。参照王朝辉等[18]的方法,对该装置下层海绵不同高度的氨气回收率进行测定,结果为75.8%~98.4%。每小区安装2个装置,分别位于播种行上(遮罩小麦植株)和小麦行间,插入地下5 cm处。随冬小麦高度的增长适时增加装置玻璃管数,玻璃管之间用金属箍密封固定。
|
| 图 1 通气式氨挥发捕获装置 Figure 1 Vented chamber for trapping ammonia volatilized |
小麦播种后,开始隔天采样,采样时间为上午10时至12时,一周后视氨挥发量逐渐延长采样时间直至冬季土壤上冻。小麦返青后每周采样,视氨挥发量调整采样频率,遇雨天顺延,直至收获。采样当天进行提取与测定。海绵中NH4+-N用1 mol·L-1 KCl浸提,靛酚蓝比色法测定。采用以下公式计算氨挥发参数:
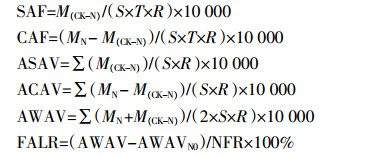
式中:SAF为土壤氨挥发速率,kg N·hm-2·d-1;CAF为冠层氨挥发速率,kg N·hm-2·d-1;ASAV为土壤氨挥发累积量,kg N·hm-2;ACAV为冠层氨挥发累积量,kg N·hm-2;AWAV为麦田氨挥发累积量,kg N·hm-2;FALR为氮肥氨挥发损失率,%;NFR为施氮量,kg N·hm-2;M(CK-N)为不遮罩植物装置平均每次测得的氨挥发量,kg N;MN为遮罩植物装置平均每次测得的氨挥发量,kg N;T为每次连续收集的时间,d;S为收集装置的横截面积,3.14×0.0752 m2;R为不同海绵高度氨捕获装置的氨气回收率;AWAVN0为不施氮小区麦田氨挥发累积量,kg N·hm-2;10 000为换算成公顷的系数。
1.2.2 叶片质外体溶液提取及其NH4+浓度、pH测定根据文献[19]提取冬小麦叶片质外体溶液:将新鲜叶片用去离子水洗净,用滤纸吸干,称取约5 g,置于200 mL注射器中,堵住出水口,加入约150 mL 280 mmol·L-1山梨醇溶液,通过抽动、排液、挤压等过程使叶片大部分变为深绿。取出叶片,吸干表面液体,在4 ℃下以1000×g离心10 min,得到质外体提取液。质外体溶液pH值用pH计(E201P,上海雷磁)测定,NH4+浓度(mmol·L-1)用靛酚蓝比色法测定。
1.2.3 叶片氨气补偿点的计算根据文献[20]计算叶片氨气补偿点(nmol NH3·mol-1空气)。当质外体pH在一定范围内,Kd < < [H+]apo(质外体H+浓度)时,25 ℃下,氨气补偿点可用如下公式计算:
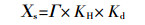
式中:Χs为氨气补偿点;Γ为质外体NH4+浓度和质外体H+浓度之比,代表不依赖于温度的氨气交换潜力;KH和Kd是热动力学常数,其值分别为10-1.76 L·mol-1和10-9.25 mol·L-1(25 ℃)。
通过以下公式,结合计算得到的25 ℃时氨气补偿点,计算实际温度下氨气补偿点:
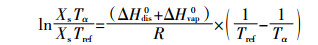
式中:Tα为实际温度,K,本试验中实际温度为采样当日平均气温;Tref为298.15 K(25 ℃);Χs Tα为实际温度下氨气补偿点;Χs Tref为25 ℃下氨气补偿点;ΔHdis0为NH4+解离焓,52.21 kJ·mol-1;ΔHvap0为蒸发焓,34.18 kJ·mol-1;R为气体常数,0.008 31 kJ·K-1·mol-1。
1.2.4 叶片谷氨酰胺合成酶(GS)测定参考文献[21]测定GS活性(A·mg-1 protein·h-1)。
称取叶片1 g(抽穗之后只取旗叶)于研钵中,加3 mL提取缓冲液(0.05 mol·L-1 Tris-HCl,pH 8.0,内含2 mmol·L-1 Mg2+,2 mmol·L-1 DTT,0.4 mol·L-1蔗糖),冰浴研磨成匀浆,转移至离心管中,在4 ℃、12 000 r·min-1条件下离心20 min,上清液即为粗酶液。
吸取1.6 mL反应混合液B(0.1 mol·L-1 Tris-HCl缓冲,含盐酸羟胺,pH 7.4)加入离心管中,另取一个离心管加1.6 mL反应混合液A(0.1 mol·L-1 Tris-HCl缓冲,pH 7.4)作为对照,加入0.7 mL粗酶液和0.7 mL 40 mmol·L-1 ATP溶液,混匀,于37 ℃下保温0.5 h;加入显色剂(0.2 mol·L-1 TCA,0.37 mol·L-1 FeCl3和0.6 mol·L-1 HCl混合液)1 mL,摇匀并放置片刻后,于5000 r·min-1条件下离心10 min,取上清液测定540 nm处的吸光值。利用考马斯亮蓝法测定粗酶液中可溶性蛋白质,根据以下公式计算GS活性,用产生的γ-谷氨酰基异羟肟酸与铁络合物540 nm处吸光值的大小来表示GS活性:
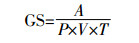
式中:A为540 nm处的吸光值;P为粗酶液中可溶性蛋白含量,mg·mL-1;V为反应体系中加入的粗酶液体积,0.7 mL;T为反应时间,0.5 h。
1.3 统计分析采用SAS 8.2进行单因素方差分析与相关分析,以Origin 2015绘制数据图像。
2 结果与分析 2.1 土壤与冠层氨挥发速率及累积量 2.1.1 越冬前土壤与冠层氨挥发速率播种施肥后前20 d为麦田氨挥发的主要时期,且土壤氨挥发速率与施氮量成正比(图 2a)。土壤氨挥发速率于施肥后第7~9 d达到峰值,施氮处理峰值(0.086~0.156 kg N·hm-2·d-1)比未施氮处理(0.044 kg N·hm-2·d-1)高95.5%~254.5%。施肥后第8~11 d,CK-N90、CK-N180的氨挥发速率分别高于N90、N180,而N0处理呈相反趋势(图 2a)。

|
| 图 2 氨挥发速率变化特征 Figure 2 Dynamics of ammonia fluxes |
追肥后10 d内,土壤氨挥发速率波动明显,于第9 d达峰值,施氮处理峰值(0.080~0.097 kg N·hm-2·d-1)比未施氮处理(0.030 kg N·hm-2·d-1)高166.7%~223.3%。返青-拔节期(图 2b),N180的氨挥发速率略低于CK-N180,而N0与N90处理呈相反趋势。小麦灌浆后(图 2c),N0、N90和N180的氨挥发速率明显高于CK-N0、CK-N90和CK-N180(灌浆前期N180处理略低于CK-N180)。5月下旬(灌浆末期)以后,CK-N0、CK-N90和CK-N180氨挥发速率波动较小,而N0、N90和N180的氨挥发速率增加显著。
2.1.3 氨挥发累积量施氮显著提高了麦田氨挥发累积量(表 1),施氮处理比未施氮处理高103.2%~130.7%,施氮处理间也存在显著差异(P < 0.05)。随施氮量的提高,麦田氮肥氨挥发损失率从4.3%(N90)降至2.7%(N180)。土壤氨挥发对麦田氨挥发的贡献率达87.2%~89.3%,施氮处理比未施氮处理高107.3%~136.3%,各处理间差异显著(P < 0.05);冠层氨挥发对麦田氨挥发贡献率为15.4%~19.9%,施氮处理比未施氮处理高56.9%~94.8%。
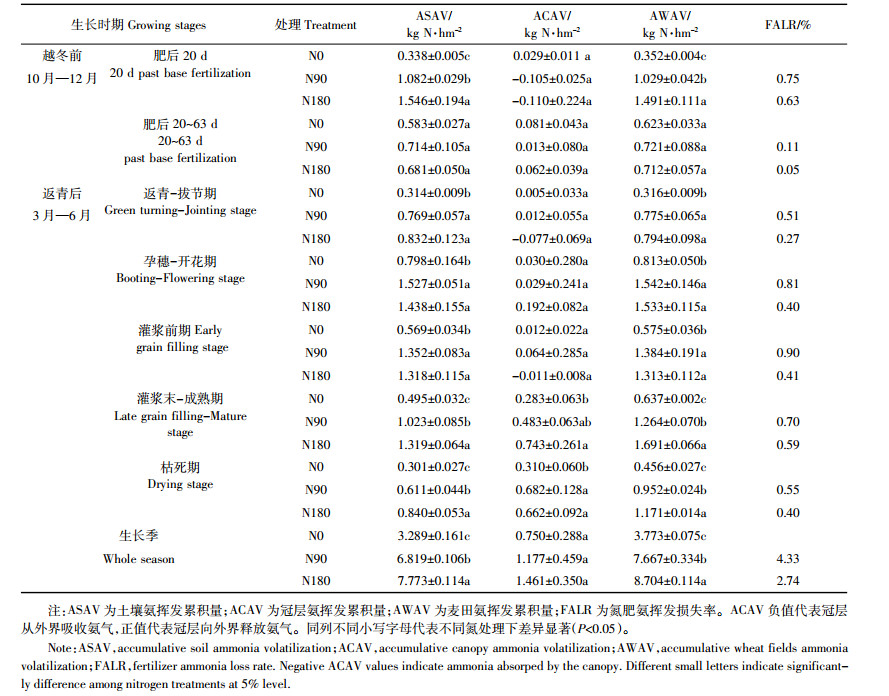 |
越冬前,施肥后20 d之内是土壤氨挥发的主要时期,且土壤氨挥发累积量随施氮量的增加显著提高(P < 0.05),施氮处理比未施氮处理高220.1%~357.4%(表 1);施氮处理冠层对土壤挥发氨气存在净吸收,吸收量占土壤挥发氨气的7.1%~9.7%;随施氮量的增加,冠层对土壤挥发氨气的吸收量占土壤氨累积挥发量的比率降低;而未施氮处理冠层发生氨气的净释放,占同时段土壤挥发氨气的8.6%。施肥20 d之后,各处理冠层均为氨气的净释放。返青后,各生育期施氮处理土壤氨挥发累积量比未施氮处理显著提高80.2%~179.1%(P < 0.05)。在返青-拔节期与灌浆前期,高施氮处理冠层对土壤挥发氨气发生净吸收,低施氮处理与未施氮处理的冠层发生氨气净释放。生育后期(灌浆末-枯死期)是冠层氨挥发的主要时期,冠层氨挥发占土壤氨挥发的65.1%~74.5%,施氮处理比未施氮处理提高96.5%~136.9%(P < 0.05)。
2.2 与冠层氨挥发相关的影响因子 2.2.1 质外体NH4+浓度、pH、叶片氨气补偿点变化灌浆末期,各处理质外体NH4+浓度均高于其他生育期,且施氮处理显著高于未施氮处理(图 3a,P < 0.05)。拔节-灌浆前期质外体NH4+浓度处于较低水平,抽穗期施氮处理显著低于未施氮处理(P < 0.05),开花期与灌浆末期则呈相反趋势。质外体溶液pH值(图 3b)变化范围为5.73~6.82,在开花期达到峰值,生育后期有降低趋势,在灌浆末期降至最低。除孕穗-抽穗期外,施氮处理的质外体pH均高于未施氮处理。开花期与灌浆末期,叶片氨气补偿点出现2个峰值(图 3c),冠层氨气补偿点为8.2~64.1 nmol·mol-1,且施氮处理叶片氨气补偿点显著高于未施氮处理(P < 0.05);其他生育期叶片氨气补偿点较低,波动范围为1.3~16.0 nmol·mol-1。

|
| 图 3 不同生育时期叶片质外体NH4+浓度、质外体pH、叶片氨气补偿点、GS活性变化 Figure 3 Apoplastic NH4+ concentration and pH, ammonia compensation point and GS of leaves in different growing stages |
返青后叶片GS活性先降低、后升高、再降低,在拔节期和开花期出现2个峰值,并在灌浆末期降至最低(图 3d)。拔节期与灌浆前期,N0处理GS活性最高,显著高于2种施氮处理(P < 0.05),且随施氮量的提高,GS活性降低;抽穗期,N0处理显著低于施氮处理(P < 0.05),且随施氮量的提高,GS活性提高;其余时期各处理间GS活性没有显著差异(P>0.05)。
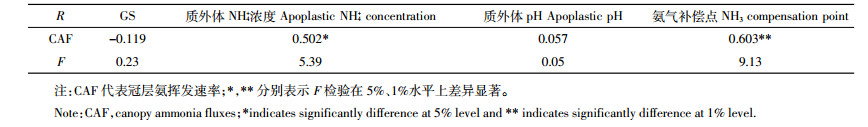
2.2.3 冠层氨挥发速率与各影响因子相关性冠层氨挥发速率与叶片氨气补偿点呈极显著正相关(P < 0.01),与质外体NH4+浓度显著正相关(P < 0.05),但与叶片GS活性、质外体溶液pH没有显著相关性(表 2)。
 |
土壤与冠层是麦田氨挥发的主要来源,对麦田氨挥发的贡献率分别为87.2%~89.3%和15.4%~19.9%(表 1)。土壤氨挥发主要发生在施肥后1~2周内,而冠层氨挥发主要发生在生育后期(图 2b,图 2c),符合一般农田土壤的氨挥发规律[7-8, 14]。
冠层氨气吸收主要出现在生育前期,并受施肥影响。低施氮处理,冠层氨气吸收主要发生在苗期;高施氮处理,苗期、返青期和灌浆前期均有冠层氨气吸收发生。Harper等[22]报道,缺氮时冠层会从大气中吸收氨气。但本研究发现N0处理冠层并没有发生明显的氨气吸收现象,可能是因为不施肥处理土壤氨挥发少(图 1),冠层空气中氨气浓度低于叶片氨气补偿点所致。相反,施氮处理土壤氨挥发强烈,空气中的氨气浓度可能高于叶片氨气补偿点,因此冠层有氨气吸收发生。Herrmann等[20]报道,施肥刈割后,尽管新生黑麦草叶片的质外体NH4+浓度及其氨挥发潜势升高,但始终低于空气中氨气浓度,因此存在冠层氨气吸收的可能性。
冬小麦冠层氨挥发主要发生在开花期与灌浆末-枯死期(图 2b,图 2c),分别占冠层氨挥发的4.5%~9.3%和79.1%~99.0%(表 1)。这是因为生育后期植物叶片以氮素转运为主,尤其是到了衰老期,蛋白质水解产生大量的NH4+(图 3a),为叶片氨挥发提供了直接来源,也导致较高的叶片氨气补偿点(图 3c)。
3.2 影响冠层氨挥发的因素质外体NH4+是冠层氨挥发的直接来源,叶片氨气补偿点是调控植物与大气氨气交换方向与强度的主要参数,其数值越大表明植物叶片氨挥发越强烈[20]。影响氨气补偿点的因素有施氮量[23]、细胞代谢或物质运输[24]等,这些因素也是影响质外体NH4+浓度的关键。相关性分析也表明,冠层氨挥发速率与叶片氨气补偿点极显著正相关(P < 0.01),与质外体NH4+浓度显著正相关(P < 0.05,表 2),而与GS活性相关性不显著。有研究[15]表明,叶片氨挥发与GS活性密切相关,利用MSO(GS抑制剂)降低GS酶活性会增加冠层氨挥发速率。这是因为降低GS活性会造成氨同化作用受到限制,导致细胞和质外体中NH4+的累积。但在正常情况下,营养生长期叶片GS活性不会受到强烈抑制,且生长越旺盛,酶活性越高,氨同化越快,此时控制冠层氨气交换方向的主要因素是大气氨气浓度。高施氮处理土壤氨挥发强烈,大气氨气浓度高于氨气补偿点,冠层从大气中吸收氨气。
冠层氨挥发主要发生于灌浆末期与枯死期,此时冠层氮代谢以分解转运为主,氨同化不是主导氮素代谢方向的关键因素;同时土壤氨挥发少,大气氨气浓度低于氨气补偿点,冠层以氨挥发为主。在营养生长和生殖生长的交汇期(花期),GS活性(图 3d)与冠层氨挥发速率(图 2b)均出现峰值,说明氮代谢和氨挥发都很旺盛。可能是由于光呼吸氮循环释放的NH4+多,其释放速率超过GS/GOGAT途径的同化速率[25],造成质外体NH4+浓度上升和冠层氨气释放。冠层氨挥发也可能来源于植株下部老叶或者地上的枯枝落叶[26]。因此,冬小麦冠层在土壤-大气氨气交换过程中的作用受生育期、施肥和营养状况等影响。
4 结论冬小麦麦田氨挥发主要出现在施肥后2~3周内,且随施氮量的增加而提高,此时施氮处理冠层发生氨气吸收现象。冠层氨挥发主要发生在生殖生长期,特别是灌浆末-枯死期。冠层氨气扩散方向主要受氨气补偿点和质外体NH4+浓度控制,与GS活性关系不大。在未来的氮素调控方面,应充分考虑冠层在农田氮素循环中的作用。
| [1] | Felix J D, Elliott E M, Gish T, et al. Examining the transport of ammonia emissions across landscapes using nitrogen isotope ratios[J]. Atmospheric Environment, 2014, 95(1) : 563–570. |
| [2] | 王敬国, 林杉, 李保国. 氮循环与中国农业氮管理[J]. 中国农业科学, 2016, 49(3) : 503–517. WANG Jing-guo, LIN Shan, LI Bao-guo. Nitrogen cycling and management strategies in Chinese agriculture[J]. Scientia Agricultura Sinica, 2016, 49(3) : 503–517. |
| [3] | Kuang F, Liu X J, Zhu B, et al. Wet and dry nitrogen deposition in the central Sichuan Basin of China[J]. Atmospheric Environment, 2016, 143 : 39–50. DOI:10.1016/j.atmosenv.2016.08.032 |
| [4] | Liu X J, Zhang Y, Han W X, et al. Enhanced nitrogen deposition over China[J]. Nature, 2013, 494(7438) : 459–462. DOI:10.1038/nature11917 |
| [5] | Morán M, Ferreira J, Martins H, et al. Ammonia agriculture emissions:From EMEP to a high resolution inventory[J]. Atmospheric Pollution Research, 2016, 7(5) : 786–798. DOI:10.1016/j.apr.2016.04.001 |
| [6] | 王书伟, 廖千家骅, 胡玉婷, 等. 我国NH3-N排放量及空间分布变化初步研究[J]. 农业环境科学学报, 2009, 28(3) : 619–626. WANG Shu-wei, LIAO QIAN Jia-hua, HU Yu-ting, et al. A preliminary inventory of NH3-N emission and its temporal and spatial distribution of China[J]. Journal of Agro-Environment Science, 2009, 28(3) : 619–626. |
| [7] | Yang Y, Zhou C J, Li N, et al. Effects of conservation tillage practices on ammonia emissions from Loess Plateau rain-fed winter wheat fields[J]. Atmospheric Environment, 2015, 104 : 59–68. DOI:10.1016/j.atmosenv.2015.01.007 |
| [8] | 山楠, 赵同科, 毕晓庆, 等. 不同施氮水平下小麦田氨挥发规律研究[J]. 农业环境科学学报, 2014, 33(9) : 1858–1865. SHAN Nan, ZHAO Tong-ke, BI Xiao-qing, et al. Ammonia volatilization from wheat soil under different nitrogen rates[J]. Journal of Agro-Environment Science, 2014, 33(9) : 1858–1865. |
| [9] | 董文旭, 胡春胜, 陈素英, 等. 保护性耕作对冬小麦-夏玉米农田氮肥氨挥发损失的影响[J]. 中国农业科学, 2013, 46(11) : 2278–2284. DONG Wen-xu, HU Chun-sheng, CHEN Su-ying, et al. Effect of conservation tillage on ammonia volatilization from nitrogen fertilizer in winter wheat-summer maize cropping system[J]. Scientia Agricultura Sinica, 2013, 46(11) : 2278–2284. |
| [10] | 李世清, 赵琳, 邵明安, 等. 植物冠层与大气氨交换的研究进展[J]. 西北植物学报, 2004, 24(11) : 2154–2162. LI Shi-qing, ZHAO Lin, SHAO Ming-an, et al. Ammonia exchange between plant canopy and the atmosphere:A review[J]. Acta Botanica Boreali-Occidentalia Sinica, 2004, 24(11) : 2154–2162. |
| [11] | Walker J T, Jones M R, Bash J O, et al. Processes of ammonia air-surface exchange in a fertilized Zea mays canopy[J]. Biogeosciences Discussions, 2012, 9(6) : 7893–7941. DOI:10.5194/bgd-9-7893-2012 |
| [12] | Martha Júnior G B, Trivelin P C O, Corsi M. Tanzania grass leaf absorption of ammonia volatilized from N15-urea applied to soil[J]. Revista Brasileira De Ciência Do Solo, 2009, 33(1) : 103–108. DOI:10.1590/S0100-06832009000100011 |
| [13] | Ping J L, Bremer E, Janzen H H. Foliar uptake of volatilized ammonia from surface-applied urea by spring wheat[J]. Communications in Soil Science and Plant Analysis, 2000, 31(1/2) : 165–172. |
| [14] | 陈刚, 徐阳春, 沈其荣. 施氮水平对水稻生育后期地上部氨挥发的影响[J]. 应用生态学报, 2008, 19(7) : 1483–1488. CHEN Gang, XU Yang-chun, SHEN Qi-rong. Effects of N fertilization levels on ammonia volatilization from rice shoot at later growth stages[J]. Chinese Journal of Applied Ecology, 2008, 19(7) : 1483–1488. |
| [15] | 陈明霞, 周彩云, 李明军, 等. 光呼吸和谷氨酰胺合成酶抑制剂对水稻冠层NH3挥发的影响[J]. 植物科学学报, 2011, 29(2) : 206–211. CHEN Ming-xia, ZHOU Cai-yun, LI Ming-jun, et al. Effects on ammonia volatilization from shoot of rice by inhibitor[J]. Plant Science Journal, 2011, 29(2) : 206–211. |
| [16] | Mattsson M, Häusler R E, Leegood R C, et al. Leaf-atmosphere NH3 exchange in barley mutants with reduced activities of glutamine synthetase[J]. Plant Physiology, 1997, 114(4) : 1307–1312. DOI:10.1104/pp.114.4.1307 |
| [17] | Farquhar G D, Firth P M, Wetselaar R, et al. On the gaseous exchange of ammonia between leaves and the environment:Determination of the ammonia compensation point[J]. Plant Physiology, 1980, 66(4) : 710–714. DOI:10.1104/pp.66.4.710 |
| [18] | 王朝辉, 刘学军, 巨晓棠, 等. 田间土壤氨挥发的原位测定--通气法[J]. 植物营养与肥科学报, 2002, 8(2) : 205–209. WANG Zhao-hui, LIU Xue-jun, JU Xiao-tang, et al. Field in situ determination of ammonia volatilization from soil:Venting method[J]. Plant Nutrition and Fertilizer Science, 2002, 8(2) : 205–209. |
| [19] | O'Leary B M, Rico A, Mccraw S, et al. The infiltration-centrifugation technique for extraction of apoplastic fluid from plant leaves using phaseolus vulgaris as an example[J]. Freshwater Biology, 2010, 55(11) : 2319–2331. |
| [20] | Herrmann B, Mattsson M, Jones S K, et al. Vertical structure and diurnal variability of ammonia exchange potential within an intensively managed grass canopy[J]. Biogeosciences and Discussions, 2009, 6(1) : 15–23. DOI:10.5194/bg-6-15-2009 |
| [21] | Meng S, Zhang C X, Su L, et al. Nitrogen uptake and metabolism of Populus simonii in response to PEG-induced drought stress[J]. Environmental and Experimental Botany, 2016, 123 : 78–87. DOI:10.1016/j.envexpbot.2015.11.005 |
| [22] | Harper L A, Sharpe R B, Langdale G W, et al. Nitrogen cycling in a wheat crop:Soil, plant, and aerial nitrogen transport[J]. Agronomy Journal, 1987, 79(6) : 965–973. DOI:10.2134/agronj1987.00021962007900060004x |
| [23] | Massad R S, Loubet B, Tuzet A, et al. Ammonia stomatal compensation point of young oilseed rape leaves during dark/light cycles under various nitrogen nutritions[J]. Agriculture Ecosystems & Environment, 2009, 133(3) : 170–182. |
| [24] | Massad R S, Loubet B, Tuzet A, et al. Relationship between ammonia stomatal compensation point and nitrogen metabolism in arable crops:Current status of knowledge and potential modelling approaches[J]. Environmental Pollution, 2008, 154(3) : 390–403. DOI:10.1016/j.envpol.2008.01.022 |
| [25] | Lea P J, Blackwell R B, Joy K W. Ammonia assimilation in higher plants[M]. New York: Oxford Scientific Publishers, 1992: 153-186. |
| [26] | Nemitz E, Sutton M A, Gut A, et al. Sources and sinks of ammonia within an oilseed rape canopy[J]. Agricultural and Forest Meteorology, 2000, 105(4) : 385–404. DOI:10.1016/S0168-1923(00)00205-7 |
 2017, Vol. 36
2017, Vol. 36