文章信息
- 王亚丽, 仪慧兰, 韩彦莎
- WANG Ya-li, YI Hui-lan, HAN Yan-sha
- SO2对谷子幼苗根系镉胁迫的缓解作用
- Sulfur dioxide alleviates cadmium toxicity in the roots of foxtail millet seedlings
- 农业环境科学学报, 2017, 36(3): 443-448
- Journal of Agro-Environment Science, 2017, 36(3): 443-448
- http://dx.doi.org/10.11654/jaes.2016-1338
文章历史
- 收稿日期: 2016-10-21
随着工业三废的排放以及农业生产中含镉(Cd)农药、化肥的过量使用,人类赖以生存的土壤、水体受到不同程度的Cd污染。据不完全统计,我国Cd污染农田面积达2.0×105 hm2,严重影响农业生产[1]。Cd毒害可直接或间接引发植物体活性氧自由基(Reactive oxygen species,ROS)的积累,高水平ROS会破坏叶绿素、核酸和蛋白质等生物大分子结构,影响细胞结构和功能,抑制植物生长发育,甚至导致死亡[2]。近年来,如何解决Cd污染土壤上的耕作问题受到广泛关注。在污染条件下,通过施加外源物质来缓解或抑制Cd对植物的毒害作用是相对快速和简便的措施,科研人员致力于寻求适合的外源物质来减轻Cd污染对植物生长发育带来的影响。
硫是植物生长必需的一种营养元素,大气中低浓度的二氧化硫(SO2)可作为植物硫营养的来源。环境中的SO2经气孔进入植物体,在细胞内溶于水产生SO32-和HSO3-。研究表明,一定浓度的SO2能够诱导植物抗氧化系统应答[3-4]。我们前期研究发现,30 mg·m-3 SO2预处理后,拟南芥对干旱胁迫的耐受性和对灰霉菌感染的抗性均明显增强[5-6]。但是,SO2在作物重金属毒害中的缓解作用少有报道。
谷子(Setaria italica L.)又称粟,在我国北方干旱半干旱地区广泛种植,是山西省传统的优质杂粮作物。本研究以谷子幼苗为实验材料,采用SO2衍生物(SO32-:HSO3-,3:1,mmol·L-1/mmol·L-1)处理[7],研究SO2对幼苗根系Cd毒性的缓解作用,为人工降低Cd污染对谷子幼苗的危害提供实验依据。
1 材料与方法 1.1 植物培养供试谷子(Setaria italica L.)品种为“长农44号”,谷种由山西省农业科学院谷子研究所郭二虎研究员惠赠。
选取籽粒饱满的谷种,用0.5%的次氯酸钠浸泡7 min,双蒸水冲洗后浸种3 h,湿纱布包裹催芽,将露白一致的谷种均匀摆放于无菌纱布上,水培法培养谷子幼苗,光周期为16 h/8 h(昼/夜),温度(25±2)℃,相对湿度45%~65%。
1.2 实验分组与处理根据预实验结果,选择对谷子幼根生长有促进作用的SO2衍生物(Na2SO3:NaHSO3,3:1,mmol·L-1/mmol·L-1)浓度500 μmol·L-1(浓度以总S含量计算),及对谷子幼根生长有抑制作用的Cd(CdCl2·2.5H2O)浓度250 μmol·L-1和500 μmol·L-1,作为后续实验浓度。
选取生长10 d且长势良好的谷子幼苗分为6组,SO2干预组用SO2衍生物预处理1 d后转入Cd溶液中处理3 d,Cd处理组水培1 d后改用Cd溶液处理3 d。具体分组处理如下:
(1)对照组(CK):水培4 d。
(2)SO2处理组(S500):500 μmol·L-1 SO2衍生物处理1 d +水培3 d。
(3)Cd处理组Ⅰ(Cd250):水培1 d + 250 μmol·L-1 Cd处理3 d。
(4)SO2干预组Ⅰ(Cd250+S500):500 μmol·L-1 SO2衍生物处理1 d + 250 μmol·L-1 Cd处理3 d。
(5)Cd处理组Ⅱ(Cd500):水培1 d + 500 μmol·L-1 Cd处理3 d。
(6)SO2干预组Ⅱ(Cd500+S500):500 μmol·L-1 SO2衍生物处理1 d + 500 μmol·L-1 Cd处理3 d。
处理期间的温度、湿度及光照条件同上。处理结束后,双蒸水冲洗,取根部迅速检测生理生化指标。以相同条件下3次生物学重复实验得到的材料来检测各处理组的相关指标。
1.3 生长指标检测利用直尺测量每组20株植株的根长,随后将它们放在烘箱中105 ℃杀青20 min,70 ℃烘至恒重,称其干重。
1.4 生理生化指标检测取谷子幼根,用羟氨氧化法测定超氧阴离子(O2-·)产生速率,硫酸钛沉淀法测定过氧化氢(H2O2)含量,硫代巴比妥酸法测定丙二醛(MDA)含量。超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性测定参照Li等[3]的方法。谷胱甘肽(GSH)含量测定参照Anderson等[8]的方法。谷胱甘肽过氧化物酶(GPX)活性测定参照Wendel等[9]的方法。谷胱甘肽硫转移酶(GST)活性测定参照Habig等[10]CDNB比色法。
1.5 数据统计分析计算各组3个重复实验的平均值和标准误,采用SPSS 16.0软件进行方差分析,用Duncan方法对不同处理组的数据进行多重比较。图中不同字母表示组间差异显著(P < 0.05),相同字母表示组间差异不显著。
2 结果与分析 2.1 镉对谷子幼苗根长的影响及SO2的缓解作用Cd胁迫后,谷子幼根生长受到明显抑制,250 μmol·L-1 Cd和500 μmol·L-1 Cd组的根长分别比对照降低了30.4%和39.8%(图 1A)。用500 μmol·L-1 SO2衍生物预处理后,Cd对根的生长抑制得到明显缓解,幼苗根长显著大于Cd单独处理组(图 1A)。250 μmol·L-1 Cd对根干重的影响不明显,而500 μmol·L-1 Cd处理组根干重显著降低(图 1B);用SO2衍生物预处理后,500 μmol·L-1 Cd组根干重显著大于Cd单独处理组(图 1B)。结果表明,Cd对谷子根系生长具有明显毒性,一定剂量的SO2预处理可以缓解Cd对幼根生长的毒性作用。

|
| 图 1 外源SO2衍生物对镉胁迫下谷子幼苗根长和根干重的影响 Figure 1 Effects of SO2 derivates on length and dry weight of the roots of millet seedlings under Cd stress 图中不同小写字母表示差异显著(P < 0.05)。下同 Different lowercase letters indicate significant difference (P < 0.05). The same below |
Cd处理后,根组织中O2-·产生速率增加,H2O2含量显著升高,250 μmol·L-1 Cd和500 μmol·L-1 Cd组的H2O2含量分别比对照提高了54.8%和75.4%,MDA含量比对照增加了48.8%和157.0%(图 2)。用SO2衍生物预处理后,Cd处理组的O2-·产生速率、H2O2和MDA含量不同程度降低,其中:250 μmol·L-1 Cd组O2-·产生速率和H2O2含量分别降低12.4%和23.5%,MDA含量显著降低35.6%;500 μmol·L-1 Cd组的O2-·产生速率、H2O2和MDA含量均显著降低,降幅分别为37.4%、37.5%和21.8%(图 2)。结果表明,Cd处理引发了谷子根部的氧化胁迫与氧化损伤,外用一定剂量SO2能抑制Cd引发的ROS升高,减轻膜脂损伤程度。

|
| 图 2 外源SO2衍生物对镉胁迫下谷子幼根O2-·产生速率、H2O2和MDA含量的影响 Figure 2 Effects of SO2 derivates on O2-· generation rate and contents of H2O2 and MDA in roots of millet seedlings under Cd stress |
Cd处理后,根部POD活性下降,GPX和CAT活性变化不明显,SOD活性上升(图 3)。用SO2衍生物预处理后,Cd处理组POD、GPX活性均上升(图 3A至图 3B);250 μmol·L-1 Cd诱发的SOD活性升高被显著抑制(图 3C);Cd250+S500和Cd500+S500组CAT活性较Cd250和Cd500单独处理组明显下降(图 3D)。结果表明,Cd胁迫改变了谷子根细胞中的抗氧化酶活性,影响了细胞的氧化还原代谢过程,外源SO2可增强Cd胁迫下植株根部的POD、GPX活性,有助于清除ROS,缓解Cd造成的氧化胁迫。
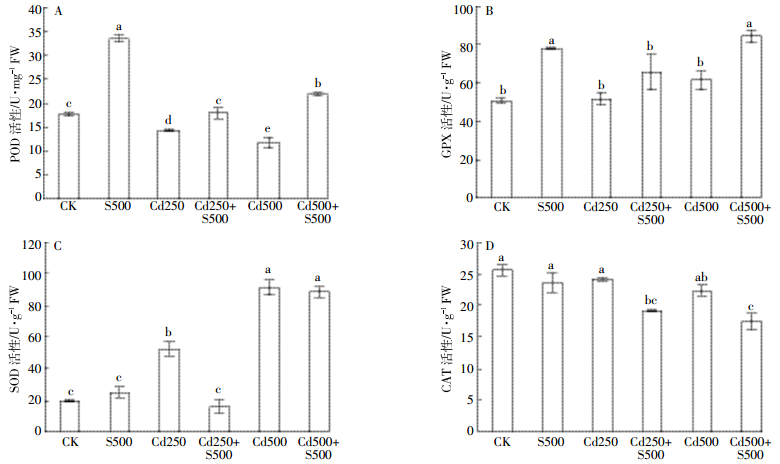
|
| 图 3 外源SO2衍生物对镉胁迫下谷子幼根POD、GPX、SOD及CAT活性的影响 Figure 3 Effects of SO2 derivates on activities of POD, GPX, SOD and CAT in roots of millet seedlings under Cd stress |
Cd处理组根中GSH含量提高,GST活性升高。用SO2衍生物预处理后,250 μmol·L-1 Cd组GSH含量显著增加68.0%,500 μmol·L-1 Cd组GST活性显著升高,增幅为21.8%(图 4)。结果表明,Cd处理组谷子根部重要抗氧化分子GSH含量和代谢解毒酶GST活性升高,参与对Cd胁迫的应答,施用SO2衍生物能提高250 μmol·L-1 Cd组GSH水平,增强500 μmol·L-1 Cd组GST活性,进而提高植株对不同浓度Cd胁迫的适应能力。
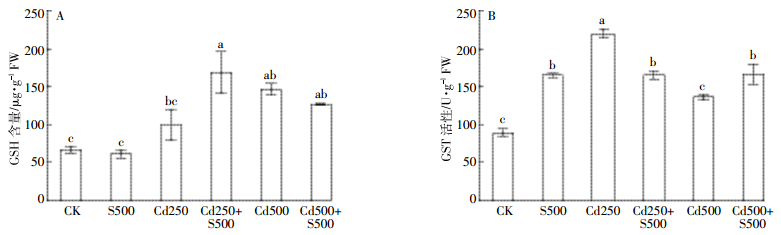
|
| 图 4 外源SO2衍生物对镉胁迫下谷子幼根GSH含量和GST活性的影响 Figure 4 Effects of SO2 derivates on GSH content and the activity of GST in roots of millet seedlings under Cd stress |
根系是植物的重要组成部分,是植物生长发育、新陈代谢的重要营养器官。根系具有固着和支持植物体的作用,能够吸收土壤中的水分和无机盐并输送到地上部供植株生长发育,还能合成和分泌多种化合物参与植物保护过程。因此,根系的生理状态会直接影响植株的正常生长发育。土壤Cd污染对植物的影响最先发生在根部,根部所在环境污染物浓度高,污染物与根部接触的时间长,致使植物根受害严重,影响植株的生长发育。本文研究Cd对谷子幼根的毒性及SO2衍生物的缓解作用,发现500 μmol·L-1 SO2衍生物预处理可缓解Cd对幼根生长的抑制(图 1)。
Cd具有很强的毒性,可诱导植物体内ROS大量积累,导致细胞氧化损伤。本研究采用的Cd处理能使谷子幼根中O2-·大量产生,H2O2水平升高,膜脂过氧化产物MDA含量提高;外源SO2衍生物在缓解Cd对谷子生长抑制的同时,明显降低了根组织的ROS积累,阻止或减轻了Cd引发的膜脂氧化损伤(图 2)。这与王云等[11]、Liang等[12]的研究结果类似,他们也发现外施硫化合物可减轻Cd对小麦、小白菜等作物造成的氧化损伤。
为进一步分析SO2缓解Cd致谷子根系氧化损伤的机制,我们检测了根系中抗氧化系统的变化。研究发现,SO2干预组根系POD和GPX活性提高,SOD和CAT活性下降(图 3),主要抗氧化酶活性的改变与Cd浓度有关,但两个SO2干预组的MDA水平显著低于Cd单独处理组(图 2C),说明SO2处理能降低根组织氧化胁迫,缓解氧化损伤。POD可催化由H2O2参与的各种还原剂的氧化反应,起到清除H2O2的作用,GPX利用GSH将脂质过氧化物和H2O2还原成相应的醇和H2O,由此SO2干预组POD和GPX升高对降低Cd引发的氧化胁迫起到了重要作用。SOD主要催化O2-·生成H2O2和O2,CAT催化H2O2生成H2O和O2。虽然SO2干预组O2-·生成速率降低的原因尚不明确,但SO2干预组SOD活性下降可能与同期酶底物O2-·减少(图 2)有一定关系,还会导致SOD产物H2O2减少,并可能引发下游H2O2分解酶CAT活性的降低。此外,作为植物细胞中重要的抗氧化酶,SOD和CAT有可能在SO2干预早期发挥作用。Zhu等[13]在研究SO2衍生物缓解小麦铝毒害时发现,短期胁迫下(12~36 h),SO2衍生物能上调SOD、CAT和APX等多种抗氧化酶活性,他们也认为外源SO2通过上调植物体内的抗氧化防御系统来提高植物对铝的耐受性。
抗氧化系统由酶和非酶系统组成,非酶组分包括抗坏血酸、GSH等。研究表明GSH在植物抵抗Cd胁迫的过程中发挥了重要作用[14]。本研究结果显示,SO2衍生物预处理能显著增加250 μmol·L-1 Cd处理组抗氧化分子GSH水平,大量积累的GSH一方面可通过氧化还原途径清除ROS(图 5),另一方面参与植物螯合肽(PCs)的合成,合成的PCs与Cd2+结合,由细胞质进入液泡,从而降低对细胞的毒害[15],减少Cd胁迫引发的根系氧化损伤(图 5)。GST是植物细胞内重要的解毒酶,能催化GSH与重金属离子结合从而脱毒,还能结合胞内的代谢废物和有害物并将其转运至胞外[16]。本研究结果显示,SO2衍生物预处理能提高500 μmol·L-1 Cd处理组的GST活性,GST活性升高可促进GSH与Cd结合,并可加速胞内有害物的排出,从而减轻Cd的毒性,降低Cd对谷子生长的抑制。这也表明SO2干预效应受Cd浓度影响。
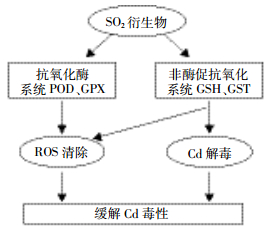
|
| 图 5 SO2缓解谷子根系镉胁迫机理示意图 Figure 5 The sketch map of SO2 alleviation the toxicity of Cd stress in millet seedlings roots |
在250、500 μmol·L-1的Cd胁迫下,谷子幼苗根组织中ROS大量积累,膜脂过氧化损伤程度增加,根生长受到抑制。500 μmol·L-1外源SO2衍生物能够通过以下两种方式有效缓解Cd对谷子幼苗根系的毒性:(1)通过上调抗氧化酶系统的POD和GPX活性来清除ROS;(2)通过维持较高的GSH水平和提高GST活性来减少Cd引发的氧化损伤,并增强Cd解毒能力。目前,关于SO2衍生物缓解谷子根系镉毒害的分子机制仍待探究,对于SO2衍生物是否能够减少谷子地上部分的Cd积累,还需进一步明确。
| [1] | 李婧, 周艳文, 陈森, 等. 我国土壤镉污染现状、危害及其治理方法综述[J]. 安徽农学通报, 2015, 21(24): 104–107. LI Jing, ZHOU Yan-wen, CHEN Sen, et al. Actualities, damage and management of soil cadmium pollution in China[J]. Anhui Agriculture Science Bulletin, 2015, 21(24): 104–107. |
| [2] | Toppi L S D, Gabbrielli R. Response to cadmium in higher plants[J]. Environmental and Experimental Botany, 1999, 41(2): 105–130. DOI:10.1016/S0098-8472(98)00058-6 |
| [3] | Li L H, Yi H L. Effect of sulfur dioxide on ROS production, gene expression and antioxidant enzyme activity in Arabidopsis plants[J]. Plant Physiology and Biochemistry, 2012, 58: 46–53. DOI:10.1016/j.plaphy.2012.06.009 |
| [4] | Giraud E, Ivanova A, Gordon C S, et al. Sulphur dioxide evokes a large scale reprogramming of the grape berry transcriptome associated with oxidative signalling and biotic defence responses[J]. Plant, Cell and Environment, 2012, 35(2): 405–417. DOI:10.1111/j.1365-3040.2011.02379.x |
| [5] | 刘佳.二氧化硫在谷子和拟南芥干旱胁迫过程中的生理作用[D].太原:山西大学, 2015. LIU Jia. The important roles of SO2 in plant response to drought stress in millet and Arabidopsis[D]. Taiyuan:Shanxi University, 2015. |
| [6] | 薛美昭, 仪慧兰. SO2诱导拟南芥miR393转录介导植株抗病性增强[EB/OL].北京:中国科技论文在线[2015-05-21].http//www.paper.edu.cn/releasepaper/content/201505-296. XUE Mei-zhao, YI Hui-lan. MiR393 mediated disease resistance to Botrytis cinerea in Arabidopsis exposed to SO2[EB/OL]. Beijing:Scientific Papers Online[2015-05-21].http//www.paper.edu.cn/releasepaper/content/201505-296. |
| [7] | Shapiro R. Genetic effects of bisulfite[J]. Mutation Research, 1977, 39(2): 149–176. DOI:10.1016/0165-1110(77)90020-3 |
| [8] | Anderson M E. Determination of glutathione and glutathione disulfide in biological samples[J]. Methods in Enzymology, 1985, 113: 548–555. DOI:10.1016/S0076-6879(85)13073-9 |
| [9] | Wendel A. Glutathione peroxidase[J]. Methods in Enzymology, 1981, 77: 325–333. DOI:10.1016/S0076-6879(81)77046-0 |
| [10] | Habig W H, Pabst M J, Jakoby W B. Glutathione S-transferases the first enzymatic step in mereapturic acid formation[J]. Biological Chemistry, 1974, 249(22): 7130–7139. |
| [11] | 王云, 张海军, 唐为忠, 等. 硫对镉胁迫下小麦幼苗生长和一些生理特性的影响[J]. 农业环境科学学报, 2008, 7(3): 1029–1032. WANG Yun, ZHANG Hai-jun, TANG Wei-zhong, et al. Effect of sulfur on plant growth and some physiological characteristics of wheat seedlings under cadmium stress[J]. Journal of Agro-Environment Science, 2008, 7(3): 1029–1032. |
| [12] | Liang T S, Han D, Guo D W. Sulfur decreases cadmium translocation and enhances cadmium tolerance by promoting sulfur assimilation and glutathione metabolism in Brassica chinensis L.[J]. Ecotoxicology and Environmental Safety, 2016, 124: 129–137. DOI:10.1016/j.ecoenv.2015.10.011 |
| [13] | Zhu D B, Hu K D, Guo X K, et al. Sulfur dioxide enhances endogenous hydrogen sulfide accumulation and alleviates oxidative stress induced by aluminum stress in germinating wheat seeds[J]. Oxidative Medicine and Cellular Longevity, 2015. DOI:10.1155/2015/612363 |
| [14] | 蔡保松, 雷梅, 陈同斌, 等. 植物螯合肽及其在抗重金属胁迫中的作用[J]. 生态学报, 2003, 23(10): 2126–2132. CAI Bao-song, LEI Mei, CHEN Tong-bin, et al. Phytochelatins and their roles in phyto-tolerance to heavy metals:A review[J]. Acta Ecologica Sinica, 2003, 23(10): 2126–2132. |
| [15] | 段喜华, 唐中华, 郭晓瑞. 植物谷胱甘肽的生物合成及其生物学功能[J]. 植物研究, 2009, 30(1): 98–105. DUAN Xi-hua, TANG Zhong-hua, GUO Xiao-rui. Biosynthesis and function of glutathione in plant[J]. Bulletin of Botanical Reserch, 2009, 30(1): 98–105. |
| [16] | Dixon D, Lapthorn A, Edwards R. Plant glutathione transferase[J]. Genome Biology, 2002, 3(3). DOI:10.1186/gb-2002-3-3-reviews3004 |
 2017, Vol. 36
2017, Vol. 36




