文章信息
- 李茴, 赵杏, 杨京平, 钟一铭, 王小鹏
- LI Hui, ZHAO Xing, YANG Jing-ping, ZHONG Yi-ming, WANG Xiao-peng
- 高温与降雨对不同茶龄土壤碳氮养分及胞外酶活性的影响
- Effects of extreme warming and rainfall on carbon and nitrogen nutrients status and enzyme activities in tea garden soils with different planting ages
- 农业环境科学学报, 2017, 36(3): 557-565
- Journal of Agro-Environment Science, 2017, 36(3): 557-565
- http://dx.doi.org/10.11654/jaes.2016-1287
文章历史
- 收稿日期: 2016-10-10
土壤碳、氮是构成土壤养分的主要成分, 其质量和含量都直接影响土壤的物理、化学和生物特征及其演变过程, 并且在保证和协调土壤养分供应与积累、影响土壤酶类物质的种类和活性、控制植物初级和次级生产量等方面都起着十分重要的作用[1]。茶园土壤微生物是茶园生态系统的重要组成部分, 参与并推动着土壤养分的循环和转化, 微生物及酶活性的特征直接影响茶叶产量和品质[2-5]。目前关于气候变化对酶活性、分解作用和异养呼吸的多数研究主要集中在高温方面。气候变化对酶活性的影响不仅包括由热动力学控制的活性变化[6], 还包括对酶生物产量和转化效率的直接或非直接影响而导致长期的酶库大小变化[7]。气候变化直接作用于生态系统, 通过对土壤微生物和植物群落的初级生产力和多样性影响, 改变土壤理化性质而影响土壤生态环境[8], 从而进一步影响土壤质量。有研究表明夏季持续高温和干旱会影响茶叶产量和质量[9]。近年来, 关于各类生态系统的土壤碳、氮库及其参与生态系统碳氮循环的过程和重要意义等方面的研究较多, 研究对象主要集中于森林、农田、湿地和草地生态系统[10-14], 但极端气候变化对茶园微生物群落结构影响研究较少。
不同茶龄土壤微生态环境不同, 对极端气候的响应也不同, 然而不同茶龄土壤碳氮养分和胞外酶活性以及其对极端事件的响应尚不明确, 因此, 本次试验比较不同茶龄 (Y10、Y30和Y50) 的茶园和荒地土壤在不同高温 (35、40 ℃) 以及极端降雨处理前后土壤碳氮养分以及胞外酶活性变化, 研究土壤质量指标随时间以及极端气候的变化, 明确极端高温胁迫对土壤环境的影响, 以及极端高温处理后降雨条件下土壤环境的恢复能力, 进一步对不同茶龄土壤质量进行综合评价。本试验研究结果将为促进全球气候变化条件下茶产业的发展, 保障茶园土壤生态系统健康, 提高茶叶产量和质量提供理论依据。
1 材料与方法 1.1 试验地点和供试材料供试土壤采自于浙江大学余杭径山茶学基地, 该基地位于杭州市余杭径山镇 (30°23′N, 119°53′E)。该区域属于亚热带季风气候区, 四季分明, 年平均气温17 ℃, 年平均降雨量约为1400 mm。选择成土母质 (第四纪土壤) 相同, 施肥情况相似的10~12 a (Y10)、28~30 a (Y30) 和48~50 a (Y50) 茶龄的茶园土壤作为研究对象, 同时选取茶园附近的荒地 (Y0) 作为对照。于2013年5月从各茶园小区在距离茶树10 cm范围内按照Z字形随机取5个位点表层土10 cm为样品 (每个类型3个), 采集的土壤用冰盒带回实验室, 土壤样品过2 mm筛, 除去动植物残体待测。按四分法取样, 分为两部分:一部分放入4 ℃冰箱保存, 用于土壤微生物指标的测定; 另一部分用于土壤理化性质的测定。土壤基本性状指标见表 1。
试验在室内恒温箱内进行土壤培养, 采用120个 (2种温度×5次取样时间×4种土壤样品×3次重复)7.5 cm (直径)×10 cm (高) 的PVC管, 底部包上纱布防止土壤掉落; 每个PVC管中装入300 g新鲜土壤置于恒温培养箱, 25 ℃条件下预培养两周, 调整土壤含水量至田间最大持水量的30%;之后将土壤样品平分两份置于两个不同的恒温培养箱内, 一个温度调至35 ℃(高温对照组), 一个温度调至40 ℃(极端高温处理组), 培养两周; 在高温处理的最后一日模拟降雨, 向实验处理采用的PVC管注无菌水100 mm, 量取的无菌水平均分成两份, 一日分两次加入土柱 (早8: 00和晚8: 00), 形成淹水条件。强度为100 mm·d-1, 再培养3 d。整个培养周期内每日用注射器注射无菌纯水调节土壤水分, 在培养期内第14、15、21、28 d和31 d破坏性取样。采集的土壤样品分两份, 一份4 ℃保存, 另一份风干, 用于相关指标检测分析。
1.3 测定方法土壤pH采用雷磁pH复合电极测量水浸提 (土:水=1: 2.5) 后的溶液; 土壤总有机碳 (TOC)、水溶性有机碳 (DOC) 采用Multi N/C 2100总有机碳分析仪测定; 土壤全氮 (TN) 采用rapid N cube氮分析仪测定; 土壤氨氮 (NH4+-N) 和硝氮 (NO3--N) 用2 mol·L-1 KCl溶液浸提 (土:液=1: 5) 后, 分别用靛酚蓝比色法和紫外双波长比色法测定。土壤微生物碳氮 (MBC和MBN) 采用氯仿熏蒸进而用提取剂提取分别测定[15-16]。β-葡萄糖苷酶 (BG)、N-乙酰氨基葡萄糖苷酶 (NAG) 和亮氨酸氨基肽酶 (LAP) 活性采用微平板荧光比色法测定, 所用基质均购自Sigma公司。采用多功能酶标仪 (MD5, Molecular Devices) 检测荧光, 365 nm激发, 460 nm检测荧光强度。每个样品重复8次, 酶活性计算参照DeForest[17]。
1.4 数据处理与分析试验数据使用Excel 2007进行计算处理, 柱状图使用Origin 8.5制作。在SPSS 16.0中采用重复测量方差分析检验土壤温度、茶龄和取样时间对土壤化学性状和胞外酶活性的影响。采用LSD检验比较每个时间点不同处理间差异; 采用Pearson相关性分析检验土壤各指标之间的相关性。
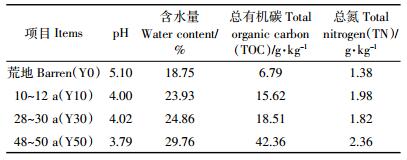
2 结果与分析 2.1 极端高温和降雨处理前后不同茶龄土壤碳库特征土壤样品预培养以后, 荒地土壤中可溶解性有机碳 (DOC) 含量显著低于茶园土壤, 各茶龄土壤中DOC含量顺序为Y30≥Y10>Y50>Y0。35 ℃和40 ℃高温处理组间土壤DOC含量无显著性差异, 且高温处理对荒地土壤的DOC含量影响也不显著, 但是在处理的第1 d土壤DOC含量有增加的趋势, Y10和Y30组在处理后期变化不大, 但是Y50组的DOC含量会呈现降低趋势。极端降雨后各茶龄土壤DOC含量会有小幅度的降低, Y10和Y30组的含量要高于其他试验组 (图 1A)。土壤样品预培养后, 土壤总有机碳 (TOC) 含量随茶龄的增加而升高, 处理前Y50土壤TOC含量分别为Y0、Y10、Y30土壤的5.95倍、2.84倍和2.11倍。高温处理初期, 除Y0组, 其他茶龄土壤TOC含量都表现出35 ℃高温组低于40 ℃高温组, 处理后期土壤TOC含量回升, Y30组达到最高 (P < 0.05)。降雨后各茶龄土壤TOC含量都会降低, 35 ℃高温组Y30土壤TOC降低幅度大于其他处理组 (图 1)。
|
| 图 1 各茶龄土壤在极端高温和降雨处理下可溶性有机碳和总有机碳变化 Figure 1 Variations of DOC and TOC with different tea cultivation ages with incubation at 35 ℃ and 40 ℃ followed by rewet 35和40代表高温35 ℃和40 ℃。小写和大写字母分别代表同一时间35 ℃和40 ℃处理下不同茶龄土壤养分差异性显著, "*"代表同一时间相同茶龄不同高温处理间土壤养分差异性显著 (P < 0.05)。图中数据均为平均值±标准差 (n=3)。下同 35 and 40 represent high temperature 35 ℃ and 40 ℃, respectively. Different capital letters and lower-case letters indicate significant differences among 35 ℃ and 40 ℃ treatments of different planting ages at the same time, respectively. '*' indicates significant differences for soils under different temperature treatments at the same time (P < 0.05). Data represents mean±standard deviation (n=3). The same as below |
土壤样品预培养以后, 土壤微生物碳 (MBC) 在各茶龄土壤中含量表现为Y30>Y10>Y50>Y0, Y0、Y10、Y30、Y50土壤MBC含量分别为23.12、60.24、67.82、32.39 mmol·kg-1。随着高温处理时间的增长, 40 ℃高温组Y0土壤MBC含量基本不变, 35 ℃高温下Y10、Y30和Y50土壤MBC含量表现出先升高后降低的趋势, 而Y50土壤MBC含量表现出先升高后降低的趋势, 35 ℃处理组土壤MBC含量显著高于40 ℃高温处理组。模拟降雨处理后各茶龄土壤MBC含量显著升高, 表现为Y30>Y10>Y50>Y0, 并且35 ℃高温组低于40 ℃高温组 (P < 0.05)(图 2A)。土壤样品预培养后, 土壤β-葡萄糖苷酶 (BG) 活性在各茶龄土壤中活性表现为Y30>Y50>Y0>Y10。高温处理后土壤BG活性显著提高, 之后表现为降低趋势; Y30、Y50土壤在35 ℃高温组土壤BG活性显著高于40 ℃高温组 (P < 0.05)。模拟降雨后, MBC显著增高, 而DOC却没有显著增加。荒地土壤BG活性升高, 茶园土壤BG活性只有40 ℃高温组表现出升高趋势, 且升高的幅度为Y30≥Y50>Y10>Y0(图 2B)。

|
| 图 2 各茶龄土壤极端高温和降雨处理下微生物碳和β-葡萄糖苷酶活性变化 Figure 2 Variations of MBA and activities of BG with different tea cultivation ages with incubation at 35 ℃ and 40 ℃ followed by rewet |
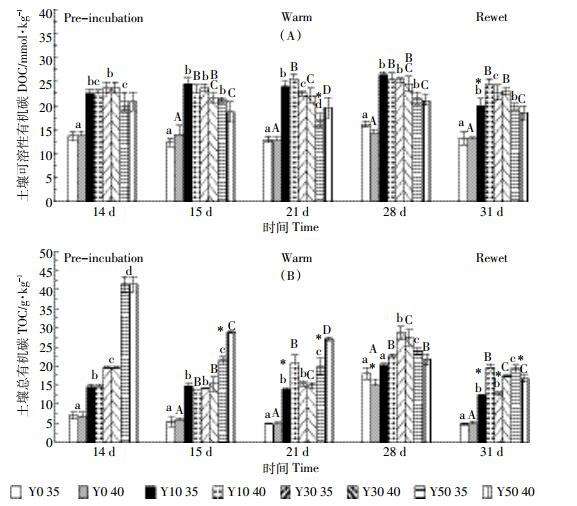
土壤样品预处理培养后, 土壤硝态氮 (NO3--N) 含量随着茶龄的增加先升高后降低, 表现为Y30(70.75 mg·kg-1)>Y10(51.96 mg·kg-1)>Y50(45.91 mg·kg-1)>Y0(17.76 mg·kg-1); 土壤铵态氮 (NH4+-N) 含量随着茶龄的增长而增大, 表现为Y50(169.15 mg·kg-1)>Y30(128 mg·kg-1)=Y10>Y0(82.13 mg·kg-1)。高温处理初期, 土壤NO3--N和土壤NH4+-N含量急剧降低, 降低后土壤NO3--N含量范围为3~6 mg·kg-1, 土壤NH4+-N含量范围为6~18 mg·kg-1; 之后随着高温处理时间的增长, 土壤NO3--N和土壤NH4+-N含量回升, 且35 ℃高温组含量要低于40 ℃高温组。模拟降雨处理后, 土壤NO3--N含量反而降低, 而土壤NH4+-N含量基本不变, 35 ℃高温处理组土壤NH4+-N含量显著低于40 ℃处理组 (图 3)。
|
| 图 3 各茶龄土壤极端高温和降雨处理下铵态氮和硝态氮变化 Figure 3 Variations of soil ammonia and nitrate nitrogen with different tea cultivation ages with incubation at 35 ℃ and 40 ℃ followed by rewet |
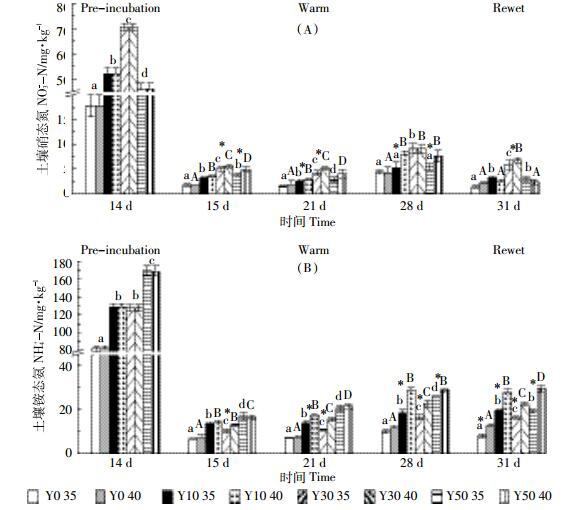
土壤样品预处理之后, 土壤微生物氮 (MBN) 含量与茶龄有关, 表现为Y50>Y10>Y0>Y30。高温处理之初, 土壤MBN含量显著增加, 随着处理时间的增长, 40 ℃高温组Y30土壤MBN含量表现出升高趋势且含量高于其他处理组; 模拟降雨处理降低土壤MBN含量; 整个处理过程中, 土壤Y30含量最高, 并且40 ℃处理组土壤MBN含量显著高于35 ℃处理组 (图 4A)。土壤预处理之后土壤涉氮酶活性 (NAG+LAP) 随着茶龄的增加表现出先升高后降低 (茶龄为30年时达到最大) 的趋势, Y30土壤NAG+LAP活性分别是Y0、Y10、Y50的8.03、2.10、3.23倍。高温处理会降低涉氮酶活性, 随着高温处理时间的增长, 降低幅度越大, 高温处理末期土壤涉氮酶活性范围仅为2~5 nmol·g-1·h-1; 模拟降雨处理之后土壤涉氮酶活性升高, 除Y30组之外, 都恢复至高温处理之前水平甚至更高; 模拟降雨处理之前Y10、Y30和Y50土壤在35 ℃处理组土壤涉氮酶活性高于40 ℃处理组, 但是模拟降雨处理组后35 ℃处理组土壤涉氮酶活性却低于40 ℃处理组 (图 4B)。
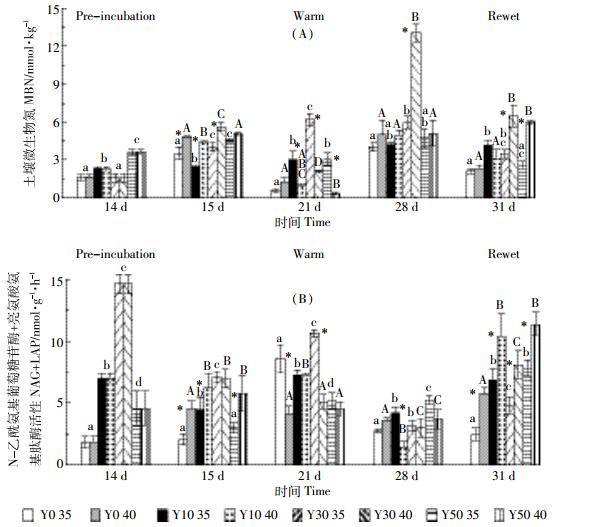
|
| 图 4 各茶龄土壤在极端高温和降雨处理下微生物氮和N-乙酰氨基葡萄糖苷酶+亮氨酸氨基肽酶活性 Figure 4 Soil MBN content and activities of NAG+LAP with different tea cultivation ages with incubation at 35 ℃ and 40 ℃ followed by rewet |
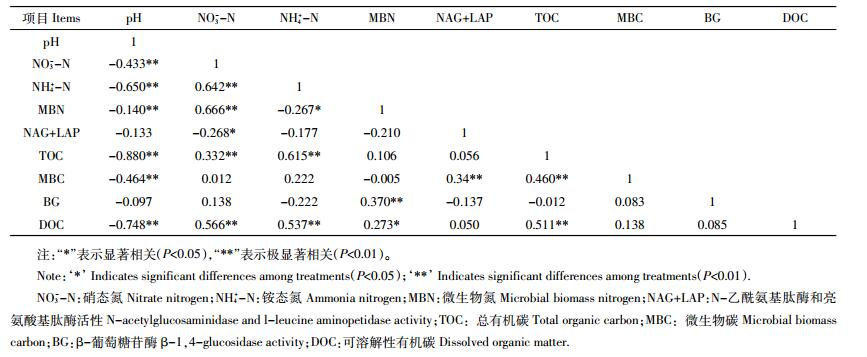
极端气候处理条件下土壤涉碳、氮生化性质指标之间相关性特征如表 2所示。除BG和NAG+LAP外, 其他涉碳和氮指标均和pH呈极显著 (P < 0.01) 负相关, 这表明在高温处理条件下, 茶园土壤中pH值依然是土壤养分的限制因素。土壤NO3--N和NH4+-N、MBN、TOC、DOC呈极显著 (P < 0.01) 正相关, 和NAG+LAP呈显著 (P < 0.05) 负相关。NH4+-N和MBN呈显著 (P < 0.05) 负相关, 和TOC、DOC呈极显著 (P < 0.01) 正相关。MBN和BG之间呈极显著 (P < 0.01) 正相关, 和DOC呈显著 (P < 0.05) 正相关, NAG+LAP和MBN呈极显著 (P < 0.01) 正相关, 高温对涉氮酶抑制作用强烈, 严重影响土壤碳氮养分含量。TOC含量和土壤DOC以及MBC呈现出极显著的正相关关系 (P < 0.01), 表明高温处理条件下碳库养分之间转换具有相互作用, 涉碳酶活性和其他养分指标无显著相关性, 表明极端高温处理已经显著影响到涉氮酶的功能。但是高温处理条件下土壤碳库和氮库的养分指标之间仍有显著相关性, 表明此条件下碳库和氮库养分转换仍相互影响。
|
由于气候变暖和降雨模式的变化导致的土壤水分变化使得土壤生态环境存在着更大的不确定性[18]。在本研究中, 结合高温情况下土壤水分的变化, 研究发现植茶年限、极端气候条件 (高温和降雨)、处理时间以及三者之间的交互作用直接影响土壤中碳库和氮库养分含量, 同时对碳氮养分形态转化的关键酶活性有显著影响。
3.1 极端高温处理对不同茶龄土壤碳库氮库影响高温处理初期土壤总有机碳 (TOC) 含量降低, 这是由于升温会加快土壤中有机碳的利用尤其是在没有植物生长的土壤环境中[19-20], 但是增加土壤中可溶性有机碳 (DOC) 的含量, 这表明高温条件下, 土壤中DOC的矿化速率比TOC转化成DOC的速率小, 从而造成土壤中DOC的积累, 因为研究表明温度高于35 ℃时会降低土壤呼吸速率[21-22]。高温处理中, Y50土壤总有机碳 (TOC) 含量降低, 而Y0、Y10和Y30土壤总有机碳 (TOC) 含量呈现先降低后升高的趋势。可能是Y50土壤中大团聚体较多[23], 大团聚体有机碳不稳定, 是土壤有机碳损失的途径之一, 且大粒径团聚体有机碳活性较强, 更易于损失[24]。
高温处理之后高温组 (35 ℃) 与极端高温组 (40 ℃) 中土壤铵态氮 (NH4+-N) 和硝态氮 (NO3--N) 的含量都显著降低, 这可能是由于土壤中的氨氧化古菌 (氨氧化古菌参与土壤中氮循环过程, 具体功能为:氨氧化古菌在酸性土壤硝化作用中起主导作用) 和细菌以及硝化细菌在短时间内能够积极响应外界温度变化, 加快土壤内部氮养分的转化造成的[25-26]。升温处理一段时间之后, 高温组 (35 ℃) 与极端高温组 (40 ℃) 中土壤NH4+-N和NO3--N含量有小范围的回升。这可能是由于土壤内部生态系统逐渐适应外界环境变化从而调整内部氮养分利用速度造成的。此外, 有研究表明高温会降低土壤根部微生物量碳 (MBC) 和土壤微生物氮 (MBN), 导致微生物基质被耗尽[27], 有研究表明40 ℃高温模拟处理的土壤24 h后土壤中的微生物量碳减少1/3[28], 这与本研究中土壤MBC和MBN含量降低趋势一致; 处理中后期MBC和MBN含量会随着高温处理而升高, 这可能是由于增温和干旱条件导致了土壤中真菌的丰富度增加[29], 况且在35 ℃条件下, 土壤真菌的活力不会降低[30]。
3.2 极端气候条件对不同茶龄土壤胞外酶活性的影响土壤涉碳酶 (BG) 活性以及涉氮酶活性 (NAG+LAP) 与土壤温度有关, 高温不仅改变土壤胞外酶活性, 还可以改变土壤内微生物细胞里面的反应[31]。土壤内部生态活动的养分消耗速率也随着温度升高而增加[32-33], 导致维持细胞功能所需的养分增加。一些模型预测表明微生物需要更多的养分来保持酶的产量从而确保增温导致的系统消耗所需增加的养分供应[34], 这与本次实验中TOC含量显著降低结果一致。40 ℃高温情况下土壤中消耗的有机质含量低于35 ℃试验组, 其中MBC、MBN、NH4+-N和NO3--N含量以及BG和NAG+LAP胞外酶活性更高, 这表明40 ℃的高温已经对土壤生态环境的活性物质起到抑制作用, 开始破坏土壤中稳定的生态环境。综合所有指标, 整个处理过程中, 茶龄为Y30的土壤相对于其他茶龄土壤在高温处理条件下更适合作物生长。
高温和干旱会对土壤产生遗留效应 (由胁迫产生的效应, 但并不随着胁迫的消失而消失的效应称为遗留效应), 近期一个长达10年干旱和灌溉条件下关于土壤生态过程以及酶活性变化的田间试验, 研究表明在灌溉初期能够看到干旱的遗留效应, 但是随着时间的增长, 遗留效应逐渐消失[35]。在土壤从高温干旱变湿润后, 土壤中的生物活性会在几小时[36-37]甚至是几分钟[38]之内增加, 这个过程会驱动土壤重新调整土壤中有机质以及难降解物质的矿化[39-40]。土壤在湿润过程促进土壤中的碳氮养分被生物利用[40], 也就解释了本试验中模拟降雨之后碳库和氮库养分降低, 微生物量碳升高的试验结果。土壤酶活性的恢复强度不大, 35~40 ℃高温对土壤胞外酶的活性造成的影响不可短时间恢复, 因此, 这个情况下微生物碳氮的再次恢复对土壤中碳氮库的重建有至关重要的作用。
4 结论在本实验中茶园土壤养分比荒地养分含量高, 随着茶龄的增长, 碳库养分含量、硝态氮及涉碳涉氮胞外酶活性呈现先升高后降低的趋势; 铵态氮养分随着茶龄的增长呈现递增趋势。高温处理对土壤碳、氮库养分和涉碳、涉氮胞外酶活性有显著影响。35 ℃高温处理降低土壤有机碳、铵态氮、硝态氮含量, 降低土壤微生物含量、土壤涉碳胞外酶活性但是会增加涉氮胞外酶活性。40 ℃高温对土壤生态系统中碳氮养分的影响更大。模拟降雨之后, 只有微生物碳以及胞外酶活性有恢复, 但是对其他养分指标没有显著影响。因此极端降雨处理有利于土壤微生态环境中的生物活性恢复, 有利于碳氮养分平衡的重建, 但是短期内并不能恢复土壤碳氮养分的有效性。整个处理过程中, 茶龄为Y30的土壤表现出更高的碳氮养分含量以及酶活性, 对极端高温及降雨的环境变异表现出更强的抵抗力, 土壤质量优于其他茶龄土壤。针对茶龄长、土壤酸度低的土壤需要改变管理模式, 例如配施有机肥、生物菌肥等方式来改善土壤质量。
| [1] | Fleischer S. Interaction between N and C in soil has consequences for global carbon cycling[J]. Journal of Resources and Ecology, 2012, 3(1): 16–19. DOI:10.5814/j.issn.1674-764x.2012.01.003 |
| [2] | Tian Y, Cao F, Wang G. Soil microbiological properties and enzyme activity in Ginkgo-tea agroforestry compared with monoculture[J]. Agroforestry Systems, 2013, 87(5): 1201–1210. DOI:10.1007/s10457-013-9630-0 |
| [3] | Xue D, Yao H, Huang C. Microbial biomass, N mineralization and nitrification, enzyme activities and microbial community diversity in tea orchard soils[J]. Plant and Soil, 2006, 288(1/2): 319–331. |
| [4] | Yao H, Liu Y, Xue D. Influence of tea cultivation on soil microbial biomass and substrate utilization pattern[J]. Communications in Soil Science and Plant Analysis, 2006, 37(5/6): 641–651. |
| [5] | 韩文炎, 王皖蒙, 郭赟, 等. 茶园土壤细菌丰度及其影响因子研究[J]. 茶叶科学, 2013, 33(2): 147–154. HAN Wen-yan, WANG Wan-meng, GUO Yun, et al. Bacterial abundance of tea garden soils and its influencing factors[J]. Journal of Tea Science, 2013, 33(2): 147–154. |
| [6] | Trasar-Cepeda C, Gil-sotres F, Leiros M C, et al. Thermodynamic parameters of enzymes in grassland soils from Galicia, NW Spain[J]. Soil Biology & Biochemistry, 2007, 39(1): 311–319. |
| [7] | Sowerby A, Emmett B, Beier C, et al. Microbial community changes in heathland soil communities along a geographical gradient:Interaction with climate change manipulations[J]. Soil Biology & Biochemistry, 2005, 37(10): 1805–1813. |
| [8] | Bardgett R D, Freenan C, Ostle N J. Microbial contribution to climate change through carbon cycle feedbacks[J]. Isme Journal, 2008, 2(8): 805–814. DOI:10.1038/ismej.2008.58 |
| [9] | 付小青, 陈佩, 秦志敏, 等. 遮阴处理对丘陵茶园生态环境及茶树气体交换的影响[J]. 中国农学通报, 2011, 27(8): 40–46. FU Xiao-qing, CHEN Pei, QIN Zhi-min, et al. Effects of shading on Eco-environment and leaf gas exchange of tea in hilly tea plantation[J]. Chinese Agricultural Science Bulletin, 2011, 27(8): 40–46. |
| [10] | 柯娴氡, 张璐, 苏志尧. 粤北亚热带山地森林土壤有机碳沿海拔梯度的变化[J]. 生态与农村环境学报, 2012, 28(2): 151–156. KE Xian-dong, ZHANG Lu, SU Zhi-yao. Variation of soil organic carbon content along altitudinal gradient in subtropical montane forest in North Guangdong[J]. Journal of Ecology and Rural Environment, 2012, 28(2): 151–156. |
| [11] | 吕国红, 王笑影, 张玉书, 等. 农田土壤碳氮及其与气象因子的关系[J]. 农业环境科学学报, 2010, 29(8): 1612–1617. LÜ Guo-hong, WANG Xiao-ying, ZHANG Yu-shu, et al. Soil carbon, nitrogen of the farmland and their relationships with climatic factors[J]. Journal of Agro-Environment Science, 2010, 29(8): 1612–1617. |
| [12] | 张春华, 王宗明, 任春颖, 等. 松嫩平原玉米带土壤碳氮储量的空间特征[J]. 应用生态学报, 2010, 2(3): 631–639. ZHANG Chun-hua, WANG Zong-ming, REN Chun-ying, et al. Spatial characteristics of soil organic carbon and nitrogen storages in Songnen Plain maize belt[J]. Chinese Journal of Applied Ecology, 2010, 2(3): 631–639. |
| [13] | 王维奇, 徐玲琳, 曾从盛, 等. 河口湿地植物活体-枯落物-土壤的碳氮磷生态化学计量特征[J]. 生态学报, 2011, 31(23): 7119–7124. WANG Wei-qi, XU Ling-lin, ZENG Cong-sheng, et al. Carbon, nitrogen and phosphorus ecological stoichiometric ratios among live plant-litter-soil systems in estuarine wetland[J]. Acta Ecologica Sinica, 2011, 31(23): 7119–7124. |
| [14] | 方精云, 杨元合, 马文红, 等. 中国草地生态系统碳库及其变化[J]. 中国科学:生命科学版, 2010, 40(7): 566–576. FANG Jing-yun, YANG Yuan-he, MA Wen-hong, et al. Ecosystem carbon stocks and their changes in China's grasslands[J]. Science China Life Sciences, 2010, 40(7): 566–576. |
| [15] | Ross D J. Influence of sieve mesh size on estimates of microbial carbon and nitrogen by fumigation-extraction procedures in soils under pasture[J]. Soil Biology & Biochemistry, 1992, 24(4): 343–350. |
| [16] | Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology & Biochemistry, 1987, 19(6): 703–707. |
| [17] | DeForest J L. The influence of time, storage temperature, and substrate age on potential soil enzyme activity in acidic forest soils using MUB-linked substrates and L-DOPA[J]. Soil Biology & Biochemistry, 2009, 41(6): 1180–1186. |
| [18] | Falloon P, betts R. Climate impacts on European agriculture and water management in the context of adaptation and mitigation-the importance of an integrated approach[J]. Science of the Total Environment, 2010, 408(23): 5667–5687. DOI:10.1016/j.scitotenv.2009.05.002 |
| [19] | Bradford M A, Davies C A, Frey S D, et al. Thermal adaptation of soil microbial respiration to elevated temperature[J]. Ecology Letters, 2008, 11(12): 1316–1327. DOI:10.1111/ele.2008.11.issue-12 |
| [20] | Bradford M A, Watts B W, Davies C A. Thermal adaptation of heterotrophic soil respiration in laboratory microcosms[J]. Global Change Biology, 2010, 16(5): 1576–1588. DOI:10.1111/gcb.2010.16.issue-5 |
| [21] | Allison S D, Treseder K K. Warming and drying suppress microbial activity and carbon cycling in boreal forest soils[J]. Global Change Biology, 2008, 14(12): 2898–2909. DOI:10.1111/gcb.2008.14.issue-12 |
| [22] | 范利超, 杨明臻, 韩文炎. 温湿度和外源有机质对茶园土壤基础呼吸作用的影响[J]. 土壤通报, 2014, 45(6): 1383–1389. FAN Li-chao, YANG Ming-zhen, HAN Wen-yan. Effects of temperature, soil moisture contents and exogenous organic matter on basic respiration in tea garden soils[J]. Chinese Journal of Soil Science, 2014, 45(6): 1383–1389. |
| [23] | 郑子成, 刘敏英, 李廷轩. 不同植茶年限土壤团聚体有机碳的分布特征[J]. 中国农业科学, 2013, 46(9): 1827–1836. ZHENG Zi-cheng, LIU Min-ying, LI Ting-xuan. Distribution characteristics of organic carbon fractions in soil aggregates under tea plantation of different ages[J]. Scientia Agricultura Sinica, 2013, 46(9): 1827–1836. |
| [24] | 王清奎, 汪思龙. 土壤团聚体形成与稳定机制及影响因素[J]. 土壤通报, 2005, 36(3): 415–421. WANG Qing-kui, WANG Si-long. Forming and stable mechanism of soil aggregate and influencing factors[J]. Chinese Journal of Soil Science, 2005, 36(3): 415–421. |
| [25] | Avrahami S, Conrad R. Patterns of community change among ammonia oxidizers in meadow soils upon long-term incubation at different temperatures[J]. Applied and Environmental Microbiology, 2003, 69(10): 6152–6164. DOI:10.1128/AEM.69.10.6152-6164.2003 |
| [26] | Szukics U, Abell G C J, Hoedl V, et al. Nitrifiers and denitrifiers respond rapidly to changed moisture and increasing temperature in a pristine forest soil[J]. Fems Microbiology Ecology, 2010, 72(3): 395–406. DOI:10.1111/fem.2010.72.issue-3 |
| [27] | Eliasson P E, Mcmurtrie R E, Pepper D A, et al. The response of heterotrophic CO2 flux to soil warming[J]. Global Chang Biology, 2005, 11(1): 167–181. DOI:10.1111/gcb.2005.11.issue-1 |
| [28] | Bottner P. Response of microbial biomass to alternate moist and day conditions in a soil incubated with C-14-Labeled and N-15-Labeled plant-material[J]. Soil Biology & Biochemistry, 1985, 17(3): 329–337. |
| [29] | Castro H F, Classen A T, Austin E E, et al. Soil microbial community responses to multiple experimental climate change drivers[J]. Applied and Environmental Microbiology, 2010, 76(4): 999–1007. DOI:10.1128/AEM.02874-09 |
| [30] | Barcenas-Moreno G, Gomez-Brandon M, Rousk J, et al. Adaptation of soil microbial communities to temperature:Comparison of fungi and bacteria in a laboratory experiment[J]. Global Change Biology, 2009, 15(12): 2950–2957. DOI:10.1111/j.1365-2486.2009.01882.x |
| [31] | Steinweg J M, Dukes J S, Paul E A, et al. Microbial responses to multi-factor climate change:Effects on soil enzymes[J]. Frontiers in Microbiology, 2013, 4: 146–146. |
| [32] | Joergensen R G, Brookes P C, Jenkinson D S. Survival of the soil microbial biomass at elevated temperatures[J]. Soil Biology & Biochemistry, 1990, 22(8): 1129–1136. |
| [33] | Alvarez R, Santanatoglia O J, Garc I A R. Effect of temperature on soil microbial biomass and its metabolic quotient in situ under different tillage systems[J]. Biology and Fertility of Soils, 1995, 19(2/3): 227–230. |
| [34] | Wang G, Post W M. A theoretical reassessment of microbial maintenance and implications for microbial ecology modeling[J]. Fems Microbiology Ecology, 2012, 81(3): 610–617. DOI:10.1111/j.1574-6941.2012.01389.x |
| [35] | Evans S E, Wallenstein M D. Soil microbial community response to drying and rewetting stress:Does historical precipitation regime matter[J]. Biogeochemistry, 2012, 109(1): 1–16. |
| [36] | Pulleman M, Tietema A. Microbial C and N transformations during drying and rewetting of coniferous forest floor material[J]. Soil Biology & Biochemistry, 1999, 31(2): 275–285. |
| [37] | Priem E A, Christensen S O R. Natural perturbations, drying-wetting and freezing-thawing soil[J]. Soil Biology & Biochemistry, 2001, 33(15): 2083–2091. |
| [38] | Lee X, Wu H, Sigler J, et al. Rapid and transient response of soil respiration to rain[J]. Global Change Biology, 2004, 10(6): 1017–1026. DOI:10.1111/gcb.2004.10.issue-6 |
| [39] | Vangestel M, Ladd J N, Amato M. Carbon and nitrogen mineralization from soils of contrasting texture and microaggregate stability influence of sequential fumigation, drying and storage[J]. Soil Biology & Biochemistry, 1991, 23(4): 313–322. |
| [40] | Appel T. Non-biomass soil organic N the substrate for N mineralization flushes following soil drying-rewetting and for organic N rendered CaCl2-extractable upon soil drying[J]. Soil Biology & Biochemistry, 1998, 30(10/11): 1445–1456. |
 2017, Vol. 36
2017, Vol. 36