文章信息
- 阎晓静, 王金花, 朱鲁生, 王军, 张风兆
- YAN Xiao-jing, WANG Jin-hua, ZHU Lu-sheng, WANG Jun, ZHANG Feng-zhao
- 卡马西平对小球藻生长的影响和氧化损伤
- Effects of carbamazepine on the growth and the oxidative damage of Chlorella
- 农业环境科学学报, 2017, 36(4): 643-650
- Journal of Agro-Environment Science, 2017, 36(4): 643-650
- http://dx.doi.org/10.11654/jaes.2016-1259
文章历史
- 收稿日期: 2016-09-30
21世纪以来, 随着环境分析技术的进步和人们环保意识的增强, 一大类新型环境污染物——药品及个人护理用品 (Pharmaceutical and personal care products, PPCPs) 开始受到人们的广泛关注。大多数PPCPs在环境中具有浓度低、结构复杂、难降解、累积性等特点[1]。长期的PPCPs污染可能对水生生物产生内分泌干扰效应或繁殖毒性[2], 诱发水生栖息物发生物化或生化功能的改变, 对生态环境及生物健康产生较大的危害。环境中很多PPCPs被检出, 质量浓度水平基本处于ng·L-1至μg·L-1范围, 虽然在环境中浓度水平较低, 但对环境的风险不容忽视[3]。Zhou等[4]研究表明, 长江和珠江水体中PPCPs具有较高的环境风险, 如双氯芬酸和布洛芬。虽然地表水中的抗生素浓度远小于医疗剂量, 却能够在人体中诱导细菌耐药性, 并破坏生态系统[5]。
卡马西平 (Carbamazepine, CBZ) 是PPCPs中的一类典型化合物。CBZ主要用于治疗癫痫、心律失常和抑郁等疾病, 用量较大[6]。CBZ排入环境的方式多样, 并可在环境中残留, 导致水体中的CBZ持续性存在, 对生态系统产生不良影响[7]。Malarvizhi等[8]报道了CBZ对鲤鱼的鳃、肝脏和肌肉的谷氨酸-草酰乙酸转氨酶 (GOT)、谷丙转氨酶 (GPT) 和乳酸脱氢酶 (LDH) 活性的影响。结果显示, 在所有器官中, CBZ对鲤鱼的GOT均呈抑制作用, 24 h LC50是59.70 mg·L-1, 而GPT和LDH活性在肝脏和肌肉中呈促进作用, 在鳃中呈抑制作用。Aguirre-Martínez等[9]也报道了CBZ对普通青蟹的稳定溶酶体膜、二苄基荧光脱烃酶、谷胱甘肽S-转移酶、谷胱甘肽过氧化物酶、脂质过氧化和DNA加合物有显著影响。CBZ还能引起斑马鱼胚胎心率降低, 其引起胚胎心率下降的24 h EC50约为626.07 mmol·L-1, 并呈现量效依赖性[10]。因此, CBZ对水生生物的毒性效应不容忽视。
藻类是水体中最主要的初级生产者, 对生态系统的平衡和稳定起到重要的作用[11]。藻类具有敏感性高、易获得、繁殖快等特点, 因而作为一种很好的测试生物被广泛应用于污染物的毒性研究中[12-13]。本实验选取的普通小球藻 (Chlorella) 即为藻类中最具代表性的一种。光合色素是植物进行光合作用的物质基础, 可以用于判断植物光合生理能力、反映环境胁迫状况, 其含量变化能较好地反映植物各阶段的生长发育是否正常[14]。生物体内的抗氧化酶系, 如超氧化物歧化酶 (SOD)、过氧化氢酶 (CAT) 和抗坏血酸、类胡萝卜素等, 在受到污染物刺激时, 其酶活性的变化可以间接反映机体受氧化胁迫的程度, 因此酶活性作为一类重要指标受到国内外学者的关注。另外, 丙二醛 (MDA) 是细胞脂质过氧化的终产物, 机体内MDA含量的多少通常可以反映出其体内脂质过氧化反应的程度, 因此对MDA含量进行测定可以较准确的反映出细胞的受损程度[15]。Yang等[16]在2-甲基乙酰乙酸乙酯 (EMA) 对三角褐指藻的毒性效应研究中发现, EMA使得三角褐指藻的活性氧自由基和MDA含量均有增加, 且三角褐指藻SOD活性随EMA浓度的增加而升高。
本实验拟研究CBZ对小球藻生长量、半最大效应浓度 (EC50)、叶绿素a和b含量、抗氧化酶系 (SOD、CAT) 活性和MDA含量的影响, 以揭示CBZ对水生生物的生态毒理效应, 为其安全使用提供理论依据。
1 材料与方法 1.1 实验材料普通小球藻购置于中国科学院武汉水生生物研究所淡水藻种库, 并经室内扩大培养用于实验。
储备液制备:将0.5 g CBZ用甲醇溶解, 配制成浓度为10000 mg·L-1的母液, 于4 ℃储存备用。
1.2 实验方法 1.2.1 藻种的培养将小球藻在无菌条件下转移至BG-11培养液中, 于光照培养箱中 (光照强度为3000 lx, 光暗比为12 h:12 h, 培养温度为25 ℃) 培养, 每天定时摇晃5~6次防止藻种老化沉淀, 以5~6 d一次的频率接种。定期镜检, 在形状上观察藻种是否单一、有无其他杂菌 (是否发生聚集现象)。预培养3代, 镜检细胞正常, 进入对数生长期时进行实验。
1.2.2 小球藻的生长抑制实验用直线内插法初步计算CBZ抑制淡水绿藻的96 h EC50范围, 以初步确定值为基准, 各向两边以等差数列形式延伸, 最终确定CBZ的浓度为:0、40、70、100、130、160 mg·L-1。在初始藻密度约为6.0×105个·mL-1时开始, 采用血球计数板计数法每24 h测定藻细胞数量, 每组设3个平行样, 连续培养96 h。最后, 根据《化学品藻类生长抑制试验》[17]中的概率单位-浓度对数法, 计算CBZ对小球藻的96 h EC50。实验采用的是16×25 (大格) 的计数板, 细胞数计算公式为:
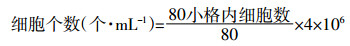
将染毒时间为96 h的小球藻藻液移取20 mL到具塞离心管 (50 mL) 中, 10 000 r·min-1、4 ℃离心10 min, 弃上清液得到藻体, 加丙酮研磨, 暗处提取1 h, 离心 (4 ℃、13000 r·min-1、10 min) 得到澄清液。采用分光光度法, 以90%丙酮为参比, 用U-2900分光光度计扫描范围为400~750 nm的光谱, 叶绿素a、b的浓度值 (mg·L-1) 使用在663、645、630 nm处测得的吸光度 (OD值) 来计算, 用750 nm处的OD值来校正浑浊度, 将每个色素的OD值减去750 nm下的浊度校正值后, 代入下列公式[18]计算浓度:
叶绿素a含量=11.64 (OD663)-2.16 (OD645)+0.10 (OD630)
叶绿素b含量=20.97 (OD645)-3.94 (OD663)-3.66 (OD630)
1.2.4 酶活性测定取一定量 (约20 mL) 的藻液, 9000 r·min-1、4 ℃离心20 min, 弃上清液, 准确称量藻体质量, 按照组织质量 (g):提取液体积 (mL) 为1:(5~10) 的比例, 加入相应的提取液, 冰浴匀浆。8500 r·min-1、4 ℃离心10 min, 上清液为粗酶液。
测定方法采用苏州科铭生物技术有限公司SOD、CAT含量试剂盒法中的分光光度法, 其中SOD、CAT分别在分光光度计波长为560、240 nm处进行测量。
(1) SOD活性计算:
抑制百分率=(A对照管-A测定管)÷A对照管×100%
SOD活性 (U·g-1鲜重)=[抑制百分率÷(1-抑制百分率)×V反总]÷(W×V样÷V样总)×样本稀释倍数=11.4×抑制百分率÷(1-抑制百分率)÷W×样本稀释倍数
式中:A对照管、A测定管分别为对照管、测定管的吸光度; V反总为反应体系总体积, 1.026 mL; V样为加入反应体系中样本体积, 0.09 mL; V样总为加入提取液体积, 1 mL; W为样本质量, g。
(2) CAT活性计算:
CAT (U·g-1鲜重)=[ΔA×V反总÷(ε×d)×109]÷(W×V样÷V样总)÷T=678×ΔA÷W
式中:ΔA为240 nm下的初始吸光度与1 min后的吸光度的差值; V反总为反应体系总体积, 1.035×10-3 L; ε为H2O2摩尔消光系数, 4.36×104 L·mol-1·cm-1; d为比色皿光径, 1 cm; V样为加入样本体积, 0.035 mL; V样总为加入提取液体积, 1 mL; T为反应时间, 1 min; W为样本质量, g。
1.2.5 MDA含量测定利用1.2.4节中提取的粗酶液, 采用试剂盒法测定。MDA含量按下式计算:
MDA含量 (nmol·g-1鲜重)=[ΔA×V反总÷(ε×d)×109]÷(W×V样÷V样总)=25.8×ΔA÷W
式中:ΔA为532 nm与600 nm下吸光度的差值; V反总为反应体系总体积, 8×10-4 L; ε为丙二醛摩尔消光系数, 155×103 L·mol-1·cm-1; d为比色皿光径, 1 cm; V样为加入样本体积, 0.2 mL; V样总为加入提取液体积, 1 mL; W为样本质量, g。
1.3 数据处理实验结果运用Excel 2010计算数据平均值和标准偏差, 采用SPSS 16.0软件进行单因素方差分析 (One-way ANOVA) 中的LSD检验和Canoco冗余分析对实验数据进行统计分析。
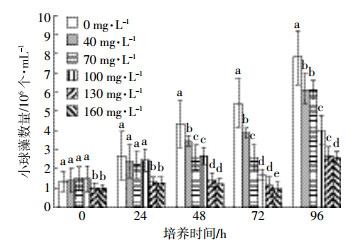
2 结果与分析 2.1 CBZ对小球藻数量的影响由图 1可知, 在实验开始时, 藻液中小球藻各个浓度处理组的数量基本一致, 随着时间的延长, 对照组数量与时间呈线性关系。第96 h的对照组和处理组小球藻数量相比前四个时间段均有显著增加, 其中在40 mg·L-1和70 mg·L-1的暴露浓度下, 小球藻细胞数量均约为6.2×106个·mL-1, 更高 (130、160 mg·L-1) 的暴露浓度下, 小球藻细胞数量分别为2.7×106、2.6×106个·mL-1。通过计算得出CBZ对小球藻的96 h EC50=154.42 mg·L-1, 根据水和废水检测分析方法[19]中藻类生长抑制实验对毒物的毒性分级标准可知, CBZ对小球藻属于低毒物质。
|
| 图 1 CBZ对小球藻数量的影响 Figure 1 Effects of CBZ on the numbers of Chlorella 图中不同小写字母表示各处理间差异显著(P < 0.05)。下同 |
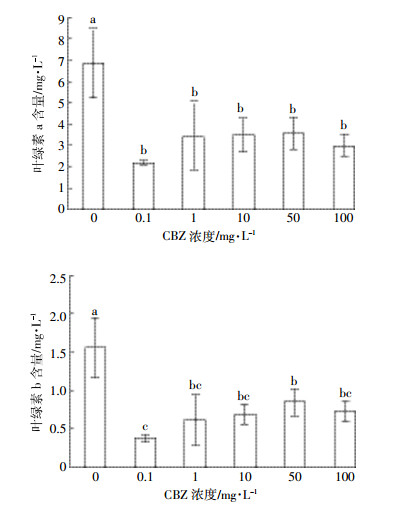
由图 2可知, 经各浓度CBZ处理后的小球藻, 叶绿素a和叶绿素b含量都明显低于对照组。随着处理组染毒浓度的升高, 叶绿素a和叶绿素b的含量均出现先减少后增加的趋势。由此可见, 低浓度 (0.1 mg·L-1) 的CBZ明显降低了小球藻叶绿素a和叶绿素b的含量, 其中叶绿素a、叶绿素b含量分别为2.16、0.38 mg·L-1。随着染毒浓度的升高, 叶绿素降低的趋势逐渐减缓。
|
| 图 2 CBZ对小球藻叶绿素含量的影响 Figure 2 Effects of CBZ on the chlorophyll content of Chlorella |
图 3为染毒第7 d时CBZ对小球藻SOD活性的影响。低浓度处理组 (0.1 mg·L-1) 相对于对照组而言, 对小球藻SOD的活性起到了促进作用, 而中高浓度处理组 (1、10、50、100 mg·L-1) 随着浓度的增加, 对SOD活性起到了相对明显的抑制作用, 其活性逐渐减弱。最终高浓度处理组 (50、100 mg·L-1) SOD活性稳定在8.68~14.21 U·g-1范围内。
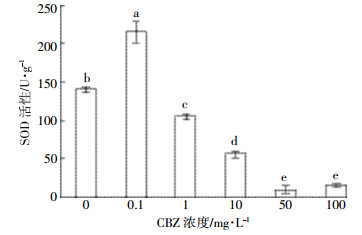
|
| 图 3 CBZ对小球藻SOD活性的影响 Figure 3 Effect of CBZ on the SOD activity of Chlorella |
图 4为染毒第7 d时CBZ对小球藻CAT活性的影响。低中浓度处理组 (0.1、1、10 mg·L-1) 表现出与对照组的显著性差异 (P < 0.05), 而高浓度处理组 (50、100 mg·L-1) 与对照组并无显著性差异。因此, 在CBZ的影响下, 中低浓度处理组的CAT活性受到激活, 并且活性随浓度升高而降低; 而高浓度的处理组活性基本不变, 大致为4.52 U·g-1。
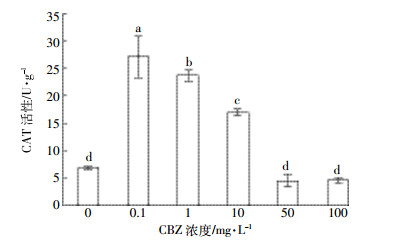
|
| 图 4 CBZ对小球藻CAT活性的影响 Figure 4 Effect of CBZ on the CAT activity of Chlorella |
图 5为染毒第7 d时CBZ对小球藻MDA活性的影响。各浓度CBZ的处理组MDA含量均略高于对照组, 处理组之间MDA含量变化不明显, 其含量在2.06~2.32 nmol·g-1之间。因此, CBZ在短时间内对小球藻的MDA含量并无明显的影响。

|
| 图 5 CBZ对小球藻MDA含量的影响 Figure 5 Effect of CBZ on the MDA content of Chlorella |
图 6为CBZ对小球藻影响的冗余分析图。CBZ浓度的变化对图中五项指标的影响程度较大, CBZ浓度与小球藻叶绿素a含量、叶绿素b含量、SOD活性、CAT活性呈负相关, 与MDA含量呈正相关, 其中小球藻CAT、SOD活性和叶绿素a含量受CBZ的影响较大。此外, SOD、CAT活性的相关性较高, 并且在CBZ浓度为0.1 mg·L-1时CAT活性受影响显著; 叶绿素a、叶绿素b含量的相关性次之, 并且在CBZ浓度为1、10 mg·L-1时受影响显著。
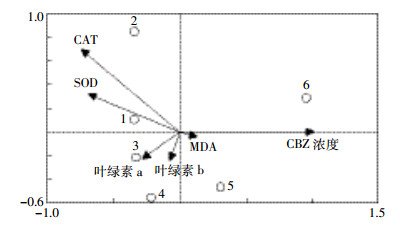
|
| 图 6 CBZ对小球藻影响的冗余分析 Figure 6 RDA for the effects of CBZ on Chlorella 数字1~6分别表示CBZ浓度为0、0.1、1、10、50、100 mg·L-1 The Number 1~6 indicate the concentration of CBZ are 0, 0.1, 1, 10, 50, 100 mg·L-1 |
本实验的目的是通过研究CBZ对小球藻的影响, 探究CBZ对水生生物的生态毒性, 为控制药物残留、保护生态环境提供理论依据。实验测得CBZ对小球藻的96 h EC50为154.42 mg·L-1, 可见有毒性影响, 并且随着CBZ浓度的升高和时间的延长, 小球藻生长受抑制作用加强, 而96 h小球藻数量有显著增加, 说明小球藻对CBZ有逐渐适应的趋势。王丽艳[20]在研究纳米CuO对小球藻的毒性效应中, 测得纳米CuO的96 h EC50为74.61 mg·L-1, 并且对小球藻的毒性存在剂量-效应关系, 与本研究中随CBZ浓度的升高, 小球藻生长受抑制加重的趋势差别较小。由此可见, 高浓度的污染物暴露均可污染水生环境, 影响藻类的生长。本实验同时也研究了小球藻叶绿素含量随CBZ暴露浓度的变化情况, 结果显示处理组叶绿素a和叶绿素b含量均明显低于对照组, 低浓度 (0.1 mg·L-1) CBZ对其含量的降低程度最显著。Zhang等[21]研究CBZ对斜生栅藻和蛋白核小球藻的生态毒理效应, 结果显示, CBZ影响两者叶绿素a的合成, 且小球藻表现出更明显的剂量-效应关系, 即小球藻叶绿素a含量随CBZ浓度的升高而减少, 与本研究结果存在差异。李威等[22]在抗癌物5-氟尿嘧啶对羊角月牙藻的叶绿素含量影响中得到与本研究相似的结果, 即低浓度 (5.15 mg·L-1) 暴露下的5-氟尿嘧啶对羊角月牙藻叶绿素含量表现出抑制作用, 浓度为12.5~32 mg·L-1时叶绿素含量有所提高, 浓度大于32 mg·L-1时其含量呈下降趋势。这种相似的结果可以解释为藻类色素合成的相关酶类在一定污染物胁迫浓度下受到激活, 叶绿素含量相应增加, 而随着胁迫浓度的升高, 由于植物细胞中活性氧受到攻击和叶绿体中捕光Chla/b-Pro复合体的合成受到抑制, 叶绿素含量又逐渐降低, 由此对藻类正常的生化反应造成危害, 并间接影响环境中的碳氧循环。
生物体内具有抗氧化作用的酶类主要包括SOD、CAT、POD等。其中SOD是清除超氧自由基的唯一特效酶, 其含量及活性是整个自由基连锁反应过程的限制性因素之一[23]; CAT是生物体内酶系统中重要的抗氧化酶之一, 可催化H2O2降解为H2O和O2, 从而防止机体氧化损伤[24]。本次实验中的小球藻SOD、CAT活性均在CBZ浓度为0.1 mg·L-1时受到激活, 说明机体内抗氧化酶含量升高, 正积极防御外来氧化的损伤; 而当染毒浓度升高至超过了细胞的抗氧化能力时, 酶结构遭到破坏, 活性呈下降趋势。李楠[25]在双酚A (BPA) 对小球藻和斑马鱼的毒性效应研究中得到与本研究相似的结论, 即低浓度的BPA对小球藻的SOD活性产生激活作用, 随着BPA浓度的升高, SOD活性下降, 说明机体在低浓度BPA的影响下, 产生了保护性的应激反应, 而高浓度BPA暴露超出其修复能力, 导致氧化损伤, 甚至死亡。此外, 吴清莲等[26]在研究Y3+对Pb2+胁迫下铜绿微囊藻生长生理的影响时发现, 低质量浓度的Y3+ (0.10~0.50 mg·L-1) 促进了Pb2+胁迫下铜绿微囊藻的抗氧化酶活性, 高质量浓度Y3+ (1.00~10.00 mg·L-1) 则抑制了铜绿微囊藻的抗氧化酶活性, 同样与本研究结果相似。可见, 实验中各暴露浓度下的污染物均能导致藻类抗氧化酶系的改变, 对藻类产生不同程度的损伤。
MDA是机体膜脂过氧化最重要的产物之一。MDA含量的增加反映机体内自由基的大量积累, 机体受到自由基攻击, 引起膜脂过氧化, 破坏细胞膜系统的完整性[27]。本研究中CBZ处理组的MDA含量均略高于对照组, 说明CBZ引起了机体的膜脂过氧化, 细胞受到损伤。杨兆壬等[28]通过急性毒性实验探究[OMIm]Br离子液体对蛋白核小球藻的致毒作用, 结果显示随着离子液体浓度升高, 小球藻MDA含量增加, 高浓度处理组 (50 mg·L-1和80 mg·L-1) 的MDA含量较对照组均有极显著差异 (n=3, P < 0.01), 说明藻细胞在不利环境中受到氧化损伤。龙瑞等[29]在Mn2+、Cd2+对伊乐藻处理7 d的实验中得出, 单一Mn2+、Cd2+胁迫均不同程度地加快了伊乐藻MDA的产生, 表明生物体可通过自身抗氧化系统的应激性清除过多的活性自由氧, 增强抗逆性以抵抗污染物的胁迫, 与本研究的结果相似。
在正常的藻细胞中, 活性氧自由基 (Reactive oxygen species, ROS) 的产生和清除处于平衡状态, 当ROS产生过多或抗氧化能力减弱时, 会导致细胞内部脂质过氧化, 使MDA含量上升, SOD、CAT活性增高, 以清除细胞内部的活性氧[30]。为了通过少数指标揭示多个变量之间的内部结构, 选择直接梯度排序方法进行分析, 本研究基于对各指标进行去趋势对应分析 (DCA) 的判断, 确定选择线性模型冗余分析。冗余分析是一种直接梯度排序分析方法, 与常规统计分析对各个指标的相关性分析结果一致, 但它以样方为基础, 能通过箭头方向和长度等在排序图上更直观表达出各要素之间的相关性和影响程度, 是一种更加科学的评价方法[31]。本研究分析结果显示, 小球藻的CAT、SOD活性和叶绿素a含量受CBZ的影响较大, 并且CBZ浓度的变化与小球藻叶绿素含量、SOD活性、CAT活性呈负相关, 与MDA含量呈正相关。这表明CBZ可对小球藻抗氧化酶类及叶绿素的合成产生不利影响, 进而造成细胞膜脂过氧化。王蓉等[32]在纳米硫化镉量子点对斜生栅藻的毒性研究中, 通过计算斜生栅藻SOD活性和MDA含量变化的百分比得出, 在硫化镉量子点暴露浓度为1.0 mg·L-1时两指标呈明显负相关关系, 与本研究结果相似。同样, 在[OMIm]Br离子液体对蛋白核小球藻的影响实验中, 分析小球藻各指标随离子液体暴露浓度的变化趋势线可得, 受试物剂量与小球藻叶绿素含量、SOD活性呈负相关, 与MDA含量呈正相关, 即离子液体与小球藻的阻滞程度和坏死程度存在剂量-效应关系[28]。
4 结论(1) CBZ对小球藻的96 h EC50为154.42 mg·L-1, 说明其对小球藻有一定的毒性, 能抑制小球藻的生长, 并且浓度越高, 抑制作用越强; CBZ影响小球藻叶绿素含量, 随CBZ浓度的升高, 叶绿素a、叶绿素b含量表现出先减少后增加的趋势。
(2) 不同浓度的CBZ对小球藻的抗氧化酶活性均有一定程度的影响, 低浓度处理组 (0.1 mg·L-1) 对小球藻SOD的活性具有促进作用, 中高浓度处理组 (1、10、50、100 mg·L-1) 对SOD活性起到了明显的抑制作用, 并随着浓度的增加逐渐增强; 中低浓度处理组 (0.1、1、10 mg·L-1) 的小球藻CAT活性受到激活, 并随浓度升高活性降低, 而高浓度的处理组 (50、100 mg·L-1) 活性与对照组无显著差异 (P < 0.05);处理组小球藻的MDA含量均高于对照组, 细胞均受到膜脂过氧化损伤。
(3) 通过CBZ对小球藻各个指标的相关性分析可得, 小球藻的CAT、SOD活性和叶绿素a含量受CBZ的影响较大。
| [1] | 王樱凝, 崔迪, 庞长泷, 等. 水中PPCPs的污染现状及其控制技术研究进展[J]. 中国给水排水, 2015, 31(24): 25–29. WANG Ying-ning, CUI Di, PANG Chang-long, et al. Pollution status and control technologies of pharmaceuticals and personal care products:Review[J]. China Water & Wastewater, 2015, 31(24): 25–29. |
| [2] | 刘娜, 金小伟, 王业耀, 等. 我国地表水中药物与个人护理品污染现状及其繁殖毒性筛查[J]. 生态毒理学报, 2015, 10(6): 1–12. LIU Na, JIN Xiao-wei, WANG Ye-yao, et al. Pharmaceuticals and personal care products (PPCPs) caused reproductive toxicity in surface water of China:A review[J]. Asian Journal of Ecotoxicology, 2015, 10(6): 1–12. |
| [3] | 刘晓晖, 董文平, 乔光明, 等. 水环境中药品和个人护理品的迁移转化、毒性效应及其风险评估[J]. 科技导报, 2015, 33(16): 56–60. LIU Xiao-hui, DONG Wen-ping, QIAO Guang-ming, et al. Transport-transformation, toxic effect and risk assessment of pharmaceuticals and personal care products in water[J]. Science and Technology Review, 2015, 33(16): 56–60. DOI:10.3981/j.issn.1000-7857.2015.16.008 |
| [4] | Zhou X F, Dai C M, Zhang Y L, et al. A preliminary study on the occurrence and behavior of carbamazepine (CBZ) in aquatic environment of Yangtze River Delta, China[J]. Environmental Monitoring and Assessment, 2011, 173(1): 45–53. |
| [5] | Huang R X, Ding P, Huang D Q, et al. Antibiotic pollution threatens public health in China[J]. The Lancet, 2015, 385(9970): 773–774. |
| [6] | 龚浩, 郭劲松, 方芳, 等. 改性陶粒对水中卡马西平去除的动态吸附实验及模型[J]. 环境工程学报, 2016, 10(7): 3573–3579. GONG Hao, GUO Jin-song, FANG Fang, et al. Experiments and model for dynamic adsorption of carbamazepine onto modified ceramisite in drinking water[J]. Chinese Journal of Environmental Engineering, 2016, 10(7): 3573–3579. DOI:10.12030/j.cjee.201501244 |
| [7] | 高晓亚. BiOX对水中卡马西平的光催化降解及其对人类皮肤角质细胞的生物效应评价[D]. 太原: 太原理工大学, 2015: 1-124. GAO Xiao-ya.Study on BiOX for photocatalytic degradation of carbamazepine and biological aspects on human HaCaT cells[D].Taiyuan:Taiyuan University of Technology, 2015:1-124. |
| [8] | Malarvizhi A, Kavitha C, Saravanan M, et al. Carbamazepine (CBZ) induced enzymatic stress in gill, liver and muscle of a common carp, Cyprinus carpio[J]. Journal of King Saud University-Science, 2012, 24(2): 179–186. DOI:10.1016/j.jksus.2011.01.001 |
| [9] | Aguirre-Martínez G V, Del Valls T A, Martín-Díaz M L. Early responses measured in the brachyuran crab Carcinus maenas exposed to carbamazepine and novobiocin:Application of a 2-tier approach[J]. Ecotoxicology and Environmental Safety, 2013, 97: 47–58. DOI:10.1016/j.ecoenv.2013.07.002 |
| [10] | 王雪, 王希敏, 韩利文, 等. 卡马西平对斑马鱼胚胎心脏功能的影响[J]. 实验动物与比较医学, 2012, 32(6): 517–520. WANG Xue, WANG Xi-min, HAN Li-wen, et al. The effect of carbamazepine on cardiac function of zebrafish embryo[J]. Laboratory Animal and Comparative Medicine, 2012, 32(6): 517–520. |
| [11] | 刘欢, 陈雪晴, 裴元生. 硼化合物对普通小球藻的急性毒性效应[J]. 环境科学研究, 2015, 28(12): 1887–1894. LIU Huan, CHEN Xue-qing, PEI Yuan-sheng. Acute toxic effects of boron compounds on Chlorella vulgaris[J]. Research of Environment Sciences, 2015, 28(12): 1887–1894. |
| [12] | Qian H F, Li J J, Sun L W, et al. Combined effect of copper and cadmium on Chlorella vulgaris, growth and photosynthesis-related gene transcription[J]. Aquatic Toxicology, 2009, 94(1): 56–61. DOI:10.1016/j.aquatox.2009.05.014 |
| [13] | Oukarroum A, Bras S, Perreault F, et al. Inhibitory effects of silver nanoparticles in two green algae, Chlorella vulgaris, and Dunaliella tertiolecta[J]. Ecotoxicology & Environmental Safety, 2012, 78: 80–85. |
| [14] | 张丽. 2, 2', 4, 4'-四溴联苯醚 (BDE-47) 对两种海洋微藻的毒性效应研究[D]. 青岛: 国家海洋局第一海洋研究所, 2015: 1-68. ZHANG Li.The toxic effects of BDE-47 on two species of marine microalgae[D].Qingdao:The First Institute of Oceanography, SOA, 2015:1-68. |
| [15] | Duryee M J, Klassen L W, Schaffert C S, et al. Malondialdehyde-acetaldehyde adduct is the dominant epitope after MDA modification of proteins in atherosclerosis[J]. Free Radical Biology & Medicine, 2010, 49(10): 1480–1486. |
| [16] | Yang C Y, Liu S J, Zhou S W, et al. Allelochemical ethyl 2-methyl acetoacetate (EMA) induces oxidative damage and antioxidant responses in Phaeodactylum tricornutum[J]. Pesticide Biochemistry & Physiology, 2011, 100(1): 93–103. |
| [17] | 国家质量监督检验检疫总局, 国家标准化管理委员会. GB/T 21805-2008化学品藻类生长抑制试验[S]. 北京: 中国标准出版社, 2008. General Administration of Quality Supervision, Inspection and Quarantine of PRC, Standardization Administration of PRC.GB/T 21805-2008 Chemicals alga growth inhibition test[S].Beijing:China Standards Press, 2008. |
| [18] | 国家环境保护总局. 水和废水监测分析方法[M]. 四版增补版. 北京: 中国环境科学出版社, 2006. State Environmental Protection Administration.Water and wastewater monitoring analysis method[M].Fourth Enlarged Edition.Beijing:China Environmental Science Press, 2006. |
| [19] | 国家环境保护总局. 水和废水监测分析方法[M]. 四版. 北京: 中国环境科学出版社, 2002. State Environmental Protection Administration.Water and wastewater monitoring analysis method[M].Fourth Edition.Beijing:China Environmental Science Press, 2002. |
| [20] | 王丽艳. 纳米CuO对小球藻的毒性效应研究[D]. 青岛: 中国海洋大学, 2013: 1-60. WANG Li-yan.Toxic effects of nano-CuO on Chlorella sp.[D].Qingdao:Ocean University of China, 2013:1-60. |
| [21] | Zhang W, Zhang M, Lin K F, et al. Eco-toxicological effect of Carbamazepine on Scenedesmus obliquus, and Chlorella pyrenoidosa[J]. Environmental Toxicology & Pharmacology, 2012, 33(2): 344–352. |
| [22] | 李威, 恽烨, 是怡芸, 等. 5氟尿嘧啶对蛋白核小球藻和羊角月芽藻生长及叶绿素含量的影响[J]. 生态毒理学报, 2015, 10(6): 213–218. LI Wei, YUN Ye, SHI Yi-yun, et al. Effects of 5-fluorouracil on the growth and chlorophyll content of Chlorella pyreuoidosa and Seleuastrum capricoruutum[J]. Asian Journal of Ecotoxicology, 2015, 10(6): 213–218. |
| [23] | Singh S, Eapen S, D'Souza S F. Cadmium accumulation and its influence on lipid peroxidation and antioxidative system in an aquatic plant, Bacopa monnieri L.[J]. Chemosphere, 2006, 62(2): 233–246. DOI:10.1016/j.chemosphere.2005.05.017 |
| [24] | 任海, 李健, 李吉涛, 等. 急性氨氮胁迫对脊尾白虾 (Exopalaemon carinicauda) 抗氧化系统酶活力及GPx基因表达的影响[J]. 农业环境科学学报, 2014, 33(4): 647–655. REN Hai, LI Jian, LI Ji-tao, et al. Effects of acute ammonia stresses on antioxidant enzyme activities and GPx gene expression in Exopalaemon carinicauda[J]. Journal of Agro-Environment Science, 2014, 33(4): 647–655. DOI:10.11654/jaes.2014.04.005 |
| [25] | 李楠. 双酚A (BPA) 对小球藻和斑马鱼的毒性效应研究[D]. 沈阳: 辽宁大学, 2013: 1-55. LI Nan.Research on the toxicity effects of BPA on Chlorella and zebrafish[D].Shenyang:Liaoning University, 2013:1-55. |
| [26] | 吴清莲, 王应军, 杜宇, 等. 钇对铅胁迫下铜绿微囊藻抗氧化能力及藻毒素释放的影响[J]. 农业环境科学学报, 2013, 32(6): 1128–1133. WU Qing-lian, WANG Ying-jun, DU Yu, et al. Effects of yttrium on physiological characteristics and microcystins release of Microcystic aeruginosa with Pb2+ stress[J]. Journal of Agro-Environment Science, 2013, 32(6): 1128–1133. |
| [27] | Aravind P, Prasad M N V. Cadmium-zinc interactions in a hydroponic system using Ceratophyllum demersum L.:Adaptive ecophysiology, biochemistry and molecular toxicology[J]. Brazilian Journal of Plant Physiology, 2005, 17(1): 3–20. |
| [28] | 杨兆壬, 周作明. [OMIm]Br对蛋白核小球藻的致毒效应[J]. 生态学杂志, 2014, 33(6): 1539–1545. YANG Zhao-ren, ZHOU Zuo-ming. Toxic effect of [OMIm]Br on Chlorella pyrenoidosa[J]. Chinese Journal of Ecology, 2014, 33(6): 1539–1545. |
| [29] | 龙瑞, 张明, 张光生, 等. Mn、Cd单一及其复合胁迫对伊乐藻生长及生理生化的影响[J]. 农业环境科学学报, 2014, 33(6): 1112–1117. LONG Rui, ZHANG Ming, ZHANG Guang-sheng, et al. Effects of Mn and Cd and their combination on growth and physiological and biochemical characteristics of Elodea nutttallii[J]. Journal of Agro-Environment Science, 2014, 33(6): 1112–1117. DOI:10.11654/jaes.2014.06.009 |
| [30] | 张化俊, 彭云, 张夙, 等. 溶藻细菌BS01产二异丁氧基苯基对塔玛亚历山大藻生长的影响[J]. 微生物学报, 2015, 55(7): 834–842. ZHANG Hua-jun, PENG Yun, ZHANG Su, et al. Algicidal effect of (2-isobutoxyphenyl) amine on Alexandrium tamarense[J]. Acta Microbiologica Sinica, 2015, 55(7): 834–842. |
| [31] | 于文婧, 孙丹峰, 曲葳. 基于冗余分析的宁夏平罗耕地土壤盐渍化特征研究[J]. 中国农业大学学报, 2015, 20(5): 103–110. YU Wen-Jing, SUN Dan-feng, QU Wei. Study of the characteristics of soil salinization based on redundancy analysis in Pingluo, Ningxia[J]. Journal of China Agricultural University, 2015, 20(5): 103–110. |
| [32] | 王蓉, 林溢琦, 孙相振, 等. 纳米硫化镉量子点对斜生栅藻的毒性研究[J]. 农业环境科学学报, 2013, 32(3): 524–529. WANG Rong, LIN Yi-qi, SUN Xiang-zhen, et al. Effect of quantum dot cadmium sulfide on Scenedesmus obliquus[J]. Journal of Agro-Environment Science, 2013, 32(3): 524–529. |
 2017, Vol. 36
2017, Vol. 36