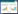文章信息
- 杨惠珍, 刘娜, 卫晓溪, 王兰
- YANG Hui-zhen, LIU Na, WEI Xiao-xi, WANG Lan
- 镉对背角无齿蚌鳃和肝脏氧化损伤的影响
- Oxidative damage of cadmium on liver and gill of freshwater mussel Anodonta woodiana woodiana
- 农业环境科学学报, 2017, 36(4): 651-656
- Journal of Agro-Environment Science, 2017, 36(4): 651-656
- http://dx.doi.org/10.11654/jaes.2016-1291
文章历史
- 收稿日期: 2016-10-10
背角无齿蚌 (Anodonta woodiana woodiana) 栖息于淡水底泥中, 行动缓慢, 长期接受水体污染物的暴露, 能较为准确地反映栖息地底泥与淡水的污染状况, 是一种理想的环境污染指示生物[1-3]。科学界将背角无齿蚌作为环境指示生物的研究主要集中于有机化合物对其生理生化等的毒性影响, 如:Alves[4]发现除草剂-2, 4-二氯苯氧乙酸可以在无齿蚌中蓄积, 且可以影响其生长与发育; Xia等[5]研究了农药-氟虫腈异构体在背角无齿蚌体内的代谢毒性 (蓄积、转化和清除); Qu等[6]探讨了2, 4-二氯苯酚和五氯苯酚对背角无齿蚌含硒谷胱甘肽过氧化物酶的影响。但是, 对重金属镉致使背角无齿蚌相关组织的损伤研究则相对甚少。
镉 (Cd2+) 是一种银白色有光泽的重金属, 其在锌-镉电池等工业生产中被广泛利用, 产生的镉废弃物对生态环境造成的污染日趋严重[7], 且主要以水体镉污染形式存在。研究表明, 镉可通过食物链在人体中富集, 进而打破机体组织器官活性氧 (Reactive oxygen species, ROS) 的平衡, 引起细胞抗氧化系统受损, 导致组织器官病变, 从而引起慢性或长期不可逆的病理效应[8-9], ROS的过量产生是镉引起细胞氧化损伤、导致生物体肝脏病变[10-11]、产生毒性作用的主要原因之一。生物体中的ROS主要包括过氧化氢 (Hydrogen peroxide, H2O2)、超氧阴离子 (Superoxide anion, O2-·) 和羟自由基 (Hydroxyl radical, ·OH) 等物质[12-13]。那么, 镉对背角无齿蚌ROS系统是否会产生影响? ROS系统的变化对背角无齿蚌抗氧化系统将产生怎样的影响?本文通过设置不同浓度Cd2+溶液, 对背角无齿蚌分别处理24、48、72、96 h, 测定背角无齿蚌鳃和肝脏中ROS的含量, 同时对鳃和肝脏总抗氧化能力 (Total Antioxidant Capacity, T-AOC) 进行测定, 探讨Cd2+对背角无齿蚌鳃和肝脏的氧化损伤, 旨在为水体Cd2+污染寻找灵敏的生物学监测指标, 并为Cd2+污染对水生动物的组织病理影响提供数据支撑与理论依据。
1 材料与方法 1.1 实验材料 1.1.1 动物背角无齿蚌也称河蚌, 于2013年4月购自太原市五龙口水产批发市场, 置水族缸 (45 cm×35 cm×30 cm) 中暂养两周。养殖条件:自来水曝气48 h, 室温15 ℃, pH 6.8, 溶氧6 mg·L-1以上。
1.1.2 试剂氯化镉 (CdCl2·2.5H2O)、氯化钠 (NaCl) 均为分析纯; H2O2含量、抗O2-·能力、抑制·OH能力、T-AOC及总蛋白 (TP) 测定试剂盒 (带标准:考马斯亮蓝法), 均购自南京建成生物公司。
1.2 实验方法 1.2.1 实验设计根据Cd2+对河蚌96 h LC50:134.9 mg·L-1的急性毒性实验, 设计了5个Cd2+浓度处理组4.22、8.43、16.86、33.72、67.45 mg·L-1和1个空白对照组, 每个浓度设3个平行组。分别处理24、48、72、96 h。将108只大小相近、体重相当的活体河蚌 (平均质量49.5 g, 平均体长7.46 cm, 平均体高3.2 cm) 分别置于18个处理缸中 (50 cm×30 cm×20 cm), 每缸6只。对照组加4 L曝气48 h的自来水, 处理组加4 L不同浓度Cd2+溶液, 室温15 ℃, pH 6.8, 溶氧6 mg·L-1以上。实验期间不喂食、不换水, 实验过程中未出现河蚌死亡现象。
1.2.2 样品制备在染毒24、48、72 h和96 h后, 用双蒸水洗净河蚌表面残留的Cd2+溶液, 分别剖取约0.1 g的鳃和肝脏组织, 迅速置于液氮中, 于-80 ℃超低温冰箱储存备用。
按照质量 (g):体积 (mL)=1:9的比例, 加入9倍体积的生理盐水, 冰水浴条件下机械匀浆, 10000 r·min-1离心10 min, 取上清10%匀浆待测。
1.2.3 生化指标及其测定方法H2O2含量、抑制·OH能力、抗O2-·能力和T-AOC的测定均依据试剂盒的说明操作。
1.2.4 蛋白含量测定采用Bradford方法, 用考马斯亮蓝蛋白检测试剂盒测定, 标准蛋白以试剂盒提供的蛋白为参照。
1.3 数据处理实验结果利用SPSS (中文17.0) 软件分析处理, 用平均值±标准误 (mean±S.E.) 表示, 用偏度系数和峰度系数检验数据的正态分布性, 对符合正太分布的数据进行单因素方差分析 (One-Way ANOVA), 应用Dunnett法进行对照组与处理组的比较, 以P < 0.05和P < 0.01作为差异显著和极显著的界值。
2 结果与分析 2.1 Cd2+对背角无齿蚌鳃H2O2含量、抑制·OH能力和抗O2-·能力的影响观察图 1 (a)得知:在同一时间, 与对照相比, 背角无齿蚌鳃中H2O2含量呈极显著升高 (P < 0.01)。在24、48、72 h, 不同浓度Cd2+处理组相比, 随着Cd2+浓度的增加, H2O2含量呈先升后降趋势。在96 h, 16.86 mg·L-1处理组, H2O2含量达到最大值 (22.68±2.87 mmol·g-1prot), 是对照组的3倍。在4.22 mg·L-1 Cd2+处理组, 随着时间的延长, H2O2含量逐渐增加; 在8.43 mg·L-1 Cd2+处理组, 随着时间的延长, H2O2含量逐渐降低; 在较高浓度Cd2+处理组 (16.86、33.72、67.45 mg·L-1), 随着时间的延长, H2O2含量呈倒U型趋势, 在96 h, H2O2含量逐渐恢复到对照组水平。
|
| 图 1 Cd2+对背角无齿蚌鳃H2O2含量、抑制·OH能力和抗O2-·能力的影响 Figure 1 Effects of Cd2+ on H2O2 contents, capacity of resisting hydroxyl radical and superoxide anion in gill of Anodonta woodiana woodiana (*P < 0.05, **P < 0.01, Mean依S.D., n=3, 下同) |
由图 1 (b)得出, 在24、72、96 h, 与对照组相比, 鳃抑制·OH能力出现极显著降低 (P < 0.01)。在48 h, 与对照组相比, 鳃抑制·OH能力无明显变化 (P > 0.05)。在24 h, 33.72 mg·L-1浓度组, 鳃组织抑制·OH能力达到最低 (0.575±0.175 mmol·g-1prot)。在同一浓度Cd2+处理组, 随着时间的延长, 鳃组织抑制·OH能力均呈先升高后降低的趋势。
从图 1 (c)可知:在同一时间, 与对照组相比, 背角无齿蚌鳃组织抗O-2·能力均呈极显著 (P < 0.01) 降低趋势。在同一Cd2+浓度处理组, 随着时间的延长, 鳃组织抗O2-·的能力无显著变化。
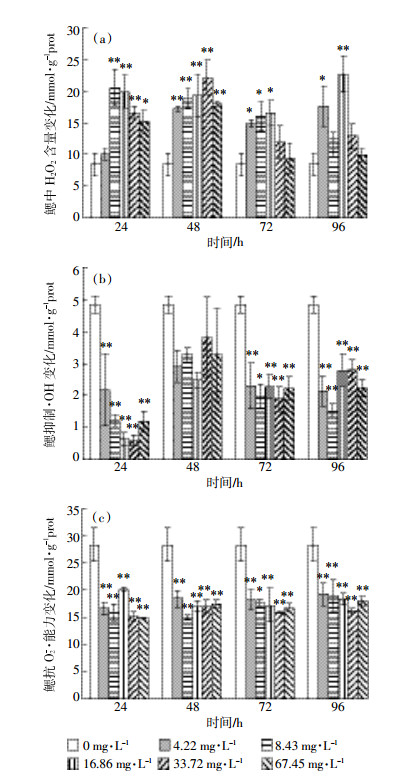
2.2 Cd2+对背角无齿蚌肝脏H2O2含量、抑制·OH能力和抗O2-·能力的影响由图 2 (a)得知, 在同一时间, 与对照相比, 肝脏中H2O2含量整体呈极显著升高 (P < 0.01)。在24 h, 不同浓度Cd2+处理组相比, 肝脏中H2O2含量呈逐渐升高的趋势; 在48 h, 4.22、8.43、16.86、33.72 mg·L-1 Cd2+处理组, 肝脏中H2O2含量呈逐渐减低趋势, 在67.45 mg·L-1浓度组肝脏中H2O2含量略微升高; 在72 h, 不同浓度Cd2+处理组相比, 肝脏中H2O2含量呈先升高后降低的趋势; 在96 h, 肝脏中H2O2含量呈逐渐降低趋势。在4.22、8.43、16.86、33.72 mg·L-1 Cd2+浓度处理组, 随着时间的延长, 肝脏中H2O2含量呈先升高后降低的趋势; 在67.45 mg·L-1 Cd2+浓度处理组, 随着时间的延长, 肝脏中H2O2含量呈逐渐降低的趋势, 且在96 h, 67.45 mg·L-1浓度组H2O2含量降至最低, 表现出明显的浓度-时间-效应关系。
|
| 图 2 Cd2+对背角无齿蚌肝脏H2O2含量、抑制·OH能力和抗O2-·能力的影响 Figure 2 Effects of Cd2+ on H2O2 contents, capacity of resisting hydroxyl radical and superoxide anion in liver of Anodonta woodiana woodiana |
依据图 2 (b)得知, 与对照组相比, 同一时间不同浓度或者同一浓度不同时间, 肝脏抑制·OH能力均无显著变化。
观察图 2 (c)发现, 在同一时间, 与对照组相比, 肝脏抗O-2·能力呈极显著降低 (P < 0.01)。在48 h, 不同浓度Cd2+处理组相比, 4.22、8.43、16.86 mg·L-1 Cd2+处理组, 肝脏抗O2-·能力呈逐渐升高趋势, 33.72、67.45 mg·L-1 Cd2+处理组, 肝脏抗O2-·能力呈现回落趋势。在48 h, 16.86 mg·L-1 Cd2+处理组, 肝脏抗O2-·能力达到最高 (26.31±3.06 mmol·g-1prot)。
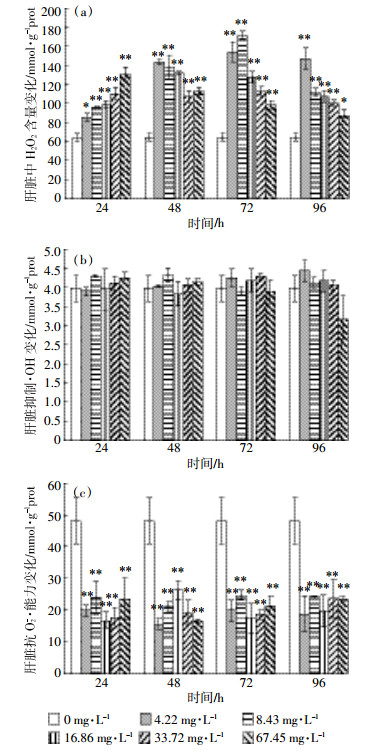
2.3 Cd2+对背角无齿蚌鳃和肝脏T-AOC的影响如图 3 (a)所示, 在24、72、96 h, 与对照组相比, 鳃T-AOC呈升高趋势, 且在72、96 h, 除67.45 mg·L-1 Cd2+处理组鳃T-AOC能力无变化外, 其他Cd2+浓度处理组鳃T-AOC能力均出现极显著性升高 (P < 0.01)。在48 h, 与对照组相比, 鳃T-AOC无明显变化, 维持稳定; 在4.22、8.43、33.72、67.45 mg·L-1 Cd2+浓度处理组, 随着时间的延长, 鳃T-AOC能力呈先升高后降低的趋势; 在16.86 mg·L-1 Cd2+浓度处理组, 鳃T-AOC能力呈逐渐升高趋势。

|
| 图 3 Cd2+对背角无齿蚌鳃和肝脏T-AOC的影响 Figure 3 Effects of Cd2+ on T-AOC in gill and liver of Anodonta woodiana woodiana |
观察图 3 (b)发现, 在同一时间, 与对照组相比, 肝脏T-AOC呈极显著性升高趋势 (P < 0.01)。在72 h, 不同浓度Cd2+处理组相比, 肝脏T-AOC呈先升高后降低的趋势。在4.22、8.43、16.86 mg·L-1 Cd2+浓度处理组, 随着时间的增加, 肝脏T-AOC能力呈先升高后降低的趋势。
3 讨论正常生理条件下, 组织细胞中H2O2、·OH和O2-·含量由机体抗氧化系统维持动态平衡状态[14]。当机体受到外界因素的胁迫时, ROS含量失衡, 机体抗氧化系统受损[15]。本实验结果也证实, Cd2+可以导致背角无齿蚌鳃和肝脏中H2O2、·OH和O2-·含量的失衡。
鳃主要由鳃丝构成, 水流经过鳃丝可以进行气体交换, 其承担蚌体的呼吸作用。本实验结果得出, 与对照组相比, 鳃组织抗O2-·能力减弱, H2O2含量增加, 抑制·OH能力减弱。这可能是因为Cd2+可以诱使鳃细胞发生单电子氧化还原反应而产生O2-·[16], O2-·在活性升高的超氧化物歧化酶 (Superoxide dismutase, SOD)[17-19]催化作用下, 大量生成H2O2且不能被及时清除, 则通过Fenton反应转化为具有较强氧化活性的·OH[15,20], 从而致使鳃抑制·OH能力减弱。这一结果证实了Cd2+可以致使背角无齿蚌鳃组织中ROS的含量增加, 进而诱使鳃组织中丙二醛 (Malondialdehyde, MDA) 含量增加, 脂质发生过氧化损伤[22], 核溶解和吞噬细胞增多[21]。本研究中H2O2含量的增加与李静等[23]研究镉可以诱导长江华溪蟹 (Sinopotamon yangtsekiense) 鳃、肝、胰腺中H2O2含量增加的结果一致。
肝脏承担蚌体的解毒作用, 含有丰富的抗氧化物酶类[24]。实验结果得出:在同一时间, 与对照组相比, 肝脏抗O2-·能力呈极显著性降低, H2O2含量呈极显著性升高, 抑制·OH能力无显著变化, 说明Cd2+可以引起肝脏抗氧化系统受损, 迫使组织抗氧化能力下降[25-26], 在24 h, 肝脏中H2O2含量呈逐渐升高的趋势。这可能是因为肝脏中O2-·在活性升高的SOD[14]催化作用下, 大量生成H2O2[15], 说明肝脏对镉引起的毒性效应较为敏感, 可以作为环境监测的靶器官。然而, 在48、72、96 h, 不同浓度Cd2+处理组相比, 肝脏中H2O2却呈逐渐降低趋势, 这可能是因为:①肝脏中部分O2-·被细胞色素C直接催化形成水[27], 使生成的H2O2含量减少; ②肝脏激活了过氧化物歧化酶 (Catalase, CAT)[21], 其催化H2O2转变为水和氧气[28], 致使肝脏中H2O2含量减少; ③肝脏中生成的H2O2被细胞色素C释放的电子还原, 清除了部分H2O2[27]。肝脏抑制·OH能力无明显变化, 可能是因为肝脏产生的O2-·和H2O2被肝脏中抗氧化酶类 (SOD、CAT等) 代谢, 很少或没有O2-·和H2O2经Fenton反应生成·OH, 说明肝脏作为机体解毒器官, 对外来毒物引起的氧化损伤具有一定抵御作用。鳃和肝脏中抗O2-·的能力均呈下降趋势, 说明O2-·可以作为监测水生生态环境Cd2+污染的生物学指标。
T-AOC是机体中包括抗氧化酶系统及非酶系统相互作用的综合性衡量指标。近年来, 对T-AOC在水生态毒理学机制研究中受到了广泛的重视, 而且, 认定组织中T-AOC是反映机体抗氧化作用的重要指标之一[29-30]。本研究结果显示, 在同一时间, 与对照组相比, 鳃和肝脏中T-AOC均呈升高趋势, 可能是因为鳃和肝脏ROS的生成刺激组织抗氧化防御系统活性增高, 从而抵御活性氧对组织的损害[28]。但是, 在4.22、8.43、33.72、67.45 mg·L-1 Cd2+浓度处理组, 随着时间的延长, 鳃T-AOC能力呈先升高后降低的趋势; 同时, 在4.22、8.43、16.86 mg·L-1 Cd2+浓度处理组, 随着时间的增加, 肝脏T-AOC能力也呈先升高后降低的趋势。这可能是因为:短时间Cd2+溶液处理背角无齿蚌, 鳃和肝脏产生氧化应激反应, 启动组织的酶与非酶系统抵御ROS的氧化损伤, 随着时间的延长, 鳃和肝脏中ROS产生过快或者过量[28], SOD和GSH等抗氧化酶与非酶物质受损, 鳃和肝脏细胞受损, T-AOC也呈降低趋势, 严重时将引发细胞凋亡[30-31]。
4 结论(1) 肝脏作为背角无齿蚌的解毒器官, 对外源Cd2+污染较为敏感, 其可以作为水体Cd2+污染监测的靶器官。
(2) 鳃和肝脏抗O2-·能力均呈降低趋势, 说明O2-·可能是Cd2+致使背角无齿蚌氧化损伤的首要因素, 其可以作为水体Cd2+污染监测的生物指标。
| [1] | Jorge M B, Loro V L, Bianchini A, et al. Mortality bioaccumulation and physiological responses in juvenile freshwater mussels (Lampsilis siliquoidea) chronically exposed to copper[J]. Aquatic Toxicology, 2013, 126C: 137–147. |
| [2] | Jain S K, David M. Vitamin D upregulates glutamate cysteine ligase and glutathione reductase, and GSH formation, and decreases ROS and MCP-1 and IL-8 secretion in high-glucose exposed U937 monocytes[J]. Biochemical and Biophysical Research Communications, 2013, 437(1): 7–11. DOI:10.1016/j.bbrc.2013.06.004 |
| [3] | Zhu S Y, Zhao X E, Zhang W, et al. Fluorescence detection of glutathione reductase activity based on deoxyribonucleic acid-templated silver nanoclusters[J]. Analytica Chimica Acta, 2013, 786: 111–115. DOI:10.1016/j.aca.2013.04.067 |
| [4] | Alves M G, Oliveira P F. 2, 4-Dichlorophenoxyacetic acid alters intracellular pH and ion transport in the outer mantle epithelium of the bivalve Anodonta cygnea[J]. Aquatic Toxicology, 2014, 154: 12–18. DOI:10.1016/j.aquatox.2014.04.029 |
| [5] | Xia X C, Hua C X, Xue S P, et al. Response of selenium-dependent glutathione peroxidase in the freshwater bivalve Anodonta woodiana exposed to 2, 4-dichlorophenol, 2, 4, 6-trichlorophenol and pentachlorophenol[J]. Fish Shellfish Immunology, 2016, 55: 499–509. DOI:10.1016/j.fsi.2016.06.012 |
| [6] | Qu H, Ma R X, Liu D H, et al. The toxicity, bioaccumulation, elimination, conversion of the enantiomers of fipronil in Anodonta woodiana[J]. Journal of Hazardous Materials, 2016, 312: 169–174. DOI:10.1016/j.jhazmat.2016.03.063 |
| [7] | 任继平, 李德发, 张丽英. 镉毒性研究进展[J]. 动物营养学报, 2003, 15(1): 1–6. REN Ji-ping, LI De-fa, ZHANG Li-ying. Toxicity research progress of cadmium[J]. Chinese Journal of Animal Nutrition, 2003, 15(1): 1–6. |
| [8] | 毛雪. 重金属镉对黑腹果蝇的毒性效应及其分子机制的初步研究[D]. 西安: 陕西师范大学, 2012: 1-78. MAO Xue.Initial study of effect of toxicity and molecular mechanism on cadmium to Drosophila melanogaster[D].Xi'an:University of Shaanxi Normal, 2012:1-78. |
| [9] | Templeton D M, Liu Y. Multiple roles of cadmium in cell death and survival[J]. Chemico-Biological Interactions, 2010, 188(2): 267–275. DOI:10.1016/j.cbi.2010.03.040 |
| [10] | Farrell K, Abbott F S. Role of N-acetylcysteine in the treatment of valproate hepatotoxicity[J]. New York:Raven Press, 1991: 149–153. |
| [11] | Wen X, Wu J, Wang F, et al. Deconvoluting the role of reactive oxygen species and autophagy in human diseases[J]. Free Radical Biology and Medicine, 2013, 65: 402–410. DOI:10.1016/j.freeradbiomed.2013.07.013 |
| [12] | Liochev S I. Reactive oxygen species and the free radical theory of aging[J]. Free Radical Biology and Medicine, 2013, 60: 1–4. DOI:10.1016/j.freeradbiomed.2013.02.011 |
| [13] | Wang H S. Development of fluorescent and luminescent probes for reactive oxygen species[J]. Trends in Analytical Chemistry, 2016, 85: 181–202. DOI:10.1016/j.trac.2016.09.006 |
| [14] | 王正秋, 江行玉, 王长海, 等. 铅镉和锌污染对芦苇幼苗氧化胁迫和抗氧化能力的影响[J]. 过程工程学报, 2002, 2(6): 558–563. WANG Zheng-qiu, JIANG Hang-yu, WANG Chang-hai, et al. Effect of antioxidant and oxidant stress on plumbum, cadmium and zinc to Phragmites Australis[J]. Journal of Progress Technology, 2002, 2(6): 558–563. |
| [15] | 殷红玲, 马媛, 王璐, 等. 虾夷扇贝内脏多糖的提取及清除羟基自由基作用的研究[J]. 水产科学学报, 2007, 26(5): 255–258. YIN Hong-ling, MA Yuan, WANG LU, et al. Research of extract and clear away radical of viscera polysaccharose from Patinopecten yesoensis[J]. Journal of Fishery Sciences, 2007, 26(5): 255–258. |
| [16] | Schuber M P. Signaling by reactive oxygen species in the nervous system[J]. Cellular and Molecular Life Sciences, 2000, 57(89): 1287–1305. |
| [17] | 邢慧芳, 李涌泉, 王兰. 镉对类背角无齿蚌外套膜、鳃抗氧化酶活性及脂质过氧化的影响[J]. 环境科学学报, 2013, 33(3): 856–860. XING Hui-fang, LI Yong-quan, WANG Lan. Effect of cadmium to antioxidant enzymes activity on mantle, gill and lipid peroxidation in Anodonta woodiana woodiana[J]. Acta Scientiae circumstantiae, 2013, 33(3): 856–860. |
| [18] | 文春根, 代功园, 谢彦海, 等. 铅对背角无齿蚌抗超氧阴离子与抑制羟自由基的影响以及可溶性蛋白分析[J]. 南昌大学学报, 2009, 33(4): 380–385. WEN Chun-gen, DAI Gong-yuan, XIE Yan-hai, et al. Effect of lead to soluble protein analysis, resisting superoxide anion and hydroxyl radical in Anodonta woodiana woodiana[J]. Journal of Nanchang University, 2009, 33(4): 380–385. |
| [19] | 闫博, 王兰, 李涌泉. 镉对长江华溪蟹肝胰腺抗氧化酶活力的影响[J]. 动物学报, 2007, 53(6): 1121–112. YAN Bo, WANG Lan, LI Yong-quan. Effect of cadmium to antioxidant enzyme activity on Sinopotamon yangtsekiense[J]. Acta Zoologica Sinica, 2007, 53(6): 1121–112. |
| [20] | 王宝杰, 王雷. 中国对虾血细胞吞噬活动中超氧阴离子的产生[J]. 中国水产科学, 2003, 10(1): 14–18. WAGN Bao-jie, WANG Lei. Generation of superoxide anion in blood cell phagocytosis Fenneropenaeus chinensis[J]. Journal of Fishery Sciences of China, 2003, 10(1): 14–18. |
| [21] | 邢慧芳. 镉对背角无齿蚌主要组织的毒性研究[D]. 太原: 山西大学, 2013: 1-57. XING Hui-fang.Toxicity research of cadmium to the main tissues in Anodonta woodiana woodiana[D].Taiyuan:Shanxi University, 2013:1-57. |
| [22] | Lopez E, Arce C, Oset-Gasque M J, et al. Cadmium induces reactive oxygen species generation and lipid peroxidation in cortical neurons in culture[J]. Free Radical Biology and Medicine, 2006, 40(6): 940–951. DOI:10.1016/j.freeradbiomed.2005.10.062 |
| [23] | 李静, 闫博, 王兰, 等. 镉诱导长江华溪蟹肝胰腺细胞凋亡研究[J]. 环境科学学报, 2010, 30(11): 2277–2284. LI Jing, YAN Bo, WANG Lan, et al. Apoptosis induced by cadmium to hepatopancreas Sinopotamon yangtsekiense[J]. Journal of Environment Scientist, 2010, 30(11): 2277–2284. |
| [24] | 马淑慧. 羟基自由基和超氧阴离子自由基测定的荧光分析法研究[D]. 泰安: 山东农业大学, 2009: 1-67. MA Shu-hui.Research of fluorescence analysis of hydroxyl radical and superoxide anion radical[D].Tai'an:Shandong Agricultural University, 2009:1-67. |
| [25] | Kyle M E, Miccade S, Nakae D, et al. Superoxide dismutase and catalase protect cultured hepatocytes from the cytotoxicity of acetaminophen[J]. Biochemical and Biophysical Research Communications, 1987, 149(3): 889–896. DOI:10.1016/0006-291X(87)90491-8 |
| [26] | Srivastava P, Puri S K, Dutta G P, et al. Effect of the antimalarial agents Primaquine and (N'-3-acetyl-4-5-dihydro-2-furanyl)-N4-(6-methoxy-8-quinolinyl)1, 4-pentane-diamine on oxidative stress and antioxidant defences in mice[J]. Biochemical Pharmacology, 1993, 46(10): 1859–1860. DOI:10.1016/0006-2952(93)90593-L |
| [27] | Xu J X, Li X, Zhang Y X, et al.Mitochondrial respiratory chain:A Salf-defense system against oxygen toxicity[C]//Lester P.Proceedings of the international symposium on natural antioxidants:Molecular mechanisms and health effects.Champaign, Illinois:AOCS Press, 1996:530-539. |
| [28] | 赵云罡, 徐建兴. 线粒体、活性氧和细胞凋亡[J]. 生物化学与生物物理进展, 2001, 28(2): 168–171. ZHAO Yun-gang, XU Jian-xing. Mitochondria, reactive oxygen and apoptosis[J]. Journal of Biochemistry and Biophysical Progress, 2001, 28(2): 168–171. |
| [29] | 高春生, 王春秀, 张书松. 水体铜对黄河鲤肝胰脏抗氧化酶活性和总抗氧化能力的影响[J]. 农业环境科学学报, 2008, 27(3): 1157–1162. GAO Chun-sheng, WANG chun-xiu, ZHANG Shu-song. Effect of copper to antioxidant enzyme activity and total antioxidant ability of hepatopancreas in Cyrinus carpio[J]. Journal of Agro-Environment Science, 2008, 27(3): 1157–1162. |
| [30] | 曹洁, 汪海娅. 总抗氧化力与心血管疾病[J]. 中国医学杂志, 2011, 17(1): 58–62. CAO Jie, WANG Hai-ya. Total antioxidant ability and cardiovascular diseases[J]. Journal of Chinese Medicine, 2011, 17(1): 58–62. |
 2017, Vol. 36
2017, Vol. 36