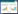文章信息
- 张丽, 侯萌瑶, 安毅, 李玉浸, 林大松, 朱丹妹, 秦莉, 霍莉莉
- ZHANG Li, HOU Meng-yao, AN Yi, LI Yu-jin, LIN Da-song, ZHU Dan-mei, QIN Li, HUO Li-li
- 生物炭对水稻根际微域土壤Cd生物有效性及水稻Cd含量的影响
- Effects of biochar on Cd bioavailability in rhizosphere microenvironment of cadmium-polluted paddy and Cd content in rice
- 农业环境科学学报, 2017, 36(4): 665-671
- Journal of Agro-Environment Science, 2017, 36(4): 665-671
- http://dx.doi.org/10.11654/jaes.2016-1363
文章历史
- 收稿日期: 2016-10-26
2. 农业部环境保护科研监测所, 天津 300191
2. Agro-Environmental Protection Institute, Ministry of Agriculture, Tianjin 300191, China
Cd作为众所周知的"五毒"元素之一, 土壤受其污染后具有隐蔽性、滞后性的特点, 不易被察觉和注意, 再加上污染范围广、持续时间长、无法被生物降解, 很容易在土壤耕层中积累, 难以消除。2014年4月环境保护部和国土资源部公布的全国土壤污染状况调查公报显示:Cd的点位超标最高, 正式被确认为我国土壤的首要污染物。农田土壤Cd污染的治理不但是环境问题, 还直接关系着人类自身的食品安全健康及可持续发展。因此, 如何有效控制及治理农田土壤中Cd金属的污染, 改善土壤质量, 是当前农业可持续发展和生态环境保护中迫切需要解决的重要内容。
近年来, 生物炭在土壤重金属污染控制方面成为一个新的研究领域。生物炭含有作物生长所必需的大量和中微量元素, 且其孔隙结构发达, 比表面积大, 具有很强的吸附能力[1]。随着研究的深入, 生物炭在改善土壤理化性质, 调控营养元素循环, 防治重金属、多环芳烃等污染物迁移转化方面的功能逐渐被人们所认知, 其在土壤改良与修复领域的应用尝试也随之日益增多[2-5]。来源广泛、对环境友好的新型吸附材料备受研究人员的关注[6-7], 已有研究表明, 生物炭可以提高土壤肥力, 促进作物生长并降低土壤重金属的生物有效性[8]。生物炭不仅是富含碳的有机物质, 还含有氮、氧、硫等多种养分元素和无机碳酸盐成分, 其输入可以增加土壤有机碳含量水平, 提供微生物可利用组分[9]。同时, 生物炭具有一定的离子交换能力和吸附特性, 其对营养元素 (如NO3--N、NH4+-N、PO43-) 的吸附和截留, 可以降低肥料养分的流失, 提高养分的利用率[10]。此外, 生物炭还可以通过对土壤pH、CEC等环境的改变, 影响氮素转化过程[11]以及提高磷素有效性[12]。
水稻是我国最主要的粮食作物, 其生产的安全性令人高度关注, 而水稻的根际环境作为营养元素和污染物进入植物根系的环境界面, 其独特的、动态的性质通过影响各种重金属化学过程而直接控制重金属从土壤向植物的传递。目前, 国内外应用生物炭对重金属污染土壤进行处理的研究很多, 但多集中在实验室人工模拟试验和盆栽试验上, 大量研究了生物炭对土壤中Cd形态的影响及植物对重金属的富集, 而有关水稻根际土及非根际土Cd有效性差异方面的研究较少。本研究选取湖南水稻 (当前受Cd污染较严重的农作物) 作为研究对象, 通过改变生物炭的施入量, 探究水稻不同部位Cd累积量、根际与非根际土壤pH及Cd有效态含量变化差异性, 旨在从根际土壤Cd生物有效性及对作物的影响方面探索生物炭对Cd污染土壤的调控机理, 并为农田土壤Cd污染控制与治理提供科学依据。
1 材料与方法 1.1 试验材料供试水稻为鱼鳞稻欣荣优华占, 采购于湖南金色农华种业科技有限公司。供试土壤为湖南Cd污染稻田土壤, 其理化性质见表 1。供试生物炭来自山东省东营市, 用玉米秸秆在550~600℃缺氧条件下热解6~8 h制备而成, 基本性质为:比表面积62.11 m2·g-1, 孔体积0.031 cm2·g-1, 平均孔径3.624 nm, 含碳量为45.44%, pH 8.49, CEC 185.56 mol·kg-1, 全氮5.50 g·kg-1, 全磷3.90 g·kg-1, 全Cd 0.03 mg·kg-1。
利用多隔层根箱水稻盆栽实验来研究生物炭对水稻根际与非根际土壤Cd环境化学行为的影响。根箱是在Moritsuka等 (2000) 研究基础上加以改进而成, 水稻根际土壤被分隔成多个空间, 具体见图 1。该装置用有机玻璃加工制成, 规格为300 mm×200 mm×250 mm, 内部分为植物根系生长室 (宽2 cm)、左右近根区 (各1 cm宽) 3个试验区, 并于紧贴中室两边的左右近根区内插入6张由覆盖400目尼龙筛的有机玻璃框制成的隔板, 框的厚度为0.8 mm。此设计避免了水稻根系组织进入相邻的隔层, 实现了根际土壤与非根际土壤之间的分离, 但水分、养分以及土壤重金属等物质可以自由通过各个隔层。至采样期, 可观察到根系在与中室相邻的两侧尼龙网上生长形成根垫, 而左右近根际并无根系组织穿过。

|
| 图 1 水稻根箱栽培示意图 Figure 1 The root box of rice cultivation |
根箱培养试验共设4个生物炭施用水平, 即生物炭施用量分别为0 (CK)、25 g·kg-1 (M1)、50 g·kg-1 (M2)、100 g·kg-1 (M3), 每个处理4次重复。土壤与生物炭按比例混合均匀后装入根际箱, 每根际箱装土4 kg。试验于日光温室内进行, 2015年5月25日将催芽露白的水稻种子直播于根际箱中间层, 每层5粒, 保持水分充足。9月30日收获。
1.3 样品采集与分析待水稻生长成熟后, 以自封袋采集水稻样品, 将采集的水稻样品用自来水冲洗, 并用超纯水润洗, 分糙米、稻壳、茎叶和根于80℃烘箱内烘干, 然后测定Cd含量。采集土样时, 开箱并逐一抽出尼龙撩网插片, 从而分离采集距根际1、2、3 cm的非根际土壤 (分别记作非根际土1、2、3), 并充分混匀, 根系生长室的根际土壤采用抖落法, 抖落根系上的大土块, 剩下粘在根系上的回实验室用刷子刷下来。土壤样品风干后混合均匀, 磨取过10目筛, 待测。土壤pH以1 mol·L-1 KCl溶液为浸提剂, 采用电位法测定。土壤中Cd有效态含量测定:称取过2 mm筛的风干土样12.5 g于100 mL塑料瓶中, 准确加入25 mL DTPA浸提剂, 将塑料瓶置于振荡机中, 以 (180±20) r·min-1的速度在 (25±2) ℃下振荡2 h后过滤于100 mL塑料瓶中, 用原子吸收分光光度计测定待测液中Cd含量。植物样品中Cd含量采用HNO3-HClO4[13-14]消化、原子吸收分光光度法测定。
1.4 仪器设备原子吸收分光光度计 (Solaar M6, 美国热电公司); 电热数控烘箱 (101-3A, 天津泰斯特仪器设备有限公司); 微型植物粉碎机 (FZ102, 天津泰斯特仪器设备有限公司); 微型土壤粉碎机 (FT102, 天津泰斯特仪器设备有限公司); 电热板 (EH35B, 北京莱伯泰科仪器设备有限公司)。
1.5 数据统计分析用Microsoft Excel 2003、Origin 8.6分析数据、作图, SPSS 16.0统计软件Turkey法进行统计分析, 显著性检验设P < 0.05, 多重比较结果以小写英文字母表示。
2 结果与分析 2.1 生物炭施加下根际与非根际土壤中pH的变化从图 2可看出, 生物炭不同施用量水平M1、M2和M3与对照相比, 根际层土壤pH值分别提升了0.02、0.06、0.08个单位, 表明生物炭施用量增加, 土壤pH值也随之增加。非根际第1、2层土壤pH值都呈先下降后上升的趋势, 其中:第1层土壤pH值在M1处理下下降了0.01个单位, M2和M3处理下分别升高了0.08、0.13个单位; 非根际第2层土壤pH值在M1处理下下降了0.02个单位, M2和M3处理pH值分别提高了0.18、0.25个单位, 但并未达到显著性差异 (P > 0.05)。非根际第3层土壤pH值在M1、M2和M3处理下均有增加, 分别提高了0.41、0.93、0.79个单位。

|
| 图 2 生物炭处理对土壤pH的影响 Figure 2 Effects of different dosages of biochar treatment on the pH value |
从图 3可知, 相比于对照, 生物炭不同用量处理下Cd的有效态含量均有降低, 且呈先下降后上升的趋势, 其中M1、M2和M3的降幅分别为7.6%、13.9%和5%。可见根际土壤Cd的有效态含量在M2处理下效果最明显。
|
| 图 3 生物炭处理对根际土壤Cd有效态含量的影响 Figure 3 Effects of different dosages of biochar treatment on the concentrations of Cd effective forms in rhizosphere soil |
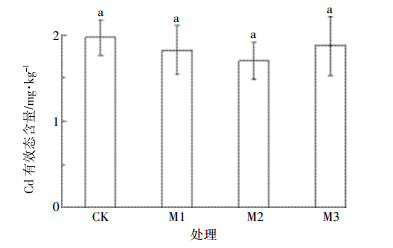
从图 4可以看出, 与对照相比, 各非根际层Cd有效态含量均显著性降低。非根际第1、2层土壤Cd有效态含量都随生物炭施用量的增加而降低。其中, 第1层土壤Cd的有效态含量在M1、M2和M3处理分别下降了9.5%、13.1%和27.4%。第2层土壤Cd有效态含量下降幅度分别为2.4%、9.6%和22.9%。M3处理下非根际第1、2层土壤Cd的有效态含量与对照达到了显著性差异 (P < 0.05)。非根际第3层土壤Cd有效态含量在M1、M2和M3处理水平下均有降低, 降幅分别为8.3%、29.2%和20.8%, 且都达到了显著性差异 (P < 0.05)。
|
| 图 4 生物炭处理对非根际土壤Cd有效态含量的影响 Figure 4 Effects of different dosages of biochar treatment on the concentrations of Cd effective forms in non-rhizosphere soil of different layers |
综合图 3和图 4来看, 根际层和非根际层土壤中Cd的有效态含量在不同生物炭施用量下均有降低。根际土壤Cd有效态含量在中用量 (M2) 生物炭施用下降幅最大, 非根际土壤第1、2层Cd有效态含量在高用量 (M3) 生物炭施用下降幅最大, 与对照相比呈显著性差异 (P < 0.05), 第3层Cd有效态含量在不同生物炭施用水平下与对照相比都呈显著性差异 (P < 0.05), 说明在Cd污染土壤中施加一定量的生物炭可降低Cd的生物有效性。对比根际与非根际土壤Cd含量可发现, 根际Cd有效态普遍低于非根际土壤。
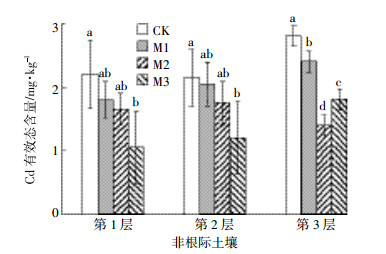
2.3 施加生物炭对水稻不同部位Cd含量的影响对成熟期水稻茎叶、根、糙米及稻壳中Cd含量进行测定, 得出在不同生物炭施用量下水稻不同部位Cd含量的变化如表 2所示。
|
由表 2可以看出, 相对于对照处理, 不同用量生物炭处理均可降低水稻各部位Cd含量, 茎叶、根、糙米和稻壳在M1、M2和M3处理水平下降幅分别为12.1%~28.2%、5.4%~49.8%、33.7%~81.2%和29.6%~47.1%。水稻茎叶Cd含量随生物炭用量的增加而降低, 但效果不显著, 水稻根部Cd含量在不同用量生物炭处理下均有降低, 且与对照相比在M2施用下达到了显著性差异 (P < 0.05);糙米和稻壳在不同用量生物炭处理下也均有下降, 糙米在M2处理水平下与对照相比达显著性差异 (P < 0.05), 而稻壳Cd含量差异不显著 (P > 0.05)。
3 讨论生物炭是一种碳含量极其丰富的木炭。它是在低氧环境下, 通过高温裂解将木材、草、玉米秆或其他农作物废物碳化。生物炭因其自身特点在施入土壤后可从多方面对土壤的物理、化学性质进行调控, 进而影响土壤中Cd的有效性及植物对Cd的吸收。生物质高温炭化后可形成大量无机盐, 与土壤混合后为土壤带来大量的盐基离子, 较易与Cd离子形成稳定的化合物, 生物炭作为一种良好的吸附材料, 表面带有大量负电荷和较高的电荷密度, 并且富含一系列含氧、含氮、含硫官能团, 具有很大的阳离子交换量 (CEC) 而吸附大量可交换态阳离子[15], 生物炭的多孔结构、高比表面积和表面丰富的含氧官能团使其有结合重金属离子的强烈倾向, 能够较好地钝化土壤中的重金属[16]。生物炭自身大都呈碱性, 能够一定程度上提高土壤的pH值, 由此来降低一些重金属可交换态的含量, 进而减轻有害元素对作物生长过程中的伤害[17-19]。
本试验发现, 根际和非根际土壤pH值在生物炭低施用量处理下略有下降, 随着生物炭施用量的增加, 土壤pH值升高。这可能是因为生物炭对土壤影响有一定的延迟作用。Glaser等[20]的研究结果与之类似, 认为生物炭对土壤pH值的改良是呈波浪形上升的。pH值是影响土壤重金属污染钝化修复效果的一个重要因素, 在酸性土壤上, 土壤pH值的提高能增加土壤对重金属的固定, 从而降低生物有效性[21]。毛懿德等[22]的研究表明, 施用生物炭可以提高土壤pH值, 减少氢离子与Cd离子的竞争置换作用, 较易形成金属氢氧化物、盐酸盐或磷酸盐沉淀, 进而增加土壤表面活性吸附点位。除此之外, 施用生物炭还可以通过影响土壤的pH值和CEC等理化性质减少土壤中重金属向植物体系的迁移, 如Uchimiya等[23]的研究表明, 生物炭的输入会引起土壤pH值的升高, 促进土壤中Cd的固定。提高土壤pH, 可加强土壤黏粒及土壤有机/无机胶体对重金属离子的吸附能力, 降低土壤中重金属离子的有效性[24]。
本试验结果显示, 受Cd污染土壤施加不同用量生物炭后水稻各部位Cd累积量均有下降, 且降幅为糙米>稻壳>茎叶>根, 说明生物炭的施入明显影响着Cd在水稻不同器官的累积分配差异。水稻根部富集Cd的能力最强, 并且把吸收的Cd大部分截留在根部器官内[25], 但在土壤中施入生物炭后, 通过提高土壤pH值、生物炭对土壤中Cd离子的竞争吸附、消减Cd生物有效性作用以及其富含的有机质增强土壤对Cd的吸附固定等方式, 降低水稻对重金属的吸收, 从而降低水稻体内重金属的含量, 尤其是降低水稻糙米重金属含量。
根际土壤是指受植物根系直接影响的那部分微域土壤, 其区域的重金属形态直接影响到重金属对植物的有效性, 根际土壤环境在土壤体系中较为独特, 它与非根际土壤在物理、化学性质方面有较大的差异。本研究发现施加生物炭后, 根际土壤pH的上升幅度小于非根际土壤, 且非根际土壤第1、2、3层土壤pH的上升幅度不断增大。这可能是由于在根际土壤中, 根系对阴阳离子的不平衡吸收及由此带来的H+和HCO3-净分泌的不同, 有机酸的分泌及大量CO2产生等, 根系的泌氧功能使根际土壤维持较高的氧化还原电位, 可降低土壤中某些有毒物质如Fe2+、Mn2+及H2S等的浓度, 生物炭的施加也降低了Cd2+浓度, 同时伴随着H+的产生, 导致土壤pH有所降低, 而非根际土壤随与根际土壤层距离的增大只单方面受到生物炭的影响。虽然土壤中的重金属含量是评价该土壤污染水平的关键因素, 但尚不能准确反应土壤中该元素的有效性, 所以分析土壤中重金属的有效性很有必要[26-27]。根际和非根际土壤有效态含量变化在生物炭施用后也存在差异性, 研究发现:一方面, 根际和非根际土壤Cd有效态含量在不同用量生物炭施用下均有下降, 通过将土壤中Cd生物可利用态向活性低的生物不可利用形态转化, 从而降低Cd的生物有效性和可迁移性, 阻控土壤中的Cd向农作物可食部位运移富集, 降低重金属对环境的危害[28-29]。说明可以通过施用生物炭降低Cd的生物有效性, 增强土壤对Cd的吸附固定[30-32]。这与侯艳伟等[33]和孙文博等[34]的研究成果一致。Beesley等[35]研究发现生物炭对土壤中Cd和Zn具有良好的吸附固定作用; 王期凯等[24]通过田间试验表明, 在受Cd污染的菜地土壤中施用生物炭显著降低土壤pH, 降低土壤Cd的活性; Beesley等[36]的田间试验同样表明, 向Cd污染土壤中施用生物炭可显著降低Cd浓度。这些实验结果均表明, 土壤中添加生物炭可以明显降低重金属的生物有效性。另一方面, 根际土壤Cd有效态含量普遍低于非根际土壤Cd有效态含量, 说明在根际微环境下Cd被活化的程度要低于非根际土壤。Lin等[37]研究同样发现, 根系及分泌物可以一定程度上影响Cd的活化, 根际土壤与非根际土壤中重金属含量的生物有效性大不相同[38], 在根际土壤微环境下, 一方面根系分泌物的释放、植物根系的生长、根系对水的吸收及根系对化学物质的吸附和解吸都会导致根际与非根际的物理、化学或生物性质大不相同[39], 另外, 根系能分泌糖类、有机酸、氨基酸及其他次生代谢物质, 可通过改变根际环境及与土壤重金属进行络合、螯合、沉淀而影响土壤中Cd的有效性[40], 诱导改变土壤微生物活动及群落结构[41], 使根际土壤中Cd有效态含量低于非根际土壤Cd有效态含量。生物炭是如何通过改变根系分泌物的组成及土壤微生物活动而影响根际微环境, 其机理有待深入研究。
总体来看, 在土壤中施用生物炭可增加土壤pH值, 降低土壤中Cd有效态含量, 降低水稻各部位Cd累积量。限于盆栽试验条件和环境与土壤等因素影响, 生物炭对水稻根际土壤微域Cd生物有效性及水稻Cd含量的长期效应还有待田间试验进一步验证, 并对其作用机制等科学问题系统研究和深入探讨。
4 结论(1) 施加生物炭可提高土壤pH值, 且施用生物炭量越多, 土壤pH值增加越明显。
(2) 不同用量生物炭施用下, 根际和非根际土壤Cd有效态含量均有下降。根际土壤在50 g·kg-1生物炭处理下降幅最大, 但效果不显著, 非根际的3层土壤在50、100 g·kg-1生物炭处理下Cd有效态含量显著降低 (P < 0.05), 且根际土壤Cd有效态含量普遍低于非根际土壤。
(3) 施加生物炭可降低水稻各部位Cd含量, 水稻根和糙米Cd含量在50 g·kg-1处理下显著降低 (P < 0.05), 降幅分别为49.8%和81.2%, 茎叶和稻壳分别在100、50 g·kg-1处理下降幅最大, 降幅分别为28.2%和47.1%。
| [1] | 刘玉学, 刘微, 吴伟祥, 等. 土壤生物质炭环境行为与环境效应[J]. 应用生态学报, 2009, 20(4): 977–982. LIU Yu-xue, LIU Wei, WU Wei-xiang, et al. Environmental behavior and effect of biomass-derived black carbon in soil:A review[J]. Chinese Journal of Applied Ecology, 2009, 20(4): 977–982. |
| [2] | Gaskin J W, Steiner C, Harris K, et al. Effect of low temperature pyrolysis conditions on biochar for agricultural use[J]. Transactions of the ASABE, 2008, 51(6): 2061–2069. DOI:10.13031/2013.25409 |
| [3] | Yao F X, Arbestain M C, Virgel S, et al. Simulated geochemical weathering of a mineral as rich biochar in a modified soxhlet reactor[J]. Chemosphere, 2010, 80(7): 724–732. DOI:10.1016/j.chemosphere.2010.05.026 |
| [4] | Yuan J H, Xu R K, Zhang H. The forms of alkalis in the biochar produced from crop residues at different temperatures[J]. Bioresource Technology, 2011, 102(3): 3488–3497. DOI:10.1016/j.biortech.2010.11.018 |
| [5] | 陈温福, 张伟明, 孟军, 等. 生物炭应用技术研究[J]. 中国工程科学, 2011, 13(2): 83–89. CHEN Wen-fu, ZHANG Wei-ming, MENG Jun, et al. Researches on biochar application technology[J]. Engineering Sciences, 2011, 13(2): 83–89. |
| [6] | Saito Y, Mori M, Shida S. Formaldehyde adsorption and desorption properties of wood-based biochar[J]. Mokuzai Gakkaishi, 2000, 46(6): 596–601. |
| [7] | Dinesh M, Charles U, Pittman J, et al. Pyrolysis of wood/biomass for bio-oil:A critical review[J]. Energy and Fuels, 2006, 20(3): 848–889. DOI:10.1021/ef0502397 |
| [8] | Lehmann J. Bio-energy in the black[J]. Frontiers in Ecology and the Environment, 2007, 5(7): 381–387. DOI:10.1890/1540-9295(2007)5[381:BITB]2.0.CO;2 |
| [9] | Woolf D, Amonette J E, Street-Perrott F A, et al. Sustainable biochar to mitigate global climate change[J]. Nature Communications, 2010(1): 56. |
| [10] | Xie Z, Xu Y, Liu G, et al. Impact of biochar application on nitrogen nutrition of rice, greenhouse-gas emissions and soil organic carbon dynamics in two paddy soils of China[J]. Plant and Soil, 2013, 370(1/2): 527–540. |
| [11] | Zhao X, Wang S Q, Xing G X. Nitrification, acidification, and nitrogen leaching from subtropical cropland soils as affected by rice straw-based biochar:Laboratory incubation and column leaching studies[J]. Journal of Soils and Sediments, 2014, 14(3): 471–482. DOI:10.1007/s11368-013-0803-2 |
| [12] | Liang B, Lehmann J, Solomon D, et al. Black carbon increases cation exchange capacity in soils[J]. Soil Science Society of America Journal, 2006, 70(5): 1719–1730. DOI:10.2136/sssaj2005.0383 |
| [13] | 张玉玲, 王松君, 王璞君, 等. 微波消解植物灰分与环境土壤中微量元素的ICP-AES方法研究[J]. 光谱学与光谱分析, 2009, 29(8): 2240–2243. ZHANG Yu-ling, WANG Song-jun, WANG Pu-jun, et al. Study of microelements in plant's ash and environmental soil by microwave digestion ICP-AES[J]. Spectroscopy and Spectral Analysis, 2009, 29(8): 2240–2243. |
| [14] | 胡恭任, 于瑞莲, 吕斌. 桐花树对水体中铬、镍、铜污染的修复实验研究[J]. 中国矿业, 2009, 18(1): 68–72. HU Gong-ren, YU Rui-lian, LÜ Bin. Experimental study on water contamination phytoremediation of Cr6+, Ni2+, Cu2+ by pittosporum trees[J]. China Mining Magazine, 2009, 18(1): 68–72. |
| [15] | Regmi P, Moscoso J L G, Kumar S, et al. Removal of copper and cadmium from aqueous solution using switchgrass biochar produced via hydrothermal carbonization process[J]. Journal of Environmental Management, 2012, 109: 61–69. DOI:10.1016/j.jenvman.2012.04.047 |
| [16] | 吴成, 张晓丽, 李关宾. 黑碳吸附汞砷铅镉离子的研究[J]. 农业环境科学学报, 2007, 26(2): 770–774. WU Cheng, ZHANG Xiao-li, LI Guan-bin. Sorption of Hg2+, As3+, Pb2+ and Cd2+ by black carbon[J]. Journal of Agro-Environment Science, 2007, 26(2): 770–774. |
| [17] | Cox D, Bezdick D, Fauci M. Effects of compost, coal ash, and straw amendments on restoring the quality of eroded palouse soil[J]. Biology Fertility of Soils, 2001, 3(55): 365–372. |
| [18] | Topoliantz S, Ponge J F, Ballof S. Manioc peel and charcoal:a potential organic amendment for sustainable soil fertility in the tropics[J]. Biology Fertility of Soils, 2005, 41(1): 15–21. DOI:10.1007/s00374-004-0804-9 |
| [19] | Van Z L, Kimber S, Morris S, et al. Effects of biochar from slow pyrolysis of paper mill waste on agronomic performance and soil fertility[J]. Plant Soil, 2010, 327(1/2): 235–246. |
| [20] | Glaser B, Lehmann J, Zech W. Ameliorating physical and chemical properties of high weathered soils in the tropics with charcoala review[J]. Biology Fertility of Soils, 2002, 35(4): 219–230. DOI:10.1007/s00374-002-0466-4 |
| [21] | 贾乐, 朱俊艳, 苏德纯. 秸秆还田对镉污染农田土壤中镉生物有效性的影响[J]. 农业环境科学学报, 2010, 29(10): 1992–1998. JIA Le, ZHU Jun-yan, SU De-chun. Effects of crop straw return on soil cadmium availability in different cadmium contaminated soil[J]. Journal of Agro-Environment Science, 2010, 29(10): 1992–1998. |
| [22] | 毛懿德, 铁柏清, 叶长城, 等. 生物炭对重污染土壤镉形态及油菜吸收镉的影响[J]. 生态与农村环境学报, 2015, 31(4): 579–582. MAO Yi-de, TIE Bo-qing, YE Chang-cheng, et al. Effects of biochar on forms and uptake of cadmium by rapeseed in cadmium-polluted soil[J]. Journal of Ecology and Rural Environment, 2015, 31(4): 579–582. DOI:10.11934/j.issn.1673-4831.2015.04.021 |
| [23] | Uchimiya M, Lima I M, Klasson K T, et al. Immobilization of heavy metal ions (CuⅡ, CdⅡ, NiⅡ and PbⅡ) by broiler litter-derived biochars in water and soil[J]. Journal of Agricultural and Food Chemistry, 2010, 58(9): 5538–5544. DOI:10.1021/jf9044217 |
| [24] | 王期凯, 郭文娟, 孙国红, 等. 生物炭与肥料复配对土壤重金属镉污染钝化修复效应[J]. 农业资源与环境学报, 2015, 32(6): 583–589. WANG Qi-kai, GUO Wen-juan, SUN Guo-hong, et al. Combined effects of biochar and fertilizer on cadmium contaminated soil remediation[J]. Journal of Agricultural Resources and Environment, 2015, 32(6): 583–589. |
| [25] | 莫争, 王春霞, 陈琴, 等. 重金属Cu、Pb、Zn、Cr、Cd在水稻植株中的富集与分布[J]. 环境化学, 2002, 21(2): 110–116. MO Zheng, WANG Chun-xia, CHEN Qin, et al. The accumulation and distribution of Cu, Pb, Zn, Cr, Cd in rice plant[J]. Environmental Chemistry, 2002, 21(2): 110–116. |
| [26] | Reeves P G, Chancy R L. Bioavailability as all issue in risk assessment and management of food cadmium:A review[J]. Science of the Total Environment, 2008, 398(1/2/3): 13–19. |
| [27] | Zhang M K, Liu Z Y, Wang H. Use of single extraction methods to predict bioavailability of heavy metals in polluted soils to rice[J]. Communications in Soil Science and Plant Analysis, 2010, 41(7): 820–831. DOI:10.1080/00103621003592341 |
| [28] | Wu F L, Lin D Y, Su D C. The effect of planting oilseed rape and compost application on heavy metal forms in soil and Cd and Pb uptake in rice[J]. Agricultural Sciences in China, 2011, 2(10): 267–274. |
| [29] | 张亚丽, 沈其荣, 姜洋. 有机肥料对镉污染土壤的改良效应[J]. 土壤学报, 2001, 38(2): 212–218. ZHANG Ya-li, SHEN Qi-rong, JIANG Yang. Effect of organic manure on the amelioration of Cd-pollution soil[J]. Acta Pedologica Sinica, 2001, 38(2): 212–218. DOI:10.11766/trxb200003240209 |
| [30] | 马铁铮, 马友华, 徐露露, 等. 农田土壤重金属污染的农业生态修复[J]. 农业资源与环境学报, 2013, 30(5): 39–43. MA Tie-zheng, MA You-hua, XU Lu-lu, et al. Agro-ecological remediation technologies on heavy metal contamination in cropland soils[J]. Journal of Agricultural Resources and Environment, 2013, 30(5): 39–43. |
| [31] | Fellet G, Marchiol L, Delle Vedove G, et al. Application of biochar on mine tailings:Effects and perspectives for land reclamation[J]. Chemosphere, 2011, 83(9): 1262–1267. DOI:10.1016/j.chemosphere.2011.03.053 |
| [32] | 朱佳文, 邹冬生, 向言词, 等. 钝化剂对铅锌尾矿砂中重金属的固化作用[J]. 农业环境科学学报, 2012, 31(5): 920–925. ZHU Jia-wen, ZOU Dong-sheng, XIANG Yan-ci, et al. Effects of passivators on stabilization of Pb, Zn and Cd in lead and zinc mine tailing[J]. Journal of Agro-Environment Science, 2012, 31(5): 920–925. |
| [33] | 侯艳伟, 曾月芬, 安增莉. 生物炭施用对污染红壤中重金属化学形态的影响[J]. 内蒙古大学学报 (自然科学版), 2011, 42(4): 460–466. HOU Yan-wei, ZENG Yue-fen, AN Zeng-li. Effects of the application of biochar on the chemical fraction of heavy metals in polluted red soil[J]. Journal of Inner Mongolia University, 2011, 42(4): 460–466. |
| [34] | 孙文博, 莫创荣, 安鸿雪, 等. 施用蔗渣对土壤镉的赋存形态和生物有效性的影响研究[J]. 农业环境科学学报, 2013, 32(9): 1793–1799. SUN Wen-bo, MO Chuang-rong, AN Hong-xue, et al. Effects of bagasse application on speciation and bioavailability of cadmium in contaminated soil[J]. Jourual of Agro-Environment Science, 2013, 32(9): 1793–1799. DOI:10.11654/jaes.2013.09.013 |
| [35] | Beesley L, Marmiroli M. The immobilisation and retention of soluble arsenic, cadmium and zinc by biochar[J]. Environmental Pollution, 2011, 159(2): 474–480. DOI:10.1016/j.envpol.2010.10.016 |
| [36] | Beesley L, Moreno-Jiménez E, Gomez-Eyles J L. Effects of biochar and greenwaste compost amendments on mobility, bioavailability and toxicity of inorganic and organic contaminants in a multi-element polluted soil[J]. Environmental Pollution, 2010, 158(6): 2282–2287. DOI:10.1016/j.envpol.2010.02.003 |
| [37] | Lin Q, Chen Y X, Chen H M, et al. Chemical behavior of Cd in rice rhizosphere[J]. Chemosphere, 2003, 50(6): 755–761. DOI:10.1016/S0045-6535(02)00216-3 |
| [38] | 胡林飞. 两种基因型水稻根际微域中重金属镉形态差异及其有效性研究[D]. 杭州: 浙江大学, 2012. HU Lin-fei.Cadmium speciation and its bioavailability in the rhizosphere microzone of two rice genotypes[D].Hangzhou:Zhejiang University, 2012. |
| [39] | 刘达, 涂璐瑶, 赵小虎, 等. 镉污染土壤施硒对植物生长及根际镉化学行为的影响[J]. 环境科学学报, 2016, 36(3): 999–1005. LIU Da, TU Lu-yao, ZHAO Xiao-hu, et al. Effect of selenium application to the cadmium-polluted rhizosphere on plant growth and chemical behavior of cadmium[J]. Acta Scientiae Circumstantiae, 2016, 36(3): 999–1005. |
| [40] | Krishnamurti G S R, Cieslinski G, Huang P M, et al. Kinetics of cadmium release from soils as influenced by organic acids:Implication in cadmium availability[J]. Journal of Environmental Quality, 1997, 26(1): 271–277. |
| [41] | Cbanmugatbas P, Bollag J M. Microbial mobilization of cadmium in soil under aerobic and anaerobic conditions[J]. Journal of Environmental Quality, 1987, 16(2): 161–167. |
 2017, Vol. 36
2017, Vol. 36