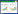文章信息
- 尹英杰, 朱司航, 徐东昊, 楚龙港, 陈冲, 赵晶晶, 商建英
- YIN Ying-jie, ZHU Si-hang, XU Dong-hao, CHU Long-gang, CHEN Chong, ZHAO Jing-jing, SHANG Jian-ying
- 生物炭和乙醇改性生物炭对铜的吸附研究
- Comparison of copper adsorption onto wheat biochar and ethanol-modified biochar
- 农业环境科学学报, 2017, 36(9): 1877-1883
- Journal of Agro-Environment Science, 2017, 36(9): 1877-1883
- http://dx.doi.org/10.11654/jaes.2017-0269
文章历史
- 收稿日期: 2017-03-03
2. 教育部植物-土壤相互作用重点实验室, 北京 100193;
3. 农业部华北耕地保育重点实验室, 北京 100193
2. Key Laboratory of Plant-Soil Interactions, Ministry of Education, Beijing 100193, China;
3. Key Laboratory of Arable Land Conservation(North China), Ministry of Agriculture, Beijing 100193, China
随着工业的发展和社会文明的进步,人类对能源的需求量不断增大,同时也对环境承载能力提出了严峻挑战[1-3]。另外,粗放型的经济增长方式,技术水平和管理水平比较落后,大量初级产品的出口,对于我国生态环境的保护产生了不利的影响[4-5]。从全国总体情况来看,我国消耗的各类非可再生资源(煤炭、石油、天然气等)高居世界前列,相应各类污染物排放量也高居世界前列。以铜污染为例,铜在自然环境中的浓度较低,在非污染自然水体中低于2 μg·kg-1,但工业排放和化石燃料燃烧使铜污染面积逐年加大,遭受城市和工业污染的地下水资源中可溶性铜浓度比背景值高出数倍,有些污染严重的河流铜浓度可高达500~2000 μg·kg-1[6]。因此,我国环境污染正在加剧,生态恶化积重难返,环境形势不容乐观[7-8]。
我国是世界秸秆生产大国,秸秆资源的开发利用不仅涉及农业生产系统中能量高效循环与农产品等物质的高效转化,也涉及到农业生态系统中环境安全、地力水平以及再生资源高效利用等可持续发展问题[9]。秸秆主要用途包括:饲料、肥料、工业原料、生物质燃料、食用菌基料、生物炭原料等[10]。秸秆等生物质在完全或部分缺氧条件下热解,除生成CO2、可燃性气体、挥发性油类和焦油类物质,还产生含碳丰富、难溶、稳定、高度芳香化的固体物质,被称为生物炭[3, 11]。生物炭具有官能团丰富、微孔结构多样、比表面积大等特性,这使其对重金属具有良好的吸附效果。
近年来,对生物炭的研究目的较为单一,仅局限于单一研究课题,例如,增加土壤碳汇和提升土壤肥力、提炼生物质燃料、吸附固定水与土壤中有机污染物、重金属污染物等[7]。通过生物质热解及其相关技术,可生产焦炭、油、合成气和H2等多种燃料,但还有相当一部分热解产物留在生物炭表面或内部[12-13]。为此,本文以小麦秸秆为原料,在300、450、600 ℃条件下制备生物炭,在此基础上使用乙醇对生物炭进行浸泡处理,提取乙醇浸泡液中的生物质油,并探究生物炭和乙醇改性生物炭对Cu2+的吸附能力,使生物炭利用率达到最大化,改善之前单一作为吸附剂使用而浪费资源的情况,为生物质资源的利用和环境污染治理提供有效措施。
1 材料与方法 1.1 生物炭的制备本实验所用小麦秸秆产自河南郑州,小麦秸秆生物炭制备采用限氧裂解法。用去离子水洗净小麦秸秆,干燥处理后将其装入直径10 cm、高15 cm的不锈钢制钢罐中压实,并以250 L·h-1的流量通入氮气,保持5 min,去除罐内的氧气。最后将小麦秸秆在限氧条件下置于马弗炉内,分别控制在300、450、600 ℃下高温加热1 h,得到三种生物炭,分别标记为WB300、WB450和WB600。制备的生物炭研磨过120目筛备用。
选取75%乙醇作为生物炭油脂提取剂,分别取一定质量的三种生物炭浸泡在75%乙醇溶液中12 h,过滤干燥后得到乙醇改性的小麦秸秆生物炭,分别标记为EWB300、EWB450和EWB600,滤液用于生物质油提取。三种生物炭干燥后研磨过120目筛备用。最后使用旋转蒸发仪,将滤液中的乙醇与油脂分离,保留并测定分离油脂的体积。
1.2 试剂与仪器三水合硝酸铜[Cu(NO3)2·3H2O,优级纯,国药集团],无磷滤纸,去离子水。
旋转蒸发仪(RE-52A,上海亚荣仪器有限公司)、调速振荡器(HY-4H,常州市凯航仪器有限公司),pH计(FE20/FG2,梅特勒-托利多仪器有限公司),分析天平(ME,梅特勒-托利多仪器有限公司)、鼓风干燥箱(DHG-9030,上海一恒仪器设备有限公司),马弗炉(SX2-2.5-10,上海景迈仪器设备有限公司),火焰原子吸收分光光度计(A3,北京普析通用仪器有限责任公司),元素分析仪(Vario MICRO,德国),接触角测量仪(JC2000C,上海中晨数字技术设备有限公司)。
1.3 乙醇提取生物炭油脂取一定量不同温度的生物炭浸泡在乙醇中,使用无磷滤纸将滤液收集在玻璃瓶中封存。RE-52A型旋转蒸发仪,温度调至40 ℃,转速调节为100 r·min-1,高效冷却器调节为-12 ℃,使乙醇与水分迅速气化,直至滤液中油脂与其他杂质完全分离为止,测定分离油脂的质量。油脂提取率按下式计算:

生物炭和乙醇改性生物炭材料接触角使用标准接触角测量仪,采用躺滴法测量。将待测固体平板放置在样品台上,调节控制滴液速率及体积,待液滴稳定后,使液滴与样品台上的待测固体触碰,此时开始采用躺滴法动态连续跟踪测量模式,测量水与生物炭之间的接触角。
1.5 吸附试验 1.5.1 吸附动力学实验准确称取Cu(NO3)2·3H2O,配制成1000 mg·L-1的Cu2+标准储备液,将其稀释成50 mg·L-1溶液进行吸附动力学实验,每组实验重复三次。将0.05 g生物炭与10 mL Cu2+稀释溶液(炭:水=1:200)共同加入到15 mL的聚乙烯离心管中,并置于25 ℃恒温振荡箱中,以150 r·min-1的速率分别振荡10、20、30 min和1、2、6、12、24、36、48、60、72、84 h,使用0.22 μm无机滤膜过滤混合液,过滤后使用A3火焰原子吸收分光光度计测定溶液中Cu2+的浓度。
分别采用一级动力学方程(1)和二级动力学方程(2)拟合实验结果:
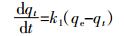 (1)
(1) 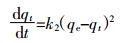 (2)
(2) 式中:t为吸附反应时间,h;qt为t时刻的吸附量,mg·kg-1;qe为达到平衡时的吸附量,mg·kg-1;k1和k2分别为一级吸附速率常数(h-1)和二级吸附速率常数(kg·mg-1·h-1)。
1.5.2 等温吸附实验以0.01 mol·L-1 NaNO3为背景电解质,将1.5.1中Cu2+标准溶液分别稀释成20、50、100、150、200、300、500 mg·L-1,并用0.01 mol·L-1 HNO3和NaOH将pH调节至(6.0±0.1)。称取0.05 g生物炭于15 mL聚乙烯离心管中,加入上述不同浓度的Cu2+稀释溶液。置于25 ℃恒温振荡箱中150 r·min-1下振荡72 h,实验重复三次。使用0.22 μm无机滤膜过滤混合液,过滤后使用A3火焰原子吸收分光光度计测定溶液中Cu2+的浓度。
采用Langmuir等温吸附模型(3)和Freundlich等温吸附模型(4)对实验结果进行拟合:
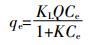 (3)
(3) 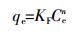 (4)
(4) 式中:qe为吸附达到平衡时的吸附量,mg·g-1;Q为吸附材料对Cu2+的最大吸附量,mg·kg-1;Ce为平衡时溶液中Cu2+的浓度,mg·L-1;KL和KF分别为Langmuir吸附平衡常数(L·mg-1)和Freundlich吸附平衡常数。
1.6 数据分析使用SPSS 20.0与Excel 2016进行数据分析,使用Sigmaplot 12.5进行模型拟合。
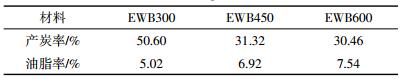
2 结果与讨论 2.1 乙醇萃取生物质油生物炭热解分为三个阶段。第一阶段:50~100 ℃,秸秆表面水分蒸发损失;第二阶段:100~350 ℃,秸秆表面官能团开始降解,并形成新的基团;第三阶段:温度高于350 ℃,作为生物炭裂解的最终阶段,表面碳骨架开始消失,产炭率也相应降低[16]。如表 1,乙醇改性生物炭在300 ℃产炭率为50.60%,处于炭裂解的第二个阶段,450、600 ℃产炭率分别是300 ℃时的61.56%和66.12%;而300、450、600 ℃产油脂率分别为5.02%、6.92%、7.54%。这表明在第三阶段炭架结构逐渐消失,秸秆裂解在前两个阶段是稳定的,这一过程含有很少水及表面官能团,在第三阶段有机官能团数量开始增多,乙醇萃取生物炭中的生物质油的数量也随之增多。这与Atkinson等[17]、何咏涛[18]的研究结果一致。
|
乙醇萃取生物炭中的油脂是经过过滤、旋转蒸发仪蒸馏作用,获得的棕黄色类似焦油的液态产物。Zheng[19]、Tsai等[20]、Williams等[21]研究表明,这种生物质油组分中几乎包括所有种类的含氧有机物,诸如醚、酯、醛、酮、酚、有机酸、醇等。
2.2 生物炭元素组成生物炭主要成分是碳、氮、氢、氧元素,同时含有钾、钙、钠、镁、硅、硫等矿质元素及其他一些元素,生物炭各组分比例与制备生物炭的材料和热解温度密切相关。由于热解过程中某些元素被浓缩和富集,生物炭的碳含量较高,一般为50%以上[22-24]。
从表 2看出,小麦生物炭和乙醇改性小麦生物炭的C含量均随制备温度的升高而增大,改性生物炭的C含量稍高于未改性生物炭。两种生物炭的O和H含量变化具有一致性,均随炭化温度升高而降低。相同热解温度,改性生物炭O含量始终小于未改性生物炭,但H含量表现为改性生物炭始终大于未改性生物炭。这是由于乙醇将含O生物质油萃取出来,而含H生物质油则不易被乙醇萃取。生物炭中N含量表现为随温度升高而降低,然而改性生物炭则表现相反,随温度升高N含量增多。
H/C与(O+N)/C原子比通常用来表征物质的芳香性和极性:H/C原子比越低,芳香性越高;(O+N)/C原子比越低,极性越弱,疏水性增强。高的O/C原子比与生物炭表面某些官能团发生氧化,与氧官能团的数量增加有关[25]。
在未改性和改性生物炭中,H/C比和(O+N)/C比都随着温度升高而减小,这是由于热解炭化过程是不饱和、芳香度低的不稳定C转变为生物炭中芳香度高、饱和度大的相对稳定C的过程,其极性减弱,疏水性增强,增大了生物炭的稳定性,而相同温度下改性生物炭比值均小于未改性生物炭,这是由于部分油脂被乙醇萃取所致。
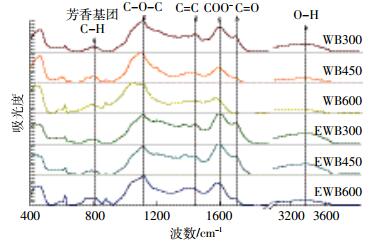
2.3 傅里叶变换红外光谱分析(FTIR)傅里叶变换红外光谱表征生物炭和乙醇改性生物炭表面的官能团种类,如图 1所示。WB组和EWB组材料官能团的特征吸收峰位置基本相同,说明其表面官能团种类大致相同,但特征吸收峰数量存在差异。通常波数755~875 cm-1附近峰为芳香基团C-H的振动所产生;波数1100 cm-1附近的吸收峰被认为是脂肪醚类的伸缩所产生的;波数1700 cm-1附近的峰为共轭酮、醌类的-C=O的伸缩产生的;通常波数3400 cm-1附近的吸收峰被认为是酚式羟基-OH伸缩振动产生的[26]。WB组和EWB组均在波数755~875、1100、1700、3400 cm-1附近有吸收峰,说明两组表面均有芳香基团、脂肪醚类、羰基、酚羟基等官能团存在。
|
| 图 1 生物炭和乙醇改性生物炭FTIR谱图 Figure 1 FTIR spectra of WBs and EWBs at different temperatures |
对比不同温度下WB组和EWB组FTIR谱图可以看出,各官能团特征峰高低具有明显差异,随温度升高,WB组和EWB组中羟基含量均降低,并且相同温度条件下EWB组羟基含量高于WB组。在吸附Cu2+过程中,会增强EWB组离子交换能力[3, 27];两组生物炭表面的脂肪醚类、共轭酮、醌类的官能团和芳香性化合物的振动峰变化也十分明显,同温度间表现为EWB组振动峰强于WB组,说明EWB组生物炭具有高度芳香化结构,其具有含氧官能团提供的π电子,在吸附Cu2+时形成更稳定的结构[28]。
2.4 生物炭与水的接触角接触角可以用来描述液体与固体的润湿状态,接触角越小表示液体在固体表面的铺展越好。因此,液滴在生物炭表面的接触角越小,液滴与生物炭的接触面积越大,铺展效果越好。图 2为生物炭和乙醇改性生物炭分别在300、450、600 ℃下与超纯水之间的接触角。不同温度间未改性生物炭与水之间的接触角范围在89.3°~122.6°间,而乙醇改性生物炭与水之间的接触角降低到68.7°~96.0°之间。这说明改性生物炭的亲水性明显高于未改性生物炭,其原因是由乙醇改性的生物炭中具有疏水基团的物质被提取所致。在实际应用中,改性生物炭可减少在土壤中生物炭的淋洗过程,充分与土壤接触以除去土壤中的污染物。
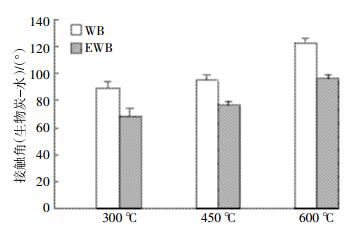
|
| 图 2 生物炭和乙醇改性生物炭与超纯水瞬间接触角 Figure 2 The instantaneous contact angles between WBs and EWBs in ultra-pure water |
图 3为生物炭与乙醇改性生物炭对溶液中Cu2+的吸附量随时间的变化曲线,显示生物炭和其改性材料对吸附速率的变化和吸附快慢程度。EWB组与WB组生物炭均在30 h左右达到吸附平衡。在前10 h,所有材料均表现出较快的吸附速率,在接近平衡前吸附速率逐渐降低,直至平衡。从图 3可以看出,EWB组低温生物炭比WB组更快达到吸附平衡,而这种差异随着裂解温度的升高而逐渐缩小。
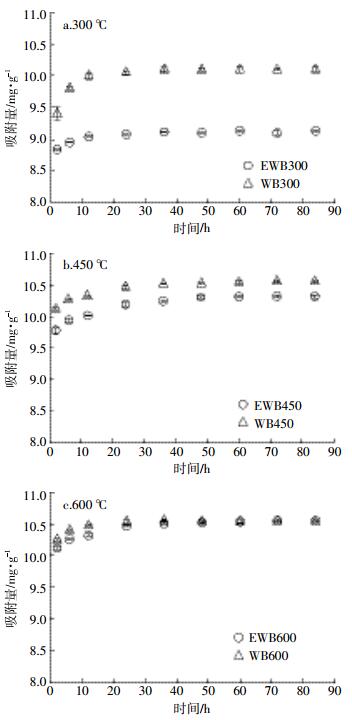
|
| 图 3 生物炭和乙醇改性生物炭对Cu2+的吸附量与时间之间的关系 Figure 3 Kinetics curve of Cu2+ adsorption on different WBs and EWBs |
采用一级动力学模型和二级动力学模型对吸附结果进行线性拟合,结果见表 3。WB组系列生物炭中二级动力学模型拟合结果较好,拟合系数R2均大于0.95,一级动力学方程对WB组和EWB组模拟结果均较差。
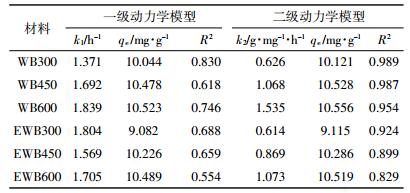
|
二级动力学模型拟合得到的吸附速率常数k2可以反映吸附过程的快慢,动力学速率常数值越大,表明吸附过程进行得越快,达到平衡所需时间越短。从表 3可知,WB组中生物炭对Cu2+吸附速率依次为WB600>WB450>WB300;在EWB组中为EWB600>EWB450>EWB300。其中WB600对Cu2+的吸附速率常数是EWB组的1.4~2.5倍。改性后的小麦秸秆生物炭Cu2+平衡吸附量比改性前减少0.35%,且二者的差值随着裂解温度的减小而增大,说明裂解温度越高,乙醇改性对生物炭的平衡吸附量的减幅越小。
2.6 吸附平衡实验图 4为生物炭和乙醇改性生物炭对Cu2+的吸附量随溶液平衡浓度的变化曲线。当Cu2+的平衡浓度小于200 mg·L-1时,生物炭和乙醇改性生物炭对Cu2+的吸附量随Cu2+的平衡浓度增加急剧增加;而当Cu2+的平衡浓度大于200 mg·L-1时,吸附量趋于平衡。相同热解温度得到的碳基材料比较,生物炭比乙醇改性生物炭在对Cu2+的吸附中,更快达到平衡浓度;不同热解温度得到的碳基材料比较,低温比高温,生物炭和乙醇改性生物炭更易达到吸附平衡。
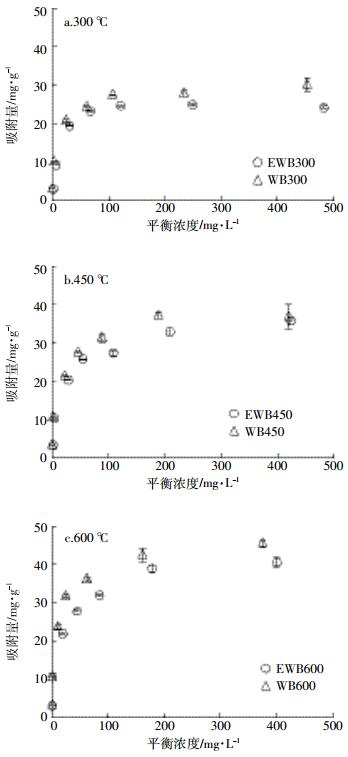
|
| 图 4 生物炭和乙醇改性生物炭对Cu2+吸附量与平衡浓度之间的关系 Figure 4 Adsorption isotherm of Cu2+ on WB and EWB |
采用Langmuir等温吸附模型和Freundlich等温吸附模型对吸附等温实验结果进行拟合,以期说明生物炭和乙醇改性生物炭对溶液中Cu2+的吸附机制,拟合结果及相关参数见表 4。生物炭和乙醇改性生物炭对Cu2+的吸附更符合Langmuir模型。WB600对Cu2+吸附最大量为44.3 mg·g-1,EWB600达到最大吸附量为41.7 mg·g-1,不同温度下,乙醇改性生物炭比生物炭对Cu2+的吸附量减少6.24%~11.21%,说明生物炭经乙醇改性后,仍然保持原生物炭90%左右的Cu2+吸附效率。EWB组与WB组均表现出,随裂解温度增加对Cu2+的最大吸附量增加的趋势。
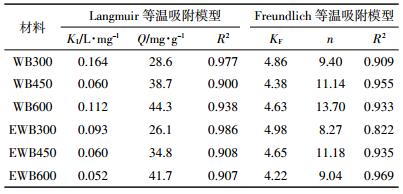
|
(1)对限氧裂解法制得的生物炭,进行油脂浸提、元素分析,发现乙醇改性生物炭600 ℃产炭率最低,但产油率最高。不同温度两种生物炭C含量表现为EWB组高于WB组0.73%~0.85%。
(2)不同温度制备的生物炭与水的接触角范围在122.6°~89.3°之间,而经过乙醇处理的生物炭与水的接触角范围在96.0°~68.7°之间,经乙醇处理的生物炭亲水性明显高于未经处理的生物炭。
(3)二级动力学和Langmuir等温吸附方程能够很好地描述生物炭和乙醇改性生物炭对Cu2+的吸附过程,WB组吸附速率常数大于EWB组。EWB组低温生物炭比WB组更快达到吸附平衡,这种差异随裂解温度升高而逐渐减小。WB组Cu2+最大吸附量高于EWB组。乙醇改性生物炭在提取生物质油基础上,还可以有90%左右的重金属去除率。
| [1] |
王利. 能源法的功能及其保障策略研究[D]. 武汉: 武汉大学, 2010. WANG Li. Studies of the functions of energy law and its safeguards[D]. Wuhan:Wuhan University, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10486-2010166879.htm |
| [2] |
沈志远. 生物质能源利用的新探索[D]. 南京: 南京林业大学, 2006. SHEN Zhi-yuan. The new that matter sources of energy makes use of probes a life[D]. Nanjing:Nanjing Forestry University, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10298-2007204459.htm |
| [3] |
李力, 陆宇超, 刘娅, 等. 玉米秸秆生物炭对Cd2+的吸附机理研究[J]. 农业环境科学学报, 2012, 31(11): 2277-2283. LI Li, LU Yu-chao, LIU Ya, et al. Adsorption mechanisms of Ca2+ on biochars derived from corn straw[J]. Journal of Agro-Environment Science, 2012, 31(11): 2277-2283. |
| [4] |
China environmental status bulletin 2015[J]. Environmental Protection, 2016, 44(11): 43-51. DOI:10.3969/j.issn.1673-2251.2016.11.042 |
| [5] |
何飞飞, 荣湘民, 梁运姗, 等. 生物炭对红壤菜田土理化性质和N2O、CO2排放的影响[J]. 农业环境科学学报, 2013, 32(9): 1893-1900. HE Fei-fei, RONG Xiang-min, LIANG Yun-shan, et al. Effects of biochar on soil physichemical properties and N2O, CO2 emissions from vegetable-planting red soil[J]. Journal of Agro-Environment Science, 2013, 32(9): 1893-1900. DOI:10.11654/jaes.2013.09.027 |
| [6] |
毕润成. 土壤污染物概论[M]. 北京: 科学出版社, 2014, 106. BI Run-cheng. Soil contaminants introduction[M]. Beijing: Science Press, 2014, 106. |
| [7] |
李宗云. 中国多元参与式生态文明建设机制研究[D]. 西安: 长安大学, 2009. LI Zong-yun. Research on the constructional mechanism of China's diversified participation on ecological civilization[D]. Xi'an:Chang'an University, 2009. http://cdmd.cnki.com.cn/Article/CDMD-11941-2009211061.htm |
| [8] |
龚维婷. 生物质微波热解制取高附加值产品的实验研究[D]. 武汉: 华中科技大学, 2011. GONG Wei-ting. A thesis submitted in partial of fulfillment of the requirements for the degree of master of engineering[D]. Wuhan:Huazhong University of Science and Technology, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10487-1012012038.htm |
| [9] |
孙挺. 基于农业生物质利用下的土地潜力分析[D]. 乌鲁木齐: 新疆农业大学, 2013. SUN Ting. Analysis of the potential of land based on the using of agricultural biomass:A case study of Hutubi County[D]. Urumqi:Xinjiang Agricultural University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10758-1013307493.htm |
| [10] |
赵文峰. 微波法制备秸秆活性炭及其对甲苯吸附性能的研究[D]. 西安: 西安建筑科技大学, 2013. ZHAO Wen-feng. Microwave prepared straw activated carbon and its impact on toluene adsorption[D]. Xi'an:Xi'an University of Architecture and Technology, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10703-1014010994.htm |
| [11] |
李瑞月, 陈德, 李恋卿, 等. 不同作物秸秆生物炭对溶液中Pb2+、Cd2+的吸附[J]. 农业环境科学学报, 2015, 34(5): 1001-1008. LI Rui-yue, CHEN De, LI Lian-qing, et al. Adsorption of Pb2+ and Cd2+ in aqueous solution by biochars derived from different crop residues[J]. Journal of Agro-Environment Science, 2015, 34(5): 1001-1008. DOI:10.11654/jaes.2015.05.025 |
| [12] |
徐楠楠, 林大松, 徐应明, 等. 玉米秸秆生物炭对Cd2+的吸附特性及影响因素[J]. 农业环境科学学报, 2014, 33(5): 958-964. XU Nan-nan, LIN Da-song, XU Ying-ming, et al. Adsorption of aquatic Cd2+ by biochar obtained from corn stover[J]. Journal of Agro-Environment Science, 2014, 33(5): 958-964. DOI:10.11654/jaes.2014.05.019 |
| [13] |
夏广洁, 宋萍, 邱宇平. 牛粪源和木源生物炭对Pb2+和Cd2+的吸附机理研究[J]. 农业环境科学学报, 2014, 33(3): 569-575. XIA Guang-jie, SONG Ping, QIU Yu-ping. Adsorption of Pb2+ and Cd2+ from aqueous solution using vermicompost derived from cow manure and its biochar[J]. Journal of Agro-Environment Science, 2014, 33(3): 569-575. DOI:10.11654/jaes.2014.03.025 |
| [16] |
Zhang M, Gao B, Yao Y, et al. Synthesis, characterization, and environmental implications of graphene-coated biochar[J]. Science of the Total Environment, 2012, 435. |
| [17] |
Atkinson C J, Fitzgerald J D, Hipps N A. Potential mechanisms for achieving agricultural benefits from biochar application to temperate soils:A review[J]. Plant and Soil, 2010, 337(1/2): 1-18. |
| [18] |
何咏涛. 利用农林废弃物联产生物油和生物炭[D]. 杭州: 浙江工业大学, 2012. HE Yong-tao. Co-production of activated carbon and bio-oil from agricultural and forestry residues[D]. Hangzhou:Zhejiang University of Technology, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10337-1012513030.htm |
| [19] |
Zheng J L. Bio-oil from fast pyrolysis of rice husk:Yields and related properties and improvement of the pyrolysis system[J]. Journal of Analytical and Applied Pyrolysis, 2007, 80(1): 30-35. DOI:10.1016/j.jaap.2006.12.030 |
| [20] |
Tsai W T, Lee M K, Chang Y M. Fast pyrolysis of rice husk:Product yields and compositions[J]. Bioresource Technology, 2007, 98(1): 22-28. DOI:10.1016/j.biortech.2005.12.005 |
| [21] |
Williams P T, Horne P A. Analysis of aromatic-hydrocarbons in pyrolytic oil derived from biomass[J]. Journal of Analytical and Applied Pyrolysis, 1995, 31: 15-37. DOI:10.1016/0165-2370(94)00814-H |
| [22] |
刘玉学, 刘微, 吴伟祥, 等. 土壤生物质炭环境行为与环境效应[J]. 应用生态学报, 2009, 20(4): 977-982. LIU Yu-xue, LIU Wei, WU Wei-xiang, et al. Environmental behavior and effect of biomass derived black carbon in soil:A review[J]. Chinese Journal of Applied Ecology, 2009, 20(4): 977-982. |
| [23] |
刘宁. 生物炭的理化性质及其在农业中应用的基础研究[D]. 沈阳: 沈阳农业大学, 2014. LIU Ning. The basic research of physicochemical properties of biochar and its application in agriculture[D]. Shenyang:Shenyang Agricultural University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10157-1016188263.htm |
| [24] |
Ahmad M, Rajapaksha A U, Lim J E, et al. Biochar as a sorbent for contaminant management in soil and water:A review[J]. Chemosphere, 2014, 99: 19-33. DOI:10.1016/j.chemosphere.2013.10.071 |
| [25] |
王定美, 王跃强, 余震, 等. 污泥与稻秆共热解对生物炭中碳氮固定的协同作用[J]. 环境科学学报, 2015, 35(7): 2202-2209. WANG Ding-mei, WANG Yue-qiang, YU Zhen, et al. Synergistic effect on carbon and nitrogen fixation of biochar during co-pyrolysis of sewage sludge and rice straw[J]. Acta Scientiae Circumstantiae, 2015, 35(7): 2202-2209. |
| [26] |
蒋旭涛, 迟杰. 铁改性生物炭对磷的吸附及磷形态的变化特征[J]. 农业环境科学学报, 2014, 33(9): 1817-1822. JIANG Xu-tao, CHI Jie. Phosphorus adsorption by and forms in Fe-modified biochar[J]. Journal of Agro-Environment Science, 2014, 33(9): 1817-1822. DOI:10.11654/jaes.2014.09.020 |
| [27] |
谢超然, 王兆炜, 朱俊民, 等. 核桃青皮生物炭对重金属铅、铜的吸附特性研究[J]. 环境科学学报, 2016, 36(4): 1190-1198. XIE Chao-ran, WANG Zhao-wei, ZHU Jun-min, et al. Adsorption of lead and copper from aqueous solutions on biochar produced from walnut green husk[J]. Acta Scientiae Circumstantiae, 2016, 36(4): 1190-1198. |
| [28] |
陈再明, 陈宝梁, 周丹丹. 水稻秸秆生物炭的结构特征及其对有机污染物的吸附性能[J]. 环境科学学报, 2013, 33(1): 9-19. CHEN Zai-ming, CHEN Bao-liang, ZHOU Dan-dan. Composition and sorption properties of rice-straw derived biochars[J]. Acta Scientiae Circumstantiae, 2013, 33(1): 9-19. DOI:10.11654/jaes.2013.01.002 |
| [29] |
谢晓梅, 廖敏, 华嘉媛, 等. 发酵稻壳对亚铁离子和硫离子的吸附-解吸附特性[J]. 环境科学, 2015, 36(10): 3896-3905. XIE Xiao-mei, LIAO Min, HUA Jia-yuan, et al. Adsorption-desorption characteristics of fermented rice husk for ferrous and sulfur ions[J]. Environmental Science, 2015, 36(10): 3896-3905. |
| [30] |
聂强. 类质同晶甾体化合物的分离过程研究[D]. 天津: 天津大学, 2007. NIE Qiang. Study on the separation and purification of two isomorphic steroids[D]. Tianjin:Tianjin University, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10056-2008181821.htm |
 2017, Vol. 36
2017, Vol. 36