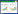文章信息
- 靳红梅, 许彩云, 黄红英, 徐跃定
- JIN Hong-mei, XU Cai-yun, HUANG Hong-ying, XU Yue-ding
- 猪粪中温厌氧消化中磺胺类抗生素的降解和吸附特征
- The degradation and adsorption of sulfonamides in mesophilic anaerobic digestion of swine manure
- 农业环境科学学报, 2017, 36(9): 1884-1892
- Journal of Agro-Environment Science, 2017, 36(9): 1884-1892
- http://dx.doi.org/10.11654/jaes.2017-0296
文章历史
- 收稿日期: 2017-03-07
2. 农业部农村可再生能源开发利用华东科学观测实验站, 南京 210014;
3. 南京农业大学资源与环境科学学院, 南京 210095
2. East China Scientific Observing and Experimental Station of Development and Utilization of Rural Renewable Energy, Ministry of Agriculture, Nanjing 210014, China;
3. College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095, China
磺胺类抗生素(SAs)是目前世界范围内使用量最大的兽用抗生素之一[1],但其在动物肠道的吸收率较低,30%~90%的SAs随动物排泄物进入环境[2],对土壤、生物、产品品质及人类健康造成巨大威胁[3-5],成为近年来国内外研究的热点。
畜禽养殖场粪污是环境中SAs最主要的来源之一,规模养殖场粪污(特别是废水)无害化处理已成为养殖污染防治的重点[6]。沼气工程(厌氧消化工艺)是规模养殖场废水处理的有效途径,在循环农业中发挥着重要的纽带作用[7]。然而,与好氧处理相比[8],厌氧消化处理对抗生素的去除率普遍偏低[9-11]。例如,Yin等[11]对污泥处理过程中磺胺甲嘧啶(SMN)的降解分析发现,好氧条件下SMN几乎全部降解,而厌氧条件下SMN的降解率只有18%;Mohring等[9]通过34 d中温厌氧消化试验发现,猪粪中的磺胺甲氧哒嗪(SMDP)去除率只有70%;许彩云等[10]利用全混合式厌氧反应器(CSTR)对猪粪中磺胺嘧啶(SDZ)、磺胺二甲嘧啶(SM2)和磺胺氯哒嗪(SCP)的去除率研究后发现,仍有约30%的SCP残留在沼液和沼渣中;本研究室对某规模猪场污染物排放长期监测结果显示,实际沼气工程对SDZ和SM2的去除率分别仅为18%和62%[12]。可见,畜禽粪便中的SAs经厌氧消化并不能被完全去除,沼液和沼渣中仍残留大量的SAs[13-15],直接还田利用会造成二次污染。但传统的养殖场废水处理工艺(如厌氧消化)仅关注化学需氧量(COD)、氮、磷等的去除,对抗生素等有害物质的降解规律关注较少[16]。
目前研究普遍认为,厌氧条件下抗生素去除的途径有降解、吸附、挥发和水解[11, 17-19],其中降解和吸附是废水厌氧消化过程中抗生素去除的最主要途径[19-20]。已有相关研究主要集中在活性污泥法处理废水等领域,在此体系中SAs等抗生素可能发生快速吸附作用而固定在固相中,但这并不是真正的去除[11]。Ben等[18]研究发现,SM2在活性污泥中的吸附是一个快速的过程,6 h后可达到平衡。一些研究认为,SAs的吸附作用在废水处理过程中占主导地位。例如,Oliveira等[14]将活性污泥经6 d中温厌氧消化后发现,吸附作用占SM2总去除量的比例高达60.0%;Li等[21]研究也表明,磺胺甲恶唑(SMX)在咸水和淡水污泥中的吸附作用分别占其总去除量的22.6%和39.1%。尽管吸附作用可大幅降低SAs在液相中的含量,但会造成SAs在沼渣中的大量累积[13, 18]。Jin等[13]对猪粪中温厌氧消化后发现,吸附在沼渣中的SDZ、SM2和SCP是沼液中的几十至几百倍。但也有研究认为,生物降解作用在SAs的去除中占主导地位。例如,Yang[22]等研究发现,吸附作用对SMX、磺胺莫托辛(SMM)、磺胺地索辛(SDM)的去除率不足20.0%,而生物降解作用所占比例分别为93.5%、89.0%和81.0%。通常情况下,微生物不能从抗生素降解转化过程中获得维持生长的碳源(或能源),而只能在对其他易利用有机物降解转化过程中对抗生素进行异化作用,即发生“共代谢作用”[23]。因此,厌氧微生物对有机物的分解作用是SAs降解的主要驱动力[24],影响有机物降解的因子均可影响SAs的降解,如可溶性COD(SCOD)、混合悬浮物固体(MLSS)、温度、氧化还原电位等[25-26]。
我国是生猪养殖大国[27],规模养殖比重已接近50%,且逐年增加。规模猪场废水和粪便中SDZ和SM2均有较高的残留量和检出率[28]。沼气工程基本成为我国规模猪场的“标配”,但厌氧消化工艺对粪污中SAs的吸附作用和生物降解缺少深入研究,制约了猪场粪污中抗生素在厌氧生物处理系统中迁移转化规律的研究和强化去除方法的开发。基于此,本研究采用室内批次厌氧发酵试验方法,探讨猪粪中SDZ和SM2在中温(37±1)℃厌氧消化条件下的生物降解和吸附规律,以期为畜禽粪污厌氧消化残留物中抗生素的高效去除提供理论支撑。
1 材料与方法 1.1 试验材料发酵原料为猪粪,取自江苏省南京市某规模生猪养殖场,一次性取样混匀后,0~4 ℃冷藏备用。猪粪总固体(TS)、挥发性固体(VS)、总氮(TN)、总磷(TP)、总有机碳(TOC)含量分别为24.5%、75.4%、2.20%、2.60%和38.6%;SDZ和SM2未检出(检测限为0.03 ng·L-1)。接种物为江苏省金坛市某生猪养殖场大型沼气工程(采用CSTR发酵工艺)的厌氧消化污泥,TS为2.20%,VS为70.18%,SDZ和SM2检出浓度分别为3.96、0.64 μg·L-1;使用前添加蔗糖在(37±1)℃条件下避光驯化至甲烷含量在50%以上。
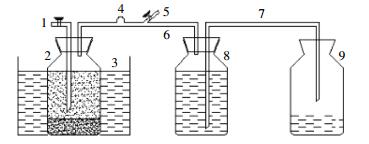
1.2 试验方法 1.2.1 试验装置试验装置采用自制的棕色玻璃反应器(图 1)。发酵罐总容积1.0 L,有效容积800 mL,顶部设有取样口和气体出口。整个试验期间发酵罐需置于恒温水浴锅(HH-4,金坛市科兴仪器厂)中,以确保发酵罐内温度维持在(37±1)℃。
|
| 1.取样口;2.发酵罐;3.水浴锅;4.取气口;5.排气口;6.导气管;7.导水管;8.集气瓶;9.集水瓶 图 1 厌氧消化装置示意图 Figure 1 Schematic diagram of anaerobic reactor |
试验采用批次发酵方式。本研究中厌氧消化发生在避光条件下,光解对抗生素的去除有限,因此假设此过程中抗生素的去除途径主要有吸附作用(A)、生物降解作用(B)和水解作用(H)。试验设7个处理组(表 1):T1~T3为厌氧消化处理组,T4~T7为添加NaN3抑制生物活性的处理组。T1为正常厌氧消化的对照处理;T2和T3处理组中,SDZ和SM2的所有去除途径均存在;T4和T5处理组中没有微生物作用,SDZ和SM2的去除途径只有A和H;T6和T7处理组中没有固体,且微生物作用也被抑制,SDZ和SM2的去除途径只有H。每个处理组设两个平行(n=2)。由此,计算SDZ和SM2的生物降解量和污泥吸附量分别为:
SDZ:生物降解量=T2-T4;污泥吸附量=T4-T6
SM2:生物降解量=T3-T5;污泥吸附量=T5-T7
1.2.3 运行方法T1~T5处理组分别在发酵罐中加入猪粪116.0 g(折合干物质28.5 g),接种驯化污泥20%(V/V),加水至800 mL,此时TS负荷为4.0%。其中:T2和T3处理组中分别加入SDZ和SM2(纯度98.0%,购自加拿大多伦多研究化学品公司),使其在系统中的浓度为20 mg·L-1;T4和T5处理组中,除了SDZ和SM2外还加入NaN3溶液,浓度为0.1%(W/V)。T6和T7处理组仅在发酵罐中加入抗生素溶液和NaN3(添加量同以上处理组),加水至800 mL。混匀后加盖密封,试验开始时向反应器内充氮气2 min,以驱赶反应器内的空气。
试验开始后的0、1、2、4、6、12、24 h和2、4、6、8、10、15、20、25 d,分别在每个发酵罐中取样2.0 mL,固液分离(10 000 r·min-1,10 min)后,测定液体中抗生素残留量、pH和SCOD;每4 d取样4.0 mL,测定COD和总挥发性脂肪酸(VFAs)等理化指标。试验结束后,测定T3~T7处理组发酵残留物的总重及固体干重,以计算厌氧发酵前后物料损失率,并分析测定T3~T6沼渣中SDZ和SM2浓度。每天监测系统总产气量及甲烷(CH4)含量,确保反应正常进行。
1.3 测定方法基本理化指标测定:(1)TS采用105 ℃烘24 h,差重法测定[29];(2)VS采用550 ℃马弗炉灼烧4 h,差重法测定[29];(3)日产气量采用排水法测定[17];(4)甲烷采用GC9890A/T气相色谱仪(TCD检测器)分析,检测器温度120 ℃,进样器为平面流通阀,分析柱为TDC-01Ф4×1 m,柱箱温度100 ℃,载气为高纯氢气,50 mL·min-1,定量管1 mL,标准气体为氮气(含42.4% CH4+28.4% CO2),分析方法为外标法;(5)消化液的pH采用玻璃电极法(GB 6920—1986),COD和SCOD采用重铬酸钾氧化法(GB 11914—1989),VFAs采用气相色谱仪(GC-2014,日本岛津)测定。
SDZ和SM2含量测定采用超高效液相色谱/串联质谱法(HPLC-MS)[30]。
样品提取和净化方法:消化液经0.45 μm玻璃纤维滤膜过滤,取1.5 mL滤液加入10 μL内标(磺胺二甲嘧啶-d6,98.0%,购自加拿大多伦多研究化学品公司)以及0.4 g乙二胺四乙酸(EDTA),并立即储存在4 ℃条件下。用甲酸调节提取液pH值至2.0~3.0,过经过活化的亲水亲油平衡(HLB)固相萃取柱,控制流速为3~5 mL·min-1。之后用超纯水冲洗HLB柱,抽真空以去除柱中残留水分并在氮气保护下干燥10 min。最后以2 mL甲醇洗脱3次,收集洗脱液,并在室温下用氮气吹至近干,用乙腈和0.2%甲酸(V:V=1:9)混合液定容至1 mL,涡旋振荡2~3 min,18 000 r·min-1离心10 min(德国Eppendorf冷冻离心机5804R,离心半径11.2 cm),取上清液冷藏待测。详细步骤参照文献[30]。采用ACQUITYTM超高效液相色谱仪-Quattro Premier XE质谱仪(美国Waters公司),配MassLynx V4.1软件Waters Acquity和UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),测定上清液中抗生素含量。
MS检测条件:采用电喷雾离子源(ESI),离子源温度120 ℃,脱溶剂温度380 ℃,脱溶剂气和锥孔气为氮气,脱溶剂气流速500 L·h-1,锥孔气流速50 L·h-1,碰撞气为高纯氩气,采用多反应监测模式(MRM)检测。ESI-MS/MS选择性反应正离子检测,进样量5 μL,检测离子和各子离子碰撞能量详见文献[30]。
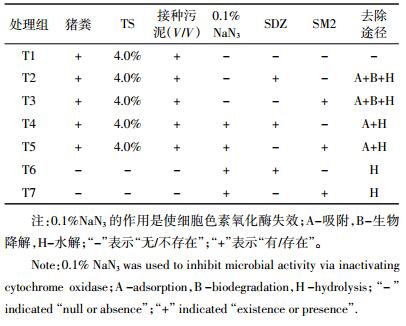
HPLC检测条件:柱温35 ℃,流动相为乙腈(A)和0.2%甲酸(B),流速0.3 mL·min-1,测定时采用的流动相梯度详见表 2。
1.4 数据分析发酵体系中固体对SDZ或SM2的吸附量可由公式(1)进行计算:
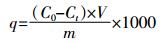 (1)
(1) 式中:q为固相中吸附浓度,μg·g-1;C0为初始时液相中SDZ或SM2浓度,mg·L-1;Ct为t时刻液相中SDZ或SM2浓度,mg·L-1;V为发酵液体积,L;m为发酵物料干重,g;1000为单位转换系数。
发酵液中SAs残留量由一级动力学模型(公式2)进行拟合:
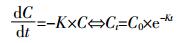 (2)
(2) 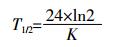 (3)
(3) 式中:C0为初始时液相中SDZ或SM2含量,mg;K为一级速率常数,h-1;Ct为t时刻液相中SDZ或SM2含量,mg;T1/2为降解半衰期,d;ln2为一级反应半衰期常数。
数据统计分析采用SPSS 19.0软件,数据拟合采用Origin 8.0绘图软件。
2 结果与讨论 2.1 产气特性厌氧消化过程中的产气特性如图 2所示。可以看出,添加抗生素后厌氧消化的产气高峰有明显的延滞(图 2a)。对照(T1)启动较快,在第13 d即达到产气峰值45.76 mL·g-1 VS·d-1,随后逐步下降,至第22 d结束产气;添加SDZ(T2)和SM2(T3)后系统的启动较慢,分别在第21、20 d达到产气峰值(32.12、31.29 mL·g-1 VS·d-1)。但从累积产气量上看(图 2b),添加抗生素的处理与正常厌氧消化的处理最终产气量基本一致,分别为355.6 mL·g-1 VS(T1)、366.7 mL·g-1 VS(T2)和368.5、mL·g-1 VS(T3)。同时,各处理甲烷含量在运行稳定后基本保持在正常范围(55%~72%)内(图 2c)。这表明,在抗生素添加浓度为20 mg·L-1下,尽管发酵初期微生物活动受到较明显抑制作用,但随后很快适应并恢复,使厌氧消化正常进行,与之前的研究较为一致[15]。其他添加NaN3的处理,未有气体产生(未列出),说明系统中的微生物活性受到抑制。

|
| 处理编号同表 1,下同 Treatment codes were listed in Table 1. The same fellow 图 2 厌氧消化过程中日产气量(a)、累积产气量(b)和甲烷比例(c) Figure 2 Daily biogas productivity (a),accumulative biogas production (b)and methane content (c)during anaerobic digestion of swine manure |
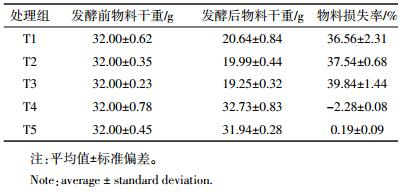
厌氧消化前后总固体含量变化如表 3所示。整个厌氧消化过程中TS损失率在37%左右,且T1~T3处理间无显著差异,与总产气量结果一致。T4和T5处理中添加了NaN3,微生物未能对有机物进行降解,因此TS未有损失。
|
厌氧消化过程中发酵液COD、SCOD和VFAs如图 3所示。COD、SCOD和VFA是反映厌氧消化系统运行和微生物菌群活性的重要参数,对SAs的生物降解和吸附起着重要的作用[29]。一般认为,COD和SCOD与抗生素发生共代谢作用而间接异化抗生素,或发生络合作用影响抗生素的迁移性及其生物利用性[23];VFAs则可通过影响微生物菌群结构间接影响抗生素的生物降解。随着有机物被厌氧微生物降解,发酵液中COD、SCOD和VFAs浓度逐渐降低,但处理间差异不显著。COD和SCOD降解率大致相同,分别达到60.0%和65.0%以上。
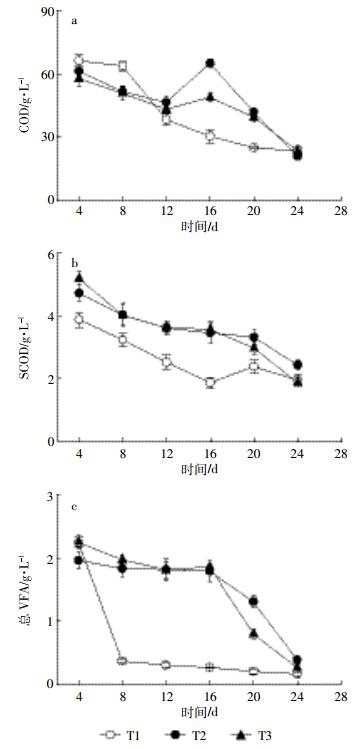
|
| 图 3 厌氧消化过程中消化液COD(a)、SCOD(b)和总VFA(c)浓度 Figure 3 Concentrations of COD (a), SCOD (b)and total VFAs (c) in liquid digestates of different treatments |
厌氧消化过程中消化液的SDZ和SM2浓度变化如图 4所示。可以看出,仅有水解发生的处理中,消化液中抗生素的浓度无明显变化,即SDZ和SM2基本保持在19.64~20.0 mg·L-1(图 4a)和19.71~20.0 mg·L-1(图 4b)范围内。可见,在猪粪中温厌氧消化过程中,抗生素的水解作用极小,与先前的报道一致[18]。在吸附和水解并存的处理中,消化液中抗生素的浓度在12 h内明显降低,随后SDZ和SM2基本保持在19.0 mg·L-1(图 4a)和18.0 mg·L-1(图 4b)左右。由于厌氧环境中抗生素的水解作用基本可忽略不计,消化液中SDZ和SM2浓度的降低主要是由吸附作用造成的,且发生的速度较快(12 h内),与Yin等[11]的研究结果一致。在正常中温厌氧消化过程中,消化液中的SDZ和SM2浓度均有大幅降低,发酵结束时消化液中SDZ和SM2残留浓度分别为11.78 mg·L-1和6.60 mg·L-1。这表明,生物降解作用在SDZ和SM2去除中起重要作用,特别是在发酵12 h后,生物降解作用基本占主导地位。
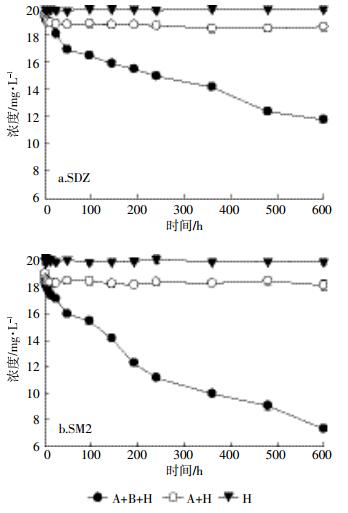
|
| 图 4 厌氧消化过程中消化液的SDZ和SM2浓度变化 Figure 4 Changes of SDZ and SM2 concentrations in liquid digestates during anaerobic digestion of swine manure |
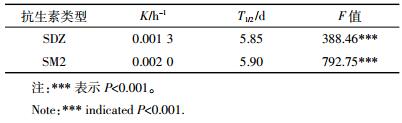
根据厌氧消化过程中物料体积和质量变化,计算得到SDZ和SM2的总去除量(图 5)。厌氧消化结束时,系统中SDZ、SM2的总去除量分别为1.76、2.22 mg,去除率分别为58.7%和74.0%,低于前期CSTR工艺对SAs的去除率(>90%)。除了厌氧消化工艺的影响外,也可能是由于本研究中抗生素添加浓度(20 mg·L-1)远高于之前的研究(10 μg·L-1)造成的。中温厌氧消化条件下,猪粪中SDZ和SM2的去除符合一级动力学模型,拟合曲线修正R2值均大于0.90(图 5)。这与活性污泥条件下抗生素的降解特征一致[8, 11, 18-19]。由模型所得的一级降解动力学参数如表 4所示。SDZ和SM2的降解半衰期分别为5.85、5.90 d,明显快于贫养水体中降解速率[31]。这主要是由于猪粪厌氧消化体系中,微生物活性远高于贫养系统,以至对抗生素的共代谢作用更强。
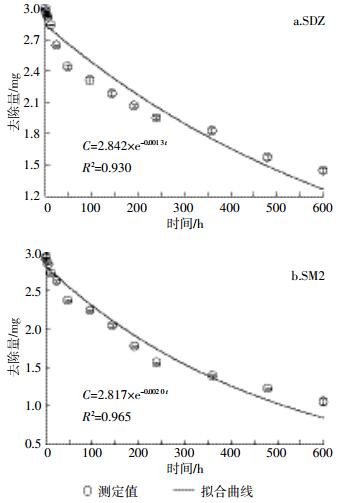
|
| 图 5 猪粪中温厌氧消化中SDZ和SM2去除动力学曲线 Figure 5 Removal dynamics of SDZ and SM2 during anaerobic digestion of swine manure |
|
水解、吸附及生物降解作用下SDZ和SM2的去除量如图 6所示。水解作用导致的SDZ和SM2去除量分别仅为0.01、0.04 mg,为总去除量的5%左右;吸附作用在厌氧消化前期(12 h内)对SDZ和SM2的去除起主要作用,去除量分别为0.16、0.25 mg(图 6a、图 6b),约在总去除量的60%以上;而随后(12 h后)生物降解作用在SDZ和SM2的去除中起关键作用,去除量分别为1.56、1.83 mg,最终去除率占总去除量的80%以上(图 6c、图 6d)。可见,生物降解和吸附作用在SDZ和SM2的去除过程中占绝对的优势,与其他研究结果相似[17-19]。同时发现,厌氧条件下SAs可能先发生快速吸附作用而固定在固相中,进而发生较为缓慢的生物降解[11, 18]。这主要是由于发酵前期,猪粪发酵液中以未溶解的有机物(如蛋白质和脂质等)居多[29],这些有机物中的羧基和酚羟基可以作为交换位点与SAs互换,或与SAs中的胺基形成氢键而吸附[18]。此外,猪粪中大量的金属离子(如Al3+、Zn2+、Cu2+、Fe3+和As3+等)在一定程度上与带负电荷的SAs产生静电引力,会强化固体对SAs的吸附作用[32],随着厌氧微生物对有机物的分解,SAs的吸附位点减少,同时与有机物发生共代谢作用,进而加速降解去除。
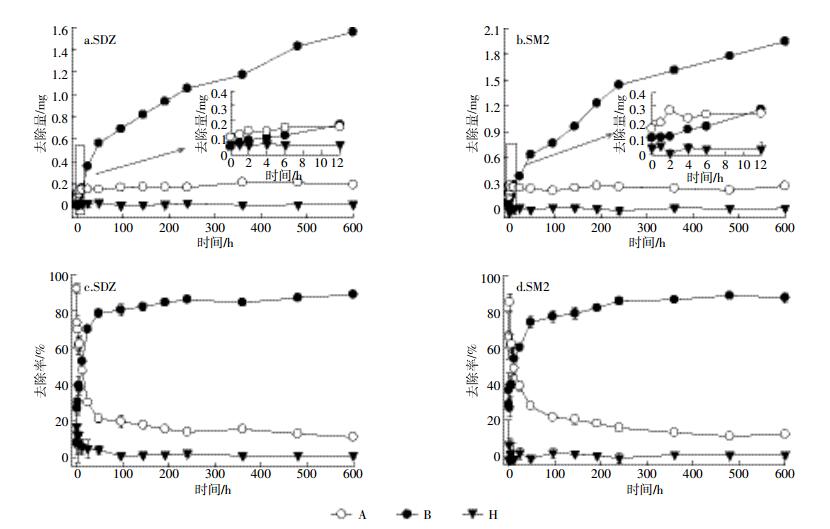
|
| 图 6 各去除途径下SDZ和SM2的去除量(a,b)及其去除率(c,d) Figure 6 Removal amounts (a, b)and rates (c, d)of SDZ and SM2 at different pathways (degradation, adsorption and hydrolysis) during anaerobic digestion of swine manure |
对于SDZ和SM2这两种SAs而言,其去除量及去除途径基本相似,SDZ和SM2在沼液中的总量分别占总残留量的95%和92%,与Ben等[17]调查的化粪池中猪粪废水固液相中SAs的分配比例基本一致。但SM2的吸附去除作用更大,主要原因是SM2的酸度系数(pKa 7.49)高于SDZ(pKa 6.40),在消化条件(发酵液pH为7.3~7.8)下以中性分子和阴离子为主,更易于与有机物或金属产生静电引力或形成氢键而吸附。
2.3.4 微生物共代谢作用对SDZ和SM2的去除共代谢是普遍存在于自然界的一种代谢方式,影响着大量自然化合物和人工合成化合物的降解过程[23]。厌氧微生物在利用碳源的同时,可对抗生素进行异化作用,但在抗生素降解转化的过程中,微生物不能从中获得维持生长的碳源或能源。SCOD主要由氨基酸、脂肪酸等组成,是厌氧消化过程中最容易被微生物利用的有机物[29]。与COD和VFAs相比,消化液中SDZ和SM2与其中SCOD含量具有极显著(P < 0.001)的正相关关系(图 7),表明SCOD和SAs间可能存在共代谢过程。这说明,厌氧微生物首先利用SCOD作为一级基质,维持自身细胞的生长,而将相对难降解的SAs作为二级基质进行异化降解。共代谢产物以N-乙酰-SDZ/SM2、4-羟基-SDZ/SM2、对氨基苯磺酸和2-氨基嘧啶等为主[32];但这些共代谢的中间产物不能作为营养被同化成细胞质,有些则会抑制关键酶的活性,甚至对微生物有毒害作用[33]。因此,厌氧消化过程中,关键酶的诱导及其活性的维持、生长基质与SAs之间的竞争抑制、SAs及其中间降解产物对微生物的毒性作用等,这些影响共代谢过程的关键性因素还需进一步研究。
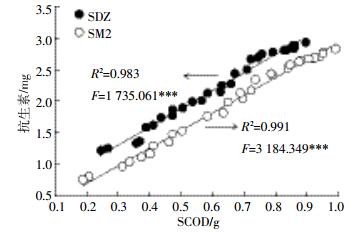
|
| 图 7 发酵过程中消化液中SDZ和SM2与其中SCOD含量的相关性 Figure 7 The relationships of SDZ and SM2 contents and their corresponding SCOD contents during anaerobic digestion |
(1)猪粪中温厌氧消化条件下,SDZ和SM2的去除符合一级动力学模型,去除率分别为58.7%和74.0%,降解半衰期分别为5.85、5.90 d。
(2)厌氧消化条件下SDZ和SM2的去除过程为:先发生快速( < 12 h)吸附作用固定在固相中,进而发生较为缓慢的生物降解作用。
(3)生物降解作用是猪粪厌氧消化中SDZ和SM2去除的主要途径,贡献率均在80%以上。共代谢作用是影响SAs生物降解的关键因素。
| [1] |
Lon A U, Michele A D. Subtherapeutic use of antibiotics in food producing animals[J]. Clinical Research and Regulatory Affairs, 2008, 9(3): 187-195. |
| [2] |
Fang H, Han Y L, Yin Y M, et al. Variations in dissipation rate, microbial function and antibiotic resistance due to repeated introductions of manure containing sulfadiazine and chlortetracycline to soil[J]. Chemosphere, 2014, 96: 51-56. DOI:10.1016/j.chemosphere.2013.07.016 |
| [3] |
Toth J D, Feng Y, Dou Z. Veterinary antibiotics at environmentally relevant concentrations inhibit soil iron reduction and nitrification[J]. Soil Biology & Biochemistry, 2011, 43(12): 2470-2472. |
| [4] |
Reichel R, Radl V, Rosendahl I, et al. Soil microbial community responses to antibiotic-contaminated manure under different soil moisture regimes[J]. Applied Microbiology and Biotechnology, 2014, 98(14): 6487-6495. DOI:10.1007/s00253-014-5717-4 |
| [5] |
Liu F, Ying G G, Tao R, et al. Effects of six selected antibiotics on plant growth and soil microbial and enzymatic activities[J]. Environmental Pollution, 2009, 157(5): 1636-1642. DOI:10.1016/j.envpol.2008.12.021 |
| [6] |
陈昦, 董元华, 王辉, 等. 江苏省畜禽粪便中磺胺类药物残留特征[J]. 农业环境科学学报, 2008, 27(1): 385-389. CHEN Hao, DONG Yuan-hua, WANG Hui, et al. Residual characteristics of sulfanilamide in animal feces in Jiangsu Province[J]. Journal of Agro-Environment Science, 2008, 27(1): 385-389. |
| [7] |
武深树, 谭美英, 刘伟. 沼气工程对畜禽粪便污染环境成本的控制效果[J]. 中国生态农业学报, 2012, 20(2): 247-252. WU Shen-shu, TAN Mei-ying, LIU Wei. Environmental cost control of livestock and poultry fecal pollution via biogas project[J]. Chinese Journal of Eco-Agriculture, 2012, 20(2): 247-252. |
| [8] |
Müller E, Schüssler W, Horn H, et al. Aerobic biodegradation of the sulfonamide antibiotic sulfamethoxazole by activated sludge applied as co-substrate and sole carbon and nitrogen source[J]. Chemosphere, 2013, 92(8): 969-978. DOI:10.1016/j.chemosphere.2013.02.070 |
| [9] |
Mohring S A I, Strzysch I, Fernandes M R, et al. Degradation and elimination of various sulfonamides during anaerobic fermentation:A promising step on the way to sustainable pharmacy?[J]. Environmental Science & Technology, 2009, 43(7): 2569-2574. |
| [10] |
许彩云, 靳红梅, 杜静, 等. 水力停留时间对猪粪厌氧发酵残留物中磺胺类抗生素分布的影响[J]. 农业环境科学学报, 2016, 35(11): 2187-2194. XU Cai-yun, JIN Hong-mei, DU Jing, et al. Effects of hydraulic retention time on sulfonamides distributions in anaerobic digestates of swine manure[J]. Journal of Agro-Environment Science, 2016, 35(11): 2187-2194. DOI:10.11654/jaes.2016-0488 |
| [11] |
Yin X W, Qiang Z M, Ben W W, et al. Biodegradation of sulfamethazine by activated sludge:Lab-scale study[J]. Journal of Environmental Engineering, 2014, 140(7): 04014024. DOI:10.1061/(ASCE)EE.1943-7870.0000850 |
| [12] |
靳红梅, 黄红英, 管永祥, 等. 规模化猪场废水处理过程中四环素类和磺胺类抗生素的降解特征[J]. 生态与农村环境学报, 2016, 32(6): 978-985. JIN Hong-mei, HUANG Hong-ying, GUAN Yong-xiang, et al. Characteristics of degradation tetracyclines and sulfonamides during wastewater treating processes in an intensive swine farm[J]. Journal of Ecology and Rural Environment, 2016, 32(6): 978-985. DOI:10.11934/j.issn.1673-4831.2016.06.017 |
| [13] |
Jin H M, Xu C Y, Du J, et al. Distribution of sulfonamides in liquid and solid anaerobic digestates:Effects of hydraulic retention time and swine manure to rice straw ratio[J]. Bioprocess and Biosystems Engineering, 2017, 40(2): 319-330. DOI:10.1007/s00449-016-1699-1 |
| [14] |
Oliveira G H D, Santos-Neto A J, Zaiat M. Evaluation of sulfamethazine sorption and biodegradation by anaerobic granular sludge using batch experiments[J]. Bioprocess and Biosystems Engineering, 2016, 39(1): 115-124. DOI:10.1007/s00449-015-1495-3 |
| [15] |
Mitchell S M, Ullman J L, Teel A L, et al. The effects of the antibiotics ampicillin, florfenicol, sulfamethazine, and tylosin on biogas production and their degradation efficiency during anaerobic digestion[J]. Bioresource Technology, 2013, 149(12): 244-252. |
| [16] |
Kim S, Aga D S. Potential ecological and human health impacts of antibiotics and antibiotic-resistant bacteria from wastewater treatment plants[J]. Journal of Toxicology & Environmental Health Part B, 2007, 10(8): 559-573. |
| [17] |
Ben W W, Pan X, Qiang Z M. Occurrence and partition of antibiotics in the liquid and solid phases of swine wastewater from concentrated animal feeding operations in Shandong Province, China[J]. Environmental Sciences Processes & Impacts, 2013, 15(4): 870-875. |
| [18] |
Ben W W, Qiang Z M, Yin X W, et al. Adsorption behavior of sulfamethazine in an activated sludge process treating swine wastewater[J]. Journal of Environmental Sciences, 2014, 26(8): 1623-1629. DOI:10.1016/j.jes.2014.06.002 |
| [19] |
Pérez S, Eichhorn P, Aga D S. Evaluating the biodegradability of sulfamethazine, sulfamethoxazole, sulfathiazole, and trimethoprim at different stages of sewage treatment[J]. Environmental Toxicology and Chemistry, 2005, 24(6): 1361-1367. DOI:10.1897/04-211R.1 |
| [20] |
Yu T H, Lin A Y, Panchangam S C, et al. Biodegradation and bio-sorption of antibiotics and nonsteroidal anti-inflammatory drugs using immobilized cell process[J]. Chemosphere, 2011, 84(9): 1216-1222. DOI:10.1016/j.chemosphere.2011.05.045 |
| [21] |
Li B, Zhang T. Biodegradation and adsorption of antibiotics in the activated sludge process[J]. Environmental Science & Technology, 2010, 44(9): 3468-3473. |
| [22] |
Yang S F, Lin C F, Lin A Y, et al. Sorption and biodegradation of sulfonamide antibiotics by activated sludge:Experimental assessment using batch data obtained under aerobic conditions[J]. Water Research, 2011, 45(11): 3389-3397. DOI:10.1016/j.watres.2011.03.052 |
| [23] |
Fischer K, Majewsky M. Cometabolic degradation of organic wastewater micropollutants by activated sludge and sludge-inherent microorganisms[J]. Applied Microbiology and Biotechnology, 2014, 98(15): 6583-6597. DOI:10.1007/s00253-014-5826-0 |
| [24] |
Pomiès M, Choubert J M, Wisniewski C, et al. Modelling of micropollutant removal in biological wastewater treatments:A review[J]. Science of the Total Environment, 2013, 443(3): 733-748. |
| [25] |
Larcher S, Yargeau V. Biodegradation of sulfamethoxazole by individual and mixed bacteria[J]. Applied Microbiology and Biotechnology, 2011, 91(1): 211-218. DOI:10.1007/s00253-011-3257-8 |
| [26] |
Lamshöft M, Sukul P, Zühlke S, et al. Metabolism of 14C-labelled and non-labelled sulfadiazine after administration to pigs[J]. Analytical and Bioanalytical Chemistry, 2007, 388(8): 1733-1745. DOI:10.1007/s00216-007-1368-y |
| [27] |
China statistical yearbook-2016[M]. Beijing: The National Bureau of Statistics of People's Republic of China, 2016.
|
| [28] |
Chen Y S, Zhang H B, Luo Y M, et al. Occurrence and dissipation of veterinary antibiotics in two typical swine wastewater treatment systems in East China[J]. Environmental Monitoring & Assessment, 2012, 184(4): 2205-2217. |
| [29] |
贺延龄. 废水的厌氧生物处理[M]. 北京: 中国轻工业出版社, 1999, 536. HE Yan-ling. Anaerobic biological treatment of waste water[M]. Beijing: China Light Industry Press, 1999, 536. |
| [30] |
郭欣妍, 王娜, 郝利君, 等. 超高效液相色谱/串联质谱法同时测定水、土壤及粪便中25种抗生素[J]. 分析化学, 2015, 43(1): 13-20. GUO Xin-yan, WANG Na, HAO Li-jun, et al. Simultaneous detection of 25 kinds of veterinary antibiotics in soil, manure and water samples using liquid chromatography tandem mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2015, 43(1): 13-20. |
| [31] |
Zhang Y, Xu J, Zhong Z X, et al. Degradation of sulfonamides antibiotics in lake water and sediment[J]. Environmental Science and Pollution Research, 2013, 20(4): 2372-2380. DOI:10.1007/s11356-012-1121-8 |
| [32] |
Guo J B, Ostermann A, Siemens J, et al. Short term effects of copper, sulfadiazine and difloxacin on the anaerobic digestion of pig manure at low organic loading rates[J]. Waste Management, 2012, 32(1): 131-136. DOI:10.1016/j.wasman.2011.07.031 |
| [33] |
Aydin S, Ince B, Ince O. Application of real-time PCR to determination of combined effect of antibiotics on bacteria, methanogenic archaea, archaea in anaerobic sequencing batch reactors[J]. Water Research, 2015, 76: 88-98. DOI:10.1016/j.watres.2015.02.043 |
 2017, Vol. 36
2017, Vol. 36