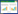文章信息
- 范瑞娟, 郭书海, 李凤梅, 吴波
- FAN Rui-juan, GUO Shu-hai, LI Feng-mei, WU Bo
- 混合烃污染土壤微生物-电动修复中的互补性研究
- Complementarity of bio-electrokinetics in the remediation of soil contaminated with multiple hydrocarbons
- 农业环境科学学报, 2018, 37(1): 64-71
- Journal of Agro-Environment Science, 2018, 37(1): 64-71
- http://dx.doi.org/10.11654/jaes.2017-0839
文章历史
- 收稿日期: 2017-06-12
- 录用日期: 2017-09-12
2. 中国科学院沈阳应用生态研究所, 沈阳 110016;
3. 国家民委发酵酿造工程生物技术重点实验室, 银川 750021
2. Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang 110016, China;
3. Key Laboratory of Fermentation Engineering and Biotechnology of State Ethnic Affairs Commission, Yinchuan 750021, China
在复杂的石油烃成分中,烷烃(包括环烷烃)以及多环芳烃分布最广,所造成的环境问题也最严重[1]。生物修复技术操作简单、处理费用低、对环境影响小,因而在石油烃类污染土壤的修复中被广泛应用[2-6]。微生物作为生物修复的功能主体,其种类、群落组成、活性、数量等对有机物的去除效率和生物利用途径起着决定性作用。不同的微生物所包含的酶系及其代谢途径不同,因而所能利用的污染物种类也不同,而石油烃组成成分复杂,需要将不同种类的菌株进行混合,制成微生物降解菌群,以实现石油烃不同组分最大程度的去除[7-8]。土壤pH和营养物质的比例对微生物生长有重要作用,从而对污染物生物降解产生重要影响,因而有必要对土壤环境条件进行优化,以提高微生物的活性和数量[9-10]。污染物结构组成和性质直接决定了其生物可利用性,然而,由于石油烃类污染物的生物可利用性很差,仅凭微生物修复技术很难实现其高效去除[11]。近年来,人们开始使用微生物-电动耦合技术以提高土壤中顽固性有机物,如石油烃的去除[12-14]。
电动技术对土壤的修复作用依赖于一系列的电化学过程,包括电迁移、电渗析、电泳以及电化学氧化在土壤中所诱导的氧化还原反应[15-16]。对于石油烃这种难迁移的疏水性有机物,在电场作用下主要依靠电化学氧化的方式得以去除[17],且在一定的范围内,电化学反应区域随电场强度的增大而扩大,从而使污染物的去除率得以提高[18]。另外,在电动处理过程中,土壤中的营养物质、电子受体、微生物等的迁移率得以促进,进而使污染物的生物可利用性得到加强[19-20]。另有研究表明,在电极附近水的电解作用会导致极端pH的发生和土壤含水率的变化,对微生物的生长具有负面影响。如,Lear等[21]研究发现,电场的施加导致阳极区域土壤酸化,使得可培养细菌和真菌的数量均有所降低,最终削弱了污染物降解效率。然而,周期性切换电极极性可消除土壤含水率和pH的大幅变化,降低对微生物的危害[22-24]。
目前,由于缺乏直接的监测手段,大多数的研究都集中在电场对生物降解的影响方面,而对电化学反应的研究较少,但间接的证据已证明了电化学反应在持久性污染物的去除方面所起的重要作用[25-26]。在微生物-电动联合修复中,污染物的去除不仅依赖于微生物的降解作用,还在很大程度上依赖于电化学氧化作用[27-31]。然而,微生物降解和电化学氧化分别在去除不同石油烃组分时的具体作用还不明确。
本文分别以正十六烷、环十二烷和芘作为直链烷烃、环烷烃和多环芳烃的代表性污染物,以三者所组成的混合有机污染物为研究对象,在二维对称电场修复平台上,采用电动修复(EK)、微生物修复(BIO)和微生物-电动联合修复(BIO-EK)的方式,通过分析不同修复方式中不同烃类污染物降解的时空特征和微生物数量、活性变化,探讨微生物降解和电化学氧化分别在去除不同石油烃组分时的具体作用。
1 材料与方法 1.1 试验材料 1.1.1 试验土壤试验土壤采自中国科学院沈阳生态实验站附近(41°31′0.19″N,123°22′8.77″E)0~30 cm土壤,其部分理化性质见表 1。使用前将土壤自然风干并过筛( < 2 mm)。
分别以正十六烷(纯度>98%,东京化成工业株式会社)、环十二烷(纯度>99%,东京化成工业株式会社)和芘(纯度>99%,百灵威科技有限公司)作为直链烷烃、环烷烃和多环芳烃的代表性污染物。将正十六烷、环十二烷和芘混入土壤中,使其最终浓度分别为4 744.54、947.22 mg·kg-1和48.81 mg·kg-1,室温状态下平衡一周。
1.1.3 培养基牛肉膏蛋白胨培养基:5 g·L-1牛肉膏,10 g·L-1蛋白胨,5 g·L-1 NaCl,pH 7.0~7.2。
无机盐培养基:1.5 g·L-1 NaNO3,1.5 g·L-1(NH4)2SO4,1.0 g·L-1 K2HPO4,0.5 g·L-1 MgSO4·7H2O,0.5 g·L-1 KCl,0.01 g·L-1 FeSO4·7H2O,0.002 g·L-1 CaCl2,pH 7.0。
1.1.4 降解菌以前期所构建的微生物降解菌群为供试微生物,该降解菌群包含直链烷烃、环烷烃和芳烃降解能力的6株菌B1、B2、B3、B6、B7和B9,其中B2和B3对直链烷烃、环烷烃和芳烃均具有降解能力,B1、B6、B7和B9对直链烷烃和环烷烃具有降解能力,初步鉴定B1、B2、B6和B7分别属于Hydrogenophaga sp.、Phenylobacterium sp.、Sphingobium sp.和Bacillus sp.,B3和B9属于Arthrobacter sp.[32]。将细菌活化后,接入到牛肉膏蛋白胨培养基中,用10 L发酵罐发酵培养(150 r·min-1、35 ℃),3 d后用低温离心机(4 ℃)进行离心(8000 r·min-1、2 min),将离心所得菌体悬浮于无机盐培养基中备用。
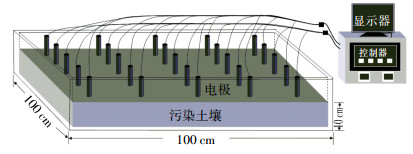
1.2 试验设计及试验装置试验装置如图 1所示,包括土壤室(100 cm×100 cm×25 cm)、25根圆柱形不锈钢电极(20 cm×1 cm)、直流电源、温度探头、pH计、控制系统和实时监测系统。25根电极以矩阵的形式排列,电极间距为20 cm;控制系统可对电极极性按设定的时间间隔进行阴阳极极性的切换,并可将电极极性以行/列转换的形式进行旋转切换,以此形成一个二维的对称电场;监测系统可对土壤温度、pH等参数进行实时监测。
|
| 图 1 试验装置 Figure 1 Schematic of the experimental set-up |
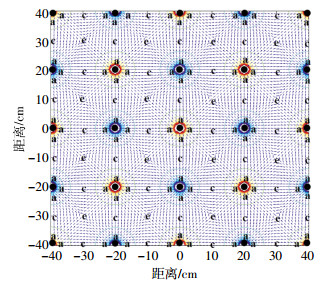
试验设计如表 2所示。其中BIO-EK和EK在图 1所示的装置中进行,施加的直流电场为1.0 V·cm-1,每5 min切换一次电极极性,每10 min进行一次行与列之间的转换。土壤中所投加的微生物比例和数量以及土壤pH和C:N:P等均按照前期试验结果来确定[32]。BIO-EK和BIO污染土壤中按照前期试验所确定的比例(B1:B2:B3:B6:B7:B9=1:1:2:0.5:1:2)及接种量(2%)投加微生物混合菌群后测得的可培养细菌数量为1.0×106 CFU·g-1干土;调节土壤pH为7.0;综合考虑土壤中污染物、有机碳、速效氮和速效磷的浓度,调节C:N:P为100:5:1,其中N由NaNO3和(NH4)2SO4提供,P由K2HPO4提供。用蒸馏水调整土壤的含水量至20%,试验过程中,定期向土壤箱中喷洒蒸馏水以保持该含水量。将土壤分层铺放在土壤室内并压实,每个土壤室中约100 kg。采样点根据电场强度分布,每10 d从图 2所示位置(a点:电极处;c点:两电极中间;e点:对角线中心)进行采样,将各相同位点的土样混匀后测定相应指标,试验共进行100 d。
|
| ●电极;a.电极处;c.两电极中间;e.对角线中心 ●Electrode; a.Adjacent to electrodes; c.Center position between two electrodes; e.Diagonal center 图 2 采样点分布等高线图 Figure 2 Contour plots signifying the distribution of sampling positions |
土壤中正十六烷、环十二烷和芘的含量采用气相色谱法测定[32]。
1.3.2 正十六烷、环十二烷和芘降解率的计算正十六烷、环十二烷和芘的降解率按照下面公式进行计算:
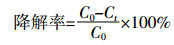
式中:C0为污染物初始含量;Ct为降解后的污染物含量。
实际降解率=处理组降解率-对照组降解率
1.3.3 脱氢酶活性分析脱氢酶活性根据TTC(2,3,5-Triphenyl Tetrazolium Chloride,2,3,5-氯化三苯基四氮唑)还原法测定[33]。其原理是TTC在细胞呼吸过程中接受氢以后,可以还原为红色的TPF(Triphenyl Formazan,三苯基甲臜),TPF在485 nm处存在吸收峰。
1.3.4 可培养细菌数量变化可培养微生物数量分析采用平板菌落计数法[34]。准确称取1 g土样,置于9 mL无机盐培养液中,140 r·min-1振荡6 h。吸取1 mL菌液,用灭菌的去离子水进行梯度稀释,直至合适的浓度。分别取各稀释浓度的菌液100 μL均匀涂布于牛肉膏蛋白胨固体平板上,待菌液渗透入培养基内,将培养皿倒置于30 ℃恒温培养箱内,48 h后统计菌落数量,计算每克土壤中菌落数量(CFU·g-1土)。
1.4 数据处理图形绘制采用SigmaPlot 10.0(Systat Software,USA);方差分析采用SPSS 17.0(SPSS Software, USA)中“Duncan”法。
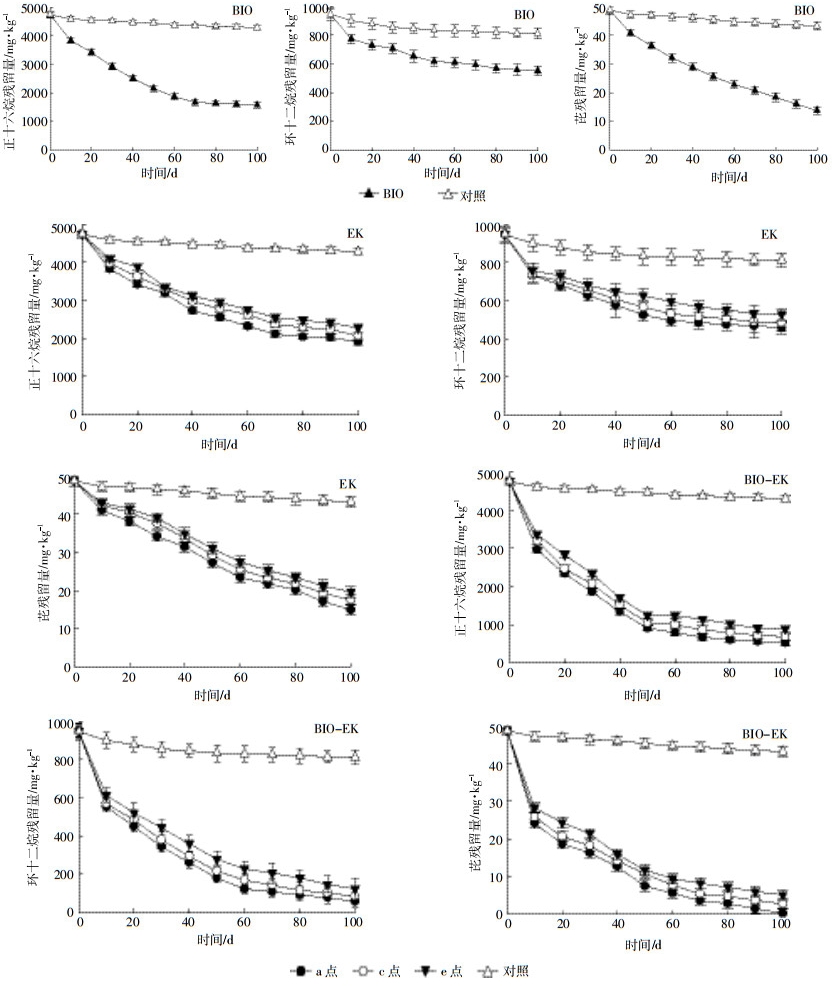
2 结果与讨论 2.1 土壤中正十六烷、环十二烷和芘的降解 2.1.1 正十六烷、环十二烷和芘含量的变化图 3为不同处理组中正十六烷、环十二烷和芘含量随时间和空间的变化情况。100 d后,除对照组外,各处理方式下正十六烷、环十二烷和芘的浓度均有明显的下降,且各污染物最大去除均发生在BIO-EK处理组中。在试验进行的前10 d,各污染物降解速率最快。
|
| 数据为3次重复的平均值。下同 Data are averages from triplicate tests. The same below 图 3 BIO、EK和BIO-EK土样中正十六烷、环十二烷和芘的含量变化 Figure 3 Content changes of n-hexadecane, cyclododecane and pyrene in soil samples from the BIO, EK and BIO-EK tests |
EK处理中,在未添加降解菌,也未进行土壤条件优化的情况下,正十六烷、环十二烷和芘也发生了明显的降解。由于极强的疏水性,这类有机污染物很难通过电渗析、电迁移和电泳的方式得以去除,而当土壤中存在“微导体”,即具有电子传导特性的粒子(如金属氧化物等)时,在外加电场的情况下,这些粒子能够诱使污染物发生电化学反应[35]。因此,间接说明EK中污染物的去除在很大程度上依赖于电化学氧化作用。各污染物最大去除均发生在BIO-EK处理组中,说明在BIO-EK处理过程中,污染物的降解依赖于微生物降解和电化学氧化的联合作用。所添加的微生物降解菌群包含直链烷烃、环烷烃和芳烃降解能力的不同菌株,其综合了不同菌在降解石油烃不同组分过程中所体现出的优势,可实现不同菌株代谢途径的互补。前10 d污染物降解速率最大,后期则逐渐降低。对于EK而言,可能由于初期土壤中积累的中间产物较少,污染物去除速率较大,而随着中间产物的积累,使得污染物去除速率逐渐降低。对于BIO-EK和BIO而言,除以上原因之外,还可能由于菌群和营养物质的添加解决了土壤中微生物活性低下和营养缺乏的问题,使得前10 d污染物降解速率最大,后期随着营养物质的消耗使得微生物活性和数量降低,从而导致污染物去除缓慢[36]。
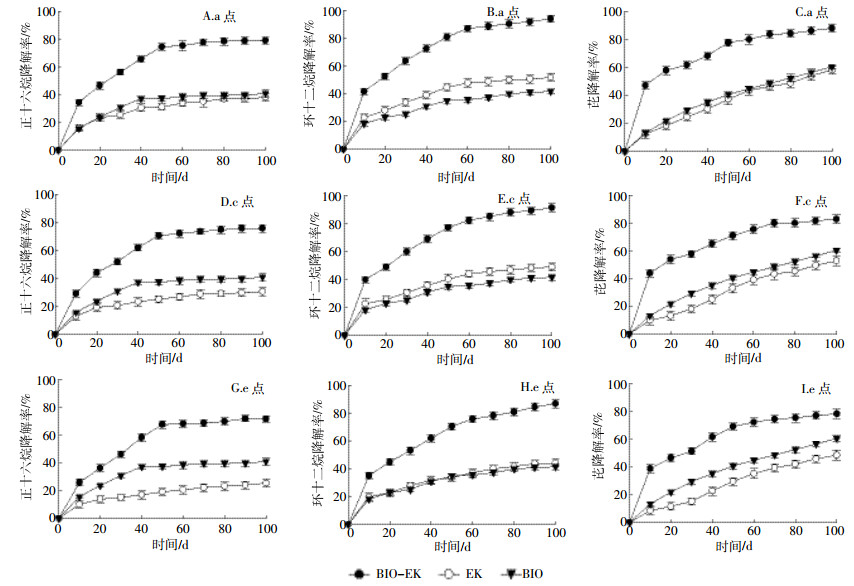
2.1.2 不同位点正十六烷、环十二烷、和芘降解率随时间变化图 4表示不同采样点(a点、c点和e点)土壤中正十六烷、环十二烷和芘降解率随时间的变化情况。
|
| 图 4 BIO、EK和BIO-EK土样中不同采样点(a、c和e)正十六烷、环十二烷和芘降解率随时间的变化 Figure 4 Degradation extent of n-hexadecane, cyclododecane and pyrene at different positions(a, c and e) in the BIO, EK and BIO-EK tests |
由图 4A、图 4D、图 4G可知,100 d后,BIO-EK中a点、c点和e点正十六烷降解率分别为79.0%、75.7%和71.4%,EK中a点、c点和e点降解率分别为38.1%、30.6%和25.4%,而BIO中的平均降解率为40.9%。进一步说明,在BIO-EK处理过程中,污染物的降解依赖于微生物降解和电化学氧化的联合作用,而结合EK和BIO中正十六烷的降解率,可推知在BIO-EK修复中,对于正十六烷的去除,微生物降解的贡献大于电化学氧化作用,并且可以看出,EK中正十六烷的降解率随电场强度的减弱而逐渐降低,由此说明电化学氧化作用的贡献率随电场强度的减弱而逐渐降低。在一系列脱氢酶的催化作用下,正十六烷被依次氧化成相应的醇、醛、酸,生成的正十六酸通过β-氧化的过程被继续降解,而电场不仅可以促进正十六烷的单末端氧化,还可促进正十六酸的β-氧化过程[37]。这可能也是BIO-EK中正十六烷降解效率最高,并且电极附近电化学氧化的贡献值较大的重要原因。
由图 4B、图 4E、图 4H可知,100 d后,BIO-EK中a点、c点和e点环十二烷降解率分别为93.9%、91.1%和86.8%,EK中a点、c点和e点降解率分别为51.6%、48.8%和44.2%,BIO中平均降解率为41.5%。表明在BIO-EK处理过程中,对于环十二烷的去除,电化学氧化的贡献大于微生物降解作用。BIO-EK中环十二烷降解效率最高,并且电极附近电化学氧化的贡献值较大,可能的原因是,电场可加速环十二烷的开环进程,使其转换成易于被生物降解的线形物质[38]。
由图 4C、图 4F、图 4I可知,100 d后,BIO-EK中a点、c点和e点芘的降解率分别为87.9%、82.9%和78.0%,EK中a点、c点和e点降解率分别为43.0%、36.7%和32.4%,BIO中的平均降解率为44.4%。表明在BIO-EK处理过程中,对于芘的去除,微生物降解的贡献大于电化学氧化作用,尤其在场强较弱的c点和e点。该结果与Huang等[28]的研究结果相似,其研究是以1-D电场为修复平台,以单一污染物芘为研究对象进行的。
综上,在微生物-电动联合修复过程中,微生物降解和电化学氧化在不同污染物的去除中体现出了互补性,其中正十六烷和芘的去除较多地依赖于微生物的降解作用,而环十二烷的去除则较多地依赖于电化学氧化作用。且微生物降解作用在场强较弱的位点贡献较大,而电化学氧化作用在场强较强的电极附近贡献较大。
2.2 脱氢酶活性和可培养细菌数量的变化脱氢酶活性是表征微生物活性的一个重要指标,是生物细胞内催化有机物氧化(脱氢),并将电子传递给最终电子受体的氧化还原酶,而这个电子传递的过程是土壤微生物呼吸途径的一个重要部分[39]。因此,本研究选择脱氢酶作为评价土壤微生物活性的指标。
BIO-EK和BIO处理中,土壤脱氢酶活性和可培养细菌数量随时间和空间变化情况如图 5所示。BIO-EK处理组中,前期脱氢酶活性和细菌数量逐渐上升,至40 d达到最大值,而后则逐渐下降,但100 d后脱氢酶活性和细菌数量仍高于初始值。a点、c点和e点之间脱氢酶活性和细菌数量均没有显著性差异(P>0.05)。BIO处理组中,10 d时脱氢酶活性和细菌数量达到最大(P < 0.01),随之逐渐降低至与初始脱氢酶活性和细菌数量相似。整体来看,BIO-EK中脱氢酶活性和细菌数量明显高于BIO中(P < 0.01)。

|
| 数据为三次重复的平均值,不同小写字母表示各处理差异显著(P<0.05)。N为可培养细菌数量,CFU·g-1 Data are averages from triplicate tests, different lowercase letters among the treatments mean significant differences(P < 0.05). N indicates culturable bacterial numbers, CFU·g-1 图 5 BIO-EK及BIO处理土壤中脱氢酶活性和可培养细菌数量变化 Figure 5 Changes of dehydrogenase activity and culturable bacterial numbers in the BIO-EK and BIO tests |
可能由于试验初期对土壤中营养物质的比例和pH进行了调节,土壤环境有利于微生物的生长,从而使得前期脱氢酶活性和细菌数量逐渐上升,随着营养物质的消耗,导致脱氢酶活性和细菌数量的降低。由于电场方向的周期性改变,使得土壤中不同位点pH均一,营养物质分散均匀,故脱氢酶活性和细菌数量在空间上没有明显的差异[40],与前期研究结果一致[31]。BIO-EK中脱氢酶活性和细菌数量高于BIO中,可能的原因是,当向土壤中施加电场时,阳极附近由于水的电解作用所产生的氧气会促进微生物细胞的呼吸速率,并间接提高土壤氧化还原水平,从而引起微生物活性和数量的增加[41],且电场方向的周期性改变增强了微生物与营养物质之间的传质性[42],也有可能引起微生物活性和数量的增加。
3 结论在微生物-电动联合修复混合烃污染土壤的过程中,微生物降解作用和电化学氧化作用在不同烃类成分的去除中表现出较为明显的互补性,其中正十六烷和芘的去除较多地依赖于微生物的降解作用,而环十二烷的去除则较多地依赖于电化学氧化作用,且微生物降解作用在场强较弱的位点贡献较大,而电化学氧化作用在场强较强的电极附近贡献较大。研究结果有望为石油烃类污染物的微生物-电动修复过程调控提供一定的理论基础。
| [1] |
Bachmann R T, Johnson A C, Edyvean R G J. Biotechnology in the petroleum industry:An overview[J]. International Biodeterioration & Biodegradation, 2014, 86: 225-237. |
| [2] |
Moliterni E, Rodriguez L, Fernández F J, et al. Feasibility of different bioremediation strategies for treatment of clayey and silty soils recently polluted with diesel hydrocarbons[J]. Water, Air, & Soil Pollution, 2012, 223(5): 2473-2482. |
| [3] |
Lladó S, Covino S, Solanas A, et al. Comparative assessment of bioremediation approaches to highly recalcitrant PAH degradation in a real industrial polluted soil[J]. Journal of Hazardous Materials, 2013, 248/249(6): 407-414. |
| [4] |
Li F, Zhu L Z, Wang L W, et al. Gene expression of an arthrobacter in surfactant-enhanced biodegradation of a hydrophobic organic compound[J]. Environmental Science & Technology, 2015, 49(6): 3698-3704. |
| [5] |
Wang S J, Wang X, Zhang C, et al. Bioremediation of oil sludge contaminated soil by landfarming with added cotton stalks[J]. International Biodeterioration & Biodegradation, 2016, 106: 150-156. |
| [6] |
李凤梅, 郭书海, 张灿灿, 等. 多环芳烃降解菌的筛选及其在焦化场地污染土壤修复中的应用[J]. 环境污染与防治, 2016, 38(4): 1-5. LI Feng-mei, GUO Shu-hai, ZHANG Can-can, et al. Isolation of PAHs degrading bacteria and its application to mediation of pulluted soil in coking site[J]. Environmental Pollution & Control, 2016, 38(4): 1-5. |
| [7] |
Lors C, Ryngaert A, Périé F, et al. Evolution of bacterial community during bioremediation of PAHs in a coal tar contaminated soil[J]. Chemosphere, 2010, 81(10): 1263-1271. DOI:10.1016/j.chemosphere.2010.09.021 |
| [8] |
Smith E, Thavamani P, Ramadass K, et al. Remediation trials for hydrocarbon-contaminated soils in arid environments:Evaluation of bioslurry and biopiling techniques[J]. International Biodeterioration & Biodegradation, 2015, 101(7): 56-65. |
| [9] |
Brinda Lakshmi M, Anandaraj V P, Velan M. Bioremediation of phenanthrene by Mycoplana sp. MVMB2 isolated from contaminated soil[J]. CLEAN-Soil, Air, Water, 2013, 41(1): 86-93. DOI:10.1002/clen.201000472 |
| [10] |
Kanwal N, Shah A A, Qayyum S, et al. Optimization of pH and temperature for degradation of tyre rubber by Bacillus sp. strain S10 isolated from sewage sludge[J]. International Biodeterioration & Biodegradation, 2015, 103(5): 154-160. |
| [11] |
Yan G X, Ma W F, Chen C M, et al. Combinations of surfactant flushing and bioremediation for removing fuel hydrocarbons from contaminated soils[J]. CLEAN-Soil, Air, Water, 2016, 44(8): 984-991. DOI:10.1002/clen.v44.8 |
| [12] |
张灿灿, 郭书海, 李婷婷, 等. 焦化厂高环PAHs污染土壤的电动-微生物修复[J]. 环境工程, 2014, 32(7): 150-154. ZHANG Can-can, GUO Shu-hai, LI Ting-ting, et al. Electro-bioremediation of coking plant soils contaminated with high-molecular polycyclic aromatic hydrocarbons[J]. Environmental Engineering, 2014, 32(7): 150-154. |
| [13] |
魏巍, 李凤梅, 杨雪莲, 等. 电动修复过程中电压对土壤中芘降解及微生物群落的影响[J]. 生态学杂志, 2015, 34(5): 1382-1388. WEI Wei, LI Feng-mei, YANG Xue-lian, et al. Influence of voltage on pyrene removal and microbial community in soil during electrokinetic remediation[J]. Chinese Journal of Ecology, 2015, 34(5): 1382-1388. |
| [14] |
Wang S, Guo S H, Li F M, et al. Effect of alternating bioremediation and electrokinetics on the remediation of n-hexadecane-contaminated soil[J]. Scientific Reports, 2016, 6: 1-13. DOI:10.1038/s41598-016-0001-8 |
| [15] |
Acar Y. Principles of electrokinetic remediation[J]. Environmental Science and Technology, 1993, 27(13): 2638-2647. DOI:10.1021/es00049a002 |
| [16] |
Probstein R F, Hicks R E. Removal of contaminants from soils by electric fields[J]. Science, 1993, 260(5107): 498-503. DOI:10.1126/science.260.5107.498 |
| [17] |
Röhrs J, Ludwig G, Rahner D. Electrochemically induced reactions in soils:A new approach to the in-situ remediation of contaminated soils:Part 2:Remediation experiments with a natural soil containing highly chlorinated hydrocarbons[J]. Electrochimica Acta, 2002, 47(9): 1405-1414. DOI:10.1016/S0013-4686(01)00855-6 |
| [18] |
Jin S, Fallgren P H. Electrically induced reduction of trichloroethene in clay[J]. Journal of Hazardous Materials, 2010, 173(1): 200-204. |
| [19] |
Wick L Y, Shi L, Harms H. Electro-bioremediation of hydrophobic organic soil-contaminants:A review of fundamental interactions[J]. Electrochimica Acta, 2007, 52(10): 3441-3448. DOI:10.1016/j.electacta.2006.03.117 |
| [20] |
Wick L Y, Mattle P A, Wattiau P, et al. Electrokinetic transport of PAH-degrading bacteria in model aquifers and soil[J]. Environmental Science & Technology, 2004, 38(17): 4596-4602. |
| [21] |
Lear G, Harbottle M J, Sills G, et al. Impact of electrokinetic remediation on microbial communities within PCP contaminated soil[J]. Environmental Pollution, 2007, 146(1): 139-146. DOI:10.1016/j.envpol.2006.06.037 |
| [22] |
Harbottle M J, Lear G, Sills G C, et al. Enhanced biodegradation of pentachlorophenol in unsaturated soil using reversed field electrokinetics[J]. Journal of Environmental Management, 2009, 90(5): 1893-1900. DOI:10.1016/j.jenvman.2008.12.012 |
| [23] |
赵庆节, 沈根祥, 罗启仕, 等. 土壤电动修复中电极切换对土壤微生物群落的影响[J]. 农业环境科学学报, 2009, 28(5): 937-940. ZHAO Qing-jie, SHEN Gen-xiang, LUO Qi-shi, et al. Effect of polarity reversal of electric field on soil microbial community[J]. Journal of Agro-Environment Science, 2009, 28(5): 937-940. |
| [24] |
Li T T, Yu W, Guo S H, et al. Effect of polarity-reversal on electrokinetic enhanced bioremediation of pyrene contaminated soil[J]. Electrochimica Acta, 2015, 187: 567-575. |
| [25] |
Alshawabkeh A N, Sheahan T C, Wu X. Coupling of electrochemical and mechanical processes in soils under DC fields[J]. Mechanics of Materials, 2004, 36(5): 453-465. |
| [26] |
Xu S J, Guo S H, Wu B, et al. An assessment of the effectiveness and impact of electrokinetic remediation for pyrene-contaminated soil[J]. Journal of Environmental Sciences, 2014, 26(11): 2290-2297. DOI:10.1016/j.jes.2014.09.014 |
| [27] |
Li F M, Guo S H, Hartog N. Electrokinetics-enhanced biodegradation of heavy polycyclic aromatic hydrocarbons in soil around iron and steel industries[J]. Electrochimica Acta, 2012, 85(15): 228-234. |
| [28] |
Huang D N, Guo S H, Li T T, et al. Coupling interactions between electrokinetics and bioremediation for pyrene removal from soil under polarity reversal conditions[J]. CLEAN-Soil, Air, Water, 2013, 41(4): 383-389. DOI:10.1002/clen.v41.4 |
| [29] |
Gargouri B, Karray F, Mhiri N, et al. Bioremediation of petroleum hydrocarbons-contaminated soil by bacterial consortium isolated from an industrial wastewater treatment plant[J]. Journal of Chemical Technology and Biotechnology, 2014, 89(7): 978-987. DOI:10.1002/jctb.2014.89.issue-7 |
| [30] |
Fan R J, Guo S H, Li T T, et al. Contributions of electrokinetics and bioremediation in the treatment of different petroleum components[J]. CLEAN-Soil, Air, Water, 2015, 43(2): 251-259. DOI:10.1002/clen.v43.2 |
| [31] |
Guo S H, Fan R J, Li T T, et al. Synergistic effects of bioremediation and electrokinetics in the remediation of petroleum-contaminated soil[J]. Chemosphere, 2014, 109: 226-233. DOI:10.1016/j.chemosphere.2014.02.007 |
| [32] |
范瑞娟, 郭书海, 李凤梅. 石油降解菌群的构建及其对混合烃的降解特性[J]. 农业环境科学学报, 2017, 36(3): 522-530. FAN Rui-juan, GUO Shu-hai, LI Feng-mei. Construction of petroleum degrading bacteria consortium and its degradation properties of mixed hydrocarbons[J]. Journal of Agro-Environment Science, 2017, 36(3): 522-530. DOI:10.11654/jaes.2016-1266 |
| [33] |
Megharaj M, Singleton I, McClure N, et al. Influence of petroleum hydrocarbon contamination on microalgae and microbial activities in a long-term contaminated soil[J]. Archives of Environmental Contamination and Toxicology, 2000, 38(4): 439-445. DOI:10.1007/s002449910058 |
| [34] |
Randall J D, Hemmingsen B B. Evaluation of mineral agar plates for the enumeration of hydrocarbon-degrading bacteria[J]. Journal of Microbiological Methods, 1994, 20(2): 103-113. DOI:10.1016/0167-7012(94)90013-2 |
| [35] |
Rahner D, Ludwig G, Röhrs J. Electrochemically induced reactions in soils:A new approach to the in-situ remediation of contaminated soils:Part 1:The microconductor principle[J]. Electrochimica Acta, 2002, 47(9): 1395-1403. DOI:10.1016/S0013-4686(01)00854-4 |
| [36] |
Chu H Y, Lin X G, Fujii T, et al. Soil microbial biomass, dehydrogenase activity, bacterial community structure in response to long-term fertilizer management[J]. Soil Biology and Biochemistry, 2007, 39(11): 2971-2976. DOI:10.1016/j.soilbio.2007.05.031 |
| [37] |
Yuan Y, Guo S H, Li F M, et al. Effect of an electric field on n-hexadecane microbial degradation in contaminated soil[J]. International Biodeterioration & Biodegradation, 2013, 77: 78-84. |
| [38] |
Yuan Y, Guo S H, Li F M, et al. Coupling electrokinetics with microbial biodegradation enhances the removal of cycloparaffinic hydrocarbons in soils[J]. Journal of Hazardous Materials, 2016, 320: 591-601. DOI:10.1016/j.jhazmat.2016.07.043 |
| [39] |
Garcia C, Hernandez T, Costa F. Potential use of dehydrogenase activity as an index of microbial activity in degraded soils[J]. Communications in Soil Science and Plant Analysis, 1997, 28(1/2): 123-134. |
| [40] |
Li T T, Guo S H, Wu B, et al. Effect of electric intensity on the microbial degradation of petroleum pollutants in soil[J]. Journal of Environmental Sciences, 2010, 22(9): 1381-1386. DOI:10.1016/S1001-0742(09)60265-5 |
| [41] |
She P, Song B, Xing X H, et al. Electrolytic stimulation of bacteria enterobacter dissolvens by a direct current[J]. Biochemical Engineering Journal, 2006, 28(1): 23-29. DOI:10.1016/j.bej.2005.08.033 |
| [42] |
Luo Q S, Zhang X H, Wang H, et al. Mobilization of phenol and dichlorophenol in unsaturated soils by non-uniform electrokinetics[J]. Chemosphere, 2005, 59(9): 1289-1298. DOI:10.1016/j.chemosphere.2004.11.043 |
 2018, Vol. 37
2018, Vol. 37