铅可以应用于很多领域,如铅酸电池、建筑材料、印刷、染料和矿物燃料等[1-2]。然而,铅是一种毒性很强的重金属,环境中过量的铅暴露能够破坏生态系统。铅不能被微生物降解,含铅废水如未有效处理,极易造成铅的转移和积累,即使低浓度铅也会对人体的神经、消化和肾脏等系统以及环境造成危害[3]。将铅从水溶液中有效分离,不仅能够回收利用铅资源,还能保护人类和生态系统的安全。目前处理含铅废水的方法有化学沉淀、电化学、氧化还原、离子交换、溶液萃取、絮凝、吸附和生物吸附等。其中生物吸附法具有去除率高、处理成本低、生物吸附材料来源广泛、吸附剂容易再生和无二次污染等优点,因此在重金属处理方面受到广泛的关注。
生物吸附法是通过某些生物体本身及其胞外分泌物吸附水溶液中的金属离子,使固相和液相进行分离从而去除水中金属离子的方法[4]。近年来,细菌、真菌、藻类等微生物已被广泛用于水中重金属的处理。目前,微生物作为吸附剂去除铅的研究多集中在微生物的筛选分离、微生物及其胞外分泌物的吸附能力、微生物的预处理和改性、吸附模型(吸附等温线和吸附动力学)、吸附机理以及其潜在的应用价值。尽管自然界中存在各种各样的微生物,但是筛选出具有耐受性及高效结合重金属能力的微生物是处理含重金属废水的关键步骤。许多微生物都能去除Pb(Ⅱ),细菌中的Bacillus sp.、Corynebacterium glutamicum、Pseudomonas aeruginosa、Enterobacter sp.和Streptomyces rimosus等,真菌中的Saccharomyces cerevisiae、Penicillium sp.和Aspergillus sp.等,以及藻类中的褐藻(Padina tetrastomatica等)、绿藻(Cladophora glomerata等)和红藻(Gracilaria corticata等)[5]。除此之外,一些微生物的胞外分泌物(EPS)也能有效去除水中的铅,如Bacillus sp.[6]、Shewanella oneidensis[7]和Aspergillus fumigatus[8]等微生物产生的分泌物就能够吸附铅。微生物对重金属吸附能力的研究,主要是对其影响因素如pH值、吸附剂用量、重金属浓度、温度、吸附等温线及吸附动力学等方面,以便得到最佳的吸附条件。微生物细胞的细胞壁组成物质中,含有羟基、羧基、氨基和磷酸基等基团,这些基团能通过离子交换、络合、静电吸引、吸附和螯合等作用结合重金属离子[9]。由于微生物所含有的官能团的数量有限,为了提高其吸附能力,近年来,化学和基因改性微生物的方法经常被用于提高微生物的生物吸附能力。Zhang等[10]制备的纳米-ZnO酵母菌可以明显提高水溶液中铅的去除能力;Montazer-Rahmatia等[11]使用化学试剂甲醛(FA)、戊二醛(GA)、聚乙烯亚胺(PEI)、CaCl2和HCl处理褐藻,提高了其吸附能力的稳定性;杨婷[12]利用基因工程技术,将枯草芽孢杆菌的抗砷基因arsR通过载体质粒转至大肠杆菌内,诱导合成砷调节蛋白ArsR,用于砷的富集和去除。
通过化学或基因改性的方法能够提高微生物去除重金属的能力,但许多学者的研究也表明不同的微生物其死细胞或活细胞的吸附能力不同。在多数的研究中,微生物的死细胞比活细胞表现出更强的吸附能力。Velásquez等[13]研究了Bacillus sphaericus OT4b31和Ⅳ(4)10处于生长中的活细胞和经过处理的死细胞对Cr(Ⅵ)吸附,死菌体是经过pH为2.5的酸化去离子水(H2SO4)处理后,再经80 ℃烘干后得到,研究结果表明,Bacillus sphaericus OT4b31和Ⅳ(4)10的活细胞对Cr(Ⅵ)的去除率分别为25%和32%,而相应的死细胞对金属Cr(Ⅵ)的去除率分别为44.5%和45%,死细胞的生物吸附能力高于活细胞,可能是由于经过处理的死细胞暴露出了更多的结合位点。Huang等[14]研究了Bacillus cereus RC-1培养后离心获得的活细胞和经过121 ℃、20 min处理的死细胞对Cd(Ⅱ)的吸附能力,结果为死细胞的吸附能力高于活细胞,且FTIR分析表明经过高温处理的Bacillus cereus RC-1的死细胞暴露出更多的-COOH,从而提高了吸附量。Du等[15]使用Pseudomonas sp. strain DY1培养后获得的活菌体和高温处理的死菌体(100 ℃ 30 min)吸附水溶液中金属络合染料酸性黑172,实验结果也表现出死菌体的吸附能力高于活菌体,高温处理的死菌体具有更强的吸附能力,是由于死细胞具有更高的细胞渗透性且细胞内蛋白质变性后氨基基团起到了重要的作用。但有些微生物经过灭活处理后,其死细胞的去除能力低于活细胞。Sayyadi等[16]研究Saccharomyces carlsbergensis PTCC 5051去除Cd(Ⅱ)和Cs(Ⅰ)时发现,经过高温灭菌处理,含有NaN3或2,4二硝基酚的氨丁三醇缓冲剂处理的Saccharomyces carlsbergensis PTCC 5051的死细胞的生物吸附能力明显低于活细胞。Malkoc等[17]研究Variovorax paradoxus和Arthrobacter viscosus对Zn(Ⅱ)的生物吸附能力时,发现Variovorax paradoxus的活细胞的吸附能力高于死细胞,而Arthrobacter viscosus的活细胞的吸附能力低于死细胞。对于不同的微生物,经过一些方法处理后得到的死细胞(例如高温处理),相对于活细胞,其吸附能力不同且吸附能力差异的机理也不同。Huang等[14]和Du等[15]的研究表明死细胞的吸附效果高于活细胞,但是两者死细胞吸附能力提高的机理是不同的。因此,本研究选用实验室筛选出的克雷伯氏菌作为目标菌种,研究其死细胞和活细胞对铅的去除能力。
克雷伯氏菌普遍存在于土壤、水体、谷物等自然环境以及生物体的消化、呼吸系统中。克雷伯氏菌属于革兰氏阴性菌,根据近几年相关研究与报道,其在污水处理及重金属治理方面具有很强的应用潜力。Muñoz等[18]研究了从污水处理厂中分离出的克雷伯氏菌3S1对水中Pb(Ⅱ)的吸附能力;信欣等[19]研究了克雷伯氏菌的胞外分泌物去除水中的Pb(Ⅱ);Yang等[20]利用克雷伯氏菌的胞外分泌物同时去除水中的Cu(Ⅱ)和Zn(Ⅱ)。克雷伯氏菌还被用于水中有机物的降解[21]。但是对克雷伯氏菌活细胞和通过高温处理后的死细胞吸附重金属能力的对比研究鲜见报道。所有对于微生物作为生物吸附剂的研究都是为实际应用作指导,因此选择安全、高效的微生物是关键的部分,若选用的微生物具有致病性等则会造成处理重金属以后产生二次污染等环境问题。本研究中选用的克雷伯氏菌,是一种具有致病性的微生物。克雷伯氏菌主要有肺炎克雷伯氏菌、臭鼻克雷伯氏菌和鼻硬结克雷伯氏菌。克雷伯氏菌有较高的发病率和死亡率,该菌能够导致医院内新生儿呼吸道和泌尿系统的感染,还会引发菌血病和烧伤患者的感染。尤其是肺炎克雷伯氏菌引起的肺炎,此菌存在于人体肠道、呼吸道,可引起支气管炎、肺炎,泌尿系和创伤感染,甚至败血症、脑膜炎、腹膜炎等。对克雷伯氏菌活菌和死菌的吸附能力进行研究,如果活菌吸附能力高于死菌,可以从理论上分析两者存在差异的原因;若死菌的吸附能力强于活菌,本研究不仅可以从理论上阐述死细胞和活细胞吸附能力差异的原理,更重要的是,具有致病性的克雷伯氏菌经过高温处理后失去活性,其对环境和人体都是一种安全的生物吸附剂,可以安全的应用于实际的生产应用中。
本文使用从云南某矿山废水中筛选得到的克雷伯氏菌,将发酵培养后直接离心收集的菌体作为活细胞吸附剂,发酵培养结束后再高温处理收集的菌体作为死细胞吸附剂,在不同影响因素条件下(pH值、吸附剂用量、反应时间和初始铅浓度),对比了活细胞和死细胞对水中铅的吸附能力。根据活细胞和死细胞的吸附动力学、吸附等温线、扫描电子显微镜(SEM)分析、比表面积分析、Zeta电位、傅里叶红外光谱(FTIR)和X射线光电子能谱(XPS)分析,阐述了克雷伯氏菌活细胞和死细胞对铅去除性能的差异,为生物吸附剂去除重金属的应用提供理论指导。
1 材料与方法 1.1 实验药剂和仪器实验药剂:蔗糖,磷酸二氢钾,磷酸氢二钾,硫酸镁,氯化钠,尿素,氢氧化钠,硫酸,硝酸铅。所用药品均为分析纯。
实验仪器:分析天平(JA3003C,上海亨方科学仪器有限公司),pH计(PHSJ-5,上海雷磁仪器厂),恒温培养振荡器(SPH-1112D,上海世平实验设备有限公司),高速冷冻离心机(GL-21M,赛特湘仪离心机仪器有限公司),立式压力蒸汽灭菌器(YXQ-LS-30SII,上海博讯医疗生物仪器股份有限公司),智能真空干燥箱(DZF,上海丙林电子科技有限公司),原子吸收分光光度计(TAS-990AFG,北京普析通用仪器有限责任公司),傅里叶变换红外光谱仪(Nicolet iS5N,赛默飞世尔科技(中国)有限公司),Zeta电位分析仪(马尔文nano ZS90,艾克赛普精密测控有限公司),扫描电子显微镜(JSM-7500F,上海百贺仪器科技有限公司),比表面积分析仪(JW-BK132F,北京精微高博科学技术有限公司),X射线光电子能谱分析仪(X′PertPowder,马尔文帕纳科公司)。
1.2 菌种来源实验所用菌株取自云南某矿山废水,使用常规的稀释涂布和分离划线法获得的耐铅细菌,经16S rDNA序列分析鉴定为克雷伯氏菌(Klebsiella sp.)。
1.3 实验用培养基菌株活化培养基:牛肉膏3.0 g,蛋白胨10.0 g,氯化钠5.0 g,琼脂粉20 g,蒸馏水1.0 L,pH=7.0~7.2。
菌株发酵培养基:蔗糖15.0 g,磷酸二氢钾2.0 g,磷酸氢二钾5.0 g,硫酸镁0.2 g,氯化钠0.1 g,尿素3.3 g,蒸馏水1.0 L,pH=6.0。
1.4 克雷伯氏菌活细胞和死细胞的制备先将克雷伯氏菌在活化培养基上培养24 h,按3%的接种量接种于液体培养基中,在恒温培养振荡器中28 ℃、120 r·min-1的条件下培养至对数期。将其中一部分发酵液进行121 ℃、30 min高温灭菌处理,然后离心(10 000 r·min-1、4 ℃)10 min后收集死菌体,作为死细胞吸附剂,命名为DC;另一部分菌体悬液直接使用离心机离心(10 000 r·min-1、4 ℃)10 min后,收集的菌体直接作为活细胞吸附剂,命名为LC。上述死细胞和活细胞吸附剂在离心后均需再用无菌水洗涤2~3次后再离心收集,以去除表面残留的培养基。收集到的死细胞和活细胞在80 ℃真空干燥箱中烘干后保存待用。
1.5 吸附试验将100 mL不同初始浓度的铅溶液加入到250 mL锥形瓶中,分别加入一定质量的DC吸附剂和LC吸附剂,使用1 mol·L-1的HNO3和1 mol·L-1的NaOH调节溶液的pH,放置于恒温培养振荡器中,混合液在特定的转速(150 r·min-1)、特定的温度条件下反应一定时间。在反应达到平衡后,使用离心机,在10 000 r· min-1、4 ℃的条件下离心10 min,将上清液使用原子吸收分光光度计测定铅离子浓度,并计算铅的去除率及DC和LC对铅的单位质量吸附量,计算公式如下:
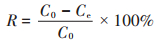
|
(1) |
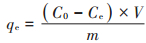
|
(2) |
式中:R表示DC和LC对Pb(Ⅱ)的去除率,%;qe为DC和LC对Pb(Ⅱ)的单位质量(干质量)吸附量,mg·g-1;C0为初始Pb(Ⅱ)浓度,mg·L-1;Ce为吸附后溶液中剩余的Pb(Ⅱ)浓度,mg·L-1;V为实验使用的Pb(Ⅱ)溶液的体积,L;m为DC和LC的质量(干质量),g。所有实验均进行3次,最后结果取平均值。
1.6 特征分析Zeta电位测定:分别称一定量的DC和LC溶于水中,使其质量浓度均为0.2 g·L-1(干质量),使用1 mol· L-1的H2SO4和1 mol·L-1的NaOH调节溶液的pH值分别为2.0、3.0、4.0、5.0、6.0和7.0,溶液混合均匀后,测定各个pH值下的Zeta电位。
SEM表征:使用日本JSM-7500F场发射电子显微镜对LC和DC的表面形态结构进行观察,实验在20 kV的电压下进行。
LC和DC的比表面积和孔径使用比表面积分析仪进行测定,比表面积使用N2的吸附-解吸曲线进行计算,孔径使用Barrett-Joyner-Halenda(BJH)模型进行测试。
FTIR表征:DC和LC两种吸附剂及DC吸附Pb(Ⅱ)后的样品(后面标记为DC-Pb)中分别加入KBr,混合均匀后研磨,直至混合物粉末粘在玛瑙研钵的壁上,然后,将混合物放入下压芯中进行压片,压片结束后,取出制作好的压片放入到红外光谱仪中测绘其红外光谱。
XPS分析:在室温下使用Al Kα X射线(hν=1 486.6 eV)单色束激发出光电子,所得到的结合能对应的峰参考C1s在结合能为284.8 eV的峰。
2 结果与讨论 2.1 DC和LC的表征分析 2.1.1 SEM分析SEM分析是一种用于分析生物吸附剂表面形态的有用的技术方法。从图 1可以看出未经处理的克雷伯氏菌LC(图 1a)和经过高温灭菌的克雷伯氏菌DC(图 1b)的表面形态存在很大的差异。LC成杆状,细胞表面平滑、规则;DC的细胞完整性被破坏,细胞表面粗糙不规则并且具有大量的孔隙结构,这些孔隙的形成有利于DC对水溶液中Pb(Ⅱ)的吸附。

|
图 1 LC和DC在SEM下的形貌特征 Figure 1 SEM morphology of LC and DC |
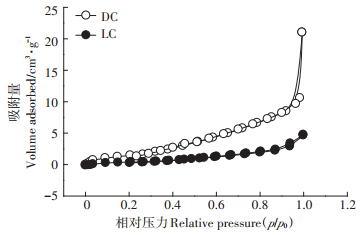
DC和LC的N2吸附-解吸等温曲线在-196.15 ℃条件下进行,结果见图 2。根据国际纯粹与应用化学联合会(IUPAC)分类,DC和LC的N2吸附-解吸曲线符合类型Ⅳ等温曲线,表明DC和LC的孔隙结构主要是微孔和介孔[22]。DC和LC的比表面积分别为12.810 m2·g-1和2.728 m2·g-1,平均孔径分别为10.150 nm和8.466 nm。因此,经过灭菌处理的DC的比表面积和孔径均明显大于LC,表明DC在吸附过程中能够提供更大的吸附表面,从而有利于对Pb(Ⅱ)的去除。该结果与SEM的结果相一致。
|
图 2 DC和LC的N2吸附-解吸曲线 Figure 2 N2 adsorption-desorption isotherms of DC and LC |
在100 mL 50 mg·L-1的Pb(Ⅱ)溶液中,分别加入0.02 g的DC吸附剂和LC吸附剂,并调节溶液pH值分别为1.0、2.0、3.0、3.5、4.0、4.5、5.0、5.5和6.0,混合液置于30 ℃恒温培养振荡器中振荡120 min。实验结果见图 3a。

|
图 3 pH对DC和LC吸附Pb(Ⅱ)的影响(a)及DC和LC表面的Zeta电位(b) Figure 3 Effect of pH on the adsorption of DC and LC for Pb(Ⅱ)(a), and Zeta potential of DC and LC (b) |
从图 3a可知,pH值对DC和LC吸附Pb(Ⅱ)有很大的影响。当pH值从2.0增加到5.5,DC和LC对Pb(Ⅱ)的吸附量分别从10.78 mg·g-1和8.91 mg·g-1,增加到131.86 mg·g-1和104.83 mg·g-1。pH值的影响表明DC和LC对Pb(Ⅱ)的吸附主要是表面络合作用。当pH值低于3.0时,DC和LC两种吸附剂表面的官能团被质子化,大量活性位点被H+占据,H+和带正电的Pb(Ⅱ)对吸附位点存在竞争,从而降低了吸附剂对Pb(Ⅱ)的吸附[23]。当pH值从3.0增大到6.0时,H+离开吸附剂表面,吸附剂表面官能团的质子化作用逐渐降低,从而更有利于吸附剂表面官能团对Pb(Ⅱ)的吸附。在pH值为3.0~6.0时,DC对Pb(Ⅱ)的吸附量高于LC,从图 3b中DC和LC表面的Zeta电位分析可知,在此pH值范围内,DC比LC带有更多的负电荷,从而加强了DC对Pb(Ⅱ)的吸附。
Reddy等[24]和He等[25]分别研究三维多孔尖晶石铁氧体和β-环糊精结合石灰去除水溶液中的Pb2+时报道了水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各存在形态所占百分比随溶液pH变化的关系如图 4所示。从图 4可知,当pH值大于6.0时,有Pb(OH)+沉淀产生。在本研究的实验条件下,经过多次重复实验,当pH值大于6.0后,已经有明显的沉淀形成,难以判断是沉淀作用还是吸附作用,因此后续实验均在pH 5.5的条件下进行。

|
图 4 Pb2+的形态分布 Figure 4 Speciation of Pb2+ |
为了对比DC和LC两种吸附剂在不同pH值条件下其表面所带电荷的情况,采用Zeta电位进行分析。胶体粒子分散在溶液中,其表面电荷产生了Zeta电位,它是描述胶粒表面电荷性质的一个物理量,由于DC和LC表面存在大量的官能团,当这两种吸附剂在溶液中分散时,细胞表面的官能团发生电离,形成双电层,进而产生Zeta电位[26]。Zeta电位可以研究吸附剂表面所带电荷量及电性随pH值的变化,还可以对比两种吸附剂表面电荷量和电性的差异以分析吸附剂在吸附过程中吸附行为的差异。
在不同的pH值条件下,DC和LC的表面电荷变化见图 3b。随着pH值的增加,DC和LC的Zeta电位降低,这是由于随着pH值的增加,两种吸附剂表面官能团的质子化作用减弱。DC和LC的等电点分别约为2.3和3.1,DC的等电点低于LC,说明DC对正价的金属离子具有更宽的吸附pH范围。在pH低于2.3时,DC表面带正电荷,会降低DC表面官能团和Pb(Ⅱ)之间的静电吸引作用从而使吸附效果受到影响。在pH值大于2.3后,DC比LC带有更多的负电荷,可能是因为经过高温灭菌处理后,DC表面暴露出更多的官能团,能够增加DC表面的电负性,从而有效提高DC对Pb(Ⅱ)的吸附量。该结果与pH值对吸附量的影响结果相一致。
2.2.2 吸附剂用量对吸附效果的影响在一系列100 mL的50 mg·L-1的Pb(Ⅱ)溶液中,分别加入吸附剂DC和LC,使其质量浓度为0.1、0.2、0.3、0.4、0.5、0.6、0.8 g·L-1(干质量),调节溶液pH=5.5,在30 ℃的条件下振荡120 min。DC和LC对Pb(Ⅱ)的去除率和吸附量结果如图 5所示。随着DC和LC用量从0.1 g·L-1增加到0.8 g·L-1,DC和LC对Pb(Ⅱ)的去除率分别从32.45%和24.05%增加到97.31%和72.47%,这是因为吸附位点的数量随着吸附剂添加量的增加而增加,从而使去除率提高。从图 5可知,DC和LC的用量增加到0.5 g·L-1后,DC和LC对溶液中Pb(Ⅱ)的去除率没有明显的增加,这可能是由于溶液中Pb(Ⅱ)的含量较低。与此同时,DC和LC对Pb(Ⅱ)的吸附量随着吸附剂用量的增加而降低,这可能是吸附剂用量增加时造成了吸附剂的聚集,从而降低了有效的吸附面积,在吸附位点之间产生了干扰;当吸附剂用量较高时,吸附剂表面可能会产生一种“屏蔽效应”,从而降低了对Pb(Ⅱ)的吸附[27]。为了避免这种“屏蔽效应”,以及考虑使用成本和在相同条件下比较两种吸附剂对Pb(Ⅱ)的去除效果,后续实验选择DC和LC的用量均为0.2 g·L-1。从实验结果可知,在不同的吸附剂用量条件下,DC对Pb(Ⅱ)的吸附效果明显优于LC。

|
图 5 DC和LC用量对吸附Pb(Ⅱ)的影响 Figure 5 Effect of DC and LC dosage on the adsorption of Pb(Ⅱ) |
吸附过程的动力学研究主要是用来描述吸附剂对吸附质的吸附速率。在初始Pb(Ⅱ)浓度为50 mg· L-1、溶液pH为5.5、吸附剂用量为0.2 g·L-1和反应温度为30 ℃的条件下,研究时间对DC和LC吸附Pb(Ⅱ)的影响及DC和LC的吸附动力学行为。
时间对DC和LC吸附Pb(Ⅱ)的影响见图 6。随着时间的增加,DC和LC对Pb(Ⅱ)的吸附量明显增加,表明在吸附剂表面存在大量可用的活性位点,且Pb(Ⅱ)吸附到了吸附剂的表面。从图 6可知,DC和LC对Pb(Ⅱ)的吸附在60 min可达到吸附平衡,因此选择60 min作为DC和LC后续实验的反应时间。

|
图 6 反应时间对DC和LC吸附Pb(Ⅱ)的影响及准一级动力学和准二级动力学模型拟合结果 Figure 6 Effect of contact time on adsorption of Pb(Ⅱ) by DC and LC and the fitting results using pseudo-first-order and pseudo-second-order models |
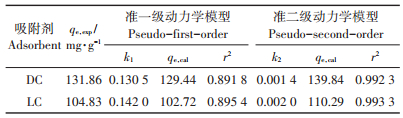
微生物细胞的吸附一般分为两个阶段:快速吸附阶段和缓慢达到平衡的慢速吸附阶段。文献中报道的有超过25种模型尝试定量的描述吸附过程的动力学行为,尽管各个模型都有其局限性,但是准一级动力学模型和准二级动力学模型已经被成功应用于对吸附数据的拟合[9]。准一级动力学模型是基于假设吸附速率受扩散步骤的控制,吸附速率与平衡吸附量和t时刻的吸附量的差值呈正比关系,主要用于通过边界扩散完成的单层吸附;准二级动力学模型是假设吸附速率受化学吸附过程的控制,其涉及吸附剂与吸附质之间存在共用电子或者电子转移,吸附过程包含了外部液膜扩散、表面吸附以及颗粒内扩散的复合吸附反应,因此准二级动力学模型能够更全面地反映固-液之间的吸附动力学行为[28-29]。基于微生物细胞本身组成的均匀性,以及其表面存在与重金属离子相结合的羟基、羧基和氨基等基团,这些基团能与金属离子之间发生物理化学反应,因此准一级动力学模型和准二级动力学模型能够对实验结果进行拟合,从而判定其吸附动力学行为。准一级动力学模型和准二级动力学模型已经被广泛用于描述微生物吸附过程的动力学行为,且多数实验结果符合准二级动力学模型[18, 30-31]。
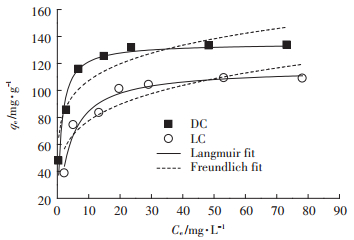
为了分析DC和LC吸附Pb(Ⅱ)的吸附动力学行为,实验结果使用准一级动力学模型(公式3)和准二级动力学模型进行拟合(公式4)[32]。

|
(3) |
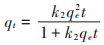
|
(4) |
式中:qt是t(min)时间吸附剂对Pb(Ⅱ)的吸附量,mg·g-1;k1和k2分别为准一级动力学和准二级动力学模型的吸附速率常数,min-1和g·mg-1·min-1。实验数据拟合见图 6和表 1。
|
|
表 1 DC和LC对Pb(Ⅱ)的吸附动力学参数 Table 1 Kinetic parameters for the adsorption of DC and LC for Pb(Ⅱ) |
从表 1可知,DC和LC对Pb(Ⅱ)的吸附结果表明,准一级动力学模型拟合的相关系数r2低于准二级动力学模型,因此,DC和LC对Pb(Ⅱ)的吸附更符合准二级动力学模型,说明两种吸附剂的吸附过程主要是化学吸附过程,化学吸附是速率控制步骤。
2.2.4 初始浓度的影响和吸附等温线吸附等温线的实验和之前的实验是一个相似的过程,配制100 mL初始浓度分别为10、20、30、40、50、75、100 mg·L-1的Pb(Ⅱ)溶液,分别加入DC和LC,吸附剂浓度为0.2 g·L-1,溶液pH=5.5,在30 ℃的条件下,反应60 min,研究不同初始Pb(Ⅱ)浓度对DC和LC吸附效果的影响,实验结果如图 7所示。在Pb(Ⅱ)浓度较低时,DC和LC对Pb(Ⅱ)的吸附量随着初始Pb(Ⅱ)浓度的增加而明显增加,表明初始Pb(Ⅱ)浓度在吸附过程中具有重要的作用,能够在铅离子之间产生驱动力,从而降低溶液中的Pb(Ⅱ)和吸附剂上吸附的Pb(Ⅱ)之间的传质阻力,因此能够加强Pb(Ⅱ)与吸附剂DC和LC之间的有效碰撞。当溶液中的Pb(Ⅱ)浓度超过一定值后(本实验是50 mg· L-1),吸附量接近一个常数,这可能是因为吸附剂表面的吸附位点达到吸附饱和。
|
图 7 吸附等温线及Langmuir和Freundlich模型拟合 Figure 7 Adsorption isotherms and the fitting results by Langmuir and Freundlich models |
为了更充分地描述DC和LC对Pb(Ⅱ)的吸附特点,实验结果使用Langmuir模型(公式5)和Freundlich(公式6)模型进行拟合[33]。

|
(5) |

|
(6) |
式中:qmax是预测的吸附剂对Pb(Ⅱ)的最大吸附量,mg·g-1;KL是Langmuir常数,L·mg-1;KF是Freundlich常数;1/n是经验参数。实验数据拟合结果见图 7和表 2。
|
|
表 2 Langmuir和Freundlich模型拟合结果 Table 2 Fitting results of adsorption isotherms based upon Langmuir and Freundlich models |
从表 2中的结果可知,Langmuir模型拟合的相关系数r2明显大于Freundlich模型,说明DC和LC对Pb(Ⅱ)的吸附结果更符合Langmuir模型,吸附过程为单分子层吸附。Langmuir模型由预测的最大吸附量(qmax)和常数KL决定,DC和LC的qmax分别为134.92 mg·g-1和116.18 mg·g-1,且DC的KL(0.887 2)明显大于LC(0.266 9),从qmax和KL的对比可知,DC比LC具有更强的吸附Pb(Ⅱ)的能力。Freundlich模型的特征由KF和n决定,KF和n值越大说明吸附剂与金属的亲和力越强。从Freundlich模型拟合的结果可知,DC的KF和n值明显大于LC,说明DC与Pb(Ⅱ)的结合能力高于LC,因此DC对Pb(Ⅱ)的吸附量高于LC。
2.2.5 温度的影响和吸附热力学计算配制100 mL初始浓度为50 mg·L-1的Pb(Ⅱ)溶液,分别加入DC和LC,吸附剂浓度为0.2 g·L-1,调节溶液pH为5.5,在温度分别为25、30、35、40 ℃的条件下,反应60 min,研究温度对DC和LC吸附效果的影响。根据DC和LC在不同温度下对Pb(Ⅱ)吸附平衡数据,计算吸附过程中的热力学参数如吉布斯自由能变ΔG、焓变ΔH和熵变ΔS,具体计算过程如下:
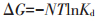
|
(7) |
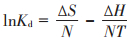
|
(8) |
式中:N为理想气体常数8.314 J·mol-1·K-1;T为温度,K;Kd为在温度T时的平衡常数。使用lnKd对1/T作图拟合,焓变ΔH和熵变ΔS可以使用所得线性图的斜率和截距计算。实验结果见图 8和表 3。
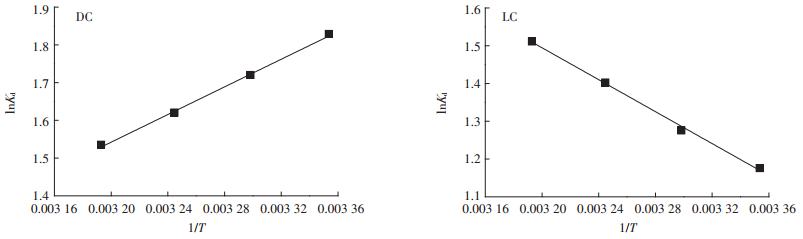
|
图 8 lnKd对1/T绘图 Figure 8 Plot of lnKd versus 1/T |
|
|
表 3 DC和LC吸附Pb(Ⅱ)的热力学参数 Table 3 Thermodynamic parameters for the adsorption of Pb2+ by DC and LC |
从表 3可知,DC和LC在不同温度下吸附Pb(Ⅱ)的ΔG均为负数,表明DC和LC吸附水溶液中Pb(Ⅱ)均是自发进行的。对于DC吸附Pb(Ⅱ),ΔG的绝对值随着温度增加而减小,表明吸附的自发能力越小;且ΔH为-15.26 kJ·mol-1,ΔH为负值表明DC吸附Pb(Ⅱ)是一个放热过程,温度升高不利于吸附过程的进行;ΔS < 0,说明DC对Pb(Ⅱ)的吸附过程为熵减的过程,吸附过程的随机性减小。此结果与吴涓等[34]研究灭活的黄孢原毛平革菌(Phanerochaete chrysosporium)对铅的吸附为自发放热的过程一致。对于LC吸附Pb(Ⅱ),其表现出与DC相反的结果,ΔG的绝对值随着温度增加而增加,吸附的自发能力也就越大;ΔH > 0和ΔS > 0,表明LC吸附Pb(Ⅱ)是吸热过程且吸附过程中固液界面的随机性增加。
2.3 吸附机理分析 2.3.1 FTIR分析FTIR是一种分析吸附剂表面官能团组成的有效手段。图 9展示了LC和DC吸附Pb(Ⅱ)前及DC吸附Pb(Ⅱ)后(DC-Pb)的FTIR光谱。从图 9 LC吸附Pb(Ⅱ)前的FTIR光谱可知,3467 cm-1和2923 cm-1分别为-OH/-NH2重叠峰和C-H的不对称伸缩振动,该区域出现的峰为糖类典型的特征峰[19];1670 cm-1由酰胺Ⅰ带中C=O和C-N伸缩产生,1549 cm-1为酰胺Ⅱ带中C-N伸缩及N-H弯曲振动产生,1245 cm-1属于酰胺Ⅲ带中C-N伸缩产生的吸收峰,以上特征峰表明克雷伯氏菌活细胞中存在蛋白质;1421 cm-1为-COOH对称伸缩的吸收峰,1083 cm-1为糖环中乙醇的C-O伸缩[18];721~964 cm-1为磷脂质或磷酸核糖基焦磷酸链中P-O-C和P-O-P伸缩振动[15]。由上述特征峰分析可知,克雷伯氏菌活细胞的主要成分为多糖、蛋白质和磷脂,含有羟基、氨基、羧基及磷酸基。对比LC和DC的FTIR光谱,可知在经过高温灭菌后,失活的死细胞和活细胞的红外光谱有明显的不同。DC的-OH/-NH2重叠峰的峰位置发生变化及C-H峰强变弱;酰胺Ⅰ带和酰胺Ⅱ带的峰明显增强;-COOH和糖环中乙醇C-O的峰强变弱且峰位置发生了偏移;721~964 cm-1吸收峰消失。上述变化表明,经过高温处理后克雷伯氏菌细胞组成成分多糖、蛋白质及磷脂受到了影响,但是酰胺Ⅰ带和酰胺Ⅱ带明显增强,表明暴露出了更多的氨基。DC吸附后,在574 cm-1出现一个新峰,表明Pb(Ⅱ)已成功被DC吸附。羟基、氨基和羧基的特征峰峰位置均发生了偏移或峰强减弱,说明它们均参与了DC对Pb(Ⅱ)的吸附过程,通过络合配位、静电作用和化学吸附反应等作用去除Pb(Ⅱ)。但是DC对Pb(Ⅱ)的吸附效果明显提高,可能是因为更多氨基的暴露和721~964 cm-1吸收峰消失。氨基基团的增多,使DC和Pb(Ⅱ)之间的络合配位及静电作用增强;721~964 cm-1吸收峰消失,表明经过高温处理后,细胞壁不再完整,因此死细胞的细胞壁的渗透性增强使重金属能够更容易进入细胞内部,从而提高了吸附能力。
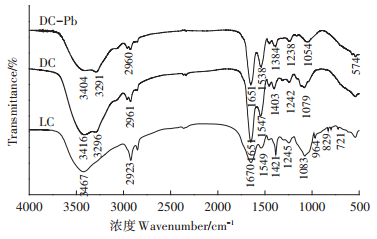
|
图 9 LC和DC吸附Pb(Ⅱ)前及DC吸附Pb(Ⅱ)后的红外光谱 Figure 9 FTIR spectra of before adsorption of LC and DC for Pb(Ⅱ) and after adsorption of Pb(Ⅱ) by DC |
使用X射线光电子能谱技术,对比LC、DC和DC吸附Pb(Ⅱ)后的样品(DC-Pb)之间的差异,结果见图 10和图 11。从图 10 LC、DC和DC-Pb全谱图可知,DC在吸附Pb(Ⅱ)后,有明显的元素Pb的峰产生,表明Pb(Ⅱ)确实吸附到了DC的表面。为了进一步分析DC和LC的不同以及DC吸附Pb(Ⅱ)起主要作用的基团,对N1s和O1s的峰进行分峰拟合,实验结果如图 11所示。对于N1s,LC仅在399.41 eV处拟合出NH2的一个峰,而DC在400.72、400.10 eV和399.30 eV处分别拟合出NH3+、N-C=O和NH2对应的峰[35]。说明经过高温灭菌处理后,有更多的氨基基团暴露出来,此结果与FTIR的分析结果一致。而DC在吸附Pb(Ⅱ)后,可以看出氨基基团的峰位置及峰面积比均发生了变化,N-C=O和NH2的峰面积比分别由吸附前的41.17%和38.67%降低至37.42%和33.12%,说明氨基基团参与了吸附过程。对比LC、DC和DC-Pb的O1s的分峰拟合结果可知,LC在533.16、532.51、531.62 eV和530.75 eV处分别拟合出O-P、C-O、O=CO和O=C-NH2的峰[36-37]。DC中O-P和O=C-O的峰面积比低于LC,但C-O和O=C-NH2的峰面积比增加,表明高温处理破坏了克雷伯氏菌细胞壁的完整性,使其他基团更多的暴露出来。在DC吸附Pb(Ⅱ)后,CO、O=C-O和O=C-NH2的结合能和峰面积比均比吸附前明显减少,表面含氧的羟基、羧基和氨基参与了反应。羟基、羧基和氨基可以通过离子交换、表面络合和静电吸引等作用结合重金属离子[38]。对于含有氨基的基团,吸附后变化最为明显,说明氨基基团在吸附过程中的贡献最大。
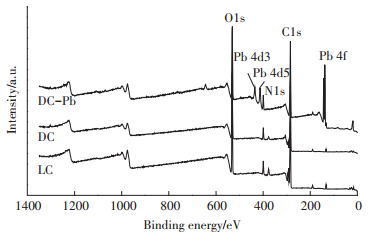
|
图 10 LC、DC和DC-Pb的XPS全谱图 Figure 10 XPS spectrum of LC, DC and DC-Pb |

|
图 11 LC、DC和DC-Pb的N1s及O1s的XPS谱图 Figure 11 XPS spectra of N1s and O1s for the LC, DC and DC-Pb |
(1)克雷伯氏菌死细胞(DC)和活细胞(LC)均能够有效去除水中的Pb(Ⅱ),在各实验条件下,DC对Pb(Ⅱ)的吸附量明显高于LC。
(2)SEM和比表面积分析可知,DC比LC具有更大的比表面积,是由于高温处理破坏了细胞的完整性且增加了细胞的通透性;Zeta电位分析表明在不同pH值条件下,在等电点之后DC比LC带有更多的负电荷,从而利于DC细胞与金属离子之间通过静电作用结合。
(3)利用FTIR和XPS分析表明,经过高温处理过的DC表面暴露出更多的氨基基团,从而对Pb(Ⅱ)具有更强的结合能力;DC中吸附Pb(Ⅱ)的官能团有羟基、羧基和氨基,其中氨基起主要作用。
(4)本研究选用的克雷伯氏菌是一种具有致病性的微生物。但是从本研究的结果可知,实验中选用的克雷伯氏菌经过高温灭活后无毒的死细胞比活细胞对Pb(Ⅱ)具有更高的吸附能力。实验结果一方面为克雷伯氏菌在实际生产应用中提供了理论指导,另一方面表明克雷伯氏菌经过高温处理失去活性后为一种绿色、环保的生物吸附剂,大幅提高了其在处理含重金属废水的过程中的利用潜力及实际应用的意义。
| [1] |
Akar S T, Arslan D, Alp T. Ammonium pyrrolidine dithiocarbamate anchored Symphoricarpus albus biomass for lead (Ⅱ) removal:Batch and column biosorption study[J]. Journal of Hazardous Materials, 2012, 227/228: 107-117. DOI:10.1016/j.jhazmat.2012.05.020 |
| [2] |
Anastopoulos I, Massas I, Ehaliotis C. Composting improves biosorption of Pb2+, and Ni2+, by renewable lignocellulosic materials. Characteristics and mechanisms involved[J]. Chemical Engineering Journal, 2013, 231(17): 245-254. |
| [3] |
Hasan H A, Abdullah S R S, Kofli N T, et al. Interaction of environmental factors on simultaneous biosorption of lead and manganese ions by locally isolated Bacillus cereus[J]. Journal of Industrial and Engineering Chemistry, 2016, 37: 295-305. DOI:10.1016/j.jiec.2016.03.038 |
| [4] |
胡晓婧, 藏婷婷, 顾海东, 等. 平菇菌糠对废水中铜离子的生物吸附性能[J]. 环境科学, 2014, 35(2): 669-677. HU Xiao-jing, ZANG Ting-ting, GU Hai-dong, et al. Biosorption characteristics of Cu2+ by spent substrate of pleurotus oyster[J]. Environmental Science, 2014, 35(2): 669-677. |
| [5] |
Wang J L, Chen C. Biosorbents for heavy metals removal and their future[J]. Biotechnology Advances, 2009, 27(2): 195-226. DOI:10.1016/j.biotechadv.2008.11.002 |
| [6] |
Shameer S. Biosorption of lead, copper and cadmium using the extracellular polysaccharides (EPS) of Bacillus sp. from solar salterns[J]. Biotech, 2016, 6(2): 194-204. |
| [7] |
Ha J Y, Gélabert A, Spormann A M, et al. Role of extracellular polymeric substances in metal ion complexation on Shewanella oneidensis:Batch uptake, thermodynamic modeling, ATR-FTIR, and EXAFS study[J]. Geochimica et Cosmochimica Acta, 2010, 74(1): 1-15. DOI:10.1016/j.gca.2009.06.031 |
| [8] |
Yin Y R, Hu Y Y, Xiong F. Biosorption properties of Cd(Ⅱ), Pb(Ⅱ), and Cu(Ⅱ) of extracellular polymeric substances (EPS) extracted from Aspergillus fumigatus and determined by polarographic method[J]. Environmental Monitoring and Assessment, 2013, 185(8): 6713-6718. DOI:10.1007/s10661-013-3059-9 |
| [9] |
Vijayaraghavan K, Yun Y S. Bacterial biosorbents and biosorption[J]. Biotechnology Advances, 2008, 26(3): 266-291. DOI:10.1016/j.biotechadv.2008.02.002 |
| [10] |
Zhang W, Wang F H, Wang P I, et al. Facile synthesis of hydroxyapatite/yeast biomass composites and their adsorption behaviors for lead (Ⅱ)[J]. Journal of Colloid and Interface Science, 2016, 477: 181-190. DOI:10.1016/j.jcis.2016.05.050 |
| [11] |
Montazer-Rahmati M M, Rabbani P, Abdolali A, et al. Kinetics and equilibrium studies on biosorption of cadmium, lead, and nickel ions from aqueous solutions by intact and chemically modified brown algae[J]. Journal of Hazardous Materials, 2011, 185(1): 401-407. DOI:10.1016/j.jhazmat.2010.09.047 |
| [12] |
杨婷.微生物细胞表面的化学/基因改性调控用于重金属分离及(形态)分析[D].沈阳: 东北大学, 2013. YANG Ting. Chemical/genetical modification of microbial cell for heavy metal separation and analysis/speciation[D]. Shenyang: Northeastern University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10145-1016011625.htm |
| [13] |
Velásquez L, Dussan J. Biosorption and bioaccumulation of heavy metals on dead and living biomass of Bacillus sphaericus[J]. Journal of Hazardous Materials, 2009, 167(1/2/3): 713-716. |
| [14] |
Huang F, Dang Z, Guo C L, et al. Biosorption of Cd(Ⅱ) by live and dead cells of Bacillus cereus RC-1 isolated from cadmium-contaminated soil[J]. Colloids and Surfaces B:Biointerfaces, 2013, 107(4B): 11-18. |
| [15] |
Du L N, Wang B, Li G, et al. Biosorption of the metal-complex dye Acid Black 172 by live and heat-treated biomass of Pseudomonas sp.strain DY1:Kinetics and sorption mechanisms[J]. Journal of Hazardous Materials, 2012, 205/206(3): 47-54. |
| [16] |
Sayyadi S, Ahmady-Asbchin S, Kamali K. Biosorption of Cd(Ⅱ) and Cs(Ⅰ) from aqueous solution by live and dead cells of Saccharomyces carlsbergensis PTCC 5051[J]. Environmental Technology, 2017, 39(4): 1-7. |
| [17] |
Malkoc S, Kaynak E, Guven K. Biosorption of zinc(Ⅱ) on dead and living biomass of Variovorax paradoxus and Arthrobacter viscosus[J]. Desalination and Water Treatment, 2016, 57(33): 15445-15454. DOI:10.1080/19443994.2015.1073181 |
| [18] |
Muñoz A J, Espínola F, Moya M, et al. Biosorption of Pb(Ⅱ) ions by Klebsiella sp. 3S1 isolated from a wastewater treatment plant:Kinetics and mechanisms studies[J]. Biomed Research International, 2015(9): 1-12. |
| [19] |
信欣, 姚力, 崔钶, 等. 耐铅产絮克雷伯氏菌胞外聚合物EPS-07吸附水中Pb(Ⅱ)的特性[J]. 中国有色金属学报, 2012, 22(9): 2667-2675. XIN Xin, YAO Li, CUI Ke, et al. Sorption characteristics of Pb(Ⅱ) from aqueous solution by extracellular polymeric substance (EPS-07) of lead-resistant and producing flocculant strain Klebsiella pneumonia[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(9): 2667-2675. |
| [20] |
Yang J, Wei W, Pi S, et al. Competitive adsorption of heavy metals by extracellular polymeric substances extracted from Klebsiella sp. J1[J]. Bioresource Technology, 2015, 196: 533-539. DOI:10.1016/j.biortech.2015.08.011 |
| [21] |
Zhang D, Zhu L Z, Li F. Influences and mechanisms of surfactants on pyrene biodegradation based on interactions of surfactant with a Klebsiella oxytoca strain[J]. Bioresource Technology, 2013, 142(142C): 454-461. |
| [22] |
Alqadami A, Naushad M, Alothman Z A, et al. Novel metal-organic framework (MOF) based composite material for the sequestration of U(Ⅵ) and Th(Ⅳ) metal ions from aqueous environment[J]. Acs Applied Materials and Interfaces, 2017, 9(41): 36026-36037. DOI:10.1021/acsami.7b10768 |
| [23] |
Cao Q, Liu Y C, Wang C Z, et al. Phosphorus-modified poly (styreneco-divinylbenzene) -PAMAM chelating resin for the adsorption of uranium (Ⅵ) in aqueous[J]. Journal of Hazardous Materials, 2013, 263: 311-321. DOI:10.1016/j.jhazmat.2013.05.039 |
| [24] |
Reddy D H K, Lee S M. Three-dimensional porous spinel ferrite as an adsorbent for Pb(Ⅱ) removal from aqueous solutions[J]. Industrial & Engineering Chemistry Research, 2013, 52(45): 15789-15800. |
| [25] |
He C, Zhou Q, Duan Z, et al. One-step synthesis of a β-cyclodextrin derivative and its performance for the removal of Pb(Ⅱ) from aqueous solutions[J]. Research on Chemical Intermediates, 2018, 44(5): 2983-2998. DOI:10.1007/s11164-018-3289-0 |
| [26] |
王婧瑶.黑曲霉-稻草秸秆复合吸附剂吸附重金属离子特征及机制研究[D].哈尔滨: 哈尔滨工业大学, 2017. WANG Jing-yao. Biosorption efficiency and mechanism of heavy metal from aqueous solution using Aspergillus niger-treated rice straw[D]. Harbin: Harbin Institute of Technology, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10213-1017862632.htm |
| [27] |
Li F Z, Li D M, Li X L, et al. Microorganism-derived carbon microspheres for uranium removal from aqueous solution[J]. Chemical Engineering Journal, 2016, 284: 630-639. DOI:10.1016/j.cej.2015.09.015 |
| [28] |
王彤彤, 马江波, 曲东, 等. 两种木材生物炭对铜离子的吸附特性及其机制[J]. 环境科学, 2017, 38(5): 2161-2171. WANG Tong-tong, MA Jiang-bo, QU Dong, et al. Characteristics and mechanism of copper adsorption from aqueous solutions on biochar produced from sawdust and apple branch[J]. Environmental Science, 2017, 38(5): 2161-2171. |
| [29] |
常春, 王胜利, 郭景阳, 等. 不同热解条件下合成生物炭对铜离子的吸附动力学研究[J]. 环境科学学报, 2016, 36(7): 2491-2502. CHANG Chun, WANG Sheng-li, GUO Jing-yang, et al. Adsorption kinetics and mechanism of copper ion on biochar with different pyrolysis condition[J]. Acta Scientiae Circumstantiae, 2016, 36(7): 2491-2502. |
| [30] |
SŞeyda Tasşar, Kaya F, Özer A. Biosorption of lead (Ⅱ) ions from aqueous solution by peanut shells:Equilibrium, thermodynamic and kinetic studies[J]. Journal of Environmental Chemical Engineering, 2014, 2(2): 1018-1026. DOI:10.1016/j.jece.2014.03.015 |
| [31] |
喻浪风, 吴平霄, 陈梅青, 等. 铜绿假单胞菌负载Fe (Ⅲ)对水中六价铬的生物吸附性能研究[J]. 环境科学学报, 2017, 37(10): 3702-3712. YU Lang-feng, WU Ping-xiao, CHEN Mei-qing, et al. Biosorption of hexavalent chromium on Pseudomonas aeruginosa pretreated with Fe(Ⅲ)[J]. Acta Scientiae Circumstantiae, 2017, 37(10): 3702-3712. |
| [32] |
Bhat S V, Melo J S, Chaugule B, et al. Biosorption characteristics of uranium (Ⅵ) from aqueous medium onto Catenella repens, a red alga[J]. Journal of Hazardous Materials, 2008, 158(2/3): 628-635. |
| [33] |
Stojakovic D, Hrenovic J, Mazaj M, et al. On the zinc sorption by the Serbian natural clinoptilolite and the disinfecting ability and phosphate affinity of the exhausted sorbent[J]. Journal of Hazardous Materials, 2011, 185(1): 408-415. DOI:10.1016/j.jhazmat.2010.09.048 |
| [34] |
吴涓, 钟升, 李玉成. 黄孢原毛平革菌(Phanerochaete chrysosporium)对Pb2+的生物吸附特性及吸附机理[J]. 环境科学研究, 2010, 23(6): 754-761. WU Juan, ZHONG Sheng, LI Yu-cheng. Biosorption characteristics and mechanism of Pb2+ by Phanerochaete chrysosporium[J]. Research of Environmental Sciences, 2010, 23(6): 754-761. |
| [35] |
Yu J X, Cai X L, Feng L Y, et al. Synergistic and competitive adsorption of cationic and anionic dyes on polymer modified yeast prepared at room temperature[J]. Journal of the Taiwan Institute of Chemical Engineers, 2015, 57: 98-103. DOI:10.1016/j.jtice.2015.05.018 |
| [36] |
Wang K, Liu Q. Adsorption of phosphorylated chitosan on mineral surfaces[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2013, 436(35): 656-663. |
| [37] |
Yu J, Tong M, Sun X, et al. A simple method to prepare poly (amic acid) -modified biomass for enhancement of lead and cadmium adsorption[J]. Biochemical Engineering Journal, 2007, 33(2): 126-133. DOI:10.1016/j.bej.2006.10.012 |
| [38] |
王耀, 梅向阳, 段正洋, 等. 生物炭及其复合材料吸附重金属离子的研究进展[J]. 材料导报, 2017, 31(19): 135-143. WANG Yao, MEI Xiang-yang, DUAN Zheng-yang, et al. Advances in adsorption of heavy metal ions by biochar and its composites[J]. Materials Review, 2017, 31(19): 135-143. DOI:10.11896/j.issn.1005-023X.2017.019.019 |
 2018, Vol. 37
2018, Vol. 37