2. 中国科学院沈阳应用生态研究所, 沈阳 110016
2. Institute of Applied Ecology, Chinese Academic of Sciences, Shenyang 110016, China
20世纪90年代中期以来,我国设施蔬菜生产蓬勃发展,2016年全国设施蔬菜播种面积548万hm2,总产量约2.8亿t,分别占全国蔬菜总播种面积和总产量的24.5%和35.1%[1]。设施蔬菜生产在满足人们常年食用各类新鲜蔬菜的同时,也因为氮磷过量输入、尾菜处置不当等引起一系列环境问题。氮肥过量使用容易导致土壤硝氮过量积累,严重时会产生土壤酸化和次生盐渍化等现象[2]。硝氮过量积累容易加剧硝氮流失,污染地表和地下水体[3],也容易导致叶菜类和根茎类蔬菜过量吸收硝氮,降低蔬菜品质[4]。饮食中的硝酸盐80%左右通过蔬菜进入人体,硝酸盐易在人体内还原成亚硝酸盐,危害健康[5]。因此,控制设施土壤硝氮积累,不仅关系到土壤质量、蔬菜品质和水环境安全,而且也关系到人们的身体健康。
休闲期土壤还原处理既是一种土壤生物消毒方法,也是一种削减土壤硝氮盈余的有效办法[6]。土壤的还原处理一般需要外加碳源来提供电子供体。甲醇等水溶性碳源使用成本较高,但可以方便地通过灌溉方式添加;秸秆类固体碳源使用成本低,但添加操作麻烦。蔬菜生长时期灌溉水中含有的适量碳源也可以调控土壤硝氮积累,但需要考虑土壤质地、土壤水分和碳源的共同影响,操作不当可能导致蔬菜减产[7]。
蔬菜生产加工环节产生的废弃物(尾菜)占蔬菜产量的30%以上,处置不当容易引起环境污染[8]。因此,尾菜无害化和资源化利用成为治理设施蔬菜生产环境问题的一个重要部分。现有的尾菜资源化利用有3个基本途径:饲料化、肥料化和能源化[9]。叶菜类尾菜因易腐烂、硝酸盐含量高一般不适合用于饲料生产。尾菜堆沤和堆肥容易污染空气,其有机组分大都被降解为二氧化碳;尾菜厌氧消化同时可得到能源物质甲烷和液体肥料沼液,但控制要求高,有规模要求,实用性差。
本文按照“以废治废”的思路,开展低成本资源化利用叶菜尾菜中的有机组分和矿质养分的研究。首先采用简单调控的厌氧发酵处理将叶菜尾菜转化为富含水溶性有机碳(SOC)和活性矿质养分的酸性发酵液,然后将发酵液用于调控设施土壤硝氮积累和蔬菜生长,其中,高剂量下主要作为碳源,用于休闲期还原处理高硝态氮积累设施土壤(高硝土壤)以削减硝氮盈余;中低剂量下作为土壤综合调理剂,用于蔬菜生长期调控土壤硝氮积累和蔬菜生长。
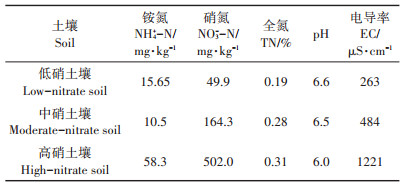
1 材料与方法 1.1 材料与试剂尾菜厌氧发酵所用原料为大白菜尾菜。盆栽蔬菜为散叶生菜。设施土壤还原处理和盆栽生菜所用的3种含硝氮设施土壤取自辽宁省铁岭县新台子镇诸民屯村蔬菜大棚表层土壤(0~20 cm),相关指标如表 1。所有土壤自然风干,过5 mm筛,均匀搅拌后用于盆栽试验和土壤还原处理试验。
|
|
表 1 试验设施土壤相关指标 Table 1 Related properties of tested greenhouse soil |
大白菜尾菜在没有接种发酵菌剂的情况下厌氧发酵,并每隔一段时间取样测定发酵液中的相关指标。处理结束后获得的发酵液含有活性氮磷钾钙镁等养分和大量的SOC,用于高硝土壤还原处理,削减土壤硝氮盈余;浇灌形式用于盆栽生菜,调控低硝和中硝土壤硝氮积累和生菜生长。
1.2.1 大白菜尾菜厌氧发酵将选取的新鲜大白菜尾菜切成5~7 cm的小段,搅拌均匀,准确称取2.5 kg置于塑料桶(高40 cm、直径32 cm)中,加入自来水,控制水菜比为2.4:1,在比较适宜的发酵碳源负荷(25 g·L-1 COD左右)和大棚环境下(15~30 ℃)薄膜覆盖水封厌氧发酵。每5 d取样测定发酵液pH值、水溶性有机物(COD)和有机酸含量。其中,处理一在发酵过程中不进行pH调节,处理二在发酵第18 d,参考发酵液pH值和有机酸含量,添加氧化镁(0.40 g·L-1)适度调高pH至5左右,每个处理两次重复。厌氧发酵30 d后结束,两种处理条件下的发酵液用100目尼龙布过滤后取样测全氮、钠钾钙镁离子含量,然后1:1混合,常温水封储存,用于土壤还原处理和盆栽生菜试验。
1.2.2 高硝土壤还原处理试验本试验模拟大棚休闲期硝酸盐型次生盐化土壤还原处理。向高30 cm、直径4 cm的玻璃管加高硝土壤200 g,保证每个管内形成的土柱高度一致,土壤压实程度一致,然后参考高硝土壤硝氮含量,尽可能地模拟真实情况下土壤还原处理的水分状况,向每个管中添加相同体积的水溶液至土壤刚刚饱和。依据水溶液中的COD含量和添加碳源类型,分为H0(对照)、H1和H2 3个处理,分别含有0或2880 mg·kg-1 COD的白糖或尾菜发酵液碳源,其中,COD的添加剂量是参考土壤还原处理预试验中的好氧菌活动强度和土壤硝氮含量确定。然后用带有针孔的透气膜封口,25 ℃培养箱内培养。培养第3、7、14、21 d测定土壤铵氮和硝氮含量变化,每个处理两次重复。
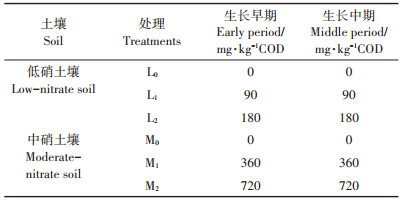
1.2.3 盆栽生菜试验盆栽生菜试验包括两种盆栽土壤,分别为低硝土壤和中硝土壤。每个花盆(高18 cm、直径20 cm)装入2.8 kg低硝或中硝土壤。因为低硝土壤和中硝土壤的硝氮含量和土壤肥力显著不同(表 1),盆栽试验中两种土壤的施肥和尾菜发酵液添加处理有所不同。生菜苗定植后以浇灌形式向低硝土壤中施入磷酸二氢钾(0.5 g·kg-1)和碳酸氢铵(0.25 g·kg-1),中硝土壤不施化肥。依据尾菜发酵液添加情况,低硝和中硝盆栽土壤各包括3个处理(表 2),每个处理3次重复。在生菜生长早期(10 d)和中期(20 d),分别向低硝土壤和中硝土壤以浇灌形式各添加一次尾菜发酵液。使用前测定发酵液COD含量,发酵液COD添加量如表 2。添加尾菜发酵液后的低硝和中硝土壤水分短时间内饱和。盆栽生菜生长过程中,土壤表面用黑色薄膜覆盖减缓水分散失。生菜苗定植后30 d收获测产,并倒出盆栽土壤,混匀后采集土样用于测定土壤无机氮含量,整株生菜纵向取样四分之一,打汁过滤后用于测定蔬菜硝酸盐含量。
|
|
表 2 盆栽土壤尾菜发酵液碳源添加情况 Table 2 Addition of cabbage waste fermentation broth in pot experiment |
尾菜发酵液COD值:快速密闭催化消解法。取3 mL稀释100倍的发酵液于消解管中,加入1 mL掩蔽剂,混匀,依次加入3 mL消解液和5 mL催化剂,置于雷磁COD-571-1装置中,在165 ℃下消解90 min,冷却后用可见分光光度计在600 nm波长下测定吸光度,通过标准曲线方程计算出COD值。发酵液全氮含量:过硫酸钾氧化消煮变为硝酸盐后,用紫外分光光度计(Analytikjena SPECORD 50)分析确定。发酵液阳离子含量:浓硝酸消煮后,稀释20倍,用离子色谱仪(DIONEX ICS-900)分析测定稀释液中的钠钾钙镁离子含量,并依据稀释倍数确定发酵液中的阳离子含量。发酵液有机酸含量:依据发酵液pH与电离非电离有机酸浓度比的对数之间存在的线性关系和多个pH变化区间内的碱度消耗量,估算有机酸含量。发酵液中的水溶性无机磷:滤纸过滤后稀释10倍,稀释液0.2 μm滤膜过滤后用离子色谱仪(DIONEX ICS- 900)分析测定其中的磷酸根含量。生菜硝酸盐:生菜与水1:5打汁滤纸过滤后稀释10倍,稀释液0.2 μm滤膜过滤后用离子色谱仪(DIONEX ICS-900)分析测定其中的硝酸根含量。土壤铵氮、硝氮含量:鲜土过2 mm筛,用浓度为2 mol·L-1的KCl溶液以1:5比例浸提,振荡1 h后过滤,取20 mL过滤液于凯式定氮仪(FOSS KjeltecTM 8100)的消煮管中,依次加入0.2 g氧化镁及0.2 g代氏合金粉,加热,以硫酸标准溶液滴定,由滴定用酸体积及土壤含水率计算铵氮及硝氮含量[10]。用电导率仪(雷磁DDSJ-308A)测定水土比5:1情况下的电导率来反映土壤盐度。用pH计(雷磁pHS-2F)测定土壤pH。
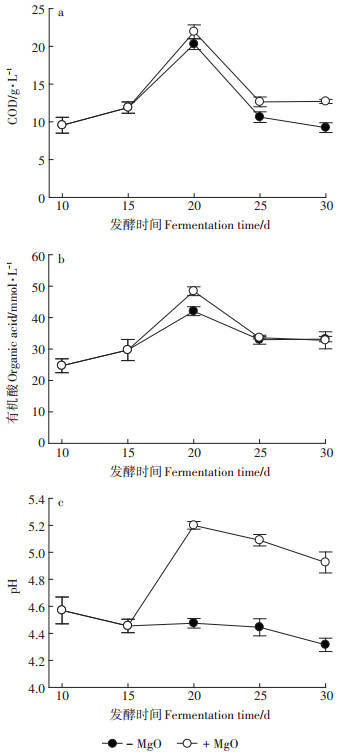
2 结果与讨论 2.1 尾菜厌氧发酵及其产物特征尾菜厌氧发酵过程中的水溶性COD含量、有机酸含量和pH的变化见图 1。不调控pH情况下,COD和有机酸含量随着厌氧发酵进程呈现先升高再降低最后趋于稳定的趋势(图 1a、图 1b),pH的变化趋势则是缓慢降低并趋于稳定(图 1c)。COD和有机酸含量都在处理第20 d达到最大值;20~25 d期间,水溶性COD和有机酸下降;25 d之后有机酸含量趋于稳定,而COD和pH则缓慢下降。厌氧发酵第18 d添加氧化镁,2 d后pH显著提高至5.20(图 1c),促进有机大分子厌氧发酵[11],显著提高有机酸含量(图 1b),25~ 30 d期间水溶性COD含量也显著提高,但有机酸含量并没有增加。
|
图 1 氧化镁对尾菜发酵过程中水溶性COD、有机酸和pH的影响 Figure 1 Effect of magnesium oxide addition on soluble COD, organic acid and pH in fermentation |
选用氧化镁或碳酸镁调控pH可显著提高发酵液中的镁离子含量(从35 mg·L-1上升到223 mg·L-1)。设施农业生产中多用生石灰和石灰氮消毒处理土壤,缓解土壤酸化,这使得钙离子常常过量而镁离子却不足,影响作物生长[12]。镁离子含量适当提高后能够增强尾菜发酵液对设施土壤的调理作用。
尾菜厌氧发酵的pH多在4~5之间,有机酸积累量超过20 mmol·L-1(图 1b、图 1c),很好地抑制了甲烷产生和硫酸盐的生物还原,酸臭味很弱。发酵结束后发酵液简单过滤后可以在常温下水封安全储存。
两种发酵条件下的尾菜发酵液不但富集SOC(图 1a、图 1b),水溶性钾、钙含量也较高且变化范围小,分别为1018~1040 mg·L-1和475~527 mg·L-1,但水溶性氮、水溶性无机磷和钠离子浓度较低,变化范围分别为195~203、127~132 mg·L-1和96~101 mg·L-1,C/N >40,K/Na>10,与沼液-有机肥浸提液的组成大不相同[13]。沼液-有机肥浸提液的C/N较低,氮、钾养分含量相对较高,适合作为水溶性有机肥用于农业生产[14]。高C/N且含多种矿质养分的尾菜发酵液适合用于调控根际土壤异养细菌为主的微生物活性,一定情况下促进土壤铵氮固持和硝氮转化。需要指出的是,本文的尾菜酸性发酵液是在大棚环境下简易调控获取的,其他温度条件下尾菜酸性发酵过程有所不同,其水溶性有机物的含量与组成会有所变化,但其作为速效碳源来源用于调控土壤硝氮累积和蔬菜生长的效果差别应不大。
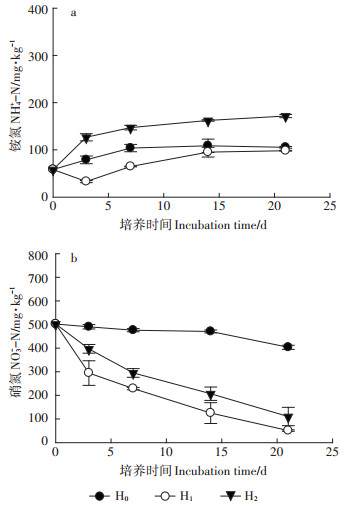
2.2 高硝土壤还原处理试验土壤还原处理21 d期间,对照(H0)土壤铵氮缓慢上升,硝氮缓慢下降,至结束时铵氮含量增加47.2 mg·kg-1,硝氮含量减少98.5 mg·kg-1(图 2)。说明土壤矿化作用较强,并提供碳源促进硝氮反硝化。加入碳源后,反硝化作用显著增强,其中白糖处理(H1)前3 d的反硝化速率更高(图 2),在此之后,两个碳源处理中的硝氮以相似的线性速率减少,至处理结束,硝氮含量分别减少451.0 mg·kg-1和391.4 mg·kg-1。参考培养结束时对照处理的硝氮减少量,添加白糖和发酵液碳源(H2)引起的硝氮去除量实际上分别为352.5 mg·kg-1和292.9 mg·kg-1。依据COD添加量,白糖和发酵液碳源的反硝化利用率均较低,分别为35.0%和30.9%。究其原因,本文土壤还原处理比较接近原位状况,不是理想化的淹水处理,好氧微生物的活动仍很强,消耗了大部分的碳源。发酵液碳源反硝化利用率相当于白糖的88.3%,尾菜发酵液可以替代价格相对昂贵的白糖、甲醇等水溶态碳源,用于土壤还原处理[15],减少土壤还原处理的操作成本。
|
图 2 添加白糖和尾菜发酵液碳源对还原处理土壤中的铵氮和硝氮的影响 Figure 2 Effects of carbon source from sucrose and cabbage waste fermentation broth on ammonium and nitrate change in anaerobic soil incubation |
施用发酵液输入铵氮为主的水溶氮(54.3 mg· kg-1)与3 d时土壤铵氮增量(68.4 mg·kg-1)比较接近,但培养结束时铵氮含量增加至126.7 mg·kg-1,铵氮增量(58.3 mg·kg-1)高于对照处理(47.2 mg·kg-1),说明还原处理期间发酵液碳源整体上促进土壤有机氮矿化。不过,施加发酵液引起的铵氮增量远低于发酵液削减的硝氮含量,因此发酵液可以用于削减土壤硝氮盈余。
土壤还原处理过程中高剂量施用发酵液碳源的同时,也输入较多的水溶态钾离子。当设施土壤硝氮含量不很高(如250 mg·kg-1)且有效钾含量较少时,比较适合用富钾的尾菜发酵液来进行还原处理,还原处理后的土壤用于蔬菜生产可以不施或减施钾肥。与水溶性钾相比,发酵液中水溶态钙镁离子的含量相对较低,基于钾的适宜输入量来确定发酵液施用量,不会导致土壤钙镁离子过量积累。因此,尾菜发酵液用于土壤还原处理,既实现土壤生物消毒[6],又削减硝氮盈余,并循环利用尾菜中的多种矿质养分,避免养分失衡。
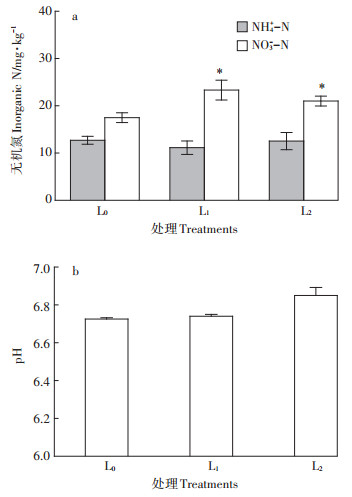
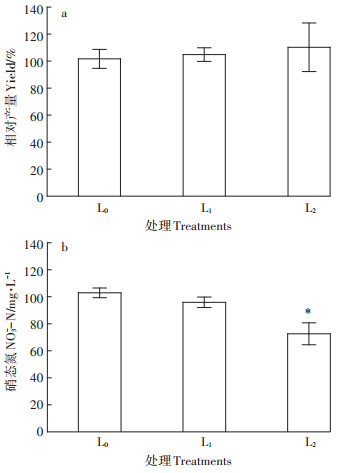
2.3 低硝土壤盆栽试验低硝土壤的硝氮含量较低(49.9 mg·kg-1),碳酸氢铵形式的氮肥施用量(44.3 mg·kg-1)也较低。盆栽生菜收获后的土壤铵氮和硝氮含量均低于20 mg·kg-1(图 3a),生菜硝氮含量相对较低(图 4b),稍高于欧洲生食标准(100 mg·kg-1)。在生菜生长早、中期低剂量添加碳源没有给生菜生长带来不利影响,收获时两个添加发酵液的处理分别增产4.8%和10.2%(图 4a),但差异不显著(P > 0.05),硝酸盐含量均有所降低,其中L2处理硝酸盐含量显著降低29.4%(P < 0.05),满足生食标准(图 4b)。
|
*:以对照L0处理为参比,差异显著(P < 0.05)。处理说明见表 2。下同 *: Difference is significant compared with the L0(control)treatment (P < 0.05). See table 2 for treatment description. The same below 图 3 施用尾菜发酵液对盆栽低硝土壤无机氮和pH的影响 Figure 3 Effects of cabbage waste fermentation broth on inorganic N and pH in potted low-nitrate soil |
|
图 4 施用尾菜发酵液对低硝土壤盆栽生菜产量和硝氮含量的影响 Figure 4 Effects of cabbage waste fermentation broth on lettuce yield and nitrate level in potted low-nitrate soil |
在生菜收获时,与对照L0处理相比,施用尾菜发酵液的L1和L2处理的土壤铵氮含量相近,但硝氮含量分别增加5.8 mg·kg-1和3.5 mg·kg-1(图 3a),差异显著(P < 0.05)。这个增量与添加发酵液引入的水溶性氮含量(3.6~7.2 mg·kg-1)接近,只是L2处理收获时的硝氮增量低于施用发酵液引入的水溶性氮含量,说明添加较高剂量的发酵液碳源有利于短时间促进缺氧环境形成,促进反硝化作用的产生,减缓硝氮积累。相反,L1处理土壤硝氮增加量稍高于发酵液引入的水溶性氮含量,说明低剂量碳源不能促进反硝化作用,反而可能刺激土壤好氧微生物的活性,加快矿化。
总体来说,两种低剂量下施用发酵液碳源对土壤硝氮的调控作用偏小,但发酵液中的小分子有机碳和活性矿质养分利于蔬菜根系生长发育,提高蔬菜产量,也利于硝酸盐在蔬菜体内还原[17],降低了生菜的硝酸盐含量(图 4)。另外,发酵液中有机酸盐矿化后释放碱度,促进pH小幅上升(图 3b)。鉴于设施土壤pH一般偏酸,施用发酵液有利于缓解设施土壤酸化。
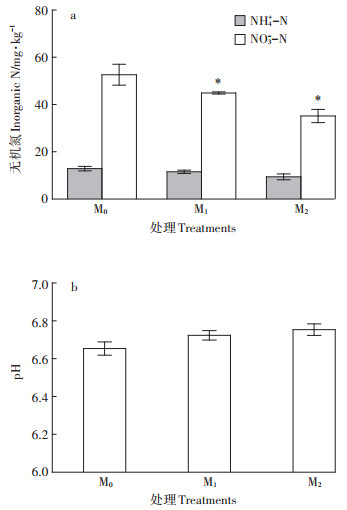
2.4 中硝土壤盆栽试验中硝土壤肥力较高,生菜生长过程中没有施用化肥。盆栽生菜生长30 d收获后,土壤硝氮含量从164.3 mg·kg-1降至52.6 mg·kg-1(图 5a),但生菜硝氮含量偏高(图 6b),不符合生食标准。高剂量添加发酵液碳源对土壤硝氮积累和pH的调控作用明显(图 5)。生菜收获后,与对照M0处理相比,添加尾菜发酵液的M1和M2处理土壤铵氮含量稍低,硝氮含量显著减少了14.6%和33.3%,pH小幅上升(图 5)。考虑到M1和M2施发酵液引入铵氮为主的水溶性氮含量达到14.4 mg·kg-1和28.8 mg·kg-1,发酵液碳源调控土壤铵氮转化和硝氮积累的作用更大。在碳源充足的情况下,土壤微生物优先固持铵氮,固持硝氮的能力很弱[18]。高剂量施用发酵液碳源可能促进部分土壤铵氮固持,但更可能在土壤湿度适宜的情况下促进土壤硝氮的反硝化转化[19-20],M1和M2处理真实削减硝氮含量应分别超过20 mg·kg-1和40 mg·kg-1。不过,考虑到M1和M2处理COD添加总量(720 mg·kg-1和1440 mg·kg-1),发酵液碳源用于土壤硝氮反硝化的比例不超过10%,其余大部分被土壤好氧菌所利用,生菜根系也可能吸收利用少量小分子有机碳源[21]。
|
图 5 施用尾菜发酵液对盆栽中硝土壤无机氮和pH的影响 Figure 5 Effects of cabbage waste fermentation broth application on inorganic N and pH in potted moderate-nitrate soil |
|
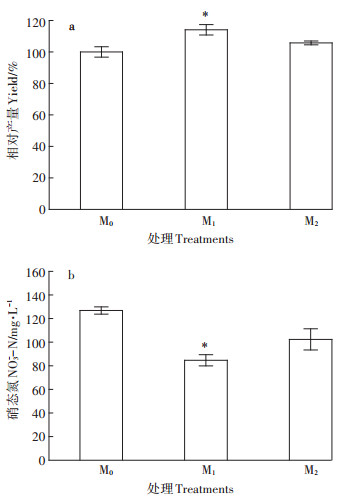
图 6 施用尾菜发酵液对中硝土壤盆栽生菜产量和硝氮含量的影响 Figure 6 Effects of cabbage waste fermentation broth application on lettuce yield and nitrate level in potted moderate-nitrate soil |
土壤水分短时间内基本饱和的情况下,盆栽土壤中引入超过300 mg·kg-1的COD有利于土壤缺氧环境的形成,促进反硝化作用,但却也可能因为缺氧和产生有害物质而对生菜的根系产生负面影响[22]。图 6显示,与对照M0处理相比,M1与M2处理均提高了产量,降低了硝酸盐含量,其中M1处理的效果显著,生菜产量提高14.1%,硝氮含量减少33.2%,完全满足生食标准。M2处理土壤硝氮含量低于M1处理,而蔬菜硝酸盐含量却高于M1处理,说明M2处理条件下根际缺氧状况更利于促进土壤硝氮转化,但也对生菜根系产生更强的胁迫效应,进而对生菜生长和转化利用硝氮产生一定的负面影响,不过,相对于对照M0处理,这种负面效应小于其正面效应,总体效果仍然是提高了生菜产量并减少其硝酸盐含量。
实际生产中,灌溉水中添加速效碳源用于安全削减土壤硝氮盈余和蔬菜硝酸盐含量,还需要综合考虑蔬菜品种、蔬菜生长时期、添加碳源类型以及土壤质地等的影响。对于根系较耐缺氧环境的蔬菜品种,添加速效碳源调控土壤硝氮盈余的风险较小。蔬菜不同生长期内,中期施用碳源的综合效果最好,这是因为生长早期的蔬菜根系发育不够完善,不易确定安全的碳源施用剂量,生长后期施用碳源对削减蔬菜硝酸盐含量作用不大。不同类型的碳源降解速率可能差别较大,进入土壤后的影响也有所不同。已有研究发现,受沼液难降解水溶性大分子有机物的影响,过量或过频施用沼液会对土壤通透性和蔬菜生长产生负面影响[23]。相对于沼液,尾菜发酵液中难降解大分子所占的比例要小很多,应用风险应很小。土壤质地通过影响土壤保水时间来影响碳源调控土壤硝氮转化的效率。因此,施用尾菜发酵液调控土壤硝氮积累和减少蔬菜硝酸盐含量,需要综合考虑上述因素,适时适量添加发酵液,降低蔬菜减产风险。
3 结论(1)厌氧发酵处理尾菜,可以得到SOC含量丰富、矿质养分元素活化、C/N很高(>40)的发酵液。厌氧发酵中途用氧化镁适度提高厌氧发酵的pH可以进一步提高SOC的含量。与沼液和有机肥浸提液相比,发酵液的SOC浓度很高,适合用于休闲期盈余硝氮削减与蔬菜生长期设施土壤积累和蔬菜生长调控。
(2)高剂量下,发酵液适合作为复合碳源用于高硝设施土壤还原处理,削减硝氮盈余,并平衡补充多种矿质养分。实际应用中,需要依据待处理土壤的硝氮含量和有效钾含量确定适宜的发酵液施用量。
(3)中低剂量下,发酵液适合作为综合调理剂,调控蔬菜生长期土壤硝氮积累和蔬菜生长。在生菜生长的早期和中期,土壤水分短时间饱和情况下各添加1次发酵液,低剂量添加发酵液SOC促进低硝土壤硝氮累积少量增加,中剂量添加发酵液SOC显著削减中硝土壤硝氮积累,但均促进蔬菜增产,降低其硝氮含量。
| [1] |
李辉尚, 王晓东, 杨唯, 等. 我国蔬菜市场2017年形势分析与后市展望[J]. 中国蔬菜, 2018(1): 7-12. LI Hui -shang, WANG Xiao-dong, YANG Wei, et al. Analysis of the situation of China's vegetable market in 2017 and outlook for the market[J]. China Vegetables, 2018(1): 7-12. |
| [2] |
蔡祖聪, 颜晓元, 朱兆良. 立足于解决高投入条件下的氮污染问题[J]. 植物营养与肥料学报, 2014, 20(1): 1-6. CAI Zu-cong, YAN Xiao-yuan, ZHU Zhao-liang. A great challenge to solve nitrogen pollution from intensive agriculture[J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(1): 1-6. |
| [3] |
杜鹏祥, 韩雪, 高杰云, 等. 我国蔬菜废弃物资源化高效利用潜力分析[J]. 中国蔬菜, 2015, 1(7): 15-20. DU Peng-xiang, HAN Xue, GAO Jie-yun, et al. Potential analysis on high efficient utilization of waste vegetable resources in China[J]. China Vegetables, 2015, 1(7): 15-20. DOI:10.3969/j.issn.1000-6346.2015.07.004 |
| [4] |
刘咏, 严小三, 张婷. 土壤硝酸盐污染的生物修复试验研究[J]. 合肥工业大学学报(自然科学版), 2010, 33(11): 1686-1689. LIU Yong, YAN Xiao-san, ZHANG Ting. Experimental study of bioremediation of nitrate-contaminated soil[J]. Journal of Hefei University of Technology (Natural Sciences), 2010, 33(11): 1686-1689. |
| [5] |
Bahadoran Z, Mirmiran P, Jeddi S, et al. Nitrate and nitrite content of vegetables, fruits, grains, legumes, dairy products, meats and processed meats[J]. Journal of Food Composition and Analysis, 2016, 51(6): 93-105. |
| [6] |
蔡祖聪, 张金波, 黄新琦, 等. 强还原土壤灭菌防控作物土传病的应用研究[J]. 土壤学报, 2015, 52(3): 469-476. CAI Zu-cong, ZHANG Jin-bo, HUANG Xin-qi, et al. Application of reductive soil disinfestation to suppress soil-bornepathogen[J]. Acta Pedologica Sinica, 2015, 52(3): 469-476. |
| [7] |
夏伟立, 罗安程, 周焱, 等. 污水处理后灌溉对蔬菜产量、品质和养分吸收的影响[J]. 科技通报, 2005, 21(1): 79-83. XIA Wei-li, LUO An-cheng, ZHOU Yan, et al. Yield, nutrient status and quality of leafy vegetables grown in soils irrigated with municipal sewage[J]. Bulletin of Science and Technology, 2005, 21(1): 79-83. DOI:10.3969/j.issn.1001-7119.2005.01.016 |
| [8] |
李俊良, 崔德杰, 孟祥霞, 等. 山东寿光保护地蔬菜施肥现状及问题的研究[J]. 土壤通报, 2002, 33(2): 126-128. LI Jun-liang, CUI De-jie, MENG Xiang-xia, et al. The study of fertilization condition and question in protectorate vegetable in Shouguang, Shandong[J]. Chinese Journal of Soil Science, 2002, 33(2): 126-128. DOI:10.3321/j.issn:0564-3945.2002.02.014 |
| [9] |
戚如鑫, 魏涛, 王梦芝, 等. 尾菜饲料化利用技术及其在畜禽养殖生产中的应用[J]. 动物营养学报, 2018, 30(4): 1297-1302. QI Ru-xin, WEI Tao, WANG Meng-zhi, et al. Technologies of feed utilization for vegetable waste and its application in livestock and poultry production[J]. Chinese Journal of Animal Nutrition, 2018, 30(4): 1297-1302. DOI:10.3969/j.issn.1006-267x.2018.04.012 |
| [10] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. LU Ru-kun. Soil agricultural chemical analysis method[M]. Beijing: China Agricultural Science and Technology Press, 2000. |
| [11] |
Horiuchi J, Shimizu T, Kobayashi M. Selective production of organic acids in anaerobic acid reactor by pH control[J]. Bioresource Technology, 2002, 82(3): 209-213. DOI:10.1016/S0960-8524(01)00195-X |
| [12] |
朱炳良, 马军伟, 叶雪珠, 等. 石灰氮的土壤改良作用及对蔬菜的施用效果研究[J]. 浙江大学学报(农业与生命科学版), 2001, 27(3): 339-342. ZHU Bing-liang, MA Jun-wei, YE Xue-zhu, et al. Effects of lime-nitrogen on soil ameliorate and vegetables production[J]. Journal of Zhejiang University(Agriculture and Life Sciences), 2001, 27(3): 339-342. DOI:10.3321/j.issn:1008-9209.2001.03.026 |
| [13] |
靳红梅, 常志州, 叶小梅, 等. 江苏省大型沼气工程沼液理化特性分析[J]. 农业工程学报, 2011, 27(1): 291-296. JIN Hong-mei, CHANG Zhi-zhou, YE Xiao-mei, et al. Physical and chemical characteristics of anaerobically digested slurry from largescale biogas project in Jiangsu Province[J]. Transactions of the Chinese Society of Agricultural Engineering, 2011, 27(1): 291-296. DOI:10.3969/j.issn.1002-6819.2011.01.047 |
| [14] |
刘荣厚, 郝元元, 叶子良, 等. 沼气发酵工艺参数对沼气及沼液成分影响的实验研究[J]. 农业工程学报, 2006, 22(增刊1): 85-88. LIU Rong-hou, HAO Yuan-yuan, YE Zi-liang, et al. Experimental research on technical parameters of anaerobic fermentation for biogas production[J]. Transactions of the Chinese Society of Agricultural Engineering, 2006, 22(Suppl1): 85-88. |
| [15] |
Kim Y S, Nakano K, Lee T J, et al. On-site nitrate removal of groundwater by an immobilized psychrophilic denitrifier using soluble starch as a carbon source[J]. Journal of Bioscience and Bioengineering, 2002, 93(3): 303-308. DOI:10.1016/S1389-1723(02)80032-9 |
| [16] |
董晓涛.沼液对果菜类蔬菜生长发育调控机制研究[D].长春: 吉林农业大学, 2004. DONG Xiao-tao. Research of regulatory mechanism of anaerobic processed liquid of livestock manures on development of fruiting vegetables[D]. Changchun: Jilin Agricultural University, 2004. http://cdmd.cnki.com.cn/Article/CDMD-10193-2004105291.htm |
| [17] |
Quan Z, Huang B, Lu C Y, et al. The fate of fertilizer nitrogen in a high nitrate accumulated agricultural soil[J]. Scientific Reports, 2016, 6: 1-9. DOI:10.1038/s41598-016-0001-8 |
| [18] |
Čuhel J, Šimek M, Laughlin R J, 等. Insights into the effect of soil pH on N2O and N2 emissions and denitrifier community size and activity[J]. Applied and Environmental Microbiology, 2010, 76(6): 1870-1878. |
| [19] |
Weier K, MacRae I, Myers R. Denitrification in a clay soil under pasture and annual crop:Estimation of potential losses using intact soil cores[J]. Soil Biology and Biochemistry, 1993, 25(8): 991-997. DOI:10.1016/0038-0717(93)90145-2 |
| [20] |
周立祥, 黄峰源, 王世梅. 好氧反硝化菌的分离及其在土壤氮素转化过程中的作用[J]. 土壤学报, 2006, 43(3): 430-435. ZHOU Li-xiang, HUANG Feng-yuan, WANG Shi-mei. Isolation of aerobic denitrifiers and their roles in soil nitrogen transformation[J]. Acta Pedologica Sinica, 2006, 43(3): 430-435. DOI:10.3321/j.issn:0564-3929.2006.03.011 |
| [21] |
朱永官, 王晓辉, 杨小茹, 等. 农田土壤N2O产生的关键微生物过程及减排措施[J]. 环境科学, 2014, 35(2): 792-800. ZHU Yong-guan, WANG Xiao-hui, YANG Xiao-ru, et al. Key microbial processes in nitrous oxide emission of agricultural soil and mitigation strategies[J]. Environmental Science, 2014, 35(2): 792-800. |
 2018, Vol. 37
2018, Vol. 37