2. 农业农村部环境保护科研监测所农业环境污染修复研究中心, 天津 300191
2. Research Centre for Remediation of Agro-Environmental Pollution, Agro-Environmental Protection Institute, Ministry of Agriculture and Rural Affairs, Tianjin 300191, China
重金属镉(Cd)因其污染性强、污染范围广而受到广泛关注。Cd在植物体内积累到一定程度后会抑制光合作用和呼吸作用,甚至导致生物量下降或死亡[1]。水稻是Cd积累能力最强的粮食作物,土壤中的Cd可以通过根系吸收转运到叶片和穗轴中,大气沉降中的Cd也可以通过叶片进入植物体内,在籽粒灌浆期间转运到稻米中[2-3]。稻米中的Cd通过食物链进入人体,危害人体健康[4]。
锌(Zn)是许多蛋白质和酶的重要组成部分,对植物的生长发育起着至关重要的作用[5-6]。研究表明,Zn与Cd会竞争相同载体蛋白进行跨膜运输[7]。加Zn可使水稻、烟草、小麦对Cd的吸收减弱,说明Zn对植物吸收Cd可能存在拮抗作用[8]。施Zn能促进小麦的光合作用,使POD酶活性提高,质膜稳定性增强,还降低了小麦体内脯氨酸的含量,进而加强了小麦对Cd胁迫的抵御能力[9]。此外,Zn可以通过缓解DNA损伤、调控脯氨酸及多胺代谢来降低Cd对植物的毒害[10]。土壤中Zn和Cd之间也存在交互作用。土壤中添加Cd会使Zn的吸附量下降、吸附速率减慢[11]。Zn能与吸附在土壤胶体上的Zn进行离子交换,降低土壤中Zn的有效性,增加土壤中可溶性Zn的含量。随着土壤中Zn浓度的增加,Zn与Cd在配合物上发生显著的竞争吸附,使得土壤中有效态Cd显著增加[12]。
硅(Si)是土壤中第二大元素,植物可以在茎叶中积累丰富的Si。Si能提高植物生长发育过程中抵抗各种生物和非生物胁迫的能力[13]。水稻是一种高积累Si的植物[14]。Si在质外体与Cd形成沉淀是缓解植物体内重金属毒害的主要原因[15]。Si和Cd在一些代谢不活跃的组织尤其是中柱鞘、木质部和韧皮部细胞壁内皮层形成的Si-Cd沉淀也可以抑制Cd的吸收和转运[16]。Si还能将更多的Cd分隔在液泡中或固定在节间[17-18],从而减少Cd在水稻中的移动。这些结果表明,施加Si能通过影响Cd在植物体内的吸收转运来减缓Cd的毒害作用。
虽然一定浓度的Si和Zn都能抑制水稻对Cd的吸收转运,但未见Si-Zn互作方式与水稻Cd吸收转运关系的研究报道。本文以水稻幼苗为材料,通过在根际环境中施加不同浓度的巯基硅和Zn,对水稻幼苗Cd的亚细胞分布特征、必需元素、可溶性蛋白进行研究,探讨了根际环境中添加Si和Zn离子抑制水稻Cd吸收转运的互作机理,从而为降Cd复合肥料的研发提供参考依据。
1 材料与方法以湘早籼24(X24)为供试材料,选用饱满均一的水稻种子,在300 mL 5%的NaClO中浸泡30 min,用去离子水反复冲洗以去除残余的NaClO。水稻种子冲洗干净后均匀放入装有少量水的育苗盘内,放入28 ℃恒温培养箱黑暗培养72 h后移入人工气候室。待水稻长到两叶一心时,选取均一的水稻幼苗移到装有8 L 1/10Hoagland营养液的塑料盆(35 cm×25 cm×12 cm)中进行培养。塑料盆上盖有带小圆孔的硬塑料板,将幼苗用海绵固定在小圆孔内。待水稻长到三叶一心时挑选长势一致的幼苗,在去离子水中饥饿1 d,然后放置于以1/10 Hoagland营养液为基础的不同处理液中处理7 d。水培试验整个过程在人工气候室中进行,昼夜时间为16 h/8 h,昼夜温度为25 ℃/20 ℃,白天光照为105 μmol·m-2·s-1、相对湿度为60%[19]。
1.1 培养与处理方法设置处理液镉(CdCl2)浓度2.7 μmol·L-1,巯基硅浓度为0.05(Si1)、0.1(Si2) mmol·L-1,Zn浓度(ZnSO4·7H2O)分别为0、0.2 mmol·L-1。巯基硅来自深圳百乐宝生物农业科技有限公司,硅含量≥30%,溶解度为75%,明显优于硅酸钠(NaSiO3·H2O)的溶解度36.1%。处理液用HCl和NaOH调节pH至5.5~6。每个处理3次重复。
1.2 样品采集与处理将处理好的水稻幼苗根系用5 mmol·L-1的CaCl2浸泡10 min[20],以吸附去除根系表面的Cd2+,之后用去离子水冲洗干净,用吸水纸吸干表面水分,用剪刀将地上部与根系分开。一部分放入信封,75 ℃恒温烘干,用于全Cd测定;另一部分,分别称取根系和地上部鲜样1 g,用锡纸包裹后放入液氮中冷冻,之后置于-80 ℃储存,用于亚细胞测定。
1.3 Cd、Si含量的测定用剪刀将恒重的样品剪碎,称重后置于消煮管中,加入7 mL HNO3过夜,用消解仪ED54于110 ℃加热2.5 h,冷却后加入1 mL的H2O2,盖盖加热1.5 h,170 ℃开盖赶酸至0.5 mL左右,定容至25 mL,用原子吸收仪(AAS,ZEEnit70d0,Analytikjena,德国)测定样品中Cd含量[21]。
分别吸取Si标液0、0.125、0.25、0.5、1.25、2.5、5 mL定容至50 mL,Si含量分别为0、2.5、5.0、10、25、40、50 μg·mL-1。向10 mL离心管中依次加入2.7 mL去离子水、200 μL Si标液、1.5 mL 0.26 mol·L-1 HCl、200 μL 10%钼酸铵,静止5 min后再加入200 μL 20%酒石酸、200 μL 2%抗坏血酸摇匀静止25 min。样品采用高压灭菌法处理后依次加入药品,600 nm处比色[22]。
1.4 亚细胞组分的测定将冷冻的水稻幼苗放在含有50 mol·L-1 Hanks平衡盐溶液(HEPES)、500 mol·L-1蔗糖溶液、1 mol·L-1二流苏糖醇(DDT)、5 mmol·L-1抗坏血酸和1%(W/V)聚乙烯吡咯烷酮(PVPP)的提取缓冲液中匀浆,并用NaOH调pH至7.5。匀浆液通过尼龙布(100目)过滤,用缓冲液冲洗后100 g离心5 min,沉淀为细胞壁组分(F1)。上清液以10 000 g离心30 min,沉淀为细胞器组分(F2),上清液为胞液组分(F3)。所有步骤均在4 ℃下进行[23]。各组分烘干后按照1.3的步骤测定Cd含量。
1.5 可溶性蛋白的测定称取45.6 g K2HPO4·3H2O和27.2 g KH2PO4放入1 L容量瓶中摇匀,标为A液和B液。将153.8 mL A液和96.2 mL B液加去离子水定容至1 L,配制成pH为7的50 mmol·L-1磷酸缓冲液。将227 mL A液和23 mL B液用去离子水定容至1 L,配制成pH为7.8的0.05 mmol·L-1磷酸缓冲液。称取0.3 g EDTA-Na2和5 g聚乙烯吡咯-K30溶于1 L pH为7的磷酸缓冲液,配制成粗酶提取液。
将新鲜水稻幼苗用去离子水清洗干净,然后各称取0.5 g左右。用液氮研磨,加入8 mL提取液,4 ℃ 10 000 r·min-1离心20 min,取上清液待测。
1.6 数据处理与计算
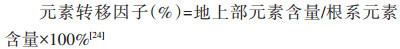
|
Cd在水稻根系和地上部亚细胞组分中的分配比率(%)为各器官亚细胞组分中的Cd含量占各器官Cd总量的百分比。
采用Excel 2007、SPSS 11.5进行数据统计分析和作图。
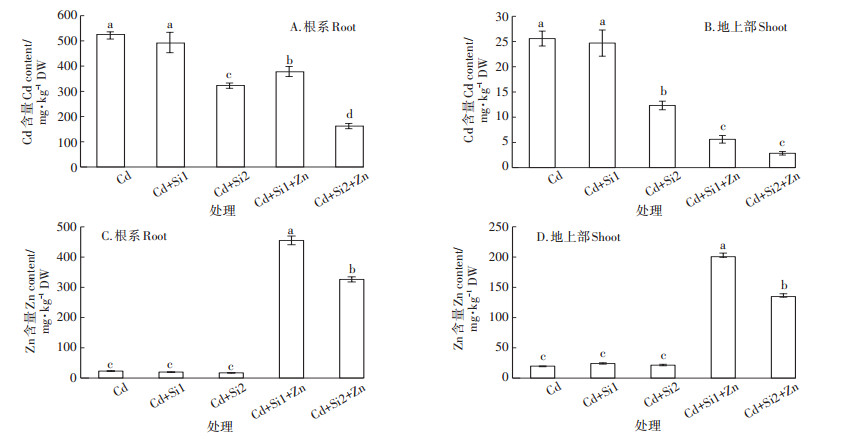
2 结果与分析 2.1 Si-Zn互作对水稻幼苗Cd和Zn含量的影响由图 1所示,施加Si和Zn对水稻根系和地上部Cd含量有显著影响。施加0.05 mmol·L-1和0.1 mmol·L-1巯基硅可使根系Cd积累量下降5.4%~34.6%(图 1A)。地上部Cd积累量分别下降3.5%和51.8%(图 1B)。同时添加0.2 mmol·L-1 Zn和0.05 mmol·L-1 Si或0.1 mmol·L-1 Si使水稻幼苗根系中的Cd含量分别下降27.4%和68.9%,使地上部的Cd含量分别下降78.0%和88.0%。Si和Zn共存时对Cd的抑制效应明显大于单独施加巯基硅的抑制效应,对地上部Cd积累量的抑制效应大于对根系Cd的抑制效应。
|
不同小写字母代表处理间差异达到0.05显著水平 Different letters indicate significant difference between treatments at P < 0.05 level Cd: 2.7 μmol·L-1 Cd, Si1: 0.05 mmol·L-1 Si, Si2: 0.1 mmol·L-1 Si, Si1+Zn: 0.05 mmol·L-1 Si+0.2 mmol·L-1 Zn, Si2+Zn: 0.1 mmol·L-1 Si+0.2 mmol·L-1 Zn.下同。The same below 图 1 Si、Zn处理对Cd胁迫中根系和地上部Cd及Zn含量的影响 Figure 1 Effects of Si and Zn treatments on the concentrations of root Cd, shoot Cd, root Zn and shoot Zn under Cd stress |
单独添加巯基硅对水稻幼苗中的Zn含量没有显著影响。施加0.2 mmol·L-1 Zn后,水稻幼苗根的Zn含量明显高于地上部,锌含量随着添加Zn浓度的增加而大幅升高。和对照相比,Si1+Zn和Si2+Zn处理使水稻根系中的Zn含量分别提高了19倍和14倍(图 1C),使地上部中的Zn含量分别提高了10倍和6倍(图 1D)。
2.2 Si-Zn互作对水稻幼苗亚细胞组分中Cd含量及分配比例的影响水稻根系细胞壁、细胞器和胞液组分中的Cd含量有显著差异。Cd在幼苗根系的亚细胞分布表现为细胞壁>胞液>细胞器(图 2A),在地上部的亚细胞分布表现分别为细胞壁≈胞液≫细胞器(图 2B)。施加Si和Zn显著降低了水稻幼苗亚细胞各组分的Cd含量。其中细胞壁和胞液中的Cd含量下降幅度较大。
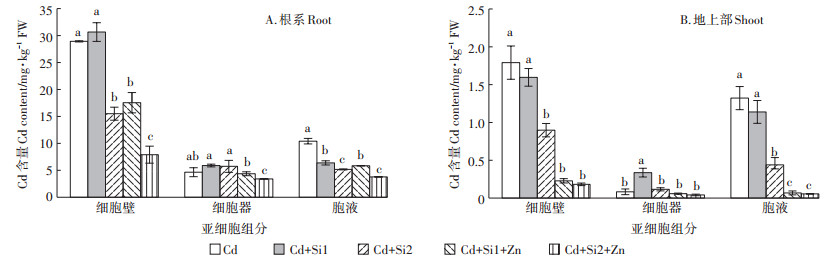
|
图 2 Si、Zn处理对Cd胁迫下幼苗根系和地上部亚细胞中Cd含量的影响 Figure 2 Effects of Si and Zn supply on Cd concentrations in subcellular fraction of roots and shoots in rice seedlings under Cd stress |
如图 2A所示,和Cd处理相比,Cd+Si1处理对根系细胞壁组分中的Cd含量无显著影响,Cd+Si2处理使根系细胞壁组分中的Cd下降了43.8%,但这2种处理使胞液组分中的Cd含量分别下降了38.7%和53.0%。Zn-Si互作显著抑制Cd进入胞液组分的过程。Cd+Si1+Zn和Cd+Si2+Zn处理使细胞壁组分中的Cd含量分别下降了39.2%和79.8%,使胞液组分中的Cd含量分别下降了43.9%和63.7%。Zn-Si互作显著抑制Cd进入细胞壁和胞液组分的过程。如图 2B所示,Cd+Si1和Cd+Si2处理使地上部细胞壁组分中的Cd含量分别降低了18.3%和56.4%,胞液组分中的Cd含量分别下降了14.8%和61.7%。Cd+Si1+Zn和Cd+ Si2+Zn处理使细胞壁中的Cd分别下降了87.2%和91.4%,使胞液中的Cd含量分别下降了95.3%和95.4%。Si-Zn互作对根系细胞壁中Cd积累的抑制作用较弱,对胞液中Cd的积累抑制作用较强。
在根际环境中添加Si和Zn对根系和地上部亚细胞组分中的Cd分配也产生了显著影响。随着Si浓度的增加,根系细胞壁中的Cd分配比例显著下降,和无Si的Cd处理相比,Cd+Si2和Cd+Si2+Zn处理使根系细胞壁中的Cd分配比例分别下降了10%和20.3% (图 3A)。而地上部Cd分配比例的下降主要表现在细胞液组分中,Cd+Si2、Cd+Si1+Zn和Cd+Si2+Zn处理使地上部细胞液中的Cd分配比例分别下降了24.4%、53.4%和51.9% (图 3B)。
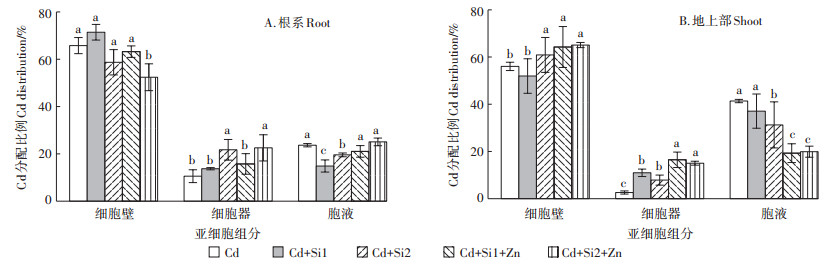
|
图 3 Si、Zn处理对幼苗根系和地上部亚细胞组分中Cd分配比例的影响 Figure 3 Effects of Si and Zn on Cd distribution in subcellular fractions of roots and shoots in rice seedlings under Cd stress |
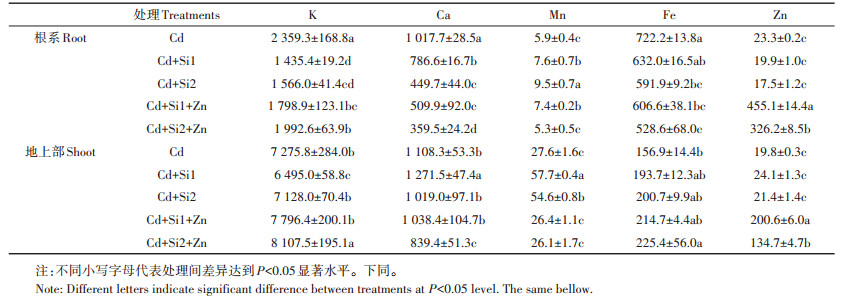
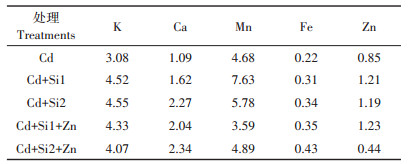
在Cd胁迫环境中,增加0.05~0.1 mmol·L-1的巯基硅,根系中的Ca、Fe含量都显著下降,Mn的含量显著增加(表 1)。和单施Si相比,同时添加Si和Zn时,根系中的K和Zn含量显著增加,而Ca和Mn含量则显著下降。Si-Zn共存时对水稻地上部的K、Fe和Zn含量有明显的促进作用。从转移因子来看,与单施Si相比,Si-Zn互作促进根系中Ca、Fe向地上部的转运,对K、Mn的转运有一定的抑制作用(表 2)。
|
|
表 1 Si和Zn对水稻幼苗根系和地上部必需元素含量的影响(mg·kg-1 DW) Table 1 Effects of Si and Zn on essential elements in rice seedlings under Cd stress(mg·kg-1 DW) |
|
|
表 2 Si和Zn对水稻幼苗必需元素转移因子的影响 Table 2 Effects of Si and Zn on the translocation factors of essential elements in rice seedlings under Cd stress |
与单独的Cd胁迫处理相比,添加0.05 mmol·L-1和0.1 mmol·L-1的巯基硅使根系中的可溶性蛋白含量分别上升14%和44%,Si和Zn共存时,根系中的可溶性蛋白含量可提高20%~45%(图 4A)。但地上部的可溶性蛋白含量在处理间没有显著差异(图 4B)。
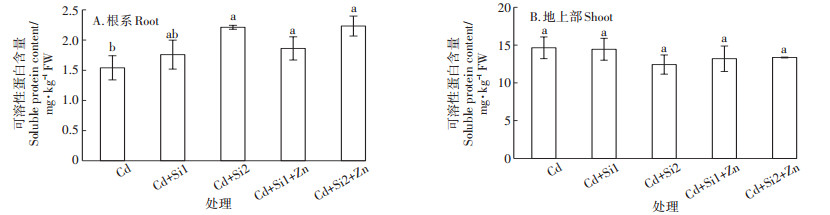
|
图 4 Si、Zn处理对水稻幼苗根系和地上部可溶性蛋白含量的影响 Figure 4 Effects of Si and Zn on soluble protein of roots and shoots in rice seedlings under Cd stress |
Si是促进水稻生长发育、提高水稻抗逆能力的有益元素,Zn则是水稻生长发育所必需的微量元素,参与多种生命活动过程。增加根际环境中的Si或Zn离子浓度能有效缓解Cd对根系的生理毒害,促进根系和地上部的生长发育[8, 25-28]。本研究发现,在含2.7 μmol·L-1 Cd的营养液中添加低浓度的Si (0.05 mmol·L-1)对水稻根系中的Cd积累量几乎没有影响,当巯基硅的浓度增加到0.1 mmol·L-1时,水稻根系和地上部的Cd含量才会显著下降。但当Si和0.2 mmol·L-1 Zn共存时,低浓度的巯基硅也能显著抑制水稻对Cd的吸收和转运。
植物在长期的进化过程中形成了多元的解毒机制,在重金属污染环境中,水稻能将大量的Cd固定在根系中[29],只有少部分Cd通过维管束组织向地上部转运。Si既能促进细胞壁的发育以及Cd与细胞壁中半纤维素的结合[30],又能和Cd形成难移动的化合物沉淀在细胞壁或液泡中[31],还能通过降低蒸腾作用抑制Cd从根系向地上部的转运[32]。Zn是多种蛋白质的主要辅酶,对重金属的跨膜运输和进出韧皮部的过程都有重要调控作用[33-34]。在本试验中,Si和Zn共存时对地上部的K、Fe和Zn含量都有显著的促进作用,必需元素吸收转运效率的提高必然会抑制相关通道对Cd的转运,因而能使根系胞液组分中的Cd含量下降43.9%以上。随着根系中可移动的Cd数量大幅度减少,地上部的Cd总量也显著下降。Si和Zn互补作用使得低浓度的Si也能对Cd在水稻体内的转运产生显著的抑制效果。
植物体内的可溶性蛋白质和可溶性糖作为渗透保护物质,有利于植物在逆境胁迫下维持细胞的结构和功能[35]。Cd胁迫通常会抑制可溶性蛋白的合成,降低酶的生物活性[11]。而Si和Zn对维持细胞内大量元素(如P、K、S)和微量元素(如Fe、Cu、Mn、Zn等)的离子平衡发挥着重要作用[36-38]。这种离子动态平衡的保持与可溶性蛋白的代谢有着密切的关系。环境中增加Si浓度不仅能显著提高Lsi1基因的表达水平,同时还调控OsHMA3、Nramp5等许多与离子转运、金属硫蛋白合成等有关的基因[30, 32],因而对蛋白质代谢产生重要影响。当Si和Zn共存时,水稻幼苗根部的可溶性蛋白含量显著提升,说明Cd对根系的生理伤害因Si和Zn的存在而修复。由于地上部胞液组分中的Cd含量仅相当于根系胞液中的十分之一,对细胞产生的生理毒害甚微,所以地上部的可溶性蛋白含量在处理间没有表现出显著差异。
4 结论(1) 在含Cd 2.7 μmol·L-1的营养液中添加0.1 mmol·L-1的巯基硅能使水稻幼苗根系和地上部的Cd含量分别下降34.7%和51.8%。
(2) Si和Zn共存时对Cd的抑制作用更加明显,同时添加0.2 mmol·L-1 Zn和0.05 mmol·L-1的巯基硅,能使水稻幼苗根系和地上部的Cd含量分别下降27.4%和78.0%。
(3) 同时添加Si和Zn能促进根系对K、Ca、Fe、Zn等元素的吸收以及向地上部的转运,并能显著提高根系中可溶性蛋白的含量。
| [1] |
Taamalli M, Ghabriche R, Amari T, et al. Comparative study of Cd tolerance and accumulation potential between Cakile maritima L. (halophyte) and Brassica juncea L.[J]. Ecological Engineering, 2014, 71(71): 623-627. |
| [2] |
温娜, 王景安, 刘仲齐. 利用AMMI模型分析稻米镉含量的基因型与环境互作效应[J]. 农业环境科学学报, 2015, 34(5): 817-823. WEN Na, WANG Jing-an, LIU Zhong-qi. Analysis of genotypic and environmental effects on cadmium content in rice by AMMI model[J]. Journal of Agro-Environment Science, 2015, 34(5): 817-823. |
| [3] |
文志琦, 赵艳玲, 崔冠男, 等. 水稻营养器官镉积累特性对稻米镉含量的影响[J]. 植物生理学报, 2015, 51(8): 1280-1286. WEN Zhi-qi, ZHAO Yan-ling, CUI Guan-nan, et al. Effects of cadmium accumulation characteristics in vegetative organs on cadmium content in grains of rice[J]. Plant Physiology Journal, 2015, 51(8): 1280-1286. |
| [4] |
Liu Y, Zhang C B, Zhao Y L, et al. Effect of growing seasons and genotypes on the accumulation of cadmium and mineral nutrients in rice grown in cadmium contaminated soil[J]. Science of the Total Environment, 2017, 579: 1282-1288. DOI:10.1016/j.scitotenv.2016.11.115 |
| [5] |
Broadley M R, White P J, Hammond J P, et al. Zinc in plants[J]. New Phtologist, 2007, 173(4): 677-702. DOI:10.1111/nph.2007.173.issue-4 |
| [6] |
Hall J L. Cellular mechanisms for heavy metal detoxification and tolerance[J]. Journal of Experimental Botany, 2002, 53(366): 1-11. |
| [7] |
Sasaki A, Yammaji N, Ma J F. Overexpreion of OsHMA3 enhances Cd tolerance and expression of Zn transporter genes in rice[J]. Journal of Experimental Botany, 2014, 65(20): 6013-6021. DOI:10.1093/jxb/eru340 |
| [8] |
尹洁, 赵艳玲, 徐莜, 等. 锌对粳稻幼苗镉吸收转运特性的影响[J]. 农业环境科学学报, 2016, 35(5): 834-841. YIN Jie, ZHAO Yan-ling, XU You, et al. Effects of zinc supply on absorption and translocation of cadmium in rice seedlings[J]. Journal of Agro-Environment Science, 2016, 35(5): 834-841. |
| [9] |
付宝荣, 李法云, 臧树良, 等. 锌营养条件下镉污染对小麦生理特性的影响[J]. 辽宁大学学报(自然科学版), 2000, 27(4): 366-370. FU Bao-rong, LI Fa-yun, ZANG Shu-liang, et al. Effect of Cd on physiological characteristics of wheat under the condition of Zn nutrition[J]. Journal of Liaoning University(Natural Sciences Edition), 2000, 27(4): 366-370. DOI:10.3969/j.issn.1000-5846.2000.04.019 |
| [10] |
Nadeem S, Sukhdevs M, Munirhussain Z, et al. Role of mineral nutrition in minimizing cadmium accumulation by plants[J]. Journal of the Science of Food & Agriculture, 2010, 90(6): 925-937. |
| [11] |
朱波, 汪涛, 王艳强, 等. 锌、镉在紫色土中的竞争吸附[J]. 中国环境科学, 2006, 26(增刊1): 73-77. ZHU Bo, WANG Tao, WANG Yan-qiang, et al. Competitive sorp-desorption of zinc and cadmium in purple soil[J]. China Environmental Science, 2006, 26(Suppl1): 73-77. |
| [12] |
田园, 王晓蓉, 林仁漳, 等. 土壤中镉铅锌单一和复合老化效应的研究[J]. 农业环境科学学报, 2008, 27(1): 156-159. TIAN Yuan, WANG Xiao -rong, LIN Ren-zhang, et al. Single and combined aging of cadmium, lead and zinc in soil[J]. Journal of AgroEnvironment Science, 2008, 27(1): 156-159. DOI:10.3321/j.issn:1672-2043.2008.01.027 |
| [13] |
Wang S, Wang F, Gao S. Foliar application with nano-silicon alleviates Cd toxicity in rice seedlings[J]. Environ Sci Pollut Res Int, 2015, 22(4): 2837-2845. DOI:10.1007/s11356-014-3525-0 |
| [14] |
Epstein E. Silicon:Its manifold roles in plants[J]. Annals of Applied Biology, 2009, 155(2): 155-160. DOI:10.1111/aab.2009.155.issue-2 |
| [15] |
Cui J H, Liu T X, Li F B, et al. Silica nanoparticles alleviate cadmium toxicity in rice cells:Mechanisms and size effects[J]. Environmental Pollution, 2017, 228: 363-369. DOI:10.1016/j.envpol.2017.05.014 |
| [16] |
Shi X, Zhang C, Wang H, et al. Effect of Si on the distribution of Cd in rice seedlings[J]. Plant & Soil, 2005, 272(1/2): 53-60. |
| [17] |
Chen R, Zhang C, Zhao Y, et al. Foliar application with nano-silicon reduced cadmium accumulation in grains by inhibiting cadmium translocation in rice plants[J]. Environmental Science & Pollution Research, 2017, 25(3): 1-8. |
| [18] |
Gu H H, Zhan S S, Wang S Z, et al. Silicon-mediated amelioration of zinc toxicity in rice (Oryza sativa L.) seedlings[J]. Plant & Soil, 2012, 350(1/2): 193-204. |
| [19] |
陆仲烟, 刘仲齐, 宋正国, 等. 大麦中镉的亚细胞分布和化学形态及PCs合成的基因型差异[J]. 农业环境科学学报, 2013, 32(11): 2125-2131. LU Zhong-yan, LIU Zhong-qi, SONG Zheng-guo, et al. Subcellular distribution and chemical forms of Cd and the synthesis of phytochelatins(PCs) in different barley genotypes[J]. Journal of Agro-Environment Science, 2013, 32(11): 2125-2131. DOI:10.11654/jaes.2013.11.004 |
| [20] |
Ueno D, Koyama E, Yamaji N, et al. Physiological, genetic, and molecular characterization of a high-Cd-accumulating rice cultivar, Jarjan[J]. Journal of Experimental Botany, 2011, 62(7): 2265-2272. DOI:10.1093/jxb/erq383 |
| [21] |
潘瑶, 尹洁, 高子平, 等. 硫对水稻幼苗镉积累特性及亚细胞分布特征的影响[J]. 农业资源与环境学报, 2015, 32(3): 275-281. PAN Yao, YIN Jie, GAO Zi-ping, et al. Effects of sulfur on the accumulation and subcellular distribution of cadmium in rice seedlings[J]. Journal of Agricultural Resources and Environment, 2015, 32(3): 275-281. |
| [22] |
贾雨薇, 杨瑞林, 张洋, 等. 一种优化的测定水稻硅含量的方法[J]. 植物学报, 2016, 51(5): 679-683. JIA Yu-wei, YANG Rui-lin, ZHANG Yang, et al. An optimized method to determine silicon content in rice[J]. Chinese Bulletin of Botany, 2016, 51(5): 679-683. |
| [23] |
Wang Y, Jing H, Gao Y. Arbuscular mycorrhizal colonization alters subcellular distribution and chemical forms of cadmium in Medicago sativa L. and resists cadmium toxicity[J]. PloS One, 2012, 7(11): e48669. DOI:10.1371/journal.pone.0048669 |
| [24] |
Gao L S, Zhu S, Sheng N B, et al. The transportation and accumulation of arsenic, cadmium, and phosphorus in 12 wheat cultivars and their relationships with each other[J]. Journal of Hazardous Materials, 2015, 299: 94-102. DOI:10.1016/j.jhazmat.2015.06.009 |
| [25] |
Bochicchio R, Sofo A, Terzano R, et al. Root architecture and morphometric analysis of Arabidopsis thaliana grown in Cd/Cu/Zn-gradient agar dishes:A new screening technique for studying plant response to metals[J]. Plant Physiology & Biochemistry, 2015, 91: 20-27. |
| [26] |
Lu Z, Zhang Z, Su Y, et al. Cultivar variation in morphological response of peanut roots to cadmium stress and its relation to cadmium accumulation[J]. Ecotoxicology & Environmental Safety, 2013, 91(4): 147. |
| [27] |
Li T, Yang X, Lu L, et al. Effects of zinc and cadmium interactions on root morphology and metal translocation in a hyperaccumulating species under hydroponic conditions[J]. Journal of Hazardous Materials, 2009, 169(1): 734-741. |
| [28] |
Liu J, Ma J, He C, et al. Inhibition of cadmium ion uptake in rice (Oryza sativa) cells by a wall-bound form of silicon[J]. New Phytologist, 2013, 200(3): 691-699. DOI:10.1111/nph.12494 |
| [29] |
赵艳玲, 张长波, 刘仲齐. 植物根系细胞抑制镉转运过程的研究进展[J]. 农业资源与环境学报, 2016, 33(3): 209-213. ZHAO Yan-ling, ZHANG Chang-bo, LIU Zhong-qi. Inhibiting cadmium transport process in root cells of plants:A review[J]. Journal of Agricultural Resources and Environment, 2016, 33(3): 209-213. |
| [30] |
Ma J, Cai H M, He C W, et al. A hemicellulose-bound form of silicon inhibits cadmium ion uptake in rice (Oryza sativa) cells[J]. New Phytologist, 2015, 206(3): 1063-1074. DOI:10.1111/nph.2015.206.issue-3 |
| [31] |
Adrees M, Ali S, Rizwan M, et al. Mechanisms of silicon-mediated alleviation of heavy metal toxicity in plants:A review[J]. Ecotoxicology and Environmental Safety, 2015, 119: 186-197. DOI:10.1016/j.ecoenv.2015.05.011 |
| [32] |
Naeem A, Saifullah, Zia-ur-Rehman M, et al. Silicon nutrition lowers cadmium content of wheat cultivars by regulating transpiration rate and activity of antioxidant enzymes[J]. Environmental Pollution, 2018, 242: 126-135. DOI:10.1016/j.envpol.2018.06.069 |
| [33] |
Song W Y, Lee H S, Jin S R, et al. Rice PCR1 influences grain weight and Zn accumulation in grains[J]. Plant Cell & Environment, 2015, 38(11): 2327-2339. |
| [34] |
Fontanili L, Lancilli C, Suzui N, et al. Kinetic analysis of zinc/cadmium reciprocal competitions suggests a possible Zn-insensitive pathway for root-to-shoot cadmium translocation in rice[J]. Rice, 2016, 9(1): 16. DOI:10.1186/s12284-016-0088-3 |
| [35] |
John R, Ahmad P, Gadgil K, et al. Effect of cadmium and lead on growth, biochemical parameters and uptake in Lemna polyrrhiza L.[J]. Plant Soil & Environment, 2008, 54(6): 262-270. |
| [36] |
Jain A, Sinilal B, Dhandapani G, et al. Effects of deficiency and excess of zinc on morphophysiological traits and spatiotemporal regulation of zinc-responsive genes reveal incidence of cross talk between micro-and macronutrients[J]. Environmental Science & Technology, 2013, 47(10): 5327-5335. |
| [37] |
Nair P M G, Chung I M. Regulation of morphological, molecular and nutrient status in Arabidopsis thaliana, seedlings in response to ZnO nanoparticles and Zn ion exposure[J]. Science of the Total Environment, 2017, 575: 187-198. DOI:10.1016/j.scitotenv.2016.10.017 |
| [38] |
Pinto E, Ferreira I M. Cation transporters/channels in plants:Tools for nutrient biofortification[J]. Journal of Plant Physiology, 2015, 179: 64-82. DOI:10.1016/j.jplph.2015.02.010 |
 2018, Vol. 37
2018, Vol. 37