2. 北京科技大学天津学院, 天津 301830
2. Tianjin College, University of Science & Technology Beijing, Tianjin 301830, China
多环芳烃(PAHs)是一类环境中广泛存在的持久性有机污染物,具有致癌性、致畸性和致突变性,因其具有强疏水性和较高的辛醇-水分配系数,易于被植物吸收积累并通过食物链富集,严重威胁生态系统和人体健康[1-3]。2014年《全国土壤污染状况调查公报》显示,我国耕地土壤中多环芳烃污染点位超标率高达1.4%,重度污染占到了0.2%[4]。在南京工业污染场地表层土壤中的PAHs平均浓度达到了17.64 mg·kg-1[5]。PAHs污染形势严峻,因此如何利用有效手段规避环境和污染区作物PAHs污染风险应是目前的研究重点。
植物-微生物联合修复汲取了植物和微生物修复的优势,近来受到广泛关注[6-8]。植物中存在数量庞大、种类丰富多样的内生细菌,植物与内生细菌、内生细菌之间的互利共生关系保证了内生细菌能够长期稳定的定殖在植物体内[9]。植物为内生菌提供场所、营养和防护[8],内生菌相比根际细菌具有更强抵御生物和非生物胁迫的能力[10]。Siciliano等[11]研究表明,在污染地区的具有难降解物降解能力的细菌中内生细菌占比高于根际细菌,暗示在这些难降解物的代谢中内生细菌发挥主要作用。另外,一些内生细菌可以通过自身分泌乙烯和1-氨基环丙烷-1-羧酸盐(ACC)脱氨酶等物质促进植物生长[12],代谢有机污染物,增强植物抗逆性,提高产量[13]。研究表明一些植物内生细菌具有降解植物体内有机污染物的能力,常见降解菌有Pantoea属[14]、Pseudomona属[15]、Sphingobacterium属[16]等。黑麦草、紫花苜蓿等牧草常作为修复植物,其吸收积累的PAHs会随食物链进入牲畜和野生动物体内,危害食品和生态安全,因此如何在高效修复的同时降低植物体内PAHs污染是亟待解决的问题。将功能菌定殖到植物体内,有助于降低植物污染风险,提高修复效果。Sun等[17]将从看麦娘中分离筛选出的芘降解内生细菌Staphylococcus sp.BJO6定殖到黑麦草体内能够促进植株生长并有效降低植株芘积累量。由此可见,利用功能内生菌定殖植物是规避植物PAHs等有机物污染的有效途径。内生菌群在植物代谢体内PAHs等有机污染物的过程中起重要作用。菌群组成和结构影响其对有机污染物的降解能力。Vila等[18]研究海洋重油降解菌群的菌群结构时发现,在能够高效降解3~5环PAHs的海洋细菌群落中,Alphaproteobacteria细菌与低环PAHs的降解相关,而Gammaproteobacteria细菌则与高环PAHs的降解相关。彭安萍等[19]提出可以利用植物中功能内生细菌调控PAHs的吸收和代谢,这对于保障污染区作物安全和修复污染区土壤具有重要意义。研究功能菌定殖对PAHs污染植物体内可培养细菌种群的影响,有助于了解功能菌与内生细菌和植物的作用关系,筛选出更多具有高效降解能力的功能内生细菌。
芘为四环多环芳烃的典型代表,常用作PAHs污染测定的指示物和生物降解研究的模型分子[20]。黑麦草是一种常见的牧草,具有生长迅速、根系发达的特点,能耐受高浓度的PAHs污染,常用于有机污染的植物修复[21]。本研究以芘作污染物,黑麦草为供试植物,采用水培体系研究了芘降解功能内生细菌Serratia sp. PW7定殖(浸根和浸种)对黑麦草体内芘污染去除以及可培养内生细菌的影响,并进一步探究功能内生细菌定殖对有机污染物代谢的影响机制,为功能内生菌-植物体系修复PAHs污染提供理论依据。
1 材料与方法 1.1 实验材料 1.1.1 功能菌株、宿主植物及芘供试菌株为本实验室分离的一株植物功能内生细菌PW7(Serratia sp.),16S rRNA基因在GenBank登录号为MG922497,具有高效芘降解能力,对链霉素、壮观霉素及四环素具有良好抗性[22]。
供试植物为黑麦草(Lolium multiflorum L.),购自明达种子公司。
本研究所用芘,分子式为C16H10,纯度大于98%,纯水中溶解度为0.12 mg·L-1,辛醇-水分配系数(lg Kow)为5.18,购自德国Fluka公司。
1.1.2 培养基植物水培体系采用Hoagland营养液[23],植物中总可培养内生细菌的培养使用LB培养基[23],功能内生细菌培养采用含芘及两种抗生素的基础盐培养基[24]。
1.2 实验方法 1.2.1 功能菌株定殖及水培实验本实验设置浸根定殖(LR)、浸种定殖(LS)和未接菌对照组(LK),各接种处理黑麦草分别暴露于含0、0.1、0.5 mg·L-1芘的Hoagland培养液中。实验共设置9组处理,每个处理设置3个重复。
接种菌株PW7菌悬液制备:单菌落接种LB液体培养基中,30 ℃ 150 r·min-1摇床培养24 h,8000 r·min-1离心5 min收集菌体,用液体基础盐培养基清洗2遍后调整菌悬液OD600nm值至1.0,4 ℃备用。黑麦草接种方法如下:(1)浸根定殖:黑麦草种子经过表面消毒,催苗育种48 h后,在Hoagland培养液中培养至株高约10 cm左右,菌悬液浸泡黑麦草根部6 h,无菌水冲洗后备用。(2)浸种定殖:经过表面消毒的黑麦草种子,催苗育种48 h后,菌悬液浸泡6 h,无菌水冲洗后,在Hoagland培养液中培养至株高约10 cm左右备用。接种处理后的幼苗移苗至装有250 mL不同芘浓度Hoagland培养液的棕色广口瓶中,每瓶10株,置于昼夜温度25 ℃/20 ℃的人工气候培养箱中培养,培养4 d后采集植物样品进行芘含量和内生菌群测定。
1.2.2 植物体内定殖菌和内生细菌计数及分离纯化采用菌落计数的方法表征功能菌在植物体内的定殖效率:清洗后的新鲜植物茎叶和根部依次经过75%的乙醇浸泡3 min、无菌水冲洗3~4次、2%的次氯酸钠溶液漂洗3 min,无菌水冲洗5次后置于固体LB平板上,30 ℃恒温培养48 h,若无菌落产生,表明表面灭菌成功。经表面灭菌处理的植物样品,研磨成匀浆后进行梯度稀释,涂布于基础盐抗性平板(芘终浓度50 mg·L-1、链霉素终浓度100 mg·L-1、壮观霉素终浓度100 mg·L-1),30 ℃恒温培养72 h,设3个重复,结合菌落形态观察和16S rRNA基因测序验证进行平板计数,计算出每克鲜组织含菌量(lg CFU·g-1)
可培养内生细菌计数及分离纯化:植物样品经表面灭菌处理后研磨成匀浆并进行梯度稀释,涂布于LB固体平板,30 ℃恒温培养72 h,每个处理设3个重复。长出菌落后,对各菌落进行菌落形态观察并计数,找出优势菌落。然后采用划线分离方法,对不同菌落进行进一步分离、纯化。最后将纯化的菌落划线于LB固体平板上,培养后于4 ℃短期保存备用。
1.2.3 植物内生细菌鉴定及对芘的降解能力验证利用菌落形态观察和16S rRNA基因序列同源性分析鉴定分离得到的植物内生细菌菌株,并确定其分类地位。提取各内生细菌总DNA(细菌基因组DNA提取试剂盒,TIANGEN)为模板进行16S rRNA基因的PCR扩增。采用引物为27f(5′-AGAGTTTGATCATGGCTCAG-3′)和1492r(5′-GGTTACCTTGTTACGACTT-3′)。PCR扩增体系:正反向引物各0.5 μL、Premix Taq(TaKaRa)12.5 μL、模板DNA 1 μL,无菌水定容至25 μL。PCR反应条件:95 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s,32个循环;72 ℃ 10 min。将PCR扩增产物送金斯瑞生物科技有限公司测序。在NCBI(http://blast.ncbi.nlm.nih.gov/Blast.cgi)中将测序结果与数据库进行16S rRNA基因序列同源性比对分析,同时提交各内生细菌测序序列至GenBank并获得登录号。各可培养内生菌按5%接种量测试其在以芘为唯一碳源的基础盐培养基中15 d对20 mg·L-1芘的降解能力。
1.2.4 植物内生细菌多样性分析植物可培养内生细菌群落多样性分析采用Shannon-Wiener多样性指数(H)和均匀性指数(J),其计算公式如下:
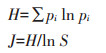
|
式中:pi为某处理组中各内生细菌数量占比;S为某处理组内生细菌群落所有种属数。
1.2.5 芘测定植物样品芘提取方法参照文献[25]。具体操作:植物根和茎叶冷冻干燥后,称量干质量(生物量);经研磨粉粹均匀后称取一定量植物样品于玻璃离心管中,每次10 mL加入二氯甲烷和正己烷等体积混合溶液超声萃取30 min,重复3次;萃取液经无水硫酸钠柱-硅胶柱净化,用10 mL二氯甲烷和正己烷等体积混合液洗脱后收集至圆底烧瓶;40 ℃恒温旋转蒸发至干,甲醇定容至5 mL,过0.22 μm孔径滤膜后,采用高效液相色谱(HPLC)定量分析。培养液中芘提取:取10 mL Hoagland培养液于玻璃离心管中,加等体积甲醇,超声萃取30 min,过0.22 μm孔径滤膜后,HPLC定量分析。HPLC分析参数:烷基C18反相色谱柱(4.6 mm×150 mm),流动相甲醇:水(V:V)=90:10,流速1.000 mL·min-1,柱温40 ℃,进样量20 μL。
1.3 数据处理及分析采用Excel 2007软件进行数据统计及图表绘制,SPSS 19.0软件进行单因素(ANOVA)方差分析和双因素相关性分析。
2 结果与分析 2.1 植物生物量及样品中芘含量菌株PW7定殖促进了黑麦草幼苗的生长,提高了植株生物量(表 1)。在高浓度污染情况下,定殖对植株的促生作用更显著。定殖的促生作用在茎叶的生长上更加明显,定殖后茎叶生物量增加7.7%~ 28.0%,根生物量增加5.3%~27.6%。比较2种定殖方法,浸根定殖的促进作用大于浸种。与对照相比,浸根处理后低浓度0.1 mg·L-1和高浓度0.5 mg·L-1芘污染组植株根生物量显著提高了18.5%和27.6%。本研究表明菌株PW7定殖能够显著降低黑麦草体内和水培液中的芘污染。在高浓度芘污染水平下,相比未接菌对照组,浸根接种和浸种接种使植株根中芘浓度显著降低了44.2%和19.9%,使植株茎叶中芘浓度显著降低了42.3%和22.2%。浸根接种更高效地去除了植物体内的芘。此外,相比未接菌对照,在低浓度芘污染组,培养液中芘去除率经浸种和浸根定殖后分别显著提高了29个和38个百分点,在高浓度芘污染组,浸根定殖后培养液中芘去除率显著提高了18个百分点。这些结果表明,功能菌株PW7定殖能够有效去除植物体内和环境中的芘污染,其中浸根与浸种定殖虽效果不同,但均为有效的修复方法。
|
|
表 1 菌株PW7定殖对黑麦草生长以及芘残留的影响 Table 1 Effects of inoculation with strain PW7 on the plant growth, pyrene removal in the plant and Hoagland solutions |
菌株PW7在黑麦草体内的数量代表了其在黑麦草体内的定殖效率。图 1表明,黑麦草茎叶和根中定殖菌数量为3.49~7.63 lg CFU·g-1,表明大量的菌株PW7能够成功定殖在植株体内生存繁殖。相同处理组,植株根中定殖菌数量均为茎叶中的100倍以上,表明菌株主要定殖在根中,但可以移动到茎叶部。同一芘污染水平下,浸根组根和茎叶中的定殖菌数量均比浸种组大一个数量级,表明与浸种定殖相比浸根定殖菌株PW7在植株体内的定殖效率更高、效果更好。此外,随着芘浓度的提高,植株根和茎叶中定殖菌数量均有增加的趋势,其中浸种组植物茎叶中的定殖菌数量变化显著,表明一定浓度芘污染有利于菌株PW7的生存繁殖。
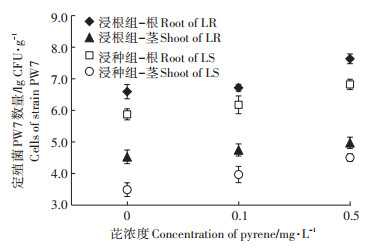
|
图 1 黑麦草根和茎叶中菌株PW7定殖数量 Figure 1 Cell counts of strain PW7 in the roots and shoots of inoculated ryegrass |
芘污染和功能菌株定殖能够影响黑麦草根和茎叶中可培养内生细菌的数量。由图 2可知,未接菌组中,与无芘污染相比,芘污染使植株根中可培养内生细菌数量显著下降,而茎叶中可培养内生细菌数量显著提高,但高浓度芘处理植株茎叶中内生细菌数量相比低浓度芘处理显著下降。在相同芘污染水平下,菌株PW7定殖改变了植株中可培养内生细菌数量。其中无污染和低浓度芘污染水平下,功能菌定殖降低了根中可培养内生细菌数量,提高了茎叶中可培养内生细菌数量;高浓度芘污染水平下,定殖使植株根和茎叶中可培养内生细菌数量均有所提高。与未接菌对照组相比,浸根对黑麦草根和茎叶中可培养内生细菌数量的影响更显著,这可能是菌株PW7定殖提高植物体内和环境中芘去除率的原因。

|
同组织中不同字母表示在0.05水平上差异显著 Different letters in same tissue means significant difference at 0.05 level 图 2 不同芘污染及定殖处理对黑麦草中总内生细菌数量的影响 Figure 2 Effects of pyrene contamination and strain PW7 inoculation on the cell counts of cultivable endophytic bacteria in ryegrass |
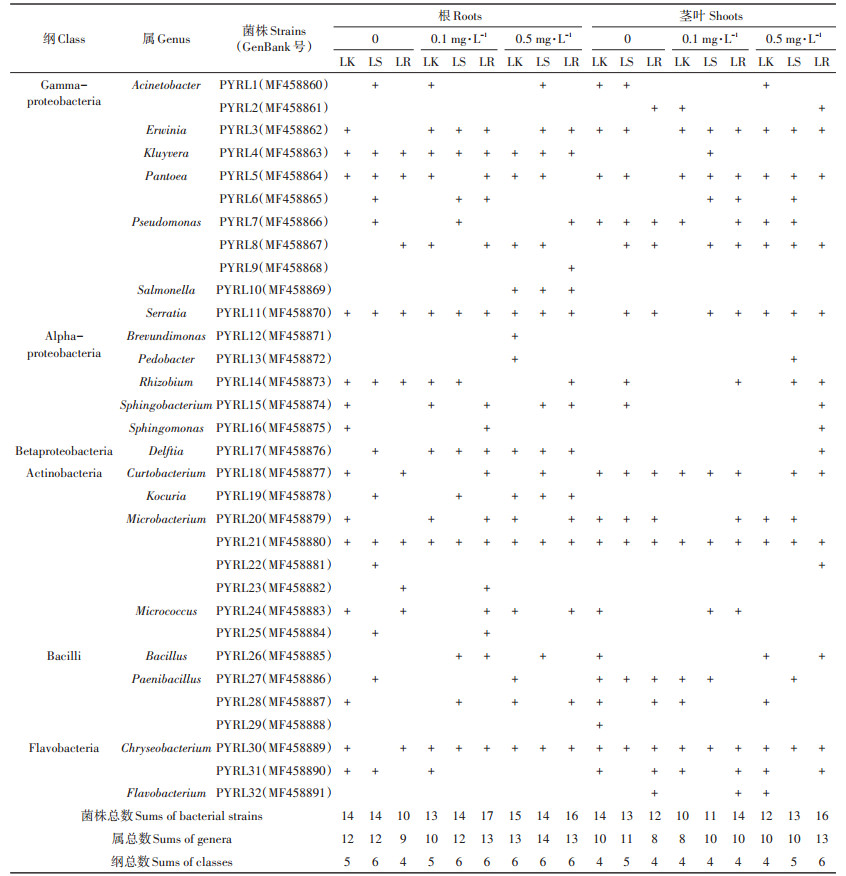
本研究从不同芘污染和定殖处理组的黑麦草植株体内共分离出32株可培养内生细菌,各内生细菌菌落形态如图 3所示,表明植物内生细菌具有丰富的多样性。从表 2可以看出,根据16S rRNA基因序列同源性比对分析,黑麦草体内的32株内生细菌分别属于Gammaproteobacteria、Alphaproteobacteria、Betaproteobacteria、Actinobacteria、Bacilli和Flavobacteria 6个纲,其中Gammaproteobacteria和Actinobacteria为根中优势纲,而Actinobacteria和Flavobacteria为茎叶中优势纲。从属分类水平上看,这32株可培养内生细菌分属21个属,其中Microbacterium属的细菌种类最多,Pseudomonas属、Paenibacillus属次之。32株内生细菌中,6株根部特有(PYRL9、PYRL10、PYRL12、PYRL19、PYRL23、PYRL25)、3株茎叶部特有(PYRL2、PYRL29、PYRL32)、4株芘污染植株特有(PYRL9、PYRL10、PYRL12、PYRL13)、4株接菌植株特有(PYRL9、PYRL22、PYRL23、PYRL25)。此外,在芘污染条件下,菌株PW7定殖黑麦草增加了黑麦草体内的可培养内生细菌的种类,菌株PW7浸根接种的黑麦草根部内生细菌种数最多,低浓度和高浓度芘污染水平下分别为17种和16种。
|
图 3 LB培养基上32株内生细菌照片 Figure 3 Photographs of colonies of the 32 endophytic bacterial strains on LB medium plate |
|
|
表 2 不同处理组黑麦草中可培养内生细菌分类汇总 Table 2 Cultivable endophytic bacterial strains isolated from the ryegrass |
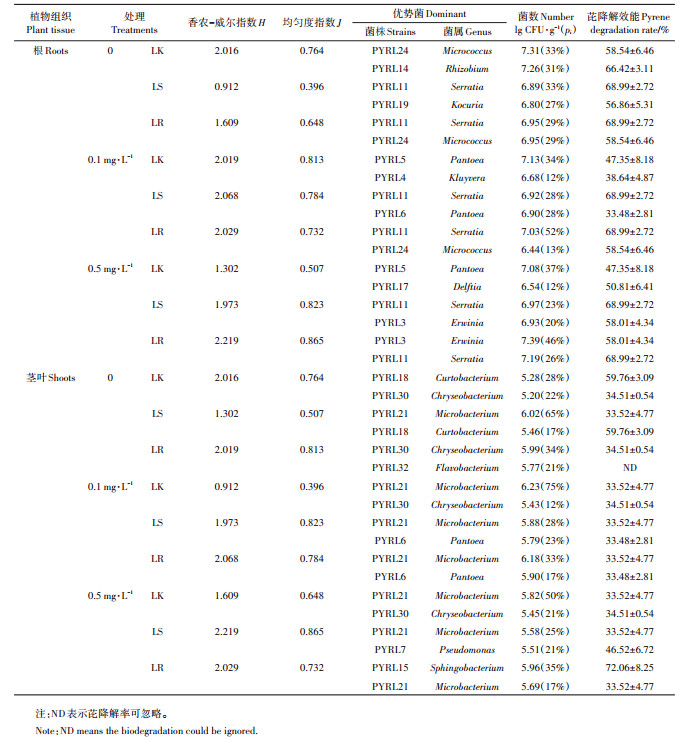
采用香农-威尔指数(H)和均匀性指数(J)两个生物多样性指数来表征黑麦草根和茎叶中可培养内生细菌的种群多样性。如表 3所示,未接菌组中,与无污染相比,除低浓度芘处理组根中内生细菌种群的香农-威尔指数和均匀性指数升高外,其他组均有所降低,表明除低浓度芘污染能略微提高黑麦草内生细菌种群多样性和均匀度外,芘污染会降低可培养内生细菌种群的多样性和均匀度,污染水平越高,影响越明显。在相同浓度芘污染条件下,菌株PW7浸根和浸种定殖均能够提高芘污染黑麦草根和茎中内生细菌种群的香农-威尔指数,只是提高程度存在差异,均匀性指数与香农-威尔指数存在类似规律。表明功能菌定殖能够提高黑麦草内生细菌种群多样性和均匀度,降低芘污染对黑麦草内生细菌种群多样性的影响。
|
|
表 3 黑麦草根和茎叶中可培养内生细菌种群分析 Table 3 Populations of endophytic bacteria in ryegrass seedlings |
芘污染和菌株PW7定殖还会影响黑麦草根和茎叶可培养内生细菌的优势种属,影响内生细菌的群落结构。从表 3可知,未接菌组中,芘污染黑麦草根中优势种属由Micrococcus属和Rhizobium属变为Pantoea属,芘污染黑麦草茎叶中绝对优势种属由Curtobacterium属变为Microbacterium属。相同芘污染水平下,菌株PW7接种后,黑麦草根部Serratia属成为绝对优势种属(LR0.5中为略优势种属),黑麦草茎叶部优势种属中的Chryseobacterium属变为Pantoea属(LS0.1、LR0.1)、Pseudomona属(LS0.5)和Sphingobacterium属(LR0.5)。
对比表 3中不同处理组黑麦草根和茎叶部优势菌株的芘降解效能发现,黑麦草内优势菌株均对芘具有一定的降解能力,其中菌株PYRL3(Erwinia)、PYRL11(Serratia)、PYRL14(Rhizobium)、PYRL15(Sphingobacterium)、PYRL18(Curtobacterium)、PYRL19(Kocuria)、PYRL24(Micrococcus)对20 mg·L-1芘的15 d降解率超过55%。在芘污染条件下,定殖黑麦草内优势菌株芘降解能力普遍高于未接菌黑麦草内优势菌株,表明菌株PW7定殖能够通过改变黑麦草内群落组成提高植物中芘去除能力。此外,各处理组根部优势菌株芘降解能力普遍高于茎叶中优势菌,表明根是黑麦草生物降解芘的主要部位。
3 讨论功能内生细菌在植物体内的定殖效率是其发挥生物防治作用的关键因素[26]。本研究中接菌处理后定殖在黑麦草根和茎叶部的定殖菌株PW7数量达103~107 CFU·g-1,表明菌株PW7能够成功定殖在黑麦草组织中并能良好生存和繁殖。菌株PW7的高效定殖有利于降低植物芘污染和促进植物生长。相关性分析表明:在芘污染条件下,黑麦草体内功能菌定殖数量与植株生长增量显著正相关(根中ρ=0.647,P=0.031;茎叶中ρ=0.661,P=0.038);特别是芘污染下黑麦草体内功能菌定殖数量与植株中芘污染去除也显著正相关(根中ρ=0.879,P=0.01;茎叶中ρ=0.655,P=0.029)。研究表明,内生细菌的定殖效率受很多因素影响,除植物自身因素[27]、内生细菌基因组[28]等因素外,定殖方式也会影响功能内生细菌的定殖效率。Afzal等[6]采用4种定殖方式将内生细菌Burkholderia phytofirmans PsJN接种到柴油污染地区的黑麦草体内,结果表明,PsJN菌株灌根接种的定殖效率最高,表现出最佳的生防效果。本研究结果也证实相比浸种接种,浸根接种黑麦草的菌株PW7定殖效率更高,降低芘污染风险的效果更好。
随着芘污染浓度的增大,黑麦草根中可培养内生细菌数量显著减少,茎叶中的数量在低浓度增加,在高浓度减少,且变化显著。Liu等[29]的研究结果也表明随着菲污染浓度的升高,小麦根中内生细菌总数减少,茎叶中先增后减。说明低浓度PAHs污染能促进植物茎叶中内生细菌生长,高浓度表现出抑制作用。本研究发现菌株PW7定殖提高了高浓度芘污染下黑麦草根和茎叶中可培养内生细菌数量,而且可培养内生细菌数量与功能菌定殖效率有关,相关性分析表明根中可培养内生细菌数量与功能菌定殖效率呈正相关关系(ρ=0.681,P=0.015),且根中内生细菌数量增加与植物体内芘污染去除显著正相关(ρ=0.668,P=0.035)。这些结果说明,菌株PW7也可通过提高植物体内总可培养内生细菌数量降低植物体内芘污染。
本研究分别从黑麦草体内分离出21属共32株可培养内生细菌,分别属于Gammaproteobacteria、Alphaproteobacteria、Betaproteobacteria、Actinobacteria、Bacilli和Flavobacteria 6个纲,表现出植物内生菌群丰富的多样性。丰富多样的内生细菌有利于促进植物生长、提高抗逆性。高浓度PAHs污染能够降低微生物多样性,Wang等[30]研究表明在高浓度PAHs污染下沉积物中细菌多样性显著下降,而Cravo-Laureau等[31]认为菌群多样性降低会严重影响污染物的降解。通过多样性指数分析发现,高浓度芘污染能够降低植物内生细菌的多样性和均匀度,但菌株PW7浸根和浸种定殖均能有效提高黑麦草根和茎叶中内生细菌的多样性和均匀度,缓解了芘污染对植物内生细菌多样性的破坏作用。这结果与Afzal等[6]的研究一致,表明利用植物与内生细菌联合作用是修复有机物污染的有效方法。
盛月慧等[23]将5种浓度菲作用于黑麦草后发现,根、茎叶中可培养内生细菌种群发生了不同程度的改变,植物内生细菌能对有机物污染做出响应。而菌株PW7定殖能使芘污染黑麦草根和茎叶中可培养内生细菌群落组成产生明显变化,改变植物优势种属,增强对有机污染物的代谢能力。芘降解菌株PW7定殖后其所属的Serratia属成为黑麦草根中的绝对优势属,其他优势属Pantoea属、Micrococcus属和Erwinia属也表现出较高的芘降解潜能。宋立超等[14]用菌株Pantoea sp. TJB5胞内酶对50 mg·L-1菲处理12 h的降解率达到70.1%。Nida等[32]将Micrococcus属细菌制成菌蜡球用于石油烃降解。定殖处理后芘污染黑麦草茎叶中的优势属Microbacterium属[33]、Pantoea属、Pseudomona属[15]和Sphingobacterium属[16]也均被报道过具有芳香烃降解潜能。Phillips等[15]研究紫花苜蓿内生细菌群落与芳香烃污染降解能力的关系时发现,当Pseudomonas属存在时,植物烷烃代谢能力提高,而当Pseudomonas属和Brevundimonas属共同存在时,植物芳香烃的代谢能力提高。功能菌定殖后这些具有芘降解潜能的属成为植物中的优势属,提高了植物代谢芘的能力,降低了植物和环境中芘的污染风险。此外,浸根和浸种处理黑麦草内生细菌群落组成的差异可能是两种定殖方式的定殖效率不同造成的。
综上所述,明确功能内生细菌定殖对植物生长量、体内芘含量及内生细菌群落的影响,有助于利用内生细菌调控植物对PAHs的吸收和代谢,筛选更多具有高效降解潜能的内生细菌,完善有机污染物的植物-微生物联合修复方法,进而有效规避有机物污染区作物的污染风险。然而,功能内生细菌定殖对植物内生细菌种群的影响机制和定殖方式的影响机制还有待进一步研究。
4 结论(1)芘降解内生细菌PW7能高效定殖在黑麦草根和茎叶中,促进植物生长,提高芘污染黑麦草根和茎叶中内生细菌数量和多样性,改变黑麦草内生细菌群落组成,进一步提高了植物中芘的代谢能力,显著降低了植物芘污染。
(2)浸根与浸种两种定殖方式均为有效可行的定殖修复方式,相比浸种定殖,具有更高定殖效率的浸根定殖表现出更显著的促生作用、菌群改变和减芘效果。关于定殖方式对内生菌群及芘污染去除的影响机制还有待进一步研究。
(3)功能菌浸根和浸种定殖是高效的有机物环境污染植物-微生物联合修复方法,能有效规避污染区作物污染风险,为更多功能菌株的发现和微生物菌种在污染修复中的应用提供依据和参考。
| [1] |
Haritash A K, Kaushik C P. Biodegradation aspects of polycyclic aromatic hydrocarbons(PAHs):A review[J]. Journal of Hazardous Materials, 2009, 169(1/2/3): 1-15. |
| [2] |
Kim K H, Jahan S A, Kabir E, et al. A review of airborne polycyclic aromatic hydrocarbons(PAHs)and their human health effects[J]. Environment International, 2013, 60(5): 71-80. |
| [3] |
刘宛, 李培军, 周启星, 等. 短期菲胁迫对大豆幼苗超氧化物歧化酶活性及丙二醛含量的影响[J]. 应用生态学报, 2003, 14(4): 581-584. LIU Wan, LI Pei-jun, ZHOU Qi-xing, et al. Effect of short-term phenanthrene stress on SOD activities and MDA contents in soybean (Glycine max) seedlings[J]. Chinese Journal of Applied Ecology, 2003, 14(4): 581-584. DOI:10.3321/j.issn:1001-9332.2003.04.023 |
| [4] |
环境保护部和国土资源部. 全国土壤污染状况调查公报[J]. 中国环保产业, 2014, 36(5): 10-11. Ministry of Environmental Protection and Ministry of Land and Resource of the People's Republic of China. The bulletin of nationwide soil pollution status survey[J]. China Environmental Protection Industry, 2014, 36(5): 10-11. |
| [5] |
廖晓勇, 崇忠义, 阎秀兰, 等. 城市工业污染场地:中国环境修复领域的新课题[J]. 环境科学, 2011, 32(3): 784-794. LIAO Xiao-yong, CHONG Zhong-yi, YAN Xiu-lan, et al. Urban industrial contaminated sites:A new issue in the field of environmental remediation in China[J]. Environmental Science, 2011, 32(3): 784-794. |
| [6] |
Afzal M, Yousaf S, Reichenauer T G, et al. The inoculation method affects colonization and performance of bacterial inoculant strains in the phytoremediation of soil contaminated with diesel oil[J]. International Journal of Phytoremediation, 2012, 14(1): 35-47. DOI:10.1080/15226514.2011.552928 |
| [7] |
Ho Y N, Shih C H, Hsiao S C, et al. A novel endophytic bacterium, Achromobacter xylosoxidans, helps plants against pollutant stress and improves phytoremediation[J]. Journal of Bioscience & Bioengineering, 2009, 108(Suppl1): S94. |
| [8] |
Ijaz A, Imran A, Haq M A U, et al. Phytoremediation:Recent advances in plant-endophytic synergistic interactions[J]. Plant & Soil, 2016, 405(1/2): 179-195. |
| [9] |
Wang Y, Dai C C. Endophytes:A potential resource for biosynthesis, biotransformation, and biodegradation[J]. Annals of Microbiology, 2011, 61(2): 207-215. DOI:10.1007/s13213-010-0120-6 |
| [10] |
Hallmann J, Quadthallmann A, Mahaffee W F, et al. Bacterial endophytes in agricultural crops[J]. Canadian Journal of Microbiology, 1997, 43(10): 895-914. DOI:10.1139/m97-131 |
| [11] |
Siciliano S D, Fortin N, Mihoc A, et al. Selection of specific endophytic bacterial genotypes by plants in response to soil contamination[J]. Applied & Environmental Microbiology, 2001, 67(6): 2469-2475. |
| [12] |
Birgit M, Alexandra P, Shin M W, et al. Comparative genome analysis of Burkholderia phytofirmans PsJN reveals a wide spectrum of endophytic lifestyles based on interaction strategies with host plants[J]. Frontiers in Plant Science, 2013, 4(4): 120. |
| [13] |
Gurska J, Wang W, Gerhardt K E, et al. Three year field test of a plant growth promoting rhizobacteria enhanced phytoremediation system at a land farm for treatment of hydrocarbon waste[J]. Environmental Science & Technology, 2009, 43(12): 4472-4479. |
| [14] |
宋立超, 钮旭光, 李培军, 等. 成团泛菌Pantoea sp. TJB5对菲的酶促降解及功能酶基因克隆[J]. 沈阳农业大学学报, 2015, 46(5): 543-547. SONG Li-chao, NIU Xu-guang, LI Pei-jun, et al. Enzymatic degradation of phenanthrene by Pantoea sp. TJB5 and cloning of enzyme gene[J]. Journal of Shenyang Agricultural University, 2015, 46(5): 543-547. DOI:10.3969/j.issn.1000-1700.2015.05.006 |
| [15] |
Phillips L A, Germida J J, Farrell R E, et al. Hydrocarbon degradation potential and activity of endophytic bacteria associated with prairie plants[J]. Soil Biology & Biochemistry, 2008, 40(12): 3054-3064. |
| [16] |
段盛文, 刘正初, 郑科, 等. Sphingobacterium bambusaue及其紫外诱变菌株的石油降解功能[J]. 微生物学通报, 2013, 40(12): 2336-2341. DUAN Sheng-wen, LIU Zheng-chu, ZHENG Ke, et al. Petroleum degradation capacity of Sphingobacterium bambusaue and its UV-mutants[J]. Microbiology China, 2013, 40(12): 2336-2341. |
| [17] |
Sun K, Liu J, Jin L, et al. Utilizing pyrene-degrading endophytic bacteria to reduce the risk of plant pyrene contamination[J]. Plant & Soil, 2014, 374(1/2): 251-262. |
| [18] |
Vila J, María N J, Mertens J, et al. Microbial community structure of a heavy fuel oil-degrading marine consortium:Linking microbial dynamics with polycyclic aromatic hydrocarbon utilization[J]. Fems Microbiology Ecology, 2010, 73(2): 349-362. |
| [19] |
彭安萍, 刘娟, 凌婉婷, 等. 功能内生细菌对植物体内有机污染物代谢的影响[J]. 农业环境科学学报, 2013, 32(4): 668-674. PENG An-ping, LIU Juan, LING Wan-ting, et al. Effects of endophytic bacteria on the metabolism of organic pollutants in plant[J]. Journal of Agro-Environment Science, 2013, 32(4): 668-674. |
| [20] |
Chen G, White P A. The mutagenic hazards of aquatic sediments:A review[J]. Mutation Research, 2004, 567(2/3): 151-225. |
| [21] |
高彦征, 凌婉婷, 朱利中, 等. 黑麦草对多环芳烃污染土壤的修复作用及机制[J]. 农业环境科学学报, 2005, 24(3): 498-502. GAO Yan-zheng, LING Wan-ting, ZHU Li-zhong, et al. Ryegrass-accelerating degradation of polycyclic aromatic hydrocarbons(PAHs)in soil[J]. Journal of Agro-Environment Science, 2005, 24(3): 498-502. DOI:10.3321/j.issn:1672-2043.2005.03.018 |
| [22] |
Zhu X, Wang W, Crowley D E, et al. The endophytic bacterium Serratia sp. PW7 degrades pyrene in wheat[J]. Environmental Science & Pollution Research, 2017, 24(7): 1-9. |
| [23] |
盛月慧, 刘娟, 高彦征, 等. 黑麦草体内POD和PPO活性及可培养内生细菌种群对不同浓度菲污染的响应[J]. 南京农业大学学报, 2013, 36(6): 51-59. SHENG Yue-hui, LIU Juan, GAO Yan-zheng, et al. Effects of phenanthrene on the POD and PPO activities and endophytic bacteria population characteristics in ryegrass (Lolium multiflorum Lam.)[J]. Journal of Nanjing Agricultural University, 2013, 36(6): 51-59. |
| [24] |
陈天寿. 微生物培养基的制造与应用[M]. 北京: 中国农业出版社, 1995: 179-184. CHEN Tian-shou. The manufacture and application of microorganism[M]. Beijing: China Agriculture Press, 1995: 179-184. |
| [25] |
凌婉婷, 高彦征, 李秋玲, 等. 植物对水中菲和芘的吸收[J]. 生态学报, 2006, 26(10): 3332-3338. LING Wan-ting, GAO Yan-zheng, LI Qiu-ling, et al. Uptake of phenanthrene and pyrene by ryegrass from water[J]. Acta Ecological Sinica, 2006, 26(10): 3332-3338. DOI:10.3321/j.issn:1000-0933.2006.10.024 |
| [26] |
何玲敏, 叶建仁. 植物内生细菌及其生防作用研究进展[J]. 南京林业大学学报(自然科学版), 2014, 38(6): 153-159. HE Ling-min, YE Jian-ren. Endophytic bacteria:Research advances and biocontrol application[J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2014, 38(6): 153-159. |
| [27] |
Pillay V K, Nowak J. Inoculum density, temperature, and genotype effects on in vitro growth promotion and epiphytic and endophytic colonization of tomato (Lycopersicon esculentum L.) seedlings inoculated with a Pseudomonad bacterium[J]. Canadian Journal of Microbiology, 1997, 43(4): 354-361. DOI:10.1139/m97-049 |
| [28] |
Rosenblueth M, Martínez L, Silva J, et al. Klebsiella variicola, a novel species with clinical and plant-associated isolates[J]. Systematic & Applied Microbiology, 2004, 27(1): 27-35. |
| [29] |
Liu J, Xiang Y B, Zhang Z M, et al. Inoculation of a phenanthrene-degrading endophytic bacterium reduces the phenanthrene level and alters the bacterial community structure in wheat[J]. Applied Microbiology & Biotechnology, 2017, 101(12): 5199-5212. |
| [30] |
Wang Y F, Tam N F. Microbial community dynamics and biodegradation of polycyclic aromatic hydrocarbons in polluted marine sediments in Hong Kong[J]. Marine Pollution Bulletin, 2011, 63(5-12): 424-430. DOI:10.1016/j.marpolbul.2011.04.046 |
| [31] |
Cravo-Laureau C, Hernandez-Raquet G, Vitte I, et al. Role of environmental fluctuations and microbial diversity in degradation of hydrocarbons in contaminated sludge[J]. Research in Microbiology, 2011, 162(9): 888-895. DOI:10.1016/j.resmic.2011.04.011 |
| [32] |
Nida A Q, Javed H, Warda F. Biodegradation of petroleum hydrocarbon by Micrococcus sp. in form of wax ball[J]. African Journal of Microbiology Research, 2017, 11(41): 1528-1531. DOI:10.5897/AJMR |
| [33] |
王元芬, 张颖, 任瑞霞, 等. 芘高效降解菌的分离鉴定及其降解特性的研究[J]. 生物技术, 2009, 19(1): 58-61. WANG Yuan-fen, ZHANG Ying, REN Rui-xia, et al. Identification and characterization of highly efficient pyrene-degrading bacteria[J]. Biotechnology, 2009, 19(1): 58-61. |
 2018, Vol. 37
2018, Vol. 37