文章信息
- 杨波, 陈银萍, 柯昀琪, 闫志强, 余沛东, 师小平
- YANG Bo, CHEN Yin-ping, KE Yun-qi, YAN Zhi-qiang, YU Pei-dong, SHI Xiao-ping
- EDDS对Cd胁迫下三叶鬼针草生长和抗氧化酶系统及Cd积累的影响
- Effects of EDDS on growth, antioxidant enzyme, and Cd accumulation of Bidens pilosa L. seedlings under Cd stress
- 农业环境科学学报, 2018, 37(5): 875-882
- Journal of Agro-Environment Science, 2018, 37(5): 875-882
- http://dx.doi.org/10.11654/jaes.2017-1116
文章历史
- 收稿日期: 2017-08-16
- 录用日期: 2017-12-29
随着人类文明的进步,工业化不断加强,在促进经济发展和提高人民生活水平的同时,越来越多的环境问题相继出现,尤其是由采矿、废气排放、污水灌溉和使用重金属超标制品等人为因素所致的重金属污染日益加剧,引起了世界各国科学家的高度重视,重金属环境污染防治已迫在眉睫。Cd污染是常见的重金属污染之一,据全国土壤污染状况调查,Cd含量分布呈现从西北到东南、从东北到西南方向逐渐升高的态势,Cd污染物点位超标率为7.0%,总体情况不容乐观[1]。
重金属污染土壤的传统修复方法,如开挖、洗涤和土地填埋等,由于对环境破坏大且成本高昂,限制了其可行性[2]。而植物修复技术是一种生物友好型的技术,越来越受到人们的关注[3-4]。但是它也有重大缺陷,就是对重金属提取率不高。近年来,有大量关于施用螯合剂以增强植物对重金属的吸收和富集的研究报道,其中生物友好型的螯合剂乙二胺二琥珀酸(EDDS)备受关注。Luo等[5]研究表明,EDDS可以增强多种植物物种对重金属Cd、Cu、Pb、Zn和Ni的摄取量。白薇杨等[6]发现,螯合剂的存在明显增加了植物对重金属Pb、Cu和Cd的富集系数,且EDDS对环境的风险比较小。Attinti等[7]研究了EDDS对香根草萃取Pb效率的影响,土壤和渗滤液结果表明,EDDS的应用增加了土壤中Pb的溶解度。
三叶鬼针草(Bidens pilosa L.)是一年生草本植物,生物量大,根系发达,抗逆性强,具有较强的争光、争水和争肥能力,对重金属污染耐性强,富集性和转移性高[8],是修复重金属污染土壤较理想的种质资源[9],但关于EDDS强化三叶鬼针草吸收Cd的能力尚不明确。
本文通过盆栽实验研究不同浓度EDDS对Cd污染条件下三叶鬼针草生长、抗氧化酶活性、Cd含量以及Cd富集系数和转运系数的影响,以期为三叶鬼针草和EDDS应用于Cd污染土壤的修复提供科学依据。
1 材料与方法 1.1 材料与试剂三叶鬼针草种子购自泰山野菜种植基地。EDDS为麦卡希试剂,现用现配,其结构如下所示:
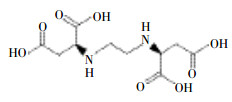
实验土壤为采自甘肃省兰州市榆中县(103°49′15″~104°34′40″E,35°34′20″~36°26′30″N)周边农田耕地0~20 cm的表层土,室内自然风干后过2 mm筛备用。土壤基本理化性质:pH值7.76,有机质含量19.80 g·kg-1,全氮含量1.19 g·kg-1,Cd含量0.49 mg·kg-1。将2 kg表层土壤与一定量的污染物(以CdCl2·2.5H2O模拟Cd胁迫,浓度为40 mg·kg-1,以溶液加入到土壤中)充分混匀后装入塑料盆(口径20 cm、高度15 cm),平衡3周后,选取均匀、饱满的三叶鬼针草种子,将其浸泡在1% NaClO溶液中10 min,用蒸馏水冲洗干净,晾干后播种以提高种子的发芽率和抗病性。种子播种到塑料盆中,播种深度0.5 cm,盆栽置于光照培养架上,在温度15~25 ℃、色温6500 K光照下,每日光照14 h(6:00—20:00),黑暗10 h,不定期的更换位置,待发芽后间苗,每盆10株,植株在重金属污染土壤中生长,以自来水浇灌(水中未检测出Cd),使土壤含水量经常保持在田间持水量(该土壤田间持水量在20%左右)的70%左右。为防止污染物淋溶渗漏损失,在盆下放置塑料托盘并将渗漏液倒回盆中。待三叶鬼针草生长60 d左右、长出6片真叶时,配制浓度为0(对照,CK)、0.5、1.5、2.5、5.0 mmol·L-1的EDDS溶液,将其pH调到7.0。分别取上述浓度的溶液100 mL施入土壤中,每个处理3个平行,7 d后取样进行各指标测定。
1.3 测定方法 1.3.1 生长指标的测定取不同处理的植株各5株,小心抖落根系土,然后依次用自来水和蒸馏水分别小心冲洗3次,操作时尽量不损伤根系,用滤纸吸干水分。分别称量地上部(茎和叶混合)和地下部(根)鲜重,用直尺测量其根长及株高。再将鲜植株置于烘箱中105 ℃杀青20 min,之后75 ℃下烘干至恒重,称其地上部及地下部干重[10]。
1.3.2 Cd含量的测定将烘干后的植物地上部和地下部分别研磨,称取0.5 g于消解管中,加入15 mL HNO3-HClO4(4:1,V/V),用DigiBlock EHD20型高温消解仪消解至澄清,定容至25 mL;将花盆中土壤风干,用四分法取部分样品研磨过0.149 mm筛,称取0.5 g,用HCl-HF-HNO3-HClO4法消解至澄清,定容至25 mL。用美国Nicolet公司的220型火焰原子吸收分光光度计测定Cd含量[11]。
1.3.3 酶活性测定紫外分光光度法测定抗坏血酸氧化酶(APX)、谷胱甘肽还原酶(GR)和过氧化氢酶(CAT)活性,愈创木酚法测定过氧化物酶(POD)活性,氮蓝四唑法测定超氧化物歧化酶(SOD)活性[12]。
以上所有指标的测定均重复3次。
1.3.4 数据统计与分析富集系数(Bioaccumulation Factor,BF)也称吸收系数,是指植物重金属浓度(地上部和地下部Cd浓度之和)与土壤中重金属浓度(土壤Cd添加量即40 mg·kg-1)之比;转运系数(Translocation Factor,TF)是指植物地上部重金属浓度与地下部同种重金属浓度的比值[13]。
采用Excel和SPSS 17.0软件进行数据处理和分析,利用Origin 2016软件绘图。采用单因素方差分析(One-way ANOVA)和Duncan法进行多重比较。
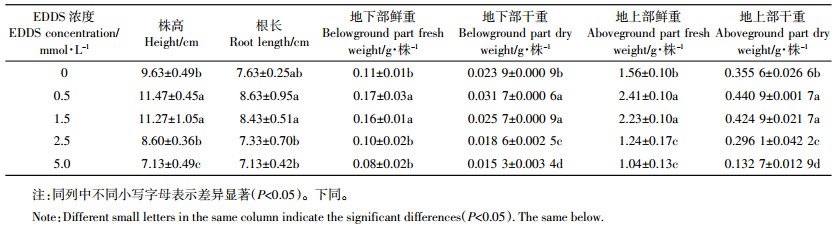
2 结果与分析 2.1 EDDS对Cd胁迫下三叶鬼针草生长的影响加入EDDS培养7 d之后,对比各处理对生长的影响(表 1)可知:40 mg·kg-1 Cd胁迫下,0.5~1.5 mmol·L-1的EDDS有利于三叶鬼针草生长,但是施加2.5~5.0 mmol·L-1的EDDS不利于其生长。与CK相比,施加0.5 mmol·L-1和1.5 mmol·L-1 EDDS分别使株高增加19.03%和16.69%、根长增加13.10%和10.48%、地下部鲜重增加54.55%和45.45%、地上部鲜重增加54.49%和42.95%、地下部干重增加32.64%和7.53%、地上部干重增加23.99%和19.49%(P < 0.05);而施加2.5 mmol·L-1和5.0 mmol·L-1 EDDS均抑制了植物生长,使株高、根长、地下部和地上部鲜重、干重显著降低(P < 0.05)。
|
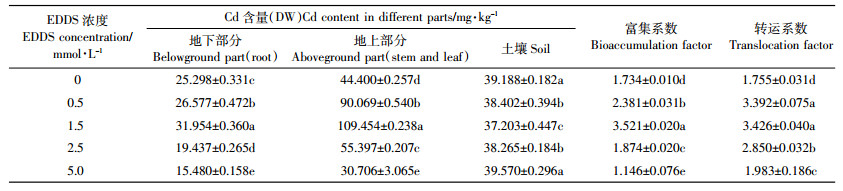
随着EDDS浓度的升高,地上部和地下部Cd含量、转运系数以及富集系数均呈先增后减的趋势,但土壤Cd含量呈先减后增的趋势(表 2)。由表 2可看出,施加5.0 mmol·L-1 EDDS时,土壤中Cd含量最高,与CK相比无显著差异,且显著高于其他处理,这是因为高浓度EDDS对植物生长有抑制作用,使其生长状况不良,对Cd的吸收量减少,使土壤中Cd含量较高;而施加0.5~2.5 mmol·L-1 EDDS时,由于植物对Cd的吸收作用,导致土壤中Cd含量低于CK。
|
与CK相比,施加低浓度(0.5~1.5 mmol·L-1)EDDS,均使植物地上部、地下部Cd含量显著增加,其中施加1.5 mmol·L-1 EDDS使地上部和地下部Cd含量达到最高,分别比CK显著增加了146.72%和26.31%(P < 0.05),其中地上部分Cd含量达到109.454 mg·kg-1,大于土壤重金属污染修复植物应具备的茎或叶富集重金属的临界Cd含量(100 mg·kg-1)。而施加2.5 mmol·L-1和5.0 mmol·L-1 EDDS均使地下部Cd含量显著减少,施加5.0 mmol·L-1 EDDS使地上部Cd含量显著减少(P < 0.05)。
施加0.5~2.5 mmol·L-1 EDDS使富集系数和转运系数均显著高于CK(P < 0.05),且大于1.0,说明Cd胁迫下较低浓度的EDDS可显著增加三叶鬼针草对Cd的富集和转运作用。而施加5.0 mmol·L-1 EDDS,富集系数明显低于CK,说明该浓度不利于三叶鬼针草对Cd的吸收,但转运系数略高于CK。
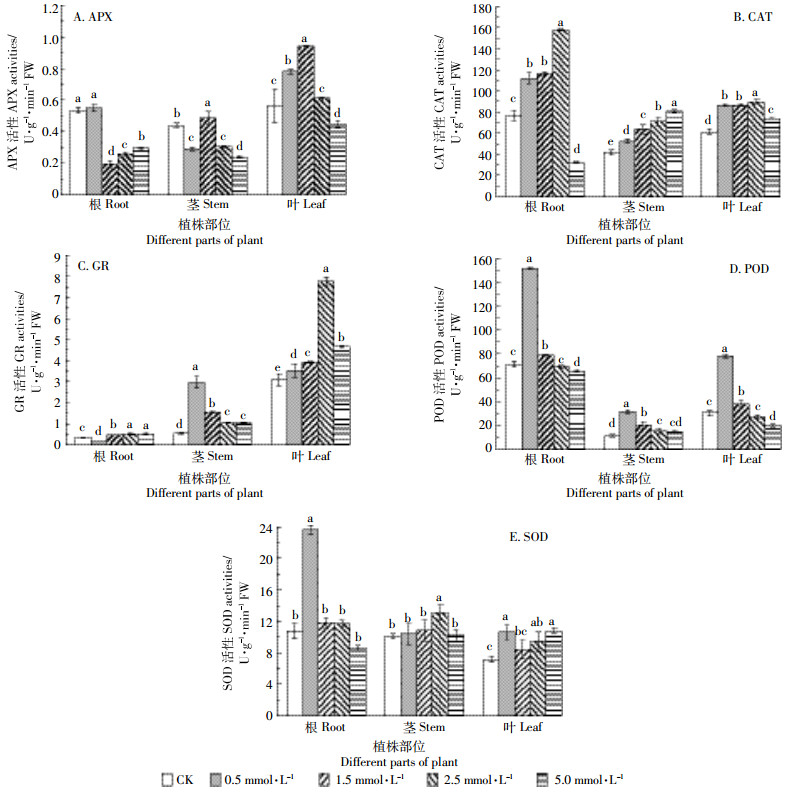
2.3 EDDS对Cd胁迫下三叶鬼针草抗氧化酶系统的影响如图 1A所示,只有0.5 mmol·L-1 EDDS使根中APX活性略高于CK,其余浓度EDDS均使根中APX活性显著低于CK(P < 0.05);茎中APX活性在施加1.5 mmol·L-1 EDDS后达到最大且显著高于CK,而其余浓度均使APX活性显著低于CK(P < 0.05);叶中APX活性在施加较低浓度(0.5 mmol·L-1和1.5 mmol·L-1)EDDS后显著增强,且在1.5 mmol·L-1 EDDS时达到最大,较CK显著增加了66.84%(P < 0.05),但随着EDDS施加浓度的进一步增加,在施加2.5 mmol·L-1 EDDS后APX活性增加不显著(P>0.05),在施加5.0 mmol·L-1 EDDS后则显著降低(P < 0.05)。
|
| 图中不同小写字母表示各处理间差异显著(P<0.05) Different small lette`rs indicate significant differences among different treatments(P<0.05) 图 1 EDDS对Cd胁迫下三叶鬼针草幼苗APX、CAT、GR、POD和SOD活性的影响 Figure 1 Effects of EDDS on activities of APX, CAT, GR, POD, and SOD in the Bidens pilosa seedlings under Cd stress |
如图 1B所示,随施加EDDS浓度的升高,根中CAT活性呈先升后降的趋势,0.5~2.5 mmol·L-1 EDDS均使根中CAT活性显著高于CK(P < 0.05),且在施加2.5 mmol·L-1 EDDS时达到最大,较CK增加了105.34%,而在施加5.0 mmol·L-1 EDDS时显著低于CK(P < 0.05);茎中CAT活性呈一直上升的趋势,且在施加5.0 mmol·L-1 EDDS时达到最大;叶中CAT活性虽然呈先升后降的趋势,但其活性均显著高于CK(P < 0.05)。
如图 1C所示,除0.5 mmol·L-1 EDDS使根中GR活性低于CK外,其余浓度使根、茎和叶中GR均显著高于CK(P < 0.05)。随施加EDDS浓度的升高,根中GR活性呈一直增强的趋势,茎中在0.5 mmol·L-1 EDDS时达到最大,之后呈一直下降的趋势,但仍显著高于CK,叶中随施加EDDS浓度的升高呈先升后降的趋势,在施加2.5 mmol·L-1 EDDS时达到最大,在5.0 mmol·L-1 EDDS时显著下降,但仍显著高于CK。
如图 1D所示,施加0.5 mmol·L-1 EDDS使根、茎、叶中POD活性显著增强,较CK分别增加了112.60%、174.31%、154.86%(P < 0.05),但随施加EDDS浓度的升高,POD活性则持续下降。
如图 1E所示,施加0.5 mmol·L-1 EDDS使根中SOD活性显著增强,较CK增加了213.37%(P < 0.05),随施加EDDS浓度的升高,根中SOD活性呈一直下降的趋势,与CK无显著差异(P>0.05);茎中SOD活性随施加EDDS浓度的升高呈先升后降的趋势,在施加2.5 mmol·L-1 EDDS时达到最大,较CK显著增加了29.59%(P < 0.05);施加0.5、2.5、5.0 mmol·L-1 EDDS均使叶中SOD活性显著高于CK(P < 0.05),尽管施加1.5 mmol·L-1 EEDS时与CK差异不显著,但SOD活性仍有提高。
2.4 三叶鬼针草幼苗根中Cd含量与抗氧化酶系统的相关性及回归分析根是植物吸收重金属的主要部位,进而才向地上部分转移,为探讨三叶鬼针草幼苗中抗氧化酶系统是否对其吸收和积累Cd的能力有影响,本研究对三叶鬼针草幼苗根中Cd含量与抗氧化酶系统做了相关性及回归分析,结果表明(表 3):根中Cd含量与GR和APX负相关,与CAT、POD、SOD呈正相关,但其相关性并不显著,说明抗氧化酶系统与三叶鬼针草幼苗吸收和积累Cd的能力没有直接的相关性,但Cd胁迫下,随着EDDS浓度的变化抗氧化酶系统被启动,对胁迫过程中积累的活性氧进行清除,减轻了外界胁迫对植物造成的膜损害。
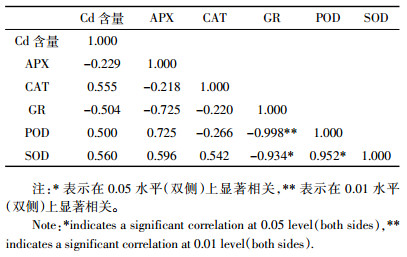
|
回归分析结果如下:
Y=25.033-8.897X1 R2=0.052
Y=14.758+0.060X2 R2=0.308
Y=37.492-36.265X3 R2=0.254
Y=8.241+0.157X4 R2=0.250
Y=9.180+0.983X5 R2=0.314
式中Y为Cd含量,X1、X2、X3、X4、X5分别为APX、CAT、GR、POD、SOD活性,R为相关系数。回归分析与相关性分析结果相同。
3 讨论 3.1 EDDS对Cd胁迫下三叶鬼针草生长及Cd富集能力的影响螯合剂对金属离子具有较强的螯合能力,进入土壤后,可活化土壤中重金属,减少土壤对重金属的吸附,提高植物对重金属的可利用性,进而被植物最大限度地吸收[14]。目前,螯合剂辅助植物修复重金属污染土壤已成为研究热点之一。但是,施用螯合剂也有一定的风险,如对植物产生毒性(影响其生长、叶片变黄等)[15-16],破坏土壤结构,使其养分流失,对土壤生态环境造成影响等。本研究结果表明:Cd胁迫下,施加较低浓度的EDDS有利于三叶鬼针草幼苗的生长,使株高、根长、地上部鲜干重和地下部鲜干重显著增加,而施加高浓度EDDS则不利于植物的生长,由表 1可看出株高、根长、地下部和地上部鲜重、干重显著降低。该结果与袁菊红[13]和Hseu等[17]研究结果一致,但刘金等[18]发现EDDS会不同程度减少苎麻生物量,熊国焕等[19]的结果表明EDDS对大叶井口边草生物量无明显的影响。这种结果的差异可能与植物物种,试验方法,螯合剂种类、浓度、施加方式、施加时间,土壤类型等不同有关,而且这种差异究竟是何种原因导致还需进一步研究。
适宜浓度的EDDS可增加土壤中重金属活性而被植物更有效地吸收,促进植物地上部对重金属更多的吸收和累积。在土壤重金属污染植物修复研究中,富集系数越大,表明植物对重金属的吸收累积能力就越强;转移系数越大,则表明重金属从根系向地上部器官转运能力就越强[20],越有利于植物修复重金属污染土壤。研究表明EDDS可促进苎麻对Cd的吸收[21],增加向日葵对铀的吸收和转运能力[22],促进金盏菊根、茎、叶各器官对Cd的富集[23],增加菊花和黑麦草对Cu的积累[24]。本研究结果表明:Cd胁迫下,施加低浓度EDDS显著增加了三叶鬼针草地上部和地下部Cd含量,其中施加1.5 mmol·L-1时,Cd积累量大于土壤重金属Cd污染修复植物应具备的茎或叶富集重金属的临界含量,说明低浓度EDDS可显著增强植物对Cd的吸收和积累,而且三叶鬼针草的富集系数与转移均在1.0之上,表明其具有超富集植物的特征[25];而高浓度则受到抑制,这可能是由于高浓度EDDS对三叶鬼针草有一定毒害作用,不利于植物生长。除施加5.0 mmol·L-1 EDDS富集系数低于CK以外,添加EDDS使富集系数和转运系数均高于CK,表明EDDS可以促进Cd在植物中富集以及向地上部转移,在植物修复方面是有利的。
3.2 EDDS对Cd胁迫下三叶鬼针草抗氧化酶系统的影响在没有受到外界胁迫的情况下,植物体内活性氧(ROS)代谢处于稳定状态。在Cd和EDDS的胁迫下植物体内平衡被打破,对植物生长和生理特性产生影响,进而影响植物的生长发育。因此,植物将对这种变化做出反应,比如激活抗氧化酶系统,使之酶活性提高以维持活性氧平衡[26-28]。研究表明砷处理使大叶井口边草叶[29]、黑麦草和丛枝菌根单一或联合修复使黑麦草[30]、酸雨使毛竹[31]、低浓度Cd胁迫使三叶鬼针草幼苗[32]中抗氧化酶被诱导,活性增强,最大限度清除自由基,防止其对植物的损伤。本研究结果表明:Cd胁迫下,施加不同浓度的EDDS,三叶鬼针草根、茎和叶中APX、CAT、GR、POD和SOD活性变化不尽相同。在施加低浓度EDDS时,根中CAT和GR优先启动,茎中APX、CAT和SOD优先启动,叶中APX、CAT和GR优先启动,清除植物体内多余的ROS,保护植物细胞膜。在施加高浓度EDDS时,根中APX、POD和SOD起主要作用,茎中GR和POD,叶中SOD和POD起主要作用,从而减轻了外界胁迫对植物造成的膜伤害。酶活性在植物体内反复变化一方面说明对Cd胁迫和EDDS较为敏感,另一方面也表明植物随着Cd胁迫的持续以及EDDS浓度和环境的变化在不断调整自身,从而适应多变环境,减轻逆境对植物自身的伤害,促进植物生长,并增加对重金属的富集和转运[11]。酶作用的不同可能是由于植物物种的种类、器官、实验条件等差异造成的,具体是何原因主导需进一步实验探索。
本研究中,尽管抗氧化酶系统与三叶鬼针草幼苗吸收和积累Cd的能力没有直接的相关性,但在Cd胁迫下,施加低浓度EDDS(0.5~2.5 mmol·L-1)三叶鬼针草根中CAT、GR、SOD和POD活性能够维持或增加,其中CAT活性增加尤为显著,表明其具有强大的清除自由基的能力,减轻了胁迫对植物膜系统造成的损害,维持植物正常生长状况,有利于Cd的富集。而施加5.0 mmol·L-1 EDDS 5种酶均显著低于CK,说明Cd胁迫和高浓度的EDDS对植物造成的影响已超过了植物抗氧化能力限度,引起细胞代谢失调,抑制了酶的合成,不能有效清除活性氧,细胞膜系统受损,植物生长受到抑制,对Cd的吸收减少。表明EDDS施入Cd污染土壤后,通过影响三叶鬼针草生理生化过程以响应重金属Cd的胁迫[33]。
4 结论(1)Cd胁迫下,施加低浓度EDDS会显著促进三叶鬼针草幼苗的生长,增加其对Cd的吸收、富集和转运。
(2)Cd胁迫下,随着不同浓度EDDS的施加,三叶鬼针草幼苗地上部和地下部组织中不同抗氧化酶优先启动,清除Cd胁迫诱导产生的过量ROS,抵御膜脂过氧化,减轻逆境对膜系统造成的损伤。
(3)施加EDDS可增强三叶鬼针草对Cd污染土壤的修复效果,结合生长指标,充分考虑土壤重金属类型和螯合剂可能对环境造成的二次污染,优先选择施用量为1.5 mmol·L-1。
| [1] |
环境保护部, 国土资源部. 全国土壤污染状况调查公报[J]. 中国环保产业, 2014, 1(5): 10-11. Ministry of Environmental Protection, Ministry of Land and Resources. The soil pollution condition investigation communique[J]. China Environmental Protection Industry, 2014, 1(5): 10-11. |
| [2] |
Nowack B, Schulin R, Robinson B H. Critical assessment of chelant-enhanced metal phytoextraction[J]. Environmental Science & Technology, 2006, 40(17): 5225-5232. |
| [3] |
Mitch M L. Phytoextraction of toxic metals:A review of biological mechanism[J]. Journal of Environmental Quality, 2002, 31(1): 109-120. DOI:10.2134/jeq2002.1090 |
| [4] |
Meers E, Ruttens A, Hopgood M, et al. Comparison of EDTA and EDDS as potential soil amendments for enhanced phytoextraction of heavy metals[J]. Chemosphere, 2005, 58(8): 1011-1022. DOI:10.1016/j.chemosphere.2004.09.047 |
| [5] |
Luo C L, Shen Z G, Lou L Q, et al. EDDS and EDTA-enhanced phytoextraction of metals from artificially contaminated soil and residual effects of chelant compounds[J]. Environmental Pollution, 2006, 144(3): 862-871. DOI:10.1016/j.envpol.2006.02.012 |
| [6] |
白薇扬, 赵清华, 谭怀琴. 非生物螯合剂EDTA与生物螯合剂EDDS联合施用提高植物提取土壤重金属效应的研究[J]. 重庆理工大学学报(自然科学), 2013, 27(8): 47-53, 61. BAI Wei-yang, ZHAO Qing-hua, TAN Huai-qin. Effects of EDTA, EDDS phytoextract artificially polluted soil with heavy metals[J]. Journal of Chongqing University of Technology(Natural Science), 2013, 27(8): 47-53, 61. |
| [7] |
Attinti R, Barrett K R, Datta R, et al. Ethylenediamine disuccinic acid(EDDS) enhances phytoextraction of lead by vetiver grass from contaminated residential soils in a panel study in the field[J]. Environmental Pollution, 2017, 225(6): 524-533. |
| [8] |
谌金吾, 孙一铭, 王凤英, 等. 三叶鬼针草毛状根的诱导及其对重金属Cd、Pb蓄积[J]. 环境科学学报, 2015, 35(5): 1596-1602. CHEN Jin-wu, SUN Yi-ming, WANG Feng-ying, et al. Induction and accumulation of cadmium and lead by hairy root of Bidens pilosa[J]. Acta Scientiae Circumstantiae, 2015, 35(5): 1596-1602. |
| [9] |
弓晓峰, 欧丽, 刘足根, 等. 氮磷钾和乙二胺四乙酸对镉污染三叶鬼针草的吸收特征研究[J]. 环境污染与防治, 2011, 33(2): 1-6, 11. GONG Xiao-feng, OU Li, LIU Zu-gen, et al. Effect of nutrient elements and EDTA on the cadmium bioaccumulation of Bidens pilosa[J]. Environmental Pollution & Control, 2011, 33(2): 1-6, 11. |
| [10] |
王芳, 常盼盼, 陈永平, 等. 外源NO对镉胁迫下玉米幼苗生长和生理特性的影响[J]. 草业学报, 2013, 22(2): 178-186. WANG Fang, CHANG Pan-pan, CHEN Yong-ping, et al. Effect of exogenous nitric oxide on seedling growth and physiological characteristics of maize seedlings under cadmium stress[J]. Acta Prataculturae Sinica, 2013, 22(2): 178-186. DOI:10.11686/cyxb20130223 |
| [11] |
刘柿良, 潘远智, 杨容孑, 等. 外源一氧化氮对镉胁迫下长春花质膜过氧化、ATPase及矿质营养吸收的影响[J]. 植物营养与肥料学报, 2014, 20(2): 445-458. LIU Shi-liang, PAN Yuan-zhi, YANG Rong-jie, et al. Effects of exogenous NO on mineral nutrition absorption, lipid peroxidation and ATPase of plasma membrane in Catharanthus roseus tissues under cadmium stress[J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(2): 445-458. DOI:10.11674/zwyf.2014.0222 |
| [12] |
陈银萍, 蘧苗苗, 苏向楠, 等. 外源一氧化氮对镉胁迫下紫花苜蓿幼苗活性氧代谢和镉积累的影响[J]. 农业环境科学学报, 2015, 34(12): 2261-2271. CHEN Yin-ping, QU Miao-miao, SU Xiang-nan, et al. Effect of exogenous nitric oxide on active oxygen metabolism and cadmium accumulation in alfalfa seedlings under cadmium stress[J]. Journal of Agro-Environment Science, 2015, 34(12): 2261-2271. DOI:10.11654/jaes.2015.12.003 |
| [13] |
袁菊红. Se胁迫条件下EDDS对彩叶草生长和生理指标及Se含量的影响[J]. 植物资源与环境学报, 2012, 21(4): 87-93. YUAN Ju-hong. Effects of EDDS on growth, physiological indexes and Se content of Coleus blumei under Se stress[J]. Journal of Plant Resources and Environment, 2012, 21(4): 87-93. |
| [14] |
Epstein A L, Gussman C D, Blaylock M J, et al. EDTA and Pb-EDTA accumulation in Brassica juncea grown in Pb-amended soil[J]. Plant and Soil, 1999, 208(1): 87-94. DOI:10.1023/A:1004539027990 |
| [15] |
胡亚虎, 魏树和, 周启星, 等. 螯合剂在重金属污染土壤植物修复中的应用研究进展[J]. 农业环境科学学报, 2010, 29(11): 2055-2063. HU Ya-hu, WEI Shu-he, ZHOU Qi-xing, et al. Application of chelator in phytoremediation of heavy metals contaminated soils:A review[J]. Journal of Agro-Environment Science, 2010, 29(11): 2055-2063. |
| [16] |
Römkens P, Bouwman L, Japenga J, et al. Potentials and drawbacks of chelate-enhanced phytoremediation of soils[J]. Environmental Pollution, 2002, 116(1): 109-121. DOI:10.1016/S0269-7491(01)00150-6 |
| [17] |
Hseu Z Y, Jien S H, Wang S H, et al. Using EDDS and NTA for enhanced phytoextraction of Cd by water spinach[J]. Journal of Environmental Management, 2013, 117(1): 58-64. |
| [18] |
刘金, 殷宪强, 孙慧敏, 等. EDDS与EDTA强化苎麻修复镉铅污染土壤[J]. 农业环境科学学报, 2015, 34(7): 1293-1300. LIU Jin, YIN Xian-qiang, SUN Hui-min, et al. EDTA and EDDS enhanced remediation of Cd and Pb contaminated soil by ramie(Boehmeria nivea)[J]. Journal of Agro-Environment Science, 2015, 34(7): 1293-1300. DOI:10.11654/jaes.2015.07.010 |
| [19] |
熊国焕, 潘义宏, 何艳明, 等. 螯合剂对大叶井口边草Pb、Cd、As吸收性影响研究[J]. 土壤, 2012, 44(2): 282-289. XIONG Gou-huan, PAN Yi-hong, HE Yan-ming, et al. Chelate assisted uptake of heavy metal of lead, cadmium and arsenic from soil with Pteris cretica var. nervosa[J]. Soils, 2012, 44(2): 282-289. |
| [20] |
孙约兵, 周启星, 任丽萍. 镉超富集植物球果蔊菜对镉-砷复合污染的反应及其吸收积累特征[J]. 环境科学, 2007, 28(6): 1355-1360. SUN Yue-bing, ZHOU Qi-xing, REN Li-ping. Growth responses of Rorippa globosa and its accumulation characteristics of Cd and As under the Cd-As combined pollution[J]. Environmental Science, 2007, 28(6): 1355-1360. |
| [21] |
拓朵朵. EDTA与EDDS强化苎麻修复汞镉复合污染土壤的研究[D]. 杨凌: 西北农林科技大学, 2016. TUO Duo-duo. Study on EDTA and EDDS strengthening ramie to restore Hg/Cd contamination soil[D]. Yangling: Northwest Agriculture and Forestry University, 2016. |
| [22] |
陈立, 王丹, 龙婵, 等. 三种螯合剂对向日葵修复铀污染土壤的效应研究[J]. 中国农学通报, 2017, 33(11): 81-88. CHEN Li, WANG Dan, LONG Chan, et al. Effect of three chelating agents on U polluted soil repairing by sunflower[J]. Chinese Agricultural Science Bulletin, 2017, 33(11): 81-88. DOI:10.11924/j.issn.1000-6850.casb16100097 |
| [23] |
白雪. EDDS强化金盏菊修复重金属污染土壤及环境风险分析[D]. 重庆: 西南大学, 2014. BAI Xue. Study on EDDS strengthening Calendula officinals to restore heavy metals soils and environmental assessment[D]. Chongqing: Southwest University, 2014. |
| [24] |
Li Y, Luo C L, Liu Y, et al. Residual effects of EDDS leachates on plants during EDDS-assisted phytoremediation of copper contaminated soil[J]. Science of the Total Environment, 2013, 444(1): 263-270. |
| [25] | |
| [26] |
Rosenbaugh E G, Manickam D S, Batrakova E V, et al. Neuronal uptake and subcellular localization of functional nanoformulated copper/zinc superoxide dismutase(SOD nano)[J]. The Faseb Journal, 2012, 26: 893. |
| [27] |
Noctor G, Foyer C H. Ascorbate and glutathione:Keeping active oxygen under control[J]. Annual Review of Plant Biology, 1998, 49(1): 249-279. DOI:10.1146/annurev.arplant.49.1.249 |
| [28] |
王松华, 张华, 何庆元. 铜胁迫对紫花苜蓿幼苗叶片抗氧化系统的影响[J]. 应用生态学报, 2011, 22(9): 2285-2290. WANG Song-hua, ZHANG Hua, HE Qing-yuan. Effects of copper stress on Medicago sativa seedlings leaf antioxidative system[J]. Chinese Journal of Applied Ecology, 2011, 22(9): 2285-2290. |
| [29] |
胡拥军, 王海娟, 王宏镔, 等. 砷胁迫下不同砷富集能力植物内源生长素与抗氧化酶的关系[J]. 生态学报, 2015, 35(10): 3214-3224. HU Yong-jun, WANG Hai-juan, WANG Hong-bin, et al. The relationship between endogenous auxin and antioxidative enzymes in two plants with different arsenic-accumulative ability under arsenic stress[J]. Acta Ecologica Sinica, 2015, 35(10): 3214-3224. |
| [30] |
江玲, 杨芸, 徐卫红, 等. 黑麦草-丛枝菌根对不同番茄品种抗氧化酶活性、镉积累及化学形态的影响[J]. 环境科学, 2014, 35(6): 2349-2357. JIANG Ling, YANG Yun, XU Wei-hong, et al. Effects of ryegrass and arbuscular mycorrhiza on activities of antioxidant enzymes, accumulation and chemical forms of cadmium in different varieties of tomato[J]. Environmental Science, 2014, 35(6): 2349-2357. |
| [31] |
郭慧媛, 马元丹, 王丹, 等. 模拟酸雨对毛竹叶片抗氧化酶活性及释放绿叶挥发物的影响[J]. 植物生态学报, 2014, 38(8): 896-903. GUO Hui-yuan, MA Yuan-dan, WANG Dan, et al. Effects of simulated acid rain on the activity of antioxidant enzyme and the emission of induced green leaf volatiles in Phyllostachys pubescens[J]. Chinese Journal of Plant Ecology, 2014, 38(8): 896-903. |
| [32] |
孙约兵, 周启星, 王林, 等. 三叶鬼针草幼苗对镉污染的耐性及其吸收积累特征研究[J]. 环境科学, 2009, 30(10): 3028-3035. SUN Yue-bing, ZHOU Qi-xing, WANG Lin, et al. Characteristics of cadmium tolerance and bioaccumulation of Bidens pilosa seedlings[J]. Environmental Science, 2009, 30(10): 3028-3035. DOI:10.3321/j.issn:0250-3301.2009.10.036 |
| [33] |
罗艳, 张世熔, 徐小逊, 等. 可降解螯合剂对镉胁迫下籽粒苋根系形态及生理生化特征的影响[J]. 生态学报, 2014, 34(20): 5774-5781. LUO Yan, ZHANG Shi-rong, XU Xiao-xun, et al. Effects of biodegradable chelants on the root morphology and physiological-biochemical characteristics of Amaranthus hybridus L. in cadmium contaminated soils[J]. Acta Ecologica Sinica, 2014, 34(20): 5774-5781. |
 2018, Vol. 37
2018, Vol. 37




