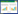文章信息
- 吴东墨, 王宏镔, 王海娟, 王忠振, 蔡文昌
- WU Dong-mo, WANG Hong-bin, WANG Hai-juan, WANG Zhong-zhen, CAI Wen-chang
- 吲哚乙酸和激动素配合施用对蜈蚣草土壤砷提取效率的影响
- Effects of the combined application of indole acetic acid and kinetin on the arsenic extraction efficiency of soil after planting Pteris vittata
- 农业环境科学学报, 2018, 37(8): 1705-1715
- Journal of Agro-Environment Science, 2018, 37(8): 1705-1715
- http://dx.doi.org/10.11654/jaes.2018-0122
文章历史
- 收稿日期: 2018-01-22
- 录用日期: 2018-04-09
随着含砷(As)矿石的开采、冶炼以及含As农药的不合理施用,环境中的As污染严重影响农业生产,破坏生态环境并威胁人类健康。2010年,中国消耗了33.8亿t煤,有可能排放了9000 t As[1]。《全国土壤污染状况调查公报》[2]显示,我国土壤As的点位超标率为2.7%,在8种无机污染物中仅次于镉(Cd)和镍(Ni),位居第三位。另有调查发现,广西南丹大厂超大型锡多金属矿田的开发导致刁江沿岸土壤As超过《土壤环境质量标准》(GB 15618—1995)(Ⅲ级)36~ 276倍[3]。因此,As污染土壤的修复显得尤为重要和迫切。
自Ma等[4]和Chen等[5]发现蜈蚣草(Pteris vittata)超量富集As以来,利用蜈蚣草修复As污染土壤便受到广泛关注。植物修复技术因具有操作简便、经济有效和环境友好等优点而成为众多修复技术中的优选,然而由于重金属超富集植物普遍具有发芽率低、生长缓慢和生物量低等缺陷,使得修复周期长、效率低。为提高植物修复效率,孙约兵等[6]提出可利用植物激素打破修复植物的种子休眠、发芽和快速生长。有研究表明,植物激素对超富集植物的生长和重金属吸收具有促进作用。据Cassina等[7]报道,在叶面、土壤和二者联合施用细胞分裂素(CTK)后,Ni超富集植物Alyssum murale的生物量分别增加了53%、41%和75%;锌(Zn)/Cd超富集植物滇苦菜(Picris divaricata)经10 μmol·L-1和100 μmol·L-1吲哚乙酸(IAA)处理,叶片铅(Pb)富集量分别上升了28.4%和37.3%[8];何冰等[9]发现叶喷一定浓度脱落酸(ABA)、IAA和6-苄氨基嘌呤(6-BA)可提高Zn/Cd超富集植物东南景天(Sedum alfredii)的生物量,并促进其对Cd的吸收和富集。
外源植物激素可有效缓解重金属对植物的毒害,提高植物对重金属的耐受性和提取能力[10],但目前单一喷施某一种(类)植物激素的研究较多,而针对不同激素配合施用改善超富集植物重金属提取效率的研究尚少。植物激素中,生长素(AUX)可调节植物生长发育、细胞分裂和伸长生长,而CTK在细胞扩增和分化、种子萌发及延缓衰老中也起着关键作用。IAA和激动素(KT)分别是AUX和CTK的典型代表,而蜈蚣草是全球公认的As超富集植物,因此,探讨IAA和KT配合施用对蜈蚣草As提取效率的影响,对协同使用植物激素以提高超富集植物对重金属污染土壤修复效率具有重要意义。为此,我们提出植物激素配合施用可以改善As超富集植物蜈蚣草As提取效率的研究假设。为验证这一假设,本文首先采用盆栽正交实验,在低As污染土壤中种植蜈蚣草,考察2个因素(IAA和KT)、4个不同的激素水平(不施加、低、中和高浓度)下蜈蚣草As提取效率的变化,找出使As提取效率最高的两种激素的最佳配比。然后研究最佳浓度配比下蜈蚣草生理生化的响应,确定与As提取效率具有显著相关性的生理生化因素,探究激素联合施用提高植物As提取效率的原因,为在重金属污染土壤修复中合理使用植物生长调节剂提供科学依据。
1 材料与方法 1.1 供试植物蜈蚣草初生小苗采自云南省红河州开远市郊区的桉树林,进行修剪后,在温室的清洁土壤中培养1个月,选取长势良好、大小一致的幼苗(高7~8 cm、带3~4片小叶)进行盆栽实验。
1.2 供试土壤采集昆明理工大学呈贡校区校园土,自然风干后过5 mm尼龙筛,将校园土、河沙和腐殖土按2: 1: 1的比例充分混匀。供试土壤基本理化性质如表 1所示。
在供试土壤中添加50 mg·kg-1 As(以NaAsO2形式加入,As浓度以纯As计)代表轻度污染条件(土壤总As含量为55 mg·kg-1),并加入N、P、K营养元素(N: P2O5: K2O=0.15: 0.10: 0.15 g·kg-1土,干质量)作基肥,平衡6周后装盆(1 kg·盆-1,干质量),每盆种植2株植物,在室温自然光下培养,温度变幅为15~25 ℃。
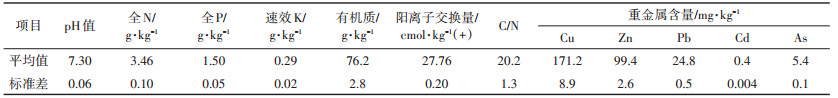
激素最佳配比筛选实验:叶喷IAA浓度为0、25、50、100 mg·L-1,KT浓度为0、20、40、60 mg·L-1,以2因素4水平进行正交实验(表 2)。植物种植2个月,每个处理设置4个重复,两种激素喷施量均为10 mL·盆-1,7 d一次。当IAA和KT水平为0 mg·L-1时,喷洒相同体积去离子水。
最佳激素配比下植物生理生化的响应实验:供试As污染土壤和基肥处理同前,As含量仍为55 mg·kg-1。设IAA和KT的最佳配比为(X,Y),其中X是IAA,Y是KT,设计施用浓度为CK(0,0)、IAA(X,0)、KT(0,Y)、IAA+KT(X,Y)。植物种植1个月,喷洒量与方法同前。
1.4 样品处理及测定筛选IAA和KT最佳配比的植物培养2个月后收获。先用自来水清洗,再用0.1 mol·L-1 HCl冲洗以去除表面附着的As,最后用去离子水洗净[11]。用滤纸吸干植物表面水分,测量其株高。将植株分为地上部分(叶柄和叶片)和地下部分(根),于烘箱105 ℃杀青30 min后,70 ℃烘干至恒质量,称量各部分干质量,再将地上和地下部分分别磨碎混匀,以测定植物含As量。
考虑到冬季气候条件的影响,IAA和KT最佳配比下植物生理生化响应实验中的植物在种植1个月后收获。清洗后,测量株高、干质量、As含量、根长、根尖数、根表面积、根系活力、光合色素(叶绿素a、叶绿素b、类胡萝卜素)、脯氨酸和可溶性糖含量,以及抗氧化酶活性和细胞膜脂过氧化产物丙二醛(MDA)含量。植物株高和干质量测定方法同前,土壤As消化采用王水-HClO4法,植物As消化采用HNO3-H2O2法,土壤有效态As浸提采用0.5 mol·L-1 NaH2PO4法[12]。土壤和植物As含量均用原子荧光法进行测定,具体操作和仪器参照和淑娟等[13]。测定As的工作曲线为:
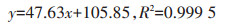
式中:y为荧光强度;x为标样As浓度,μg·L-1。
As的加标回收率为94%~97%,符合As测定质量控制要求。根长、根尖数和根表面积的测定先用扫描仪(HP Laser Jet M1005 MEP)扫描完整根系图像,再用Winrhizo根系系统分析软件分析[14];根系活力测定采用氯化三苯基四氮唑(TTC)法,光合色素测定采用95%乙醇提取-分光光度法,脯氨酸测定采用酸性茚三酮法,可溶性糖测定采用苯酚法,超氧化物歧化酶(SOD)活性测定采用氮蓝四唑法,过氧化氢酶(CAT)活性测定采用高锰酸钾滴定法,过氧化物酶(POD)活性测定采用愈创木酚法,MDA含量的测定采用硫代巴比妥酸法,具体见文献[15]。
1.5 数据统计与分析实验数据经Microsoft Excel 2010处理,用SPSS 20.0进行方差和相关分析,Origin 9.0绘图。运用Tukey′s HSD(Honestly significant difference)法进行多重比较,显著性差异水平取0.05,极显著性差异水平取0.01。指标计算所用公式如下:
植物提取As量=植物地上部分As含量×植物地上部分干质量
As提取效率=植物提取As量(/土壤As含量×土壤干质量)×100%
植物As富集系数(Bioconcentration factor,BCF)=地上部分As含量/土壤As含量
植物As转运系数(Translocation factor,TF)=地上部分As含量/地下部分As含量。
2 结果与分析 2.1 IAA和KT配合施用对蜈蚣草As提取效率的影响 2.1.1 对蜈蚣草株高和干重的影响55 mg·kg-1 As处理下,IAA和KT的不同配比对蜈蚣草株高和干重的影响不同。5、6、8、9、10、13、14、15号处理组(组号具体含义见表 2)蜈蚣草株高均显著高于未施用激素的对照组(1号处理组)(P<0.05,图 1A)。2、3、4、6、8、10号处理组蜈蚣草地上部分干重与对照组相比显著增加(P<0.05,图 1B),4、6、7、8、9号处理组地下部分干重显著提高(P<0.05),其余处理组则与对照无显著差异。可见,6号和8号处理组的激素配比条件下,蜈蚣草的株高、地上和地下部分干质量均显著增加。
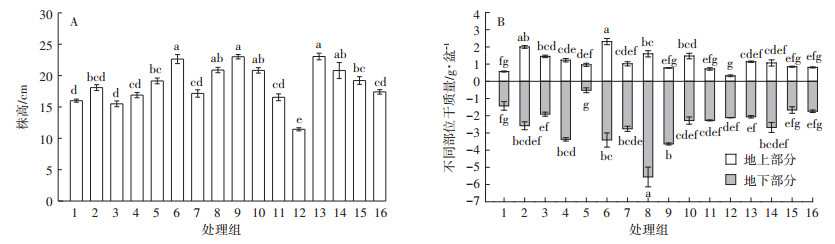
|
| 处理组号同表 2,与 IAA和 KT处理浓度一一对应。结果为均值±SE(n=4),图中不同字母表示植物在不同浓度 IAA和 KT配合施用下的差异显著(P < 0.05)。下同 The meaning of numbers is shown in Table 2, which is corresponded to the IAA and KT concentrations. The results are mean ± SE(n=4). The different letters in the figure indicate that the plant height or dry weight has significant difference(P < 0.05)among different treatments. The same below 图 1 不同浓度IAA和KT配合施用对蜈蚣草株高和干质量的影响 Figure 1 Effects of IAA and KT with combined application on plant height and dry weight of P. vittata |
盆栽2个月后,与对照组相比,9、11、12、13、15处理组的IAA和KT配合施用显著提高了蜈蚣草地上部As含量和富集系数(P<0.05,图 2A,表 3),其中地上部As含量显著增加了56.6%~92.9%。IAA和KT的施用也使植物地下部分As含量显著增加(P<0.05,图 2A),且各处理组转运系数均大于1(表 3)。
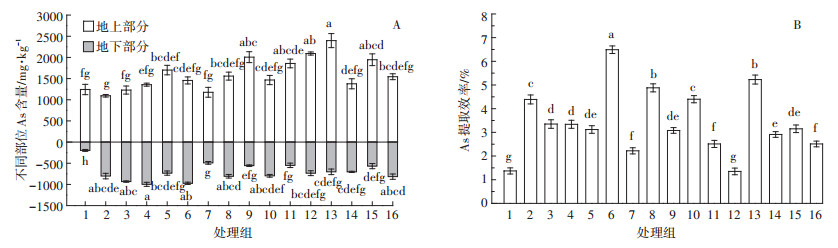
|
| 图 2 不同浓度IAA和KT配合施用对蜈蚣草As吸收和提取效率的影响 Figure 2 Effects of IAA and KT with combined application on As uptake and extraction efficiency of P. vittata |

|
另外,除12号处理组As提取效率与对照组无显著差异外,其余处理组As提取效率均显著高于对照组(P<0.05,图 2B)。其中,6号处理组As提取效率最高,为6.49%,是对照的4.7倍。同时,测得6号处理组土壤总As含量为(51.5±1.0)mg·kg-1(n=4),这与植物提取As量基本对应。结合2.1.1结果,25 mg·L-1 IAA和20 mg·L-1 KT为使蜈蚣草砷提取效率最佳的配比。
2.2 激素最佳配比下蜈蚣草的生理生化响应 2.2.1 蜈蚣草的生长状况从图 3可知,种植1个月后,与未施用激素的对照(CK)和单一激素处理相比,最佳配比IAA+KT处理使蜈蚣草株高、地上部和地下部干质量显著增加并达到最大值(P<0.05)。
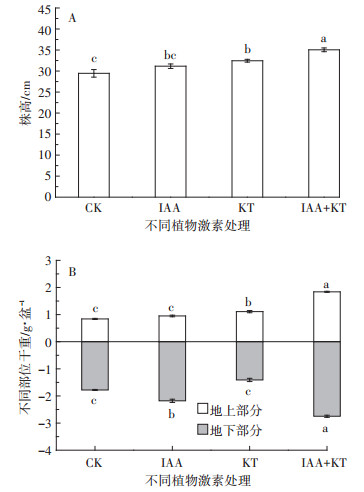
|
| 图 3 激素最佳配比下蜈蚣草的株高和干重 Figure 3 Plant height and dry weight of P. vittata under optimum matching of plant hormones |
最佳激素配比下,蜈蚣草根长、根尖数、根表面积和根系活力均显著高于CK和单一激素处理(P<0.05,图 4)。除单独KT处理下蜈蚣草根表面积与CK相比显著降低外(P<0.05,图 4C),单独IAA或KT施用下蜈蚣草根长、根尖数、根表面积和根系活力均与CK无显著差异。

|
| 图 4 激素最佳配比下蜈蚣草的根系形态和根系活力 Figure 4 Root morphology and root activity of P. vittata under optimum matching of plant hormones |
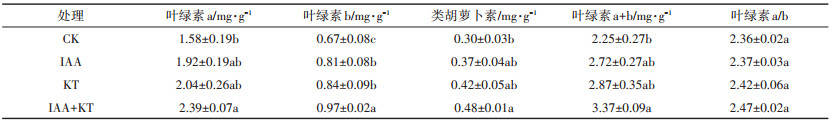
与CK相比,蜈蚣草在IAA+KT处理时,叶绿素a、叶绿素b、类胡萝卜素和叶绿素a+b含量均显著增加(P<0.05,表 4)。而单一激素施用时,除叶绿素b含量显著增加(P<0.05)外,其余光合色素含量均与CK无显著差异。
|
蜈蚣草在施用激素后,叶片脯氨酸含量显著提高(P<0.05,图 5A),并在单独IAA处理时最高。另外,单独KT处理和IAA+KT处理使蜈蚣草叶片可溶性糖含量较CK和单独IAA处理显著增加(P<0.05,图 5B)。
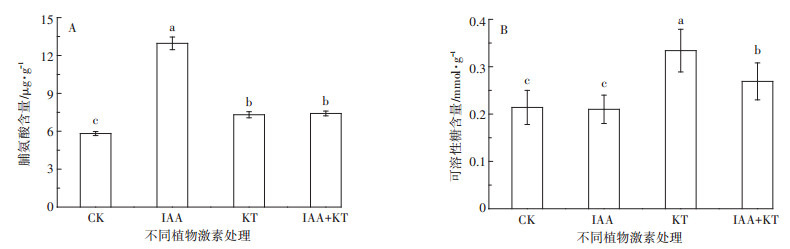
|
| 图 5 激素最佳配比下蜈蚣草叶片脯氨酸和可溶性糖含量 Figure 5 Contents of proline and soluble sugar in fronds of P. vittata under optimum matching of plant hormones |
与CK相比,单一激素处理使蜈蚣草叶中SOD活性显著提高(P<0.05,图 6A),但IAA+KT处理则与CK无显著差异。蜈蚣草叶片CAT活性在单独IAA或激素复合处理下与CK相比显著降低(P<0.05,图 6B),但在KT单独处理下与CK无显著差异。POD活性在IAA+KT处理时较其他处理显著提高(P<0.05,图 6C)。从细胞膜脂过氧化产物MDA的生成情况看,激素配合施用使蜈蚣草叶片MDA含量显著降低(P<0.05,图 6D),而单一激素处理则与CK无显著差异。
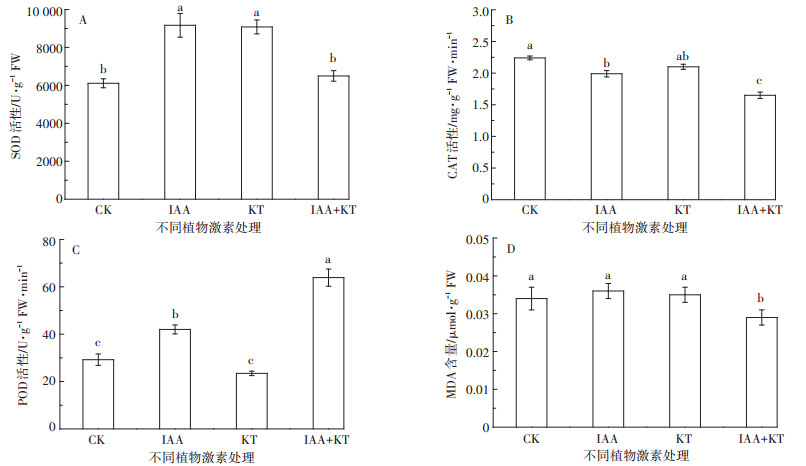
|
| 图 6 激素最佳配比下蜈蚣草叶片抗氧化酶活性和丙二醛含量 Figure 6 Activities of antioxidative enzymes and MDA content in fronds of P. vittata under optimum matching of plant hormones |
如表 5所示,与CK相比,蜈蚣草地上部As含量和富集系数除在单独KT处理显著增加(P<0.05)外,其余处理均无显著差异;地下部分As含量在单独KT处理和IAA+KT处理下显著降低(P<0.05)。然而,蜈蚣草在最佳激素配比下,As提取效率相比其他处理显著提高(P<0.05),达3.31%。
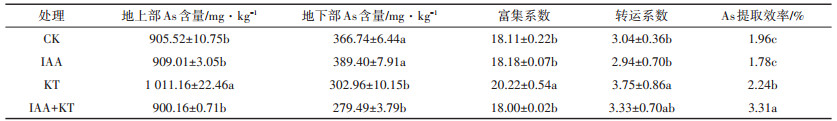
|
与CK相比,单独KT处理和IAA+KT处理使土壤总As含量显著降低至(53.7±1.5)mg·kg-1和(53.1 ± 1.8)mg·kg-1(P<0.05,n=4,图 7A),单独IAA处理则与对照无显著差异。不同植物激素处理下土壤有效态As含量与CK无显著差异(P>0.05,图 7B)。
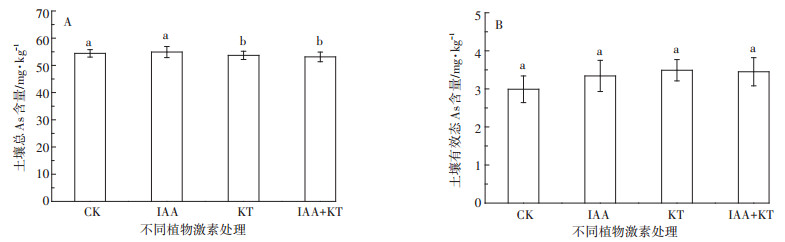
|
| 图 7 激素最佳配比下蜈蚣草栽培土壤总As和有效态As含量 Figure 7 Total and bioavailable As contents in soil after planting P. vittata under optimum matching of plant hormones |
最佳激素配比下,蜈蚣草As提取效率与各形态和生理生化指标之间的Pearson相关关系表明(表 6),蜈蚣草As提取效率与其根长、叶绿素a含量、叶绿素b含量、类胡萝卜素含量、叶绿素a+b值、叶绿素a/b值和POD活性呈显著正相关(P<0.05),与其地上部分干质量和根系活力呈极显著正相关(P<0.01)。
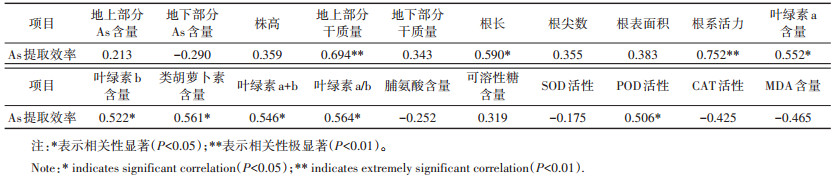
|
有研究表明,外源植物激素如IAA或KT的应用是提高植物生物量、植物重金属吸收量以及缓解重金属胁迫导致的植物生长代谢和生理失调状况的有效方法[16-17]。然而,这些研究通常仅外源添加单一种类的激素。考虑到植物激素之间有交叉反应(Cross talking),激素间的比例调控着植物的生理效应,因此利用植物激素提高植物重金属提取效率不应局限于单一激素的调控。尽管向言词等[18]报道,15 mg·L-1 IAA与100 mg·L-1赤霉素(GA)或40 mg·L-1 6-BA联合作用可协同强化油菜对Cd的提取,但对As的提取是否有效尚缺乏研究。本研究16种不同IAA和KT浓度组合中,25 mg·L-1 IAA和20 mg·L-1 KT配合施用使蜈蚣草株高和干质量显著增加(图 1和图 3),在种植2个月后As提取效率达到6.49%(图 2B)。这表明为提高蜈蚣草的As提取效率,植物激素的配合施用是一个值得考虑的途径。虽然目前很多提高植物重金属提取效率的方法主要是通过添加活化剂如乙二胺四乙酸(EDTA)等以增加土壤重金属有效态含量,但由于EDTA会对植物根系造成毒害,被活化的重金属也会随淋洗液大量流出,进而增加环境风险[19]。
3.2 配合施用IAA和KT能有效改善植物根系形态和根系活力在植物生长过程中,任何一种生理活动都不是受单一激素控制,而是多种激素相互作用的结果。AUX和CTK通过促进植物侧根发育、调节自身代谢和信号传递等过程调控植物对非生物胁迫的耐性和适应性[20]。本研究结果表明,与不添加激素和仅添加一种激素相比,配合添加IAA和KT后,植物的形态学指标如根长、根尖数和根表面积改善较大,均显著增加(P<0.05)并增加最多(图 4)。这可能是由于低浓度的AUX可以促进器官的生长、细胞核分裂以及侧根和不定根的形成,而CTK促进细胞质的分裂、细胞扩大,并延缓叶片的衰老。两种激素的协同增效作用较好地改善了植物的生长发育,根系形态的变化随之影响其生理功能的发挥,根长、根尖数和根表面积的提高有利于根系活力的增强(图 4D),植物干重也显著增加(图 3B),从而有利于植物对As的吸收和富集。根系活力是植物生长的重要生理指标之一,可反映植物根吸收水和营养物质、合成某些化合物以及氧化/还原根际元素的能力[21]。在环境胁迫下,它还可反映植株的生长健壮程度和抗逆能力[22]。我们先前的研究结果也表明,IAA的添加促使大叶井口边草(Pteris cretica var. nervosa)保持较高的根系活力,进而有助于其超量富集As[13]。
3.3 配合施用IAA和KT能有效提高植物光合色素含量、渗透调节能力和过氧化物酶活性通常,AUX能促进叶绿体的光合磷酸化和碳同化,并提高叶绿体的高能态[23];CTK也可刺激原生质体到叶绿体的转变,促进叶绿体超微结构和叶绿素合成[24]。外源添加IAA或KT通过提高植物生物量和光合色素含量来促进植物的光合效率,从而改善重金属胁迫导致的植物光合功能下降[25-26]。此外,研究表明,植物受重金属胁迫时叶片ABA/CTK比值显著增加,CTK含量显著降低,高水平的ABA抑制植物气孔开度和蒸腾作用,而IAA和CTK促进气孔开放并抵消ABA诱导的气孔关闭[27-28]。本研究发现,IAA和KT最佳配比下,蜈蚣草光合色素(叶绿素a、叶绿素b、类胡萝卜素)含量显著提高(表 4)。因此,As处理下,IAA和KT的配合施加可能相比单一激素更有利于植物调节内源激素平衡,增强其与ABA的拮抗作用,从而提高植物光合作用和蒸腾作用,以维持正常生长代谢能力,促进植物生长和对As的提取。
脯氨酸和可溶性糖可作为渗透剂和活性氧(ROS)清除剂来保护细胞免受重金属胁迫带来的损害。外源添加植物激素能显著增加脯氨酸和可溶性糖含量[29]。在环境胁迫下,植物激素在脯氨酸的合成与代谢中起着重要作用[30]。Singh和Prasad[26]研究发现,Cd胁迫下外源添加KT能显著增加茄子(Solanum melongena)幼苗脯氨酸含量。本研究发现,无论IAA和KT单独或者复合添加,蜈蚣草叶片脯氨酸含量均显著高于对照,尤其是IAA单独处理下增加最多(图 5A)。究其原因:一方面IAA能增加植物根尖H2O2的含量[31],此时脯氨酸大量积累有利于清除ROS;另一方面,IAA能提高As胁迫下植物的根系活力,从而有利于植物对As的吸收和富集[13]。大量As进入植物体后,植物必然会启动一系列抗性机制,脯氨酸的合成便是渗透调节机制之一。然而,关于IAA和KT在植物受As胁迫时调节脯氨酸合成、代谢中作用的机理方面报道较少,还需要进一步深入研究。此外,单独KT处理和IAA+KT处理也显著提高了蜈蚣草叶片可溶性糖含量(图 5B)。这可能是因为CTK在诱导细胞壁转化酶和糖转运蛋白表达、调节糖信号传导中起重要作用,并介导硝酸盐活化在植物光合作用中的基因表达[32]。另外,单独KT处理和IAA+KT处理显著提高蜈蚣草叶绿素b含量(表 4),从而提高植物光合效率,促进糖的合成。
AUX和CTK能提高一些抗氧化酶的活性,降低活性氧浓度,以缓解重金属毒害。例如在Cd胁迫下,10 μmol·L-1 KT处理使茄子幼苗SOD、CAT和POD活性显著增加,H2O2和MDA含量显著降低[26]。何冰等[9]也发现,添加0.2 mg·L-1 IAA或6-BA能显著提高东南景天叶中SOD活性。本研究也得出了类似的结果,IAA和KT的配合施用使蜈蚣草叶片POD活性显著增加(图 6C),MDA含量则显著降低(图 6D)。POD一方面通过调节活性氧水平,催化H2O2等物质参与各种氧化反应[33];另一方面,POD对IAA在植物体内的分解代谢也起到一定作用。过多的IAA会伤害植物体,此时植物体便会将IAA氧化,如增加吲哚乙酸氧化酶和IAA-POD活性[34]。
3.4 配合施用IAA和KT尽管能显著提高蜈蚣草As提取效率,但对土壤有效态As含量无显著影响重金属胁迫下,植物会通过根系分泌物来改变根际微环境的生物和化学性质,从而提高重金属的生物有效性,以利于植物的吸收和积累[35]。已有很多研究表明,与非As超富集植物波士顿蕨(Nephrolepis exaltata)相比,蜈蚣草根系能分泌更多的溶解性有机碳、草酸和植酸[36]以及提高根际土壤的pH值[37],从而有利于土壤As的活化。因此,在蜈蚣草根系既吸收和富集As、并不断活化As的情况下,加之种植时间短(1个月),造成不同激素处理下土壤有效态As含量并无显著差异(图 7B)。当然,在本研究中我们用NaH2PO4浸提有效态As,今后需进一步用顺序提取法分析更多的As形态及其随时间的动态变化。
相比添加活化剂等提高植物提取效率的技术手段,IAA和KT直接施用于植物,易被植物吸收,并通过酶促反应在植物体内分解,对土壤质量无负面影响。最近有研究发现,应用CTK在提高植物重金属修复效率的同时还能显著减少EDTA引起的渗滤液体积,从而降低重金属淋溶的风险[19]。此外,廖晓勇等[38]通过田间试验,研究磷肥对58.0~67.7 mg·kg-1 As污染土壤植物修复效率的影响,结果发现种植蜈蚣草7个月后,未施加磷肥的对照组和施磷量200 kg·hm-2的处理组修复效率分别达2.31%和7.84%。而本研究中,IAA和KT配合施用下蜈蚣草在1个月时As提取效率便达到了3.31%(表 5)。因此,配合施用植物激素促进植物重金属提取效率的研究应得到更多关注。当然,如果将植物激素与化肥配合施用,效果可能更佳。需要说明的是,由于本研究仅限于室内盆栽实验,其实际效果仍需在大田进行验证。由于大田环境的复杂性,通过配合施用激素来强化植物修复As污染土壤的方式仍需进一步优化,如确定最佳施用量、施用时间、频率和成本等。此外,本研究仅对轻度As污染土壤应用植物激素强化植物修复技术,而当前土壤中As污染范围广,污染程度差异大,且As赋存形态众多,因而如何推广也是今后应该关注的重点和难点。
4 结论(1) IAA和KT的配合施用可有效促进超富集植物蜈蚣草快速生长,并提高其As提取效率。轻度As污染条件下,盆栽2个月,复合施用25 mg·L-1 IAA和20 mg·L-1 KT使蜈蚣草As提取效率最高,达到6.49%。
(2) 激素最佳配比能改善蜈蚣草As提取效率原因是由于其显著增加了植物地上部干质量、根长、根系活力、光合色素含量和POD活性,As提取效率与这些指标成显著正相关。因此,保持较高的地上部生物量、根系活力、光合色素含量和POD活性有助于蜈蚣草As提取效率的提高。
致谢 衷心感谢美国加州大学河滨分校(University of California,Riverside)化学和环境工程专业段文焱博士协助修改润色英文摘要。| [1] |
Zhao F J, Ma Y B, Zhu Y G, et al. Soil contamination in China:Cureent status and mitigation strategies[J]. Environmental Science and Technology, 2015, 49(2): 750-759. DOI:10.1021/es5047099 |
| [2] |
环境保护部, 国土资源部. 全国土壤污染状况调查公报[R], 2014-04-17. Ministry of Environmental Protection, Ministry of Land and Resources. Report on the national general survey of soil contamination[R]. 2014-04-17. |
| [3] |
宋书巧, 吴欢, 黄钊, 等. 刁江沿岸土壤重金属污染特征研究[J]. 生态环境学报, 2005, 14(1): 34-37. SONG Shu-qiao, WU Huan, HUANG Zhao, et al. The characteristics of heavy metals in soils along Diaojiang Rriver[J]. Ecology and Environment, 2005, 14(1): 34-37. |
| [4] |
Ma L Q, Komar K M, Tu C, et al. A fern that hyperaccumulates arsenic-a hardy, versatile, fast-growing plant helps to remove arsenic contaminated soils[J]. Nature, 2001, 409: 579. DOI:10.1038/35054664 |
| [5] |
Chen T B, Wei C Y, Huang Z C, et al. Pteris vittata L.:An arsenic hyperaccumulator and its character in accumulating arsenic[J]. Chinese Science Bulletin, 2002, 47(3): 207-210. DOI:10.1360/02tb9049 |
| [6] |
孙约兵, 周启星, 郭观林. 植物修复重金属污染土壤的强化措施[J]. 环境工程学报, 2007, 1(3): 103-110. SUN Yue-bing, ZHOU Qi-xing, GUO Guan-lin. Phytoremediation and strengthening measures for soil contaminated by heavy metals[J]. Chinese Journal of Environmental Engineering, 2007, 1(3): 103-110. |
| [7] |
Cassina L, Tassi E, Morelli E, et al. Exogenous cytokinin treatments of an Ni hyper-accumulator, Alyssum murale, grown in a serpentine soil:Implications for phytoextraction[J]. International Journal of Phytoremediation, 2011, 13(Suppl): 90-101. |
| [8] |
都瑞军. 化学螯合剂和植物激素提高超富集植物提取重金属效率[D]. 广州: 中山大学, 2010. DU Rui-jun. Enhancing the phytoextraction efficiency of hyperaccumulators with the application of chemical chelators and phytohormone[D]. Guangzhou: Sun Yat-sen University, 2010. |
| [9] |
何冰, 陆覃昱, 李彦彦, 等. 不同生长调节剂对东南景天镉积累的影响[J]. 农业环境科学学报, 2014, 33(8): 1538-1545. HE Bing, LU Qin-yu, LI Yan-yan, et al. Effects of different growth regulators on cadmium accumulation by Sedum alfredii H[J]. Journal of Agro-Environment Science, 2014, 33(8): 1538-1545. DOI:10.11654/jaes.2014.08.011 |
| [10] |
曾小英, 康小虎, 李师翁. 生长调节物质在重金属污染植物中的应用研究进展[J]. 环境科学与技术, 2016, 39(1): 32-37. ZENG Xiao-ying, KANG Xiao-hu, LI Shi-weng. Research advance in effect and application of plant growth regulators in plants grown on heavy metals contamination soil[J]. Environmental Science and Technology, 2016, 39(1): 32-37. |
| [11] |
Tu C, Ma L Q, Zhang W, et al. Arsenic species and leachability in the fronds of the hyperaccumulator Chinese brake(Pteris vittata L.)[J]. Environmental Pollution, 2003, 124(2): 223-230. DOI:10.1016/S0269-7491(02)00470-0 |
| [12] |
Huang R Q, Gao S F, Wang W L, et al. Soil arsenic availability and the transfer of soil arsenic to crops in suburban areas in Fujian Province, Southeast China[J]. Science of the Total Environment, 2006, 368(2/3): 531-541. |
| [13] |
和淑娟, 王宏镔, 王海娟, 等. 砷胁迫下吲哚乙酸对不同砷富集能力植物根系形态和生理的影响[J]. 农业环境科学学报, 2016, 35(5): 878-885. HE Shu-juan, WANG Hong-bin, WANG Hai-juan, et al. Effects of indole-3-acetic acid on morphologic and physiological characteristics of root systems of plants with different arsenic-accumulating abilities under As stress[J]. Journal of Agro-Environment Science, 2016, 35(5): 878-885. DOI:10.11654/jaes.2016.05.009 |
| [14] |
张中峰, 张金池, 黄玉清, 等. 水分胁迫和接种菌根真菌对青冈栎根系形态的影响[J]. 生态学杂志, 2015, 5(5): 1198-1204. ZHANG Zhong-feng, ZHANG Jin-chi, HUANG Yu-qing, et al. Effects of water stress and mycorrhizal fungi on root morphology of Cyclobalanopsis glauca seedlings[J]. Chinese Journal of Ecology, 2015, 5(5): 1198-1204. |
| [15] |
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000. LI He-sheng. Principles and techniques of plant physiological biochemical experiment[M]. Beijing: Higher Education Press, 2000. |
| [16] |
He S J, Hu Y J, Wang H B, et al. Effects of indole-3-acetic acid on arsenic uptake and antioxidative enzymes in Pteris cretica var. nervosa and Pteris ensiformis[J]. International Journal of Phytoremediation, 2017, 19(3): 231-238. DOI:10.1080/15226514.2016.1207609 |
| [17] |
Nazir H, Asghar H N, Zahir Z A, et al. Judicious use of kinetin to improve growth and yield of rice in nickel contaminated soil[J]. International Journal of Phytoremediation, 2015, 18(7): 651-655. |
| [18] |
向言词, 官春云, 黄璜, 等. 植物生长调节剂IAA、GA和6-BA对芥菜型油菜和甘蓝型油菜富集镉的强化[J]. 农业现代化研究, 2010, 31(4): 504-508. XIANG Yan-ci, GUAN Chun-yun, HUANG Huang, et al. Enhancement of cadmium accumulation by Brassica juncea and B. napus using indole-3-acetic acid(IAA), gibberellic aid(GA)and 6-benzyladenine(6-BA)[J]. Research and Agricultural Modernization, 2010, 31(4): 504-508. |
| [19] |
Luo J, Cai L, Qi S, et al. Improvement effects of cytokinin on EDTA assisted phytoremediation and the associated environmental risks[J]. Chemosphere, 2017, 185: 386-393. DOI:10.1016/j.chemosphere.2017.07.036 |
| [20] |
Nishiyama R, Watanabe Y, Fujita Y, et al. Analysis of cytokinin mutants and regulation of cytokinin metabolic genes reveals important regulatory roles of cytokinins in drought, salt and abscisic acid responses, and abscisic acid biosynthesis[J]. Plant Cell, 2011, 23(6): 2169-2183. DOI:10.1105/tpc.111.087395 |
| [21] |
Luo H H, Zhang Y L, Zhang W F. Effects of water stress and rewatering on photosynthesis, root activity, and yield of cotton with drip irrigation under mulch[J]. Photosynthetica, 2016, 54(1): 65-73. DOI:10.1007/s11099-015-0165-7 |
| [22] |
王学奎, 黄见良. 植物生理生化实验原理与技术[M]. 北京: 高等教育出版社, 2015, 123-124. WANG Xue-kui, HUANG Jian-liang. Principles and techniques of plant physiological biochemical experiment[M]. Third edition. Beijing: Higher Education Press, 2015, 123-124. |
| [23] |
Tamàs I A, Atkins B D, Ware S M, et al. Indoleacetic acid stimulation of phosphorylation and bicarbonate fixation by chloroplast preparation in light[J]. Canadian Journal of Botany, 1972, 50(7): 1523-1527. DOI:10.1139/b72-189 |
| [24] |
Cortleven A. Regulation of chloroplast development and function by cytokinin[J]. Journal of Experimental Botany, 2015, 66(16): 4999-5013. DOI:10.1093/jxb/erv132 |
| [25] |
赵书晗, 王海娟, 王宏镔. 砷胁迫下吲哚乙酸对不同砷富集能力植物光合作用的影响[J]. 农业环境科学学报, 2017, 36(6): 1093-1101. ZHAO Shu-han, WANG Hai-juan, WANG Hong-bin. Effect of indoleacetic acid on photosynthesis of arsenic-stressed plants with different arsenic-accumulating ability[J]. Journal of Agro-Environment Science, 2017, 36(6): 1093-1101. DOI:10.11654/jaes.2017-0092 |
| [26] |
Singh S, Prasad S M. Growth, photosynthesis and oxidative responses of Solanum melongena L. seedlings to cadmium stress:Mechanism of toxicity amelioration by kinetin[J]. Scientia Horticulturae, 2014, 176(2): 1-10. |
| [27] |
Yan H, Filardo F, Hu X, et al. Cadmium stress alters the redox reaction and hormone balance in oilseed rape(Brassica napus L.)leaves[J]. Environmental Science and Pollution Research, 2016, 23(4): 3758-3769. DOI:10.1007/s11356-015-5640-y |
| [28] |
Kebert M, Rapparini F, Neri L, et al. Copper-induced responses in poplar clones are associated with genotype-and organ-specific changes in peroxidase activity and proline, polyamine, ABA, and IAA levels[J]. Journal of Plant Growth Regulation, 2017, 36(1): 131-147. DOI:10.1007/s00344-016-9626-x |
| [29] |
Amri B, Khamassi K, Ali M B, et al. Effects of gibberellic acid on the process of organic reserve mobilization in barley grains germinated in the presence of cadmium and molybdenum[J]. South African Journal of Botany, 2016, 106: 35-40. DOI:10.1016/j.sajb.2016.05.007 |
| [30] |
Ali N, Hadi F. Phytoremediation of cadmium improved with the high production of endogenous phenolics and free proline contents in Parthenium hysterophorus plant treated exogenously with plant growth regulator and chelating agent[J]. Environmental Science and Pollution Research, 2015, 22(17): 13305-13318. DOI:10.1007/s11356-015-4595-3 |
| [31] |
Ivanchenko M G, Den O D, Monshausen G B, et al. Auxin increases the hydrogen peroxide(H2O2)concentration in tomato(Solanum lycopersicum)root tips while inhibiting root growth[J]. Annals of Botany, 2013, 112(6): 1107-1116. DOI:10.1093/aob/mct181 |
| [32] |
Shahri W, Ahmad S S, Tahir I. Sugar signaling in plant growth and development[M]//Plant signaling: Understanding the molecular crosstalk, India: Springer, 2014: 93-116.
|
| [33] |
Verma S, Dubey R S. Lead toxicity induces lipid peroxidation and alters the activities of antioxidant enzymes in growing rice plants[J]. Plant Science, 2003, 164(4): 645-655. DOI:10.1016/S0168-9452(03)00022-0 |
| [34] |
Beffa R, Martin H V, Pilet P E. In vitro oxidation of indoleacetic acid by soluble auxin-oxidases and peroxidases from maize roots[J]. Plant Physiology, 1990, 94(2): 485-491. DOI:10.1104/pp.94.2.485 |
| [35] |
朱永官. 土壤-植物系统中的微界面过程及其生态环境效应[J]. 环境科学学报, 2003, 23(2): 205-210. ZHU Yong-guan. Micro-interfacial processes in soil-plant systems and their environmental impacts[J]. Acta Scientiae Circumstantiae, 2003, 23(2): 205-210. |
| [36] |
Tu S, Ma L Q, Luongo T. Root exudates and arsenic accumulation in arsenic hyperaccumulating Pteris vittata and non-hyperaccumulating Nephrolepis exaltata[J]. Plant and Soil, 2004, 258(1): 9-19. DOI:10.1023/B:PLSO.0000016499.95722.16 |
| [37] |
Gonzaga M I S, Santos J A G, Ma L Q. Arsenic chemistry in the rhizosphere of Pteris vittata L. and Nephrolepis exaltata L.[J]. Environmental Pollution, 2006, 143(2): 254-260. DOI:10.1016/j.envpol.2005.11.037 |
| [38] |
廖晓勇, 陈同斌, 谢华, 等. 磷肥对砷污染土壤的植物修复效率的影响:田间实例研究[J]. 环境科学学报, 2004, 24(3): 455-462. LIAO Xiao-yong, CHEN Tong-bin, XIE Hua, et al. Effect of application of P fertilizer on efficiency of As removal from As-contaminated soil using phytoremediation:Field study[J]. Acta Scientiae Cirumstantiae, 2004, 24(3): 455-462. |
 2018, Vol. 37
2018, Vol. 37