在海洋环境中,氮是浮游植物赖以生存的必需元素之一,氮循环调控着海洋中氮营养物的可利用性和生物生产力,对于海洋生态系统的功能至关重要。自20世纪中期以来,人类经济活动的飞速发展,将各种生活污水和工业废水大量排入江河湖海,近海水体中无机氮含量的快速增长,改变了浮游植物的群落组成和演替规律,打破了水体中原有的氮素转化平衡,造成了近海河口区域的富营养化及有害藻华频发[1]。因此有害藻华的防治工作已经成为全世界邻海国家亟待解决的生态环境问题,氮素营养与浮游植物的关系也成为人们关注的焦点。
通常情况下,藻类首先利用环境中无机氮。铵态氮(NH4+-N)和硝态氮(NO3--N)是无机氮的两种主要形态,在自然界的氮循环中,浮游藻类对NH4+-N和NO3--N的吸收利用是十分重要的一个环节[2-3]。研究表明,两种无机氮源在被藻类利用的过程中存在复杂的相互作用。一般认为,多数藻类更倾向于优先利用NH4+-N[4-6]。Dortch[7]指出,藻类对NH4+-N的优先利用可能存在两种机制,一种机制是两种无机氮源同时存在时,藻类更偏好吸收NH4+-N,而另一种机制则是NH4+-N能直接抑制NO3--N的吸收。但无论属于何种机制,NH4+-N对NO3--N的抑制作用都非绝对,也不一定单独存在,它们受环境因素的影响很大。Glibert[8]在对一种硅藻(柔弱根管藻Rhizosolenia delicatula)的研究中发现,NH4+-N对NO3--N的作用并不是常见的抑制作用而是促进其吸收。此外,一些其他的研究表明,NO3--N对同体系中的NH4+-N同样存在一定程度上的抑制作用,只不过抑制效应并没有NH4+-N对NO3--N的作用那么强烈[9-10]。总之,藻类对氮的吸收和同化是一个非常复杂的生理生化过程,我们很难用一个简单的机制就将其解释清楚。目前的研究尚无法完全清楚地阐释NH4+-N和NO3--N两种无机氮源在藻类吸收过程中的相互关系及作用机制,因此进一步研究不同藻类对这两种无机氮源的吸收动力学特征也是十分必要的。
海洋生态系统动力学模型作为定量地认识和分析海洋生态系统现象的有力工具,近年来得到了长足发展。用生态动力学模型的方法定量研究浮游植物种群动力学与营养盐吸收动力学的耦合关系是一个非常重要的方向,Malerba等[11]以Quota模型为基础,模拟了不同形态的铵-硝氮源、饥饿时间等因素对小球藻(Chlorella sp.)生长的影响。Alijani等[12]则是基于生态化学计量比理论构建模型,用于模拟光强和碳、磷等营养盐对藻菌关系的影响,该模型较好地模拟了浮游植物和细菌对多变的营养盐和光照条件的响应。Daines等[13]基于藻类生理功能特征和资源分配平衡角度构建模型,深入分析了藻细胞内氮、磷元素的流向,使动力学模型和生物化学过程得到有机的结合。这些模型都在一定程度上很好地描述和分析了营养盐与浮游植物之间的相互关系。海洋生物与环境之间的关系错综复杂,随着我们对海洋环境认识的不断深入,解决这些难题的必要性也日益提升,通过现场实验结合模型预测的方法为研究这些复杂机制提供新思路。
本文通过分析我国渤海代表性硅藻——三角褐指藻在不同形态、不同浓度无机氮源培养条件下的生长动力学和氮吸收动力学特征,为理解浮游植物铵-硝氮源吸收动力学机制提供一种可能的解释和补充,为防治有害藻华和探索富营养化条件下优势藻的形成机理提供理论依据。同时,通过构建简单有效的动力学模型对试验所得动力学趋势进行模拟和预测,力求为相关研究提供一种可行的辅助分析手段。
1 材料与方法 1.1 藻种来源三角褐指藻(Phaeodactylum tricornutum)购自中科院海洋研究所微藻种质库。所购藻种在本试验室经扩大培养3次以后,即可作为受试藻种。
1.2 培养条件试验基础介质为人工海水[14](盐度约为3.5%,初始pH为7.06),培养基选用f/2改良培养基[15],其中氮源及其浓度根据试验需要进行调整。藻种置于1000 mL三角瓶,在光照培养箱(LRH-250-GS II人工气候箱,广东省医疗器械厂)中进行一次性培养,培养体积为800 mL,初始藻密度约为2×104 cells·mL-1,每个处理设3个平行组,培养温度为(22±1)℃,光暗比为12L: 12D,光照强度为80 μmol·m-2·s-1,每天定时摇瓶3~4次,并随机变换三角瓶的位置。
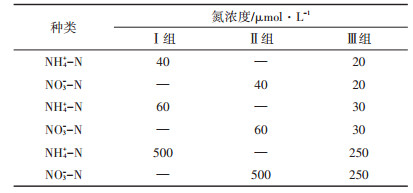
1.3 试验设计根据试验需要,设置3个氮浓度,分别为40、60 μmol · L-1和500 μmol · L-1。其中40 μmol · L-1和60 μmol·L-1为接近自然海水中的无机氮浓度,另外为观察在差异明显的高浓度氮培养条件下三角褐指藻的生长情况、氮吸收动力学特征、两种无机氮源的相互关系,以及为验证模型预测的适用范围,同时为观察较高的氨氮浓度是否对藻细胞产生毒性抑制效应[16],我们依据樊娟[17]的研究结果,选择500 μmol·L-1为高氮浓度组。同时设置3种氮源添加方式,Ⅰ组为单加NH4+-N试验组,Ⅱ组为单加NO3--N试验组,Ⅲ组为NH4+-N和NO3--N混合试验组,具体详见表 1。试验从接种初始日起,测定初始藻细胞密度、藻细胞内氮素含量和培养基中两种无机氮浓度,之后每48 h测定一次,直至氮源耗尽,停止试验。
|
|
表 1 试验设计方案 Table 1 The scheme of experimental design |
利用流式细胞仪计数藻细胞数量。采集约3 mL水样于低温保存管中,用终浓度为1%的戊二醛固定,混合均匀后室温下静置15 min,液氮冰冻后于-80 ℃保存备用,样品后续进行批量检测。将固定样品于37 ℃下水浴解冻,用SYBR Green I染料染色,室温下黑暗处理15 min,上流式细胞仪(BD C6plus)(设定488 nm,15 mW氩激光),并在530/30 nm测量,根据不同的坐标参数(FITC、SSC、PerCP-Cy5-5-H等)对染色细胞进行区分和计数[18]。
1.5 培养液中NH4+-N、NO3--N浓度的测定藻液经0.22 μm滤膜过滤,取滤液,用次溴酸钠氧化法测定NH4+-N,锌镉还原法测定NO3--N[19]。
1.6 藻细胞内氮含量的测定取50 mL三角褐指藻藻液,将藻细胞过滤在0.7 μm Whatman GF/F滤膜(滤膜需预先经450 ℃煅烧12 h)上,60 ℃烘干后用元素分析仪(EURO EA3000)测定藻细胞内的N含量(单位为g·50 mL-1)。该部分数据主要应用于模型拟合过程,详见1.7。
1.7 模型方程的建立与参数估计本文所构建模型是在参考了Lawson等[20]所建立的一个经典的海洋生态系统模型的基础上,通过对原模型中一些理化因素(如浮游动物捕食、光照等)进行简化而得到。不同氮培养条件下模型方程的主要形式如下所示。
(1)单加NH4+-N试验组:
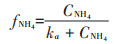
|
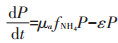
|
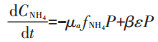
|
(2)单加NO3--N试验组
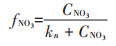
|
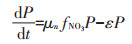
|
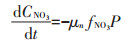
|
(3)混合氮源试验组
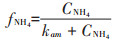
|
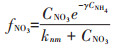
|
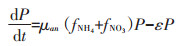
|
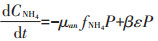
|
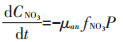
|
式中:CNH4代表培养基中NH4+-N的底物浓度,μmol· L-1;CNO3代表培养基中NO3--N的底物浓度,μmol·L-1;k 代表氮的半饱和吸收常数,μmol·L-1;μ代表藻的最大比生长速率,d-1;P代表每升溶液中所有藻体内氮含量,μmol·L-1;γ代表NH4+-N对NO3--N的抑制常数;β 代表藻类死亡后再生为NH4+-N的比例系数;ε代表藻细胞的死亡率,d-1。
其中,P的换算公式为:50 mL溶液中所有藻体内氮含量(μg)×20÷14
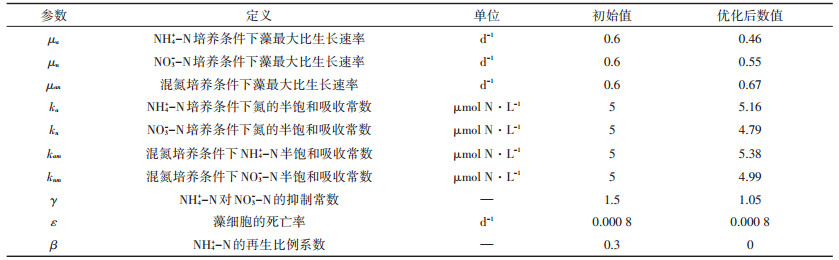
模型拟合所需参数是在参考大量前人相关研究成果的基础上[7, 21-24],初步选定初始值(遵循的原则为:优先考虑三角褐指藻相关的参数,其次考虑与三角褐指藻相近种属藻类的参数),然后运用本实验中40 μmol·L-1氮培养条件下3组的试验数据通过下山单纯形法(Nelder-Mead)优化得到试验参数值。接下来,进一步通过该参数对60 μmol·L-1及500 μmol·L-1浓度试验组进行模型拟合,验证模型预测效果。
1.8 数据统计分析试验所有数据均使用SigmaPlot 10.0和SPSS 19.0软件进行统计分析,模型拟合采用R 3.4.3进行。
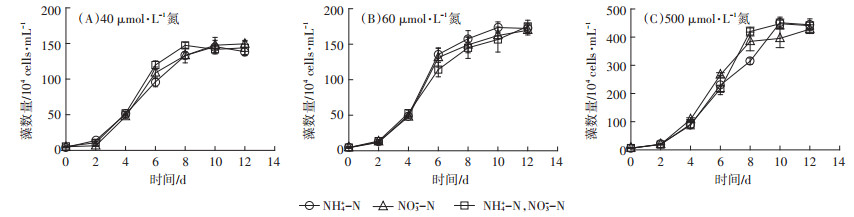
2 结果与分析 2.1 三角褐指藻在不同氮培养条件下的生长情况由图 1可知,本试验三角褐指藻在各种氮浓度和形态的培养条件下,均能正常生长,且均在第10 d左右进入生长稳定期,但不同浓度下,藻类到达稳定期时的生物量有所差别。3种氮浓度条件下能达到的最大藻密度分别为40 μmol·L-1培养时为1.59×106 cells·mL-1,60 μmol·L-1培养时为1.82×106 cells·mL-1,500 μmol·L-1培养时为4.72×106 cells·mL-1。统计分析表明,相同浓度不同形态氮培养条件下,三角褐指藻的生长均没有显著差异(P > 0.05),同形态不同浓度下,三角褐指藻生长存在显著差异(P < 0.05)。
|
图 1 不同氮源培养条件下三角褐指藻生长曲线 Figure 1 The growth curve of Phaeodactylum tricornutum under different nitrogen culture conditions |
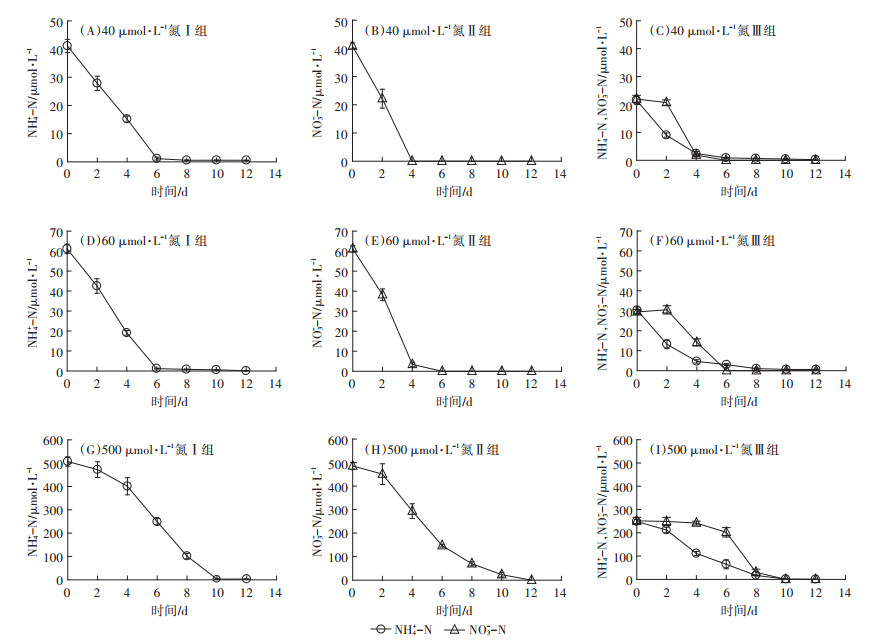
由图 2中A、C、D、F、G、I 6图可以看出,在不同氮浓度培养条件下添加NH4+-N的Ⅰ、Ⅲ处理组中,NH4+-N均能被迅速地吸收利用。而NO3--N的情况则不同,在图 2的B、E、H 3图中,不存在NH4+-N的情况下,NO3--N能被迅速的吸收利用,甚至在低浓度氮源条件下(40 μmol·L-1和60 μmol·L-1)NO3--N作为唯一氮源时其消耗比NH4+-N作为唯一氮源时更加快速。但当两种氮源同时存在时,NO3--N的吸收在前期均出现了不同程度的延迟现象,且延迟时间随培养环境中NH4+-N浓度的增加而增加,说明NO3--N的吸收受到了NH4+-N的影响,这一阶段NH4+-N是藻类吸收的主要氮源形式。
|
图 2 不同氮源培养条件下三角褐指藻培养基中氮浓度变化趋势 Figure 2 Changes of the nitrogen concentration in medium for Phaeodactylum tricornutum under different nitrogen culture conditions |
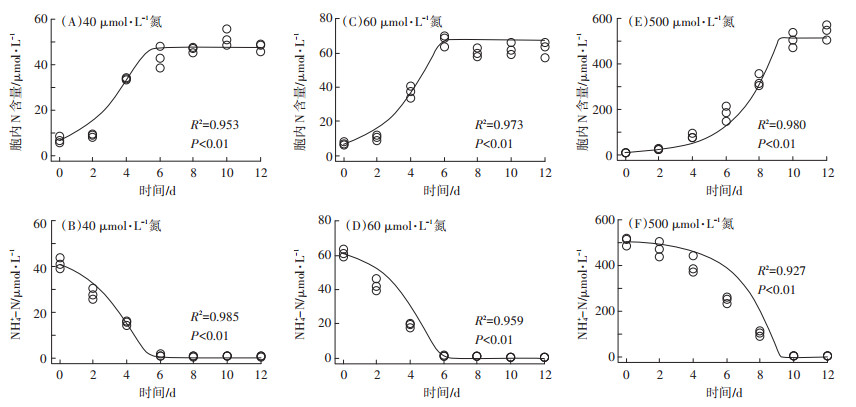
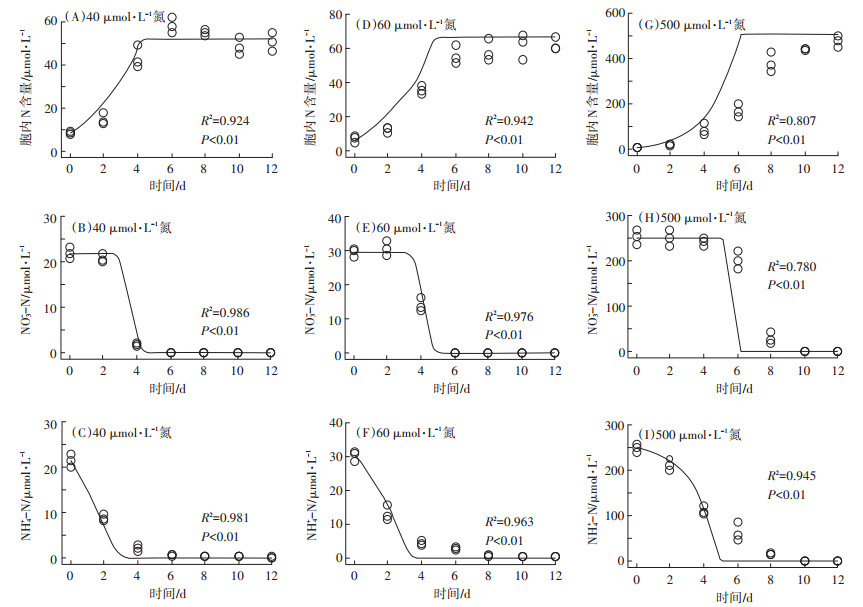
通过40 μmol·L-1试验组数据优化得到的模型参数如表 2所示。在此浓度下,拟合Ⅰ~Ⅲ各组中藻细胞内氮浓度和培养基中氮浓度的试验观测值和模型预测值的决定系数R2分别为0.953(图 3A)、0.985(图 3B);0.911(图 4A)、0.982(图 4B);0.924(图 5A)、0.986(图 5B)、0.981(图 5C)。
|
|
表 2 模型参数汇总 Table 2 Summary table of model parameters |
|
图中散点为实测数据,曲线为模型拟合数据 The scatter points in the figure represent the measured data, and the curves represent the model fitting data 图 3 三角褐指藻在NH4+-N不同浓度培养条件下藻体内总氮含量和培养基中氮浓度变化趋势模型拟合结果 Figure 3 Model fitting results for total intracellular nitrogen content and changes of nitrogen concentration in medium under different concentration of NH4+-N |
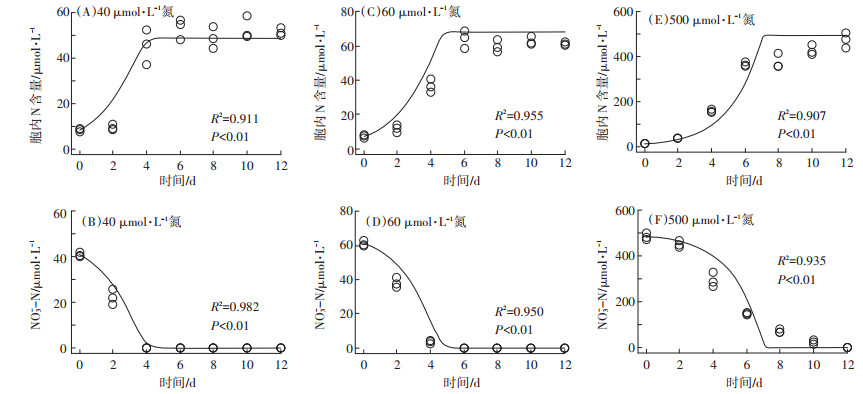
|
图中散点为实测数据,曲线为模型拟合数据 The scatter points in the figure represent the measured data, and the curves represent the model fitting data 图 4 三角褐指藻在NO3--N不同浓度培养条件下藻体内总氮含量和培养基中氮浓度变化趋势模型拟合结果 Figure 4 Model fitting results for total intracellular nitrogen content and changes of nitrogen concentration in medium under different concentration of NO3--N |
|
图中散点为实测数据,曲线为模型拟合数据 The scatter points in the figure represent the measured data, and the curves represent the model fitting data 图 5 三角褐指藻在混合氮源不同浓度培养条件下藻体内总氮含量和培养基中氮浓度变化趋势模型拟合结果 Figure 5 Model fitting results for total intracellular nitrogen content and changes of nitrogen concentration in medium under different concentration of mixed nitrogen(NH4+-N and NO3--N) |
进一步用优化后的模型对60 μmol· L-1及500 μmol·L-1试验组所得趋势进行预测,结果如图 3~图 5所示。模型预测值与试验观测值均十分吻合,决定系数R2全部介于0.780~0.986之间,说明该模型能很好地预测三角褐指藻在各浓度、各形态氮源下的生长动力学和氮吸收动力学趋势。
3 讨论氮是浮游植物细胞内核酸、蛋白质和叶绿素等的基本元素之一,在浮游植物的生命活动中占有非常重要的地位。自然界中除少数蓝藻具有自身固氮能力外,藻类必须从环境中吸收一定的氮源以满足其生长、繁殖的需要,同时不同种类的微藻对氮源的种类和浓度需求也不一样[25]。从本试验中藻类生长动力学结果可以看出,氮浓度的改变对三角褐指藻的生长影响显著,同形态不同浓度的氮培养条件下,藻类生物量均存在显著差异(P < 0.05),证明了氮素营养是三角褐指藻生长的一种非常重要的限制因子。与此同时,同浓度不同形态氮培养条件下,三角褐指藻的生长却没有出现明显差异(P > 0.05)。一般认为微藻最容易利用NH4+-N,但是随着NH4+-N被利用,培养液的pH逐渐下降,以至于抑制微藻的生长,因而高浓度的NH4+-N反而会抑制微藻的生长[26]。本试验的结果表明,500 μmol·L-1 NH4+-N试验组中藻类的生长与其他同浓度试验组没有明显差异,说明该浓度的NH4+-N并没有对三角褐指藻的生长产生抑制效应,这也证明一定浓度范围内,三角褐指藻均能很好地利用NH4+-N和NO3--N两种无机氮源,这与Yongmanitchai等[27]的研究结果是一致的。
另外,对藻类氮吸收动力学特征进行分析,在3种不同氮浓度的培养条件下,单一添加NH4+-N或NO3--N时,氮营养均能被藻类快速吸收,而两种无机氮源同时存在时,则出现了明显的NO3--N吸收延迟现象。对于这样的特征,目前有几种可能的解释:首先,藻类可能会根据所处环境中氮源的多少及形态对吸收氮源的策略进行自我调整,对三角褐指藻而言,已有研究证明其对各种氮源均具有广泛的利用性[27-28],因此当环境中存在NH4+-N或NO3--N为唯一氮源时,其均能很好地吸收利用。而当环境中同时存在NH4+-N和NO3--N时,藻类则会改变吸收策略。由于吸收NH4+-N不需要转换氮的价态并消耗相应的能量,因此,藻类很可能优先利用NH4+-N[29]。这一特征也在大量的室内藻类培养及实际水体研究中得到了较充分的证实[7]。同时,除藻类对其偏好性吸收外,NH4+-N的存在也可能抑制硝酸盐还原酶、转运酶等的活性,损害藻类吸收NO3--N的能力[30-31]。另外,值得注意的是,由于不同种类的微藻对氮的种类和浓度需求不同,它们对于NH4+-N和NO3--N的利用以及不同环境下氮吸收策略的差异在自然环境中具有重要意义。在河口及近岸海域,由于陆源输入的影响,经常会出现脉冲式营养盐输入,那些能更加快速适应氮环境变化的藻类,很可能迅速成为优势种,进而改变浮游植物的群落结构,甚至进一步引发藻华[11]。
本文通过构建数学模型模拟了三角褐指藻在不同氮源培养条件下的氮吸收动力学特征。值得注意的是,模型中参数的取值大小很大程度上影响着计算结果,因此选取合适的参数值,对模型预测结果的准确性至关重要。但在实际环境评价工作中,有些参数往往难以测定,同时由于有针对性的现场观测和模拟实验数据匮乏,致使无法向模型提供理想的参数,进而降低了模拟结果的准确性。因此在借鉴相关经验值的基础上对参数进行优化是十分必要的。自20世纪60年代开始,随着计算机技术的普及和迅速发展,参数自动估计方法得到了普遍应用,大幅加快了参数优选的速度,增加了模拟结果的客观性和可信度[32]。并且随着参数自动估计方法的发展,优选算法也变得多种多样[33]。单纯形法,又称之为下山单纯形法,是一种经典的直接搜索最优解算法,由Nelder和Mead提出[34]。该方法由一组解构成初始单纯形,在每次迭代中,逐步剔除最差解,并寻求更好的解。该方法实现简单、性能良好、精度高,适合计算变量数不多的方程求极值。目前在不同研究领域都有较为广泛的应用[35-37],本文运用单纯形法对营养盐吸收动力学模型中的参数进行优化求解。通过优化所得到的参数符合藻类生长和营养盐吸收动力学相关性研究的常规经验值,同时通过在两种具有明显差异的氮浓度培养条件下(60 μmol·L-1和500 μmol·L-1)对模型预测能力验证,其均可以较好地预测试验结果,说明我们通过单纯形法所优化的模型参数基本符合本研究中微藻的真实生理特征。
4 结论(1)三角褐指藻在各种氮浓度和形态的培养条件下,均能正常生长。同浓度不同形态氮培养条件下,三角褐指藻的生长均没有显著差异(P > 0.05),同形态不同浓度下,三角褐指藻生长差异显著(P < 0.05)。
(2)分别以NH4+-N和NO3--N作为唯一氮源时,三角褐指藻能够迅速对氮源吸收利用,两种氮源同时存在时,藻类优先利用NH4+-N,NO3--N出现吸收延迟的现象,且延迟时间随培养环境中NH4+-N浓度的增加而增加。
(3)通过构建营养盐吸收动力学模型模拟了三角褐指藻在不同氮源培养条件下的生长和氮吸收动力学特征。模型预测值与试验观测值均十分吻合,决定系数R2全部介于0.780到0.986之间,该模型很好地预测了三角褐指藻在各浓度、各形态氮源下的生长动力学和氮吸收动力学趋势。
| [1] |
Zehr J P, Kudela R M. Nitrogen cycle of the open ocean:From genes to ecosystems[J]. Annual Review of Marine Science, 2011, 3(1): 197-225. DOI:10.1146/annurev-marine-120709-142819 |
| [2] |
Gruber N. The marine nitrogen cycle: Overview and challenges[M]. Elsevier Science & Technology: Nitrogen in the Marine Environment. 2008.
|
| [3] |
Zehr J P, Ward B B. Nitrogen cycling in the ocean:New perspectives on processes and paradigms[J]. Applied & Environmental Microbiology, 2002, 68(3): 1015-1024. |
| [4] |
Berges J. Miniview:Algal nitrate reductases[J]. British Phycological Journal, 1997, 32(1): 3-8. DOI:10.1080/09541449710001719315 |
| [5] |
Gao G, Zhong Z H, Zhou X H, et al. Changes in morphological plasticity of Ulva prolifera under different environmental conditions:A laboratory experiment[J]. Harmful Algae, 2016, 59: 51-58. DOI:10.1016/j.hal.2016.09.004 |
| [6] |
周涛, 李正魁. 太湖浮游植物与营养盐相互关系[J]. 农业环境科学学报, 2013, 32(2): 327-332. ZHOU Tao, LI Zheng-kui. The relationship between phytoplankton and nutrients of Lake Taihu, China[J]. Journal of Agro-Environment Science, 2013, 32(2): 327-332. |
| [7] |
Dortch Q. The interaction between ammonium and nitrate uptake in phytoplankton[J]. Marine Ecology Progress, 1990, 61: 183-201. DOI:10.3354/meps061183 |
| [8] |
Glibert P M, Goldman J C, Carpenter E J. Seasonal variations in the utilization of ammonium and nitrate by phytoplankton in Vineyard Sound, Massachusetts, USA[J]. Marine Biology, 1982, 70(3): 237-249. DOI:10.1007/BF00396842 |
| [9] |
Dortch Q, Conway H L. Interactions between nitrate and ammonium uptake:Variation with growth rate, nitrogen source and species[J]. Marine Biology, 1984, 79(2): 151-164. DOI:10.1007/BF00951824 |
| [10] |
Lee J, Parker A E, Wilkerson F P, et al. Uptake and inhibition kinetics of nitrogen in Microcystis aeruginosa:Results from cultures and field assemblages collected in the San Francisco Bay Delta, CA[J]. Harmful Algae, 2015, 47: 126-140. DOI:10.1016/j.hal.2015.06.002 |
| [11] |
Malerba M E, Connolly S R, Heimann K. An experimentally validated nitrate-ammonium-phytoplankton model including effects of starvation length and ammonium inhibition on nitrate uptake[J]. Ecological Modelling, 2015, 317: 30-40. DOI:10.1016/j.ecolmodel.2015.08.024 |
| [12] |
Alijani M K, Wang H, Elser J J. Modeling the bacterial contribution to planktonic community respiration in the regulation of solar energy and nutrient availability[J]. Ecological Complexity, 2015, 23: 25-33. DOI:10.1016/j.ecocom.2015.05.002 |
| [13] |
Daines S J, Clark J R, Lenton T M. Multiple environmental controls on phytoplankton growth strategies determine adaptive responses of the N:P ratio[J]. Ecology Letters, 2014, 17(4): 414-425. DOI:10.1111/ele.12239 |
| [14] |
Guillard R R. Culture of phytoplankton for feeding marine invertebrates[M]. Springer US: Culture of Marine Invertebrate Animals. 1975: 29-60.
|
| [15] |
Guillard R R, Ryther J H. Studies of marine planktonic diatoms. I. Cyclotella nana Hustedt, and Detonula confervacea(cleve)Gran[J]. Canadian Journal of Microbiology, 1962, 8(2): 229-239. DOI:10.1139/m62-029 |
| [16] |
Källqvist T, Svenson A. Assessment of ammonia toxicity in tests with the microalga, Nephroselmis pyriformis, Chlorophyta[J]. Water Research, 2003, 37(3): 477-484. DOI:10.1016/S0043-1354(02)00361-5 |
| [17] |
樊娟.氮、磷浓度及氮输入频度对两种海洋微藻生长的影响研究[D].天津: 南开大学, 2010. FAN Juan. The effect of nitrogen and phosphorus concentration and nitrogen input frequency on the growth of two phytoplankton species[D]. Tianjin: Nankai University, 2010. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1814258 |
| [18] |
Marie D, Partensky F, Jacquet S, et al. Enumeration and cell cycle analysis of natural populations of marine picoplankton by flow cytometry using the nucleic acid stain SYBR Green I[J]. Appl Environ Microbiol, 1997, 63(1): 188-193. |
| [19] |
国家海洋局.海洋调查规范.第4部分, 海水化学要素调查: GB/T 12763. 4-2007[S].北京: 中国标准出版社, 2007. State Oceanic Administration. GB/T 12763. 4-2007 Specification for oceanographic survey Part 4: Survey of chemical parameters in sea water[S]. Beijing: China Standards Press, 2007. |
| [20] |
Lawson L M, Hofmann E E, Spitz Y H. Time series sampling and data assimilation in a simple marine ecosystem model[J]. Deep Sea Research Part Ⅱ Topical Studies in Oceanography, 1996, 43(2/3): 625-651. |
| [21] |
Eppley R W, Thomas W H. Comparison of half-saturation constants for growth and nitrate uptake of marine phytoplankton(2)[J]. Journal of Phycology, 1969, 5(4): 375-379. DOI:10.1111/jpy.1969.5.issue-4 |
| [22] |
Eppley R W, Rogers J N, Mccarthy J J. Half-saturation constants for uptake of nitrate and ammonium by marine phytoplankton[J]. Limnology & Oceanography, 1969, 14(6): 912-920. |
| [23] |
Raimbault P, Slawyk G, Gentilhomme V. Direct measurements of nanomolar nitrate uptake by the marine diatom Phaeodactylum tricornutum, (Bohlin). Implications for studies of oligotrophic ecosystems[J]. Hydrobiologia, 1990, 207(1): 311-318. DOI:10.1007/BF00041470 |
| [24] |
Terry K L. Nitrate uptake and assimilation in Thalassiosira weissflogii and Phaeodactylum tricornutum:Interactions with photosynthesis and with the uptake of other ions[J]. Marine Biology, 1982, 69(1): 21-30. DOI:10.1007/BF00396956 |
| [25] |
Strom S L, Bright K J. Inter-strain differences in nitrogen use by the coccolithophore Emiliania huxleyi, and consequences for predation by a planktonic ciliate[J]. Harmful Algae, 2009, 8(5): 811-816. DOI:10.1016/j.hal.2007.10.005 |
| [26] |
蒋汉明, 高坤山. 氮源及其浓度对三角褐指藻生长和脂肪酸组成的影响[J]. 水生生物学报, 2004, 28(5): 545-551. JIANG Han-ming, GAO Kun-shan. Effects of nitrogen sources and concentration on the growth and fatty acid composition of Phaeodactylum tricornutum[J]. Acta Hydrobiologica Sinica, 2004, 28(5): 545-551. DOI:10.3321/j.issn:1000-3207.2004.05.015 |
| [27] |
Yongmanitchai W, Ward O P. Growth of and omega-3 fatty acid production by Phaeodactylum tricornutum under different culture conditions[J]. Applied & Environmental Microbiology, 1991, 57(2): 419-425. |
| [28] |
Perezgarcia O, Escalante F M, Debashan L E, et al. Heterotrophic cultures of microalgae:Metabolism and potential products[J]. Water Research, 2011, 45(1): 11-36. DOI:10.1016/j.watres.2010.08.037 |
| [29] |
Crawford N M, Kahn M L, Leustek T, et al. Nitrogen and sulfur[M]. Biochemistry & Molecular Biology of Plants, 2000: 786-849.
|
| [30] |
L'Helguen S, Maguer J F, Caradec J. Inhibition kinetics of nitrate uptake by ammonium in size-fractionated oceanic phytoplankton communities:Implications for, new production and f-ratio estimates[J]. Journal of Plankton Research, 2008, 30(10): 1179-1188. DOI:10.1093/plankt/fbn072 |
| [31] |
Morris I, Syrett P J. The development of nitrate reductase in Chlorella and its repression by ammonium[J]. Archives of Microbiology, 1963, 47(1): 32-41. |
| [32] |
张洪刚, 郭生练, 王才君, 等. 概念性流域水文模型参数优选技术研究[J]. 武汉大学学报(工学版), 2004, 37(3): 18-22. ZHANG Hong-gang, GUO Sheng-lian, WANG Cai-jun, et al. Review and research of calibration techniques for conceptual hydrological model[J]. Engineering Journal of Wuhan University, 2004, 37(3): 18-22. |
| [33] |
刘少博.基于生态水文模型的参数估计算法和灵敏度分析算法研究[D].甘肃: 兰州大学, 2012. LIU Shao-bo. Study on parameter estimation and sensitivity analysis algorithms based on hydrological model and ecological model[D]. Gansu: Lanzhou University, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10730-1012374209.htm |
| [34] |
Nelder J A, Mead R. A simplex method for function minimization[J]. Computer Journal, 1965, 7(4): 308-313. DOI:10.1093/comjnl/7.4.308 |
| [35] |
Taghavifar H. Towards multiobjective Nelder-Mead optimization of a HSDI diesel engine:Application of Latin hypercube design-explorer with SVM modeling approach[J]. Energy Conversion & Management, 2017, 143: 150-161. |
| [36] |
苏宏升, 殷凯乐. 基于Nelder-mead单纯形法的改进人工蜂群算法研究[J]. 计算机工程与应用, 2016, 52(24): 50-56. SU Hong-sheng, YIN Kai-le. Nelder-mead simplex method based improved artificial bee colony[J]. Computer Engineering and Applications, 2016, 52(24): 50-56. DOI:10.3778/j.issn.1002-8331.1502-0087 |
| [37] |
张弛.基于计算流体力学的聚合反应分子量分布的模拟与优化[D].杭州: 浙江大学, 2017. ZHANG Chi. Simulation and optimization of nonideal polymerization reactors based on molecular weight distribution using computational fluid dynamics method[D]. Hangzhou: Zhejiang University, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10335-1017181126.htm |
 2018, Vol. 37
2018, Vol. 37