2. 天津农学院农学与资源环境学院, 天津 300384
2. College of Agriculture and Environmental Resources, Tianjin Agricultural University, Tianjin 300384, China
不同土地利用方式可以引起陆地生态以及生物地球化学循环过程的变化,导致土壤性质变化和土地生产力改变[1]。作为人类和社会生存与发展必不可少的自然资源——森林生态系统迫于人类对粮食需求的增加而受到严重威胁,目前全球已有大面积的森林改为耕地用于农业生产[2-3]。与林地相比,耕地的土壤物理、化学和生物学性质发生了变化,生态系统的结构和功能也发生改变,土壤质量也有显著差异[4-5]。在我国东北地区有大面积森林分布,自20世纪50年代以来,部分林地改为耕地[6],虽然粮食产量得到了提升,但亟待开展土壤生态系统对这种变化的响应相关研究。同时,在开垦林地的过程中一小部分空地逐渐发展成为天然草地,这种土地利用转变方式是否为东北地区生态重建提供新的参考及其土壤生态系统变化情况,同样需要相关研究以提供理论依据。
土壤微生物多样性是土壤生态系统中物质和能量转化、循环和利用的基础,是土壤生态系统稳定性和可持续性的保障[7]。真菌作为土壤微生物群落中的关键功能类群,能够动态地适应改变的环境,参与分解有机质、促进土壤团聚体形成、稳固和改善土壤结构,促进植物对氮磷等矿质营养元素的吸收[8-9],推动土壤物质转换、能量流动和生物转化循环过程[10],其多样性变化可以指示土壤生态系统的健康状况。Biolog微平板技术已被广泛应用于微生物群落结构分析,具有灵敏度高、分辨力强、无需分离纯种微生物、操作简便等优点,能反映微生物种群的总体活性[11]。随着Biolog微平板技术的不断发展,最初仅被用于丝状真菌鉴定的Biolog FF微平板培养方法,逐渐用于土壤真菌的碳源利用功能多样性分析[12]。研究表明,土壤真菌群落多样性受土壤质地、土壤养分、pH值和植被等影响[13-17],能够反映土壤生态过程的变化。目前,土地利用方式对土壤生态系统影响的研究主要集中在对土壤有机碳[18]、土壤养分[19-20]、细菌功能多样性[21]、细菌和真菌遗传和结构多样性的影响[22-23]等方面,对土壤真菌群落代谢特征等的影响尚缺乏研究。
本研究采用Biolog FF微平板培养方法测定东北丘陵区不同土地利用方式(林地、耕地和草地)土壤真菌群落代谢特征的变化,并耦合理化性质测定分析土壤真菌代谢特征变化的主要驱动因子,旨在明确不同土地利用方式下土壤真菌群落代谢特征,探索土地利用类型与土壤真菌群落结构变化之间的关系,从而为东北地区土壤的可持续合理利用提供科学依据。
1 材料与方法 1.1 研究区概况研究区位于吉林省四平市伊通满族自治县,地处长白山脉向松辽平原过渡的丘陵地带。自20世纪50年代以来,该地区进行了大规模的开垦和采伐,形成了林地、耕地和草地等多样的土地利用类型。本研究选择在伊通满族自治县管辖的西苇镇的西苇林场和北京大北农生物技术有限公司吉林省试验示范基地进行,试验示范基地的耕地由林地转型而来。试验地的地理位置为125°20′ N,43°15′ E,属于中温带湿润季风气候区,年平均气温4.6 ℃,无霜期约为138 d,年平均降雨量627.8 mm,土壤为白浆土,是吉林省的典型土壤类型,也是东北地区重要的土壤资源[24]。
1.2 研究对象以林地(F)、耕地(A)和草地(M)3种土地利用类型为研究对象。林地为红松林(Pinus koraiensis),为林场的典型林分,林龄已达50年以上。耕地为农用坡耕地,紧邻林地,23年前出于扩大耕地面积的需要,林场将部分林地树木砍伐后用作农业生产,其耕作制度为玉米连作,常年使用化肥,不施有机肥,近3年化肥(N:P:K=15:15:15复合肥)施用量平均为750kg·hm-2,以基肥形式一次性施入,由于地处丘陵地带,当地玉米生产均无法采用机械化,只能靠人工种植和收获,田间管理措施按照当地常规操作进行。草地则是在林地树木砍伐后,由一小部分未用于农业生产及其他用途的空地逐渐形成的天然草地,主要分布野艾蒿(Artemisia lavandulifolia)、一年蓬(Erigeron annuus)、突节老鹳草(Geranium krameri)等草本植物,同样已有23年之久。
1.3 土壤样品采集在林地和草地样地内,分别设置3个15 m×15 m的标准样方,每个标准样方内依据W形多点采样法共设置15个采样点;从试验基地中选取3个小区(面积为10 m×15 m)作为耕地样地,在每个小区内同样依据W形多点采样法选取15个采样点。采样时去除表层的枯枝落叶,用直径为3.5 cm的土壤采样器采集0~15 cm的表层土壤。将同一处理同一小区(样方)的土壤充分混匀形成一个混合样品,装入1个自封袋中,放入低温样品储藏箱中带回实验室。将样土分为3份,其中1份存放在4 ℃冰箱用于测定土壤真菌功能多样性,1份风干后用于测定土壤理化性质。各处理的土壤基本理化性质见表 1。
|
|
表 1 供试土壤的基本理化性质 Table 1 Basic physical-chemical properties of tested soils |
土壤真菌群落代谢特征采用Biolog FF板测定(FF MicroPlate,Biolog,Hayward,CA,USA)[7]。称取5 g鲜土于盛有45 mL灭菌的NaCl溶液(0.85%)三角瓶中,恒温培养振荡器中180 r·min-1振荡30 min;将振荡后的土壤溶液稀释1000倍,吸取150 μL稀释液至Biolog FF板的微孔中,每个样品各3板(3次重复),25 ℃恒温培养168 h,每隔24 h读取490 nm波长下的光密度值。
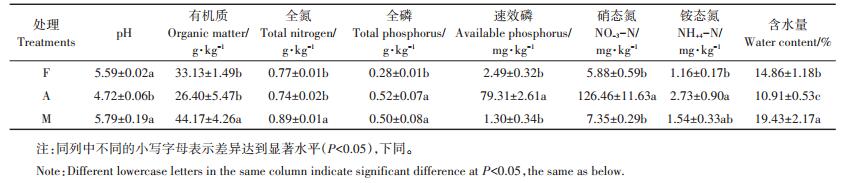
1.5 数据处理与统计分析选取培养96 h的光密度值计算平均颜色变化率(Average well color development,AWCD)、Shannon指数(H′)、Simpson指数(D)、McIntosh指数(U)和丰富度指数(S,被利用的碳源总数目,本研究中为Ci-R值大于0.20的孔数),计算公式如下:
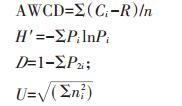
|
式中:Ci为第i孔的吸光值;R为对照孔的吸光值;n为培养基碳源的种类数,Biolog-FF板的n值为95;Pi为第i孔的相对吸光值与整个平板相对吸光值总和的比值;ni是第i孔的相对吸光值(Ci -R)。
选取96 h的平均颜色变化率(AWCD)对真菌碳源利用进行主成分分析。
采用SPSS 22.0软件进行单因素方差分析(Oneway ANOVA)和主成分分析(Principle component analysis,PCA)。采用CANOCO 4.5.1软件进行冗余分析(Redundancy analysis,RDA),并采用蒙特卡洛检验进行显著性分析(P < 0.05)。
2 结果与分析 2.1 土地利用方式对真菌平均颜色变化率的影响平均颜色变化率(AWCD)表征微生物群落碳源利用率,是土壤微生物群落利用单一碳源能力的一个重要指标,反映了土壤微生物碳源利用的强度,可以表征土壤微生物活性[25]。由图 1可见,AWCD值随培养时间延长而逐渐升高,各处理的AWCD值在培养24 h前均很小,表明土壤真菌对碳源的利用率很低;培养24 h后,林地和草地的AWCD值快速升高,而耕地的AWCD值在培养48 h后才表现出明显升高趋势。培养96 h时草地的AWCD值最高,林地次之,耕地最低;草地显著高于林地和耕地(P < 0.05),而林地和耕地间差异不显著(P>0.05)。
|
图 1 不同土地利用方式土壤真菌的平均颜色变化率(AWCD) Figure 1 Average well color development(AWCD)of soil fungi under different land use types |
微生物群落功能多样性变化多采用Shannon指数(H′)、Simpson指数(D)、McIntosh指数(U)和丰富度指数(S)等指标来表示,结果见表 2。其中Shannon指数(H′)反映微生物群落物种的丰富度,Simpson指数(D)反映微生物群落常见物种的优势度,McIntosh指数(U)反映微生物群落物种的均匀度,丰富度指数(S)反映微生物利用碳源的数量[26-27]。4种多样性指数的变化表现一致,即草地>林地>耕地。草地的Shannon指数(H′)和Simpson指数(D)均显著高于林地和耕地(P < 0.05),林地显著高于耕地(P < 0.05);草地的McIntosh指数(U)同样显著高于林地和耕地(P < 0.05),但林地与耕地间差异不显著(P>0.05);丰富度指数(S)的分析结果与McIntosh指数相同。不同处理的微生物群落Shannon指数(H′)、Simpson指数(D)、McIntosh指数(U)和丰富度指数(S)的变化整体上表现出与AWCD相似的规律,耕地的土壤真菌群落代谢活性和多样性指数低于林地,而草地的土壤真菌群落代谢活性和多样性指数显著高于林地和耕地(P < 0.05)。
|
|
表 2 不同土地利用方式土壤真菌多样性指数 Table 2 Diversity index of soil fungi under different land use types |
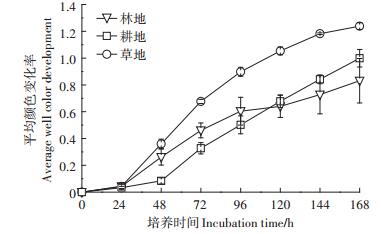
Biolog-FF微平板共有95种碳源,分为6大类,包括糖类(32种)、氨基酸类(13种)、羧酸类(17种)、聚合物类(6种)、胺类(6种)和其他类(9种),以此来反映真菌群落利用各类碳源的特征[7, 28]。土地利用方式的转变改变了真菌对Biolog FF板中碳源的总利用强度。与林地相比,耕地真菌对碳源的总利用强度降低了16.9%,差异不显著(P>0.05),而草地真菌对碳源的总利用强度升高了48.6%(P < 0.05)(图 2a)。土地利用方式转变对Biolog FF板中每一类碳源的利用均有明显影响(图 2b)。草地对糖类、羧酸类、其他类和氨基酸类碳源的利用能力显著高于林地和耕地,而对胺类的利用能力显著高于耕地(P < 0.05),与林地差异不显著(P>0.05)。除聚合物类外,林地对其他5种碳源的利用能力均高于耕地,但差异均不显著(P> 0.05),而耕地对聚合物类的利用能力显著高于林地(P < 0.05)。
|
不同小写字母表示差异达到显著水平(P < 0.05) Different lowercase letters indicate significant difference at P < 0.05 level 图 2 不同土地利用方式土壤真菌碳源利用强度 Figure 2 Utilization intensities of carbon sources by soil fungi under different land use types |
由图 3可见,3种土地利用方式土壤真菌对各类碳源相对利用率最高的是羧酸类,占总碳源利用率的29.87%~35.77%,其次为糖类,占总碳源利用率的22.27%~23.79%,氨基酸类碳源的利用强度略低于糖类,占总碳源利用率的18.24%~19.30%。而对其他类、胺类和聚合物类碳源的相对利用率较低,分别占总碳源利用率的9.87%~10.95%、4.51%~9.74%和4.68~9.34%。耕地对羧酸类和聚合物类碳源的相对利用率高于林地,其中对聚合物类的相对利用率显著高于林地(P < 0.05),而对糖类、其他类、胺类和氨基酸类碳源的相对利用率均低于林地,但差异均不显著。草地对糖类、其他类、胺类和氨基酸类碳源的相对利用率均最高,对羧酸类和聚合物类碳源的相对利用率最低。这说明林地、耕地和草地土壤真菌对碳源的利用的偏好不同。
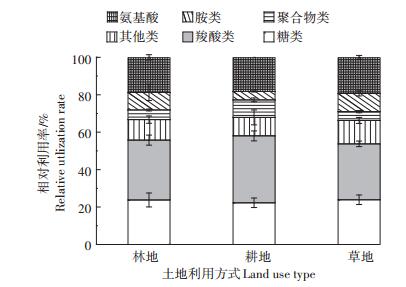
|
图 3 不同土地利用方式土壤真菌碳源相对利用率 Figure 3 Relative utilization rate of carbon substrate by soil fungi under different land use types |
采用基于对不同底物碳源利用能力的主成分分析方法研究不同土地利用方式土壤真菌群落在碳源利用上的具体差异。95个主成分因子中前8个累积方差贡献率达到100%,根据提取的主成分个数一般要求累计方差贡献率达到80%的原则[7],共提取了5个主成分,累计贡献率达到83%,由于第3~5主成分贡献率均较小,选取累积方差贡献率为53.8%的前2个主成分PC1和PC2来分析土壤真菌群落的代谢特征。由图 4可见,耕地位于第二象限,林地位于第一和第三象限,草地位于第一和第四象限,耕地、林地和草地间没有交集,说明林地、耕地和草地土壤真菌群落对底物碳源的代谢特征不同。
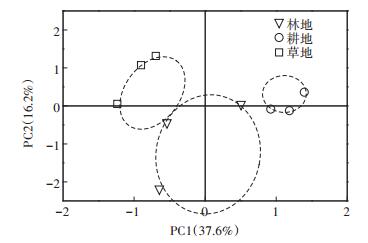
|
图 4 不同土地利用方式土壤真菌群落代谢特征的主成分分析 Figure 4 Principal component analysis of metabolic characteristics of soil fungi under different land use types |
对3种土地利用方式土壤真菌群落对不同碳源利用的相对吸光值进行RDA分析,确定环境因子对真菌群落代谢特征的影响。结果(图 5)表明,前2轴可以解释真菌群落功能多样性变化的65.4%,土壤总氮、有机质、pH和含水量与环境第一轴呈极显著正相关(R2分别为0.922 7、0.899 1、0.818 9、0.907 8,P < 0.01),速效磷和硝态氮与环境第一轴呈极显著负相关(R2分别为-0.747 5、-0.735 2,P < 0.01)。总氮、含水量、有机质、pH、速效磷和硝态氮与物种第一轴R2分别为0.919 7、0.904 8、0.896 2、0.816 8、-0.745 1、-0.732 8(P < 0.01),说明影响土壤真菌群落代谢特征的主要因素依次是总氮、含水量、有机质、pH、速效磷和硝态氮,表明真菌群落代谢特征变化是这6个环境因子协同作用的结果。
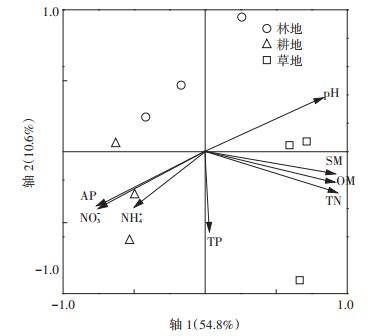
|
TP、AP、TN、NH4+、NO3-、OM、pH和SM分别代表总磷、速效磷、总氮、铵态氮、硝态氮、有机质、pH和含水量 TP, AP, TN, NH4+, NO3-, OM, pH and SM stands for total phosphorus, available phosphorus, ammonium nitrogen, nitrate nitrogen, organic matter, pH and water content, respectively 图 5 不同土地利用方式土壤真菌群落代谢特征的RDA分析 Figure 5 RDA analysis of metabolic characteristics of soil fungi under different land use types |
AWCD值可以直观反映土壤微生物群落代谢活性,群落功能多样性指数能够反映土壤微生物群落状态与功能[29]。本研究中,耕地土壤真菌活性(AWCD)低于林地,而草地AWCD高于林地和耕地,说明草地土壤真菌对碳源消耗量最大,真菌活性最高,林地次之,而耕地土壤真菌对碳源消耗最少,真菌活性最小。同时多样性指数表现出与AWCD相同的变化规律。此结果的产生可能是土地利用方式的转变引起土壤理化性质的改变所致。微生物种群数量和多样性与土壤养分的含量密切相关[25, 30],且植被往往通过影响土壤基本理化性质影响土壤生物区系[31]。本研究中耕地和草地与林地相比植被发生了显著变化,由木本植物转变为草本植物以及禾本作物,加之耕地长期的化肥施用,直接造成土壤理化性质的改变。耕地与林地相比,土壤pH显著降低,土壤酸化程度加强。这与Cai等[32]和Zhou等[33]的研究结果一致,直接导致了耕地土壤真菌活性及其多样性的降低。与Fang等[34]研究结果相同,本研究中耕地的有机质含量低于林地,农田向土壤输入碳的量低于自然生态系统[35],随着其自身碳源的不断消耗,有机质含量逐渐降低。真菌在土壤生态系统中发挥重要作用[36],参与土壤有机质循环过程[37],而土壤有机底物的减少直接导致真菌数量及活性的降低,我们采用qPCR方法研究发现耕地真菌数量显著低于林地(数据未列出),也证实了这一结论。但是本试验地为丘陵地,其独特的地理特征也决定了其耕作制度,由于无法采用机械化,玉米的种植和收获均采用人工方式,导致收获后,除玉米地上部分移出农田外,其根茬仍全部保留在农田里。这可能是耕地土壤中有机质含量较林地下降不显著的原因。同时根茬也为以真菌为代表的分解微生物提供了一定数量的可以利用的有机碳源,但是不同土地利用类型下返还到土壤中碳源类型的改变,很可能造成真菌数量的显著变化。与林地相比,草地的总氮、总磷、铵态氮和含水量显著增加(P < 0.05),pH、有机质、硝态氮也有明显增加,草地中不同植物交错叠加,根系分泌物十分丰富,明显提高了土壤的养分含量,为真菌的生存和繁殖提供了所需的营养和能源物质。已有研究表明根系分泌物对土壤微生物的分布有重要作用,直接影响土壤微生物的数量、活性和群落结构[38]。这些方面差异的综合作用造成了草地真菌的活性和多样性明显变化。
本研究中,通过分析发现3种土地利用方式的真菌不仅对Biolog FF板中碳源的总利用强度不同,而且对Biolog FF板中每一类碳源的利用也有明显不同。微生物对不同类型碳源的相对利用程度可以反映微生物的代谢功能类群[39]。土壤真菌对不同碳源相对利用率的差异分析表明,不同土地利用方式土壤真菌的主要功能代谢类群明显不同,因此不同土地利用方式土壤真菌群落的代谢特征存在明显差异。林地对6种碳源的相对利用率均位于草地和耕地之间,说明草地和耕地真菌对碳源的利用相比于林地向相反方向发展,土壤真菌对碳源利用的偏好发生了改变。这与本课题组研究发现土地利用方式转变改变了土壤细菌对碳源利用的偏好(数据未列出)的结果一致。同时分析发现,本研究中东北丘陵区白浆土3种土地利用方式土壤真菌对各类碳源相对利用率最高的均是羧酸类,与胡国彬等[7]研究发现小麦和蚕豆间作系统下红壤根际真菌对FF板中各类碳源相对利用率最高的是糖类的研究结果有所不同,说明土壤类型可能是决定真菌对碳源利用的选择性的关键因素。本课题组研究发现3种土地利用方式土壤细菌对碳源相对利用率最高的是糖类(数据未列出),表明在本研究的供试土壤条件下真菌和细菌本身对碳源利用的选择性明显不同。PCA分析结果发现不同土地利用方式土壤真菌对碳源的利用存在显著差异,说明不同土地利用方式明显改变了土壤真菌群落对底物碳源的代谢特征。进一步采用RDA对可能造成差异的因子进行分析发现,土壤理化性质(总氮、含水量、有机质、pH、速效磷和硝态氮)与土壤真菌功能多样性密切相关,说明不同土地利用方式导致土壤的理化性质改变,进而导致土壤真菌功能群落的不同。研究不同土地利用方式对土壤真菌功能多样性的影响,可以从侧面反映土壤基本理化性质对土壤真菌功能多样性的综合作用。
4 结论土壤真菌的活性和碳源的利用强度依次为草地>林地>耕地。3种土地利用方式土壤真菌功能多样性和群落代谢特征不同,其土壤真菌群落结构也有所不同。土壤真菌对碳源利用的偏好因土地利用方式而改变。土壤理化性质的改变是导致真菌群落代谢特征变化的主要原因,其代谢特征变化主要受总氮、含水量、有机质、pH、速效磷和硝态氮等因子的共同影响。虽然草地土壤真菌活性和多样性等指标均明显高于林地和耕地,但按照因地制宜的环境改善策略,在吉林省丘陵区采用退耕还林的生态重建方案更符合当地实际。
| [1] |
孙瑞, 孙本华, 高明霞, 等. 长期不同土地利用方式下土壤微生物特性的变化[J]. 植物营养与肥料学报, 2015, 21(3): 655-663. SUN Rui, SUN Ben-hua, GAO Ming-xia, et al. Changes of soil microbial characteristics under long-term different land use patterns on an anthropogenic loess soil[J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(3): 655-663. |
| [2] |
Food and Agriculture Organization of the United Nations. State of the world's forests, 2012[R]. Rome: Food and Agriculture Organization of the United Nations, 2012.
|
| [3] |
Achard F, Beuchle R, Mayaux P, et al. Determination of tropical deforestation rates and related carbon losses from 1990 to 2010[J]. Global Change Biology, 2014, 20(8): 2540-2554. DOI:10.1111/gcb.2014.20.issue-8 |
| [4] |
Schloter M, Dilly O, Munch J C. Indicators for evaluating soil quality[J]. Agriculture Ecosystems and Environment, 2003, 98. |
| [5] |
Lagomarsino A, Benedetti A, Marinari S, et al. Soil organic C variability and microbial functions in a Mediterranean agro-forest ecosystem[J]. Biology and Fertility of Soils, 2011, 47(3): 283-291. DOI:10.1007/s00374-010-0530-4 |
| [6] |
王慧杰.建国以来东北地区耕地演化及其生态环境后效[D].长春: 东北师范大学, 2016. WANG Hui-jie. Cultivated land evolution of Northeast and its ecological environment result after founding of the nation[D]. Changchun: Northeast Normal University, 2016. |
| [7] |
胡国彬, 董坤, 董艳, 等. 小麦与蚕豆间作对根际真菌代谢功能多样性的影响[J]. 土壤学报, 2015, 52(4): 926-933. HU Guo-bin, DONG Kun, DONG Yan, et al. Effects of intercropping of wheat and faba bean on diversity of metabolic function of rhizosphere fungal community[J]. Acta Pedologica Sinica, 2015, 52(4): 926-933. |
| [8] |
Boddington C L, Dodd J C. The effect of agricultural practices on the development of indigenous arbuscular mycorrhizal fungi:Ⅱ. Studies in experimental microcosms[J]. Plant and Soil, 2012, 218(1/2): 145-157. |
| [9] |
陈志豪, 梁雪, 李永春, 等. 不同施肥模式对雷竹林土壤真菌群落特征的影响[J]. 应用生态学报, 2017, 28(4): 1168-1176. CHEN Zhi-hao, LIANG Xue, LI Yong-chun, et al. Effects of different fertilization regimes on soil fungal communities under Phyllostachys violascens stand[J]. Chinese Journal of Applied Ecology, 2017, 28(4): 1168-1176. |
| [10] |
汪其同, 高明宇, 刘梦玲, 等. 基于高通量测序的杨树人工林根际土壤真菌群落结构[J]. 应用生态学报, 2017, 28(4): 1177-1183. WANG Qi-tong, GAO Ming-yu, LIU Meng-ling, et al. Illumina Miseq sequencing-based fungal community of rhizosphere soils along root orders of poplar plantation[J]. Chinese Journal of Applied Ecology, 2017, 28(4): 1177-1183. |
| [11] |
胡国彬, 董坤, 董艳, 等. 间作缓解蚕豆连作障碍的根际微生态效应[J]. 生态学报, 2016, 36(4): 1010-1020. HU Guo-bin, DONG Kun, DONG Yong, et al. Effects of cultivars and intercropping on the rhizosphere microenvironment for alleviating the impact of continuous cropping of faba bean[J]. Acta Ecologica Sinica, 2016, 36(4): 1010-1020. |
| [12] |
吴照祥, 郝志鹏, 陈永亮, 等. 三七根腐病株根际土壤真菌群落组成与碳源利用特征研究[J]. 菌物学报, 2015, 34(1): 65-74. WU Zhao-xiang, HAO Zhi-peng, CHEN Yong-liang, et al. Characterization of fungal community composition and carbon source utilization in the rhizosphere soil of Panax notoginseng suffering from root-rotdisease[J]. Mycosystema, 2015, 34(1): 65-74. |
| [13] |
秦红, 李昌晓, 任庆水. 不同土地利用方式对三峡库区消落带土壤细菌和真菌多样性的影响[J]. 生态学报, 2017, 37(10): 3494-3504. QIN Hong, LI Chang-xiao, REN Qing-shui. Effects of different land use patterns on soil bacterial and fungal biodiversity in the hydro-fluctuation zone of the Three Gorges Reservoir region[J]. Acta Ecologica Sinica, 2017, 37(10): 3494-3504. |
| [14] |
Zu Y G, Gao C Y, Wang W J, et al. Characteristics of the microbial community in rhizosphere of Camptotheca acuminata cultured with exotic invasive plant Eupatorium adenophorum[J]. Science in China Series C:Life Sciences, 2007, 50(1): 22-30. DOI:10.1007/s11427-007-0012-6 |
| [15] |
Tripathi B M, Kim M, Singh D, et al. Tropical soil bacterial communities in Malaysia:pH dominates in the equatorial tropics too[J]. Microbial Ecology, 2012, 64(2): 474-484. DOI:10.1007/s00248-012-0028-8 |
| [16] |
Schutter M E, Sandeno J M, Dick R P. Seasonal, soil type, and alternative management influences on microbial communities of vegetable cropping systems[J]. Biology and Fertility of Soils, 2001, 34(6): 397-410. DOI:10.1007/s00374-001-0423-7 |
| [17] |
Suleiman A K A, Manoeli L, Boldo J T, et al. Shifts in soil bacterial community after eight years of land-use change[J]. Systematic and Applied Microbiology, 2013, 36(2): 137-144. DOI:10.1016/j.syapm.2012.10.007 |
| [18] |
李欣雨, 夏建国, 鄢广奎, 等. 名山河流域不同土壤类型和土地利用方式下有机碳的分布特征[J]. 水土保持学报, 2017, 31(3): 224-230, 238. LI Xin-yu, XIA Jian-guo, YAN Guang-kui, et al. Distribution of organic carbon under different soil types and utilization patterns in Mingshan River watershed[J]. Journal of Soil and Water Conservation, 2017, 31(3): 224-230, 238. |
| [19] |
张晓东, 李忠, 张峰. 新疆艾比湖地区不同土地利用方式土壤养分、酶活性及微生物特性研究[J]. 水土保持研究, 2017, 24(6): 91-96. ZHANG Xiao -dong, LI Zhong, ZHANG Feng. Soil enzyme activities and microbial characteristics under different land use patterns in Aibinur Lake region of Xinjiang[J]. Journal of Soil and Water Conservation, 2017, 24(6): 91-96. |
| [20] |
唐柄哲, 何丙辉, 闫建梅. 川中丘陵区土地利用方式对土壤理化性质影响的灰色关联分析[J]. 应用生态学报, 2016, 27(5): 1445-1452. TANG Bing-zhe, HE Bing-hui, YAN Jian-mei. Gray correlation analysis of the impact of land use type on soil physical and chemical properties in the hilly area of central Sichuan, China[J]. Chinese Journal of Applied Ecology, 2016, 27(5): 1445-1452. |
| [21] |
Nautiyal C S, Chauhan P S, Bhatia C R. Changes in soil physicochemical properties and microbial functional diversity due to 14 years of conversion of grassland to organic agriculture in semi-arid agroecosystem[J]. Soil and Tillage Research, 2010, 109: 55-60. DOI:10.1016/j.still.2010.04.008 |
| [22] |
De G V, Bekele I, Dipchansingh D, et al. Microbial community structure and function of soil following ecosystem conversion from native forests to teak plantation forests[J]. Frontiers in Microbiology, 2016, 7: 1976. |
| [23] |
French K E, Tkacz A, Turnbull L A. Conversion of grassland to arable decreases microbial diversity and alters community composition[J]. Applied Soil Ecology, 2017, 110: 43-52. DOI:10.1016/j.apsoil.2016.10.015 |
| [24] |
孟庆英, 张春峰, 贾会彬, 等. 不同机械改土方式对白浆土物理特性及酶活性的影响[J]. 土壤学报, 2016, 53(2): 552-559. MENG Qing-ying, ZHANG Chun-feng, JIA Hui-bin, et al. Effects of mechanical soil amelioration method on physical properties of and enzyme activity in planosol[J]. Acta Pedologica Sinica, 2016, 53(2): 552-559. |
| [25] |
曹永昌, 谭向平, 和文祥, 等. 秦岭地区不同林分土壤微生物群落代谢特征[J]. 生态学报, 2016, 36(10): 2978-2986. CAO Yong-chang, TAN Xiang-ping, HE Wen-xiang, et al. The metabolism characteristics of microbial community in different forest soil in Qinling Mountains area[J]. Acta Ecologica Sinica, 2016, 36(10): 2978-2986. |
| [26] |
宋蒙亚, 李忠佩, 吴萌, 等. 不同种植年限设施菜地土壤微生物量和群落结构的差异[J]. 中国农业科学, 2015, 48(18): 3635-3644. SONG Meng-ya, LI Zhong-pei, WU Meng, et al. Changes in soil microbial biomass and community structure with cultivation chronosequence of greenhouse vegetables[J]. Scientia Agricultura Sinica, 2015, 48(18): 3635-3644. DOI:10.3864/j.issn.0578-1752.2015.18.007 |
| [27] |
律泽, 胡筱敏, 安婧, 等. 佳乐麝香与镉复合污染对土壤微生物群落功能和丰度的影响[J]. 农业环境科学学报, 2017, 36(1): 66-75. LÜ Ze, HU Xiao-min, AN Jing, et al. Joint effects of galaxolide and cadmium on soil microbial community function and abundance[J]. Journal of Agro-Environment Science, 2017, 36(1): 66-75. |
| [28] |
Mafham J P, Boddy L, Randerson P F. Analysis of microbial community functional diversity using sole-carbon-source utilization profiles-a critique[J]. FEMS Microbiology Ecology, 2002, 42(1): 1-14. |
| [29] |
邹春娇, 齐明芳, 马建, 等. Biolog-ECO解析黄瓜连作营养基质中微生物群落结构多样性特征[J]. 中国农业科学, 2016, 49(5): 942-951. ZHOU Chun-jiao, QI Ming-fang, MA Jian, et al. Analysis of soil microbial community structure and diversity in cucumber continuous cropping nutrition medium by Biolog-ECO[J]. Scientia Agricultura Sinica, 2016, 49(5): 942-951. |
| [30] |
傅伯杰, 陈利顶, 王军, 等. 土地利用结构与生态过程[J]. 第四纪研究, 2003, 23(3): 247-255. FU Bo-jie, CHEN Li-ding, WANG Jun, et al. Land use structure and ecological processes[J]. Quaternary Sciences, 2003, 23(3): 247-255. DOI:10.3321/j.issn:1001-7410.2003.03.002 |
| [31] |
张兴昌, 邵明安. 黄土丘陵区小流域土壤氮素流失规律[J]. 地理学报, 2000, 67(5): 617-626. ZHANG Xing-chang, SHAO Ming-an. Soil nitrogen loss by erosion as affected by vegetation cover and comprehensive managements in Zhifanggou catchment of hilly Loess Plateau[J]. Acta Geographica Sinica, 2000, 67(5): 617-626. |
| [32] |
Cai Z J, Wang B R, Xu M G, et al. Intensified soil acidification from chemical N fertilization and prevention by manure in an 18-year field experiment in the red soil of southern China[J]. Journal of Soils and Sediments, 2015, 15(2): 260-270. DOI:10.1007/s11368-014-0989-y |
| [33] |
Zhou J, Xia F, Liu X, et al. Effects of nitrogen fertilizer on the acidification of two typical acid soils in south China[J]. Journal of Soils and Sediments, 2014, 14(2): 415-422. DOI:10.1007/s11368-013-0695-1 |
| [34] |
Fang X, Wang Q, Zhou W, et al. Land use effects on soil organic carbon, microbial biomass and microbial activity in Changbai Mountains of northeast China[J]. Chinese Geographical Science, 2014, 24(3): 297-306. DOI:10.1007/s11769-014-0670-9 |
| [35] |
Huang J Y, Song C C. Effects of land use on soil water soluble organic C and microbial biomass C concentrations in the Sanjiang Plain in Northeast China[J]. Acta Agriculturae Scandinavica, Section B-Plant Soil Science, 2010, 60(2): 182-188. |
| [36] |
Sun R, Dsouza M, Gilbert J A, et al. Fungal community composition in soils subjected to long-term chemical fertilization is most influenced by the type of organic matter[J]. Environmental Microbiology, 2016, 18(12): 5137-5150. DOI:10.1111/1462-2920.13512 |
| [37] |
Wall D H, Virginia R A. Controls on soil biodiversity:Insights from extreme environments[J]. Applied Soil Ecology, 1999, 13(2): 137-150. DOI:10.1016/S0929-1393(99)00029-3 |
| [38] |
Nayyar A, Hamel C, Lafond G, et al. Soil microbial quality associated with yield reduction in continuous-pea[J]. Applied Soil Ecology, 2009, 43(1): 115-121. DOI:10.1016/j.apsoil.2009.06.008 |
| [39] |
张红, 吕家珑, 曹莹菲, 等. 不同植物秸秆腐解特性与土壤微生物功能多样性研究[J]. 土壤学报, 2014, 51(4): 743-752. ZHANG Hong, LÜ Jia-long, CAO Ying-fei, et al. Decomposition characteristics of different plant straws and soil microbial functional diversity[J]. Acta Pedologica Sinica, 2014, 51(4): 743-752. |
 2018, Vol. 37
2018, Vol. 37