2. 青岛市农村环境工程研究中心, 青岛 266109
2. Qingdao Research Center of Rural Environmental Engineering, Qingdao 266109, China
邻苯二甲酸酯(简称PAEs)是一类人工合成的有机化合物,主要被用作增塑剂和软化剂,是塑料生产过程的重要化工原料。全球塑料制品的广泛使用导致PAEs成为环境介质中最普遍存在的有机污染物之一[1]。国内外大量研究表明,PAEs具有内分泌干扰性[2-3],可通过呼吸、食物摄入和皮肤接触进入人体和动物体,干扰人类及其他动物正常的内分泌活动,进而影响生殖健康,威胁到人类及其他生物的生存[4-5]。
已有研究证实,PAEs属于难降解有机污染物,在环境中水解、光解速度较慢,微生物降解是PAEs衰减的主要途径[6],驯化分离高效降解菌成为PAEs污染环境生物修复的重要基础性工作[7-8]。近年来,国内外学者选择不同的PAEs化合物作为目标污染物,从污泥、土壤、河道底泥等环境介质中已经成功分离出部分PAEs高效降解菌,包括Gordonia sp.[9]、Sphingobium sp.[10]、Enterobacter sp.[11]、Arthrobacter sp.[12-13]、Achromobacter insolitus[14]、Bacillus sp.[15]、Paenibacillus sp.[16]、Pseudomonas sp.[17-18]、Enterobacter sp.[17]、Rhodococcus sp.[17]、Ensifer sp.[19]、Pseudomonas putida[20]、Chryseobacterium sp.[21]、Mycobacterium sp.[22]、Xanthobacter sp.[23]。由于国内外不同地域土壤和水体中PAEs浓度水平和单体组成存在显著差异[24-25],而已经报道的PAEs降解菌适用环境条件有限,因此,仍有必要进一步筛选高效广谱的PAEs降解菌,为PAEs污染环境修复提供更为丰富的菌种资源。
鉴于邻苯二甲酸二丁酯(DBP)和邻苯二甲酸二(2-乙基己基)酯(DEHP)是目前我国土壤和水体中最主要的2种PAEs化合物[24],故本文选择DBP和DEHP作为目标污染物,从土壤中筛选得到2株PAEs高效降解菌RXX-2和RXX-3,通过形态观察、生理生化及16S rDNA序列分析等手段对菌株进行了鉴定,并采用摇瓶振荡培养考察了菌株在不同的环境条件下对PAEs的降解性能,旨在为菌株用于PAEs污染环境修复提供一定的参考依据。
1 材料和方法 1.1 实验材料DBP和DEHP购自北京百灵威科技有限公司;高效液相色谱分析所用试剂均为色谱纯,其余试剂均为分析纯。
牛肉膏蛋白胨培养基:牛肉膏3.0 g、NaCl 5.0 g、蛋白胨10.0 g,H2O 1000 mL。
无机盐培养基:K2HPO4·3H2O 1.0 g、NaCl 1.0 g、MgSO4·7H2O 0.4 g、NH4NO3 0.5 g、CaCl2 0.1 g、FeCl3·6H2O 0.01 g,H2O 1000 mL。
1.2 实验方法 1.2.1 PAEs降解菌的驯化与分离从青岛市设施菜地和白沙河沿岸采集土样,称10 g土样分别加入盛有100 mL灭菌蒸馏水的三角瓶中,在30 ℃、175 r·min-1条件下振荡混匀。按1%的接种量取上述样品菌悬液的上清液,加入到DBP/DEHP分别为50 mg·L-1的无机盐培养液中,避光振荡培养7 d后进行下一次传代,每次传代逐渐提高DBP和DEHP浓度,浓度系列递增为50~1000 mg·L-1。每7 d作为一个驯化周期传代一次,持续进行培养。取100 µL终期驯化液,涂布于DBP/DEHP浓度相同的无机盐固体平板上,置于30 ℃生化培养箱中静置培养。待长出肉眼可见菌落后,观察其生长特征,筛选出长势最好的菌株,挑取单菌落将其反复划线接种于新的无机盐固体培养基上,直至镜检纯化为止。
1.2.2 菌株的鉴定利用微生物生化鉴定试剂对菌株进行生理生化特性的测定,委托生工生物工程(上海)股份有限公司测定菌株的16S rRNA序列,并用MEGA 5软件构建系统发育树。综合菌株的形态特征、生理生化特征及16S rDNA序列分析结果,对菌株进行鉴定。
1.2.3 菌悬液的制备挑取新鲜单菌落接种到牛肉膏蛋白胨液体培养基中,在摇床中28 ℃、170 r·min-1恒温振荡培养至对数生长期。取出液体培养基,将培养液分装于50 mL已灭菌的离心管中,在室温条件下于4000 r·min-1离心分离10 min。弃去上清液后,使用灭菌的生理盐水(0.9%的NaCl溶液)重悬后再次离心,重复该过程3次后,用生理盐水将菌体调配成菌悬液(OD600=1.0)。
1.2.4 环境条件对菌株降解PAEs的影响(1)pH。将上述菌悬液接种到初始浓度为100 mg·L-1 DBP/DEHP无机盐培养基中,用0.1 mol·L-1 HCl和0.1 mol·L-1 NaOH调节培养基的pH分别为5、6、7、8、9,在接种量1.0%(体积比)、温度25 ℃、转速150 r·min-1的条件下振荡培养5 d,测定剩余PAEs含量,并测定其OD600值。每个处理设置3个重复,下同。
(2)温度。将上述菌悬液接种到初始浓度为100 mg·L-1 DBP/DEHP无机盐培养基中,设置培养温度为15、20、25、30、35 ℃,在接种量1.0%(体积比)、pH 7、转速150 r·min-1条件下振荡培养5 d,测定剩余PAEs含量,并测定其OD600值。
(3)转速。将上述菌悬液接种到初始浓度为100 mg·L-1 DBP/DEHP无机盐培养基中,设置转速0、100、150、175、200 r·min-1,在接种量为1.0%(体积比)、pH 7、温度25 ℃的条件下振荡培养5 d,测定剩余PAEs含量,并测定其OD600值。
(4)接种量。将上述菌悬液接种到初始浓度为100 mg·L-1 DBP/DEHP无机盐培养基中,接种量分别为0、0.5%、1.0%、1.5%、2.0%(体积比),在pH 7、温度25 ℃、转速150 r·min-1的条件下振荡培养5 d,测定剩余PAEs含量,并测定其OD600值。
(5)最佳条件下菌株对PAEs的降解性能。依据上述实验确定的最佳降解条件,将菌悬液接种到初始浓度为100 mg·L-1 DBP/DEHP无机盐培养基中,振荡培养5 d,分别在第1、2、3、4、5 d测定剩余PAEs含量。
1.2.5 PAEs含量的测定采取液液萃取法对样品中剩余PAEs进行提取。向100 mL的DBP/DEHP无机盐培养基中加入乙酸乙酯后振荡30 min,全部移至分液漏斗充分振荡后静置分层,收集上层萃取液。用乙酸乙酯洗脱,收集全部洗脱液至鸡心瓶中,加入适量无水硫酸钠去除水分。在玻璃砂芯漏斗中铺一定量弗罗里硅土,用乙酸乙酯过滤并洗脱,收集全部洗脱液至鸡心瓶中,旋转蒸发浓缩至干,加入色谱级甲醇定容至1.5 mL,过有机系0.22 µm滤膜后采用高效液相色谱仪进行分析。
色谱条件为:色谱柱:inertsil ODS-SP(250 mm× 4.6 mm i.d.,5.0 µm);流动相A:甲醇,流动相B:水。采用梯度洗脱:设定B起始为30%,在20 min内匀速下降至5%,而后瞬间降至0%并保持5 min,再回到30%平衡10 min等待下一次进样;总流速:0.8 mL·min-1;柱温箱温度:32 ℃;进样量:20 µL;检测器:紫外检测器;检测波长:228 nm。
1.2.6 数据分析统计利用SPSS 21.0对数据进行单因素方差分析(ANOVA)以确定不同处理组之间的差异,显著性水平为P < 0.05,利用软件Origin 9.0作图。
2 结果与讨论 2.1 菌株的分离及生理生化鉴定经过富集培养,分离得到2株PAEs降解菌,分别命名为RXX-2、RXX-3。2株降解菌于30 ℃恒温培养3~5 d后,对其菌落形态进行观察,详见图 1。RXX-2菌落呈圆形,淡黄色,黏质不透明,边缘整齐,表面隆起,湿润光滑,直径一般在0.5~0.8 mm;RXX-3菌落呈圆形,白色,黏质不透明,边缘整齐,表面隆起,湿润光滑,直径一般在0.1~0.3 mm。

|
图 1 菌落形态 Figure 1 Colony morphology |
利用微生物生化鉴定试剂对2株降解菌的生理生化特性进行测定,结果见表 1。由表可以看出,菌株RXX-2和菌株RXX-3的生理生化特性相似,葡萄糖发酵、阿拉糖发酵、柠檬酸盐试验呈阳性,半乳糖发酵、甘露醇发酵、肌醇发酵、山梨醇发酵、鼠李糖发酵、蔗糖发酵、密二糖发酵、色氨酸酶、丙酮酸酶、脲酶、精氨酸脱羧酶、赖氨酸脱羧酶、鸟氨酸脱羧酶、吲哚、硫化氢、硝酸盐试验呈阴性,不同之处为菌株RXX-2的氧化酶试验呈阳性,菌株RXX-3的氧化酶试验呈阴性。
|
|
表 1 2株降解菌的生理生化特征 Table 1 Physiological and biochemical characteristics of two degrading strains |
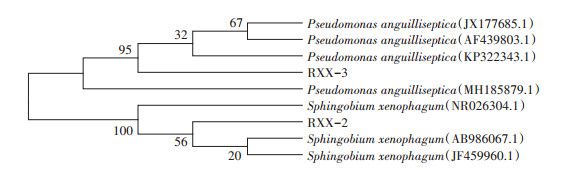
经16S rDNA菌种鉴定,并绘制菌株RXX-2和RXX-3的系统发育树(图 2)。结果表明,RXX -2与食异源物鞘氨醇菌(Sphingobium xenophagum)的相似性达到100%,RXX-3与鳗败血假单胞菌(Pseudomonas anguilliseptica)的相似性达到98%,综合菌株的形态特征、生理生化特征及16S rDNA序列分析结果,初步鉴定菌株RXX-2、RXX-3分别为食异源物鞘氨醇菌(Sphingobium xenophagum)和鳗败血假单胞菌(Pseudomonas anguilliseptica)。
|
图 2 菌株RXX-2和RXX-3的系统发育树 Figure 2 Phylogenetic tree of strain RXX-2 and RXX-3 |
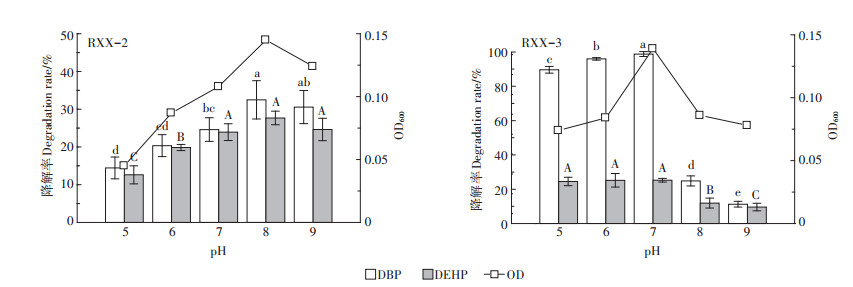
pH对菌株降解PAEs的影响见图 3。由图可知,在pH=5~9的范围内,随初始pH升高,菌株RXX-2、RXX-3的生长量及PAEs降解率均呈现先增大后减小的趋势,但2株降解菌的最适pH条件略有不同。在初始pH=8条件下菌株RXX-2的生长和降解能力最强,DBP和DEHP降解率分别达到32.5%和27.7%,而菌株RXX-3在初始pH=7条件下生长和降解能力最强,DBP和DEHP降解率分别达到98.8%和25.3%。进一步分析发现,菌株RXX-2在中性偏碱性(pH=7、8、9)条件下对PAEs的降解率显著高于酸性条件,这与文献[26]报道的红球菌(Rhodococcus sp.)相似,该菌株在中性偏碱性(pH=7、8)条件下生长降解状况最佳,其原因可能是PAEs在降解过程中会代谢成邻苯二甲酸、原儿茶酸等酸性物质所致[27],而菌株RXX-3在中性偏酸性(pH=5、6、7)条件下对PAEs的降解率显著高于碱性条件,表明2株降解菌分别适于不同酸碱环境的PAEs污染修复。
|
不同小写和大写字母分别表示处理之间DBP和DEHP降解率差异显著(P < 0.05)。下同 The different lowercase and uppercase letters indicate significant differences among treatments of DBP and DEHP at P < 0.05 levels, respectively. The same below 图 3 pH对菌株降解PAEs的影响 Figure 3 Effect of pH on degradation of PAEs by strains |
温度对菌株降解PAEs的影响见图 4。由图可知,在培养温度为15~35 ℃范围内,菌株RXX - 2、RXX-3的生长量及PAEs的降解率随温度的升高呈现先增大后减小的趋势。菌株RXX-2和RXX-3的最适生长温度分别为25 ℃和30 ℃,温度过低(15 ℃)会明显影响菌株的生长,降解活性较低,当温度升至30 ℃时,PAEs降解率达到最高值,此时菌株RXX-2对DBP和DEHP降解率分别达到46.6%和31.2%,菌株RXX-3对DBP和DEHP降解率分别达到97.7%和43.7%,当温度继续升至35 ℃时,DBP和DEHP的降解率均显著低于30 ℃条件。该现象与其他学者[28-31]研究菌株在不同温度条件下降解PAEs的结论一致,其原因可能是温度会影响菌体的酶、核酸、蛋白质等组分,继而影响其细胞生长速率和生物化学反应速率[32]。

|
图 4 温度对菌株降解PAEs的影响 Figure 4 Effect of temperature on degradation of PAEs by strains |
转速对菌株降解PAEs的影响见图 5。由图可知,在转速为0~200 r·min-1的范围内,菌株RXX-2、RXX-3的生长量及PAEs降解率随转速的升高均呈现先增大后减小的趋势。菌株RXX-2和RXX-3分别在转速150 r·min-1和175 r·min-1条件下生长量最高,但在转速为175 r·min-1时2株降解菌均表现出最强的降解能力,菌株RXX-2对DBP和DEHP降解率分别达到50.2%和34.7%,菌株RXX - 3对DBP和DEHP降解率分别达到87.5%和37.9%。由此表明,转速过快或过慢都影响2菌株的生长,导致降解活性降低,这与周长健[33]分离的节杆菌(Arthrobacter sp.)JQ-1相似,当摇床转速在150~175 r·min-1之间时,菌株的生长降解状况最佳,其原因可能是由于摇床转速间接地反映了培养液中溶解氧(DO)含量,提高转速有利于空气中的氧气向培养基扩散,从而更好地满足菌株生长代谢的需求,但当转速过高时,菌株生长趋势开始变得缓慢,可能是由于摇床振荡过快造成菌株细胞破裂或培养液中DO已经达到饱和状态[34]。

|
图 5 转速对菌株降解PAEs的影响 Figure 5 Effect of speed on degradation of PAEs by strains |
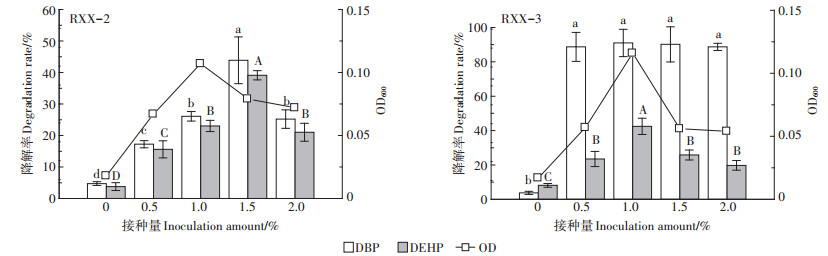
接种量对菌株降解PAEs的影响见图 6。由图可知,在未接种降解菌的条件下,DBP和DEHP降解率很低,随着菌液接种量的提高,2菌株的生长量及PAEs降解率均呈现先增大后减小的趋势。菌株RXX-2、RXX-3均在接种量1.0%的条件下生长量最高,菌株RXX-2在接种量为1.5%时对PAEs的降解能力显著高于其他接种量条件,DBP和DEHP降解率分别达到43.9%和39.1%,而菌株RXX-3在接种量为1.0%时对PAEs的降解能力最强,DBP和DEHP降解率分别达到91.0%和42.4%,尤其是对DEHP的降解能力显著高于其他的接种量条件。在正常情况下,菌液的接种量越高越有利于污染物的降解,但随着接种量的不断提高,较高的细菌数会形成对底物的竞争性利用,导致供单位微生物支配的营养物质减少,从而部分细菌会死亡,菌株降解活性下降,故表现为菌株在较高接种量时对底物的降解率反而降低[35]。
|
图 6 接种量对菌株降解PAEs的影响 Figure 6 Effect of inoculation amount on degradation of PAEs by strains |
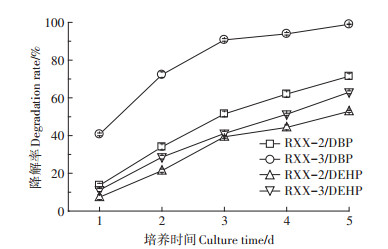
最佳条件下菌株对PAEs的降解性能见图 7。由图可知,随着培养时间的延长,菌株RXX-2、RXX-3对DBP和DEHP的降解率持续升高,第3 d时,菌株RXX-3对DBP的降解率已超过90%,到培养末期,菌株RXX - 2和RXX-3对DBP的降解率分别达到71.43%和98.98%,对DEHP的降解率分别达到52.85%和62.96%。在整个培养期,菌株RXX-3对DBP和DEHP的降解能力始终高于菌株RXX-2,且DBP的降解率始终高于DEHP,这主要是由于DBP的分子摩尔质量(278.4 g·mol-1)和lgKow(4.45,Kow为辛醇-水分配系数)均小于DEHP(分别为390.6 g·mol-1、7.50),而水溶解度(11.2 mg·L-1)高于DEHP(0.003 mg·L-1)[2],导致其微生物利用率相对较高,降解速率较快。
|
图 7 最佳条件下菌株对PAEs的降解性能 Figure 7 Degradation rates of strains to PAEs under the optimal conditions |
(1)从土壤中分离得到2株PAEs降解菌RXX-2、RXX-3,初步鉴定2菌株分别为食异源物鞘氨醇菌(Sphingobium xenophagum)和鳗败血假单胞菌(Pseudomonas anguilliseptica)。
(2)菌株RXX-2降解PAEs的最佳条件为pH 8、温度30 ℃、转速175 r·min-1、接种量1.5%,而菌株RXX-3的最佳条件为pH 7、温度30 ℃、转速175 r·min-1、接种量1.0%。
(3)在最佳降解条件下,经过5 d的培养,菌株RXX-2对DBP和DEHP的降解率分别达到71.43%和52.85%,RXX-3对DBP和DEHP的降解率分别达到98.98%和62.96%,表明筛选得到的2株降解菌在PAEs污染环境的生物修复方面具有良好的应用前景。
| [1] |
He L, Gielen G, Bolan N S, et al. Contamination and remediation of phthalic acid esters in agricultural soils in China: A review[J]. Agronomy for Sustainable Development, 2015, 35(2): 519-534. DOI:10.1007/s13593-014-0270-1 |
| [2] |
Staples C A, Peterson D R, Parkerton T F, et al. The environmental fate of phthalate esters: A literature review[J]. Chemosphere, 1997, 35(4): 667-749. DOI:10.1016/S0045-6535(97)00195-1 |
| [3] |
Mckee R H, Butala J H, David R M, et al. NTP center for the evaluation of risks to human reproduction reports on phthalates: Addressing the data gaps[J]. Reproductive Toxicology, 2004, 18(1): 1-22. DOI:10.1016/j.reprotox.2003.09.002 |
| [4] |
Benjamin S, Pradeep S, Josh M S, et al. A monograph on the remediation of hazardous phthalates[J]. Journal of Hazardous Materials, 2015, 298: 58-72. DOI:10.1016/j.jhazmat.2015.05.004 |
| [5] |
曹龙, 张朝升, 陈秋丽, 等. 邻苯二甲酸酯的环境污染和生态行为及毒理效应研究进展[J]. 生态毒理学报, 2018, 13(2): 34-46. CAO Long, ZHANG Chao-sheng, CHEN Qiu-li, et al. Progress in the study of environmental pollution and ecological behavior and toxicological effects of phthalate ester[J]. Asian Journal of Ecotoxicology, 2018, 13(2): 34-46. |
| [6] |
吴琼, 张晓峰, 任伟, 等. 邻苯二甲酸酯的污染现状及微生物降解研究进展[J]. 微生物学杂志, 2018, 38(2): 122-128. WU Qiong, ZHANG Xiao-feng, REN Wei, et al. Advances in pollution satus and microbio-degradation of phthalates[J]. Journal of Microbiology, 2018, 38(2): 122-128. DOI:10.3969/j.issn.1005-7021.2018.02.018 |
| [7] |
骆祝华, 黄翔玲, 叶德赞. 环境内分泌干扰物-邻苯二甲酸酯的生物降解研究进展[J]. 应用与环境生物学报, 2008, 14(6): 890-897. LUO Zhu-hua, HUANG Xiang-ling, YE De-zan. Advances in research of biodegradation of environmental endocrine disruptors-phthalate esters[J]. Chinese Journal of Applied & Environmental Biology, 2008, 14(6): 890-897. |
| [8] |
王玉婷, 刘方, 任文杰, 等. 酞酸酯污染农田土壤生物修复研究进展[J]. 微生物学杂志, 2018, 38(4): 126-134. WANG Yu-ting, LIU Fang, REN Wen-jie, et al. Advances in bioremediation of phthalate contaminated farmland soil[J]. Journal of Microbiology, 2018, 38(4): 126-134. |
| [9] |
Sarkar J, Chowdhury P P, Dutta T K. Complete degradation of di-n-octyl phthalate by Gordonia sp. strain Dop5[J]. Chemosphere, 2013, 90(10): 2571-2577. DOI:10.1016/j.chemosphere.2012.10.101 |
| [10] |
Whangsuk W, Sungkeeree P, Nakasiri M, et al. Two endocrine disrupting dibutyl phthalate degrading esterases and their compensatory gene expression in Sphingobium sp. SM42[J]. International Biodeterioration & Biodegradation, 2015, 99: 45-54. |
| [11] |
Fang C R, Yao J, Zheng Y G, et al. Dibutyl phthalate degration by Enterobacter sp. T5 isolated from municipal solid waste in landfill bioreactor[J]. International Biodeterioration and Biodegradation, 2010, 64(6): 442-446. DOI:10.1016/j.ibiod.2010.04.010 |
| [12] |
Wen Z D, Gao D W, Wu W M. Biodegradation and kinetic analysis of phthalates by an Arthrobacter strain isolated from constructed wetland soil[J]. Applied Microbiology and Biotechnology, 2014, 98(10): 4683-4690. DOI:10.1007/s00253-014-5568-z |
| [13] |
褚娇艳, 刘腾飞, 张汉虞, 等. 一株邻苯二甲酸二丁酯降解菌的筛选及其降解特性[J]. 微生物学通报, 2017, 44(7): 1555-1562. CHU Jiao-yan, LIU Teng-fei, ZHANG Han-yu, et al. Screening and characterization of a dibutyl phthalate-degrading bacterium[J]. Microbiology China, 2017, 44(7): 1555-1562. |
| [14] |
杨统一, 高俊贤, 刘琦, 等. 邻苯二甲酸二丁酯高效降解菌的分离、鉴定及降解特性[J]. 江苏科技大学学报(自然科学版), 2015(6): 607-611. YANG Tong-yi, GAO Jun-xian, LIU Qi, et al. Isolation and identification of highly efficient DBP-degrading strain and its degradation study[J]. Journal of Jiangsu University of Science and Technology (Natural Science Edition), 2015(6): 607-611. DOI:10.3969/j.issn.1673-4807.2015.06.018 |
| [15] |
刘帅, 王志刚, 胡云龙, 等. 一株黑土生境中DMP降解菌的分离鉴定和降解条件研究[J]. 浙江农业学报, 2015, 27(10): 1807-1812. LIU Shuai, WANG Zhi-gang, HU Yun-long, et al. Identification of a DMP-degraded strain in black soil and the optimation of degradation conditions[J]. Acta Agriculturae Zhejiangensis, 2015, 27(10): 1807-1812. DOI:10.3969/j.issn.1004-1524.2015.10.22 |
| [16] |
金雷, 陈瑜, 严忠雍, 等. 邻苯二甲酸二丁酯高效降解菌H-2的分离鉴定及其降解特性[J]. 食品科学, 2014, 35(15): 202-206. JIN Lei, CHEN Yu, YAN Zhong-yong, et al. Isolation and identification of a Di-n-butyl phthalate (DBP)-Degrading Strain H-2 and its degradation characteristics[J]. Food Science, 2014, 35(15): 202-206. DOI:10.7506/spkx1002-6630-201415041 |
| [17] |
温志丹, 高大文, 李喆, 等. 邻苯二甲酸酯降解菌的分离鉴定及降解特性[J]. 哈尔滨工业大学学报, 2013, 45(12): 38-42. WEN Zhi-dan, GAO Da-wen, LI Zhe, et al. Isolation and identification of phthalate-degrading bacteria and their characteristics[J]. Journal of Harbin Institute of Technology, 2013, 45(12): 38-42. DOI:10.11918/j.issn.0367-6234.2013.12.007 |
| [18] |
高静静, 陈丽玮, 王宜青, 等. 一株邻苯二甲酸二(2-乙基己基)酯(DEHP)高效降解菌的筛选及其降解特性[J]. 环境化学, 2016, 35(11): 2362-2369. GAO Jing-jing, CHEN Li-wei, WANG Yi-qing, et al. Isolation, identification of a DEHP-degrading bacterium and its high effective biodegradation characteristics[J]. Environmental Chemistry, 2016, 35(11): 2362-2369. DOI:10.7524/j.issn.0254-6108.2016.11.2016040103 |
| [19] |
张颖, 王丽华, 陈艺洋, 等. 一株DBP高效降解菌的筛选及降解特性研究[J]. 东北农业大学学报, 2016, 47(8): 46-54. ZHANG Ying, WANG Li-hua, CHEN Yi-yang, et al. Study on isolation and identification of a Di-n-butyl phthalate (DBP)-degrading strain and its degradation characteristics[J]. Journal of Northeast Agricultural University, 2016, 47(8): 46-54. DOI:10.3969/j.issn.1005-9369.2016.08.006 |
| [20] |
张可, 陈强, 陈伟, 等. 邻苯二甲酸二甲酯(DMP)降解菌的分离鉴定及降解特性[J]. 安全与环境学报, 2017, 17(2): 645-649. ZHANG Ke, CHEN Qiang, CHEN Wei, et al. On the isolation, identification and characterization of DMP-degrading strain[J]. Journal of Safety and Environment, 2017, 17(2): 645-649. |
| [21] |
范思艺, 陈芳艳, 唐玉斌, 等. 1株金黄杆菌的分离鉴定及其对DBP的降解特性[J]. 环境科学与技术, 2018, 41(增刊1): 41-46. FAN Si-yi, CHEN Fang-yan, TANG Yu-bin, et al. Isolation, identification of a Chryseobacterium strain and its degradation characteristics for DBP[J]. Environmental Science & Technology, 2018, 41(Suppl 1): 41-46. |
| [22] |
杨婧, 郭楚玲, 刘沙沙, 等. 邻苯二甲酸酯降解菌的筛选、降解特性及土壤修复研究[J]. 农业环境科学学报, 2018, 37(5): 933-940. YANG Jing, GUO Chu-ling, LIU Sha-sha, et al. Isolation and characterization of phthalate-degrading bacterial strain, and its application in phthalate-contaminated soil[J]. Journal of Agro-Environment Science, 2018, 37(5): 933-940. |
| [23] |
王嘉翼, 樊双虎, 任超, 等. 一株黄色杆菌的分离鉴定及对邻苯二甲酸酯的降解研究[J]. 生物技术通报, 2018, 34(10): 163-170. WANG Jia-yi, FAN Shuang-hu, REN Chao, et al. Identification of newly isolated Xanthobacter sp. and its degradability to phthalic acid esters[J]. Biotechnology Bulletin, 2018, 34(10): 163-170. |
| [24] |
Lü Huixiong, Mo C H, Zhao H M, et al. Soil contamination and sources of phthalates and its health risk in China: A review[J]. Environmental Research, 2018, 164: 417-429. DOI:10.1016/j.envres.2018.03.013 |
| [25] |
Dawen G, Zhe L, He W, et al. An overview of phthalate acid ester pollution in China over the last decade: Environmental occurrence and human exposure[J]. Science of the Total Environment, 2018, 645: 1400-1409. DOI:10.1016/j.scitotenv.2018.07.093 |
| [26] |
Li J, Chen J, Zhao Q, et al. Bioremediation of environmental endocrine disruptor di-n-butyl phthalate ester by Rhodococcus ruber[J]. Chemosphere, 2006, 65(9): 1627-1633. DOI:10.1016/j.chemosphere.2006.03.005 |
| [27] |
金德才, 吴学玲, 梁任星, 等. 一株DMP降解菌的分离鉴定及其降解特性[J]. 微生物学通报, 2009, 36(9): 1318-1323. JIN De-cai, WU Xue-ling, LIANG Ren-xing, et al. Isolation, identification and degradation characteristics of a DMP-degrading strain[J]. Microbiology, 2009, 36(9): 1318-1323. |
| [28] |
Quan C S, Liu Q, Tian W J, et al. Biodegradation of an endocrine-disrupting chemical, di-2-ethylhexyl phthalate, by Bacillus subtilis No. 66[J]. Applied Microbiology & Biotechnology, 2005, 66(6): 702-710. |
| [29] |
Chen J A, Li X, Li J, et al. Degradation of environmental endocrine disruptor di-2-ethylhexyl phthalate by a newly discovered bacterium, Microbacterium sp. strain CQ0110Y[J]. Applied Microbiology & Biotechnology, 2007, 74(3): 676. |
| [30] |
Pradeep S, Josh M K S, Binod P, et al. Achromobacter denitrificans strain SP1 efficiently remediates di (2-ethylhexyl) phthalate[J]. Ecotoxicology & Environmental Safety, 2015, 112: 114-121. |
| [31] |
Tang W J, Zhang L S, Fang Y, et al. Biodegradation of phthalate esters by newly isolated Rhizobium sp. LMB-1 and its biochemical pathway of di-n-butyl phthalate[J]. Journal of Applied Microbiology, 2016, 121(1): 177-186. DOI:10.1111/jam.13123 |
| [32] |
Tiehm A, Frizsche C. Utilization of solubilized and crystalline mixtures of polycyclic aromatic hydrocarbons by a Mycobacterium sp[J]. Applied Microbiology & Biotechnology, 1995, 42(6): 964-968. |
| [33] |
周长健.高效DEHP降解菌的筛选鉴定及其土壤模拟修复初探[D].哈尔滨: 东北农业大学, 2016. ZHOU Chang-jian. Isolation of an efficient di-(2-ethylhexyl) phthalate degrading bacteria and preliminary study of the soil remediation [D]. Harbin: Northeast Agricultural University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10224-1016094568.htm |
| [34] |
徐成斌, 王闻烨, 李鲜珠, 等. 一株菲降解菌的鉴定及降解特性[J]. 环境科学学报, 2015, 35(3): 684-691. XU Cheng-bin, WANG Wen-ye, LI Xian-zhu, et al. Identification and characteristics of a phenanthrene-degrading bacterium[J]. Acta Scientiae Circumstantiae, 2015, 35(3): 684-691. |
| [35] |
王巧凤.炼油废水中塑化剂优势菌的筛选及降解特性研究[D].武汉: 武汉科技大学, 2013. WANG Qiao-feng. Isolation and degeradation of dominant bacteria of plasticizing agent in refinery wastewater[D]. Wuhan: Wuhan University of Science and Technology, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10488-1014113617.htm |
 2019, Vol. 38
2019, Vol. 38



