2. 河南省水体污染防治与修复重点实验室, 河南 平顶山 467036
2. Henan Province Key Laboratory of Water Pollution Control and Rehabilitation Technology, Pingdingshan 467036, China
氮、磷等营养盐是湿地生态系统初级生产力的重要限制因子之一,其对于湿地生态稳定和健康运行具有重要影响[1]。湿地生态系统作为氮、磷等营养盐的重要储存库,在地球化学循环过程中起着汇集、转化和迁移的重要作用[2]。挺水植物作为湿地生态系统的重要组成部分,主要生长在水陆交界区域,该区域被誉为生物地球化学循环的“热区”[3-4]。近年来,水生植物在湖泊富营养化预防和治理方面发挥着重要作用,但在实际应用中,植物进入冬季时会衰亡,大量植物残体腐解会对水体造成二次污染,如苦草的腐解导致水体TN和TP含量大幅增加[5];芦苇腐解引起水体水质的剧烈变化[6],并且与生物量密度有关[7],唐金艳等[8]的研究也得出类似结论。可见,大量植物腐解会导致水体一定时期内呈现富营养化状态,比较研究湿地不同挺水植物腐解过程及其对水质的影响,对湿地挺水植物管理和水质保护具有重要意义。
本文以北方湿地常见的5种挺水植物为研究对象,通过构建室内试验系统模拟挺水植物腐解过程,研究5种挺水植物腐解及其对水质的影响,以期为湿地水生态修复中挺水植物的选择及其残体的科学管理提供理论依据。
1 材料和方法 1.1 样品的采集和预处理挺水植物(海寿花Pontederia cordata、白菖蒲Acorus calamus、美人蕉Canna indica、再力花Thalia dealbata 和风车草Cyperus alternifolius)为本实验室在人工湖中培育而成。2017年10月份在河南城建学院人工湖采集(仅地上部分),植物采集后,用纯水洗净,105 ℃杀青15 min,65 ℃烘干至恒质量。将植物茎叶均剪成1 cm的碎片,混匀后置于200目网袋中,-45 ℃保存备用。2018年3月在白龟湖湿地(33°46′05.85″N,113°09′45.07″E)采集水体和沉积物,水样过200目筛网,沉积物过100目筛网,去除其中的植物残体和杂物。
1.2 植物腐解试验系统采用体积为12 L的聚乙烯水桶为容器(桶底直径21 cm,桶口直径26 cm,桶高27.5 cm),加入经过预处理的底泥(2 kg)和水样(10 L),静置72 h。将装有海寿花、菖蒲、美人蕉、再力花和风车草的网袋浸没于水桶内,生物量密度为2 g·L-1,同时设置对照组,每组3个重复。在室内进行试验(2018年3月—7月,为期60 d),分别在第0、2、6、12、18、24、30、36、42、48 d和60 d测定植物和水体相关理化指标。植物和水样采集方式:从桶内取出一只网袋(初始量为2 g植物),于65 ℃烘干至恒质量;使用水泵从水面下5 cm处抽取1 L水样。试验过程中,每周使用双蒸水补充因蒸发损失的水量。
1.3 样品测定和数据分析植物:经H2SO4-H2O2消煮后,采用半微量凯氏法测定总氮(TN)[7];采用钼锑抗比色法测定总磷(TP)[7];腐解速率(k)参照文献[9]方法分析:
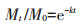
|
式中:Mt表示植物在时间t 的质量,kg;M0为初始质量,kg;k为腐解速率常数,d-1;t为腐解时间,d。
水体:采用雷磁PHS-3E和JPSJ-605S分别测定pH和溶解氧(DO);总磷(TP)、氨氮(NH4+-N)、硝酸盐氮(NO3--N)和亚硝酸盐氮(NO2--N)的测定参照文献[7]。使用Excel进行图表绘制,SPSS 18.0进行线性相关性和单因素方差分析。
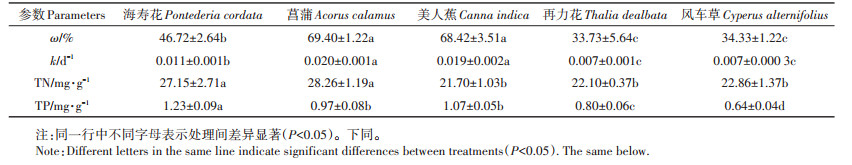
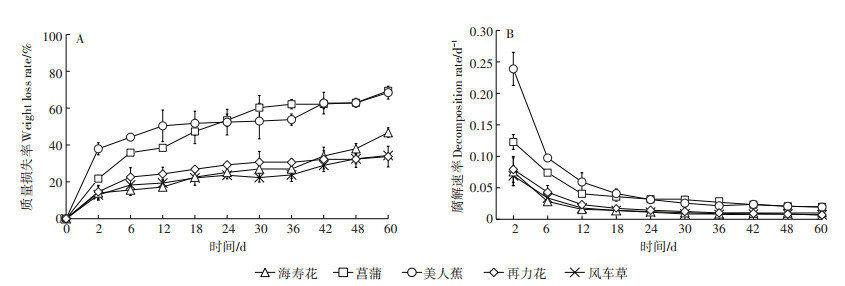
2 结果与分析 2.1 植物质量损失率(ω)和腐解速率(k)的变化为期60 d的腐解过程中,5种挺水植物的质量损失率在试验初期快速上升(0~6 d),随后缓慢上升(图 1A)。第6 d时,海寿花、菖蒲、美人蕉、再力花和风车草质量损失率分别为15.57%、35.85%、44.24%、22.63%和18.29%。试验结束时,5种植物质量损失率大小依次为菖蒲(69.40%) > 美人蕉(68.42%) > 海寿花(46.72%) > 风车草(34.33%) > 再力花(33.73%),其中菖蒲和美人蕉无显著差异(P > 0.05)(表 1),再力花和风车草无显著差异(P > 0.05)。如图 1B所示,5种挺水植物的腐解速率变化趋势一致,最高值均出现在第2 d,并于第6 d后快速下降,随后缓慢下降。
|
|
表 1 植物理化参数单因素方差分析(第60 d) Table 1 One-way ANOVA of plants physiochemical parameters(The 60th day) |
|
图 1 植物质量损失率和腐解速率变化趋势 Figure 1 Dynamics of weight loss rate and decomposition rate |
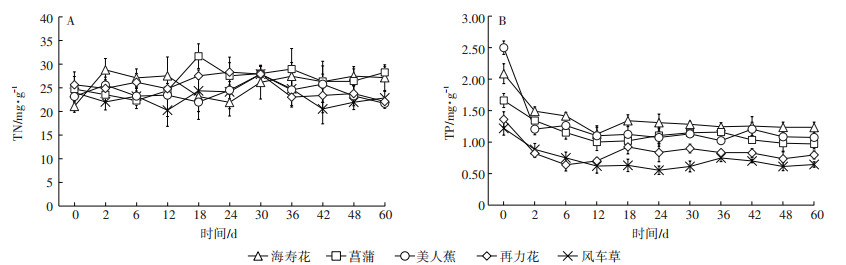
如图 2A所示,整个试验周期内,5种挺水植物TN含量均呈现窄幅波动,但变化趋势并不相同。试验结束时,植物TN含量与初始值相比,海寿花和菖蒲略有上升,其余3种略有下降,依次为菖蒲 > 海寿花 > 风车草 > 再力花 > 美人蕉,其中海寿花和菖蒲无显著差异(P > 0.05),美人蕉、再力花和风车草之间无显著差异(P > 0.05)(表 1)。
|
图 2 植物TN和TP变化趋势 Figure 2 Dynamics of TN and TP |
如图 2B所示,5种挺水植物TP变化趋势一致,试验初期(0~6 d)快速下降,第6 d时,海寿花、菖蒲、美人蕉、再力花和风车草TP较初始值分别下降了32.17%、30.67%、49.44%、53.02%和38.47%,第6 d后,植物TP含量变化波动范围变小。试验结束时(表 1),仅菖蒲和美人蕉之间不存在显著差异(P > 0.05)。
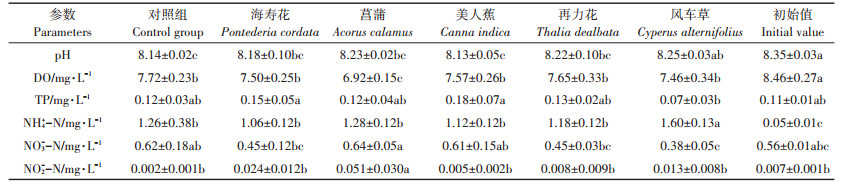
2.3 水体pH、DO和TP变化趋势为期60 d的试验周期内,各处理组水体pH变化趋势相似(图 3A),初期快速下降,均在第2 d出现最低值,然后快速上升,海寿花、美人蕉、再力花和风车草组水体pH在第18 d均上升到8.0以上,菖蒲组水体pH于第30 d上升到8.07。对照组变化趋势与处理组略显不同,在试验初期下降幅度不大,于第6 d达到最低值8.08,随后趋于平缓。试验结束时,初始值与风车草无显著差异(P > 0.05),但与其余各处理组均存在显著差异(P < 0.05)(表 2)。

|
图 3 水体pH、DO和TP变化趋势 Figure 3 Dynamics of pH, DO and TP in water |
|
|
表 2 水体理化参数单因素方差分析(第60 d) Table 2 One-way ANOVA of physiochemical parameters in water(The 60th day) |
对照组水体DO变化趋势与处理组相似(图 3B),在30 d内,各组均呈现整体下降趋势,并于第30 d出现最低值,其中以菖蒲组(2.38 mg·L-1)最低。第30 d后,水体DO快速上升。实验结束时,各组DO浓度均显著低于初始值(P < 0.05),菖蒲组均显著低于其余各组(P < 0.05)(表 2)。
对照组与各处理组水体TP变化趋势相似(图 3C),可分为两个阶段,第一阶段(0~18 d),TP浓度均先上升,然后下降,其中对照组和风车草最大值出现在第6 d,分别为0.27 mg·L-1和0.47 mg·L-1,海寿花、菖蒲、美人蕉和再力花最大值出现在第12 d,分别为0.87、0.41、0.56 mg·L-1和0.34 mg·L-1;第二阶段(18~ 60 d)TP浓度窄幅波动。试验结束时(表 2),各组TP浓度依次为美人蕉 > 海寿花 > 再力花 > 对照 > 菖蒲 > 风车草,其中风车草与初始值无显著差异(P > 0.05)。
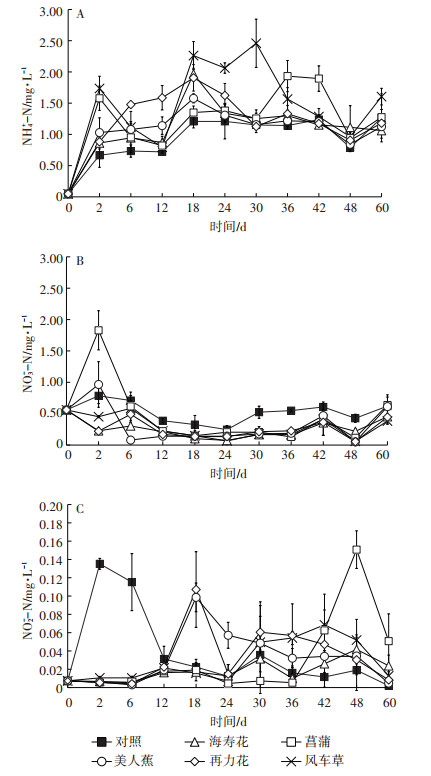
2.4 水体NH4+-N、NO3--N和NO2--N的变化如图 4A所示,各组水体NH4+-N第2 d均呈现快速上升,但随后出现差异。第2~12 d时,菖蒲和风车草持续下降,随后上升再下降,最高点分别出现在第36 d(1.93 mg·L-1)和第30 d(2.46 mg·L-1);海寿花和美人蕉则变化较为平缓,第12 d后快速上升,随后下降并窄幅波动;再力花则在0~18 d内持续上升,在第18 d出现最大值(2.46 mg·L-1),随后下降并趋于平缓。试验结束时(表 2),各组均显著高于初始值(P < 0.05)。与对照组相比,风车草与对照组存在显著差异(P < 0.05)。
|
图 4 水体NH4+-N、NO3--N和NO2--N浓度随时间变化 Figure 4 Dynamics of NH4+-N, NO3--N and NO2--N in water |
各组水体NO3--N变化趋势也存在差异(图 4B),其中菖蒲和美人蕉先上升,随后下降,最终趋于平缓;海寿花、再力花和风车草则先略微下降,随后上升再下降,最终趋于平缓;对照组在试验周期内,变化幅度均不大。试验结束时,各组与初始值均不存在显著差异(P > 0.05)。
各组水体NO2-N变化趋势差异较为明显(图 4C),对照组最高值出现在第2 d,达到0.135 mg·L-1。各处理组则在0~12 d内变化趋势一致,随后出现分化,均呈现出不同变化趋势。试验结束时,仅菖蒲组显著高于初始值(P < 0.05),同时显著高于其余各组(P < 0.05)。
3 讨论 3.1 植物腐解的影响因素影响植物腐解速率的因素较多,如水体环境[10-11]、生物量密度[7-8, 12]、植物成分组成[8, 13-14]、沉积物性质[15]以及微生物群落结构组成[16]等,但一般而言,植物腐解过程可分为两个阶段:快速溶解阶段和缓慢分解阶段[17]。本研究中,在试验初期(0~12 d)植物体内的有机颗粒和无机盐类等成分通过淋溶作用快速释放到水体环境,引起水质大幅波动;试验后期(12~ 60 d),植物体内难溶性物质在微生物作用下缓慢分解,水体和植物理化参数呈现波动变化状态。
与此同时,植物类型和种类与腐解速率也存在着密切联系[8, 18-19],一般而言,浮水植物的腐解速率最大,沉水植物次之,而挺水植物最低。究其原因,是植物本身理化性质的不同,导致腐解速率存在差异。有研究表明[13, 20],植物腐解速率与体内初始有机氮含量成正比,曹培培等[18]和曹勋等[21]的研究也发现,腐解速率分别与植物残体的TN和TP均存在显著正相关性,但本研究未得出类似结论,皮尔逊线性相关性分析表明,5种植物腐解速率与植物残体TN并不存在显著的线性相关性(P > 0.05)。此外,仅海寿花、菖蒲和风车草的腐解速率与其残体TP含量呈显著的线性正相关(P < 0.05)。在整个试验周期内,菖蒲和美人蕉的腐解速率均显著高于海寿花、再力花和风车草,这可能与其木质素含量较低有关。对温带阔叶林4种植物叶片凋落物腐解速率的研究表明[22],木质素对元素的释放有抑制作用,木质素的含量比N含量更能影响植物的腐解速率[18, 20, 23]。本研究中,菖蒲和美人蕉茎叶比较低,木质素含量要小于海寿花、再力花和风车草。
有研究认为[18],植物腐解过程TN含量变化趋势与其初始值相关,并且N含量越低的枯落物其固N的趋势越强[24]。本研究中,5种挺水植物在腐解过程中,TN变化趋势各异,但整体呈现窄幅波动,并未发现类似规律。在植物体内,N素主要以有机氮的形式存在,相较于其他化合物,其分解速率相对较慢[25],另一方面微生物附着在植物残体表面,存在一定的固N作用[24],二者共同作用下使植物TN的变化呈现上下波动。
各处理组植物残体TP的变化趋势相似,均在试验初期快速下降,该现象与之前报道类似[8, 21]。这是因为P元素在植物组织内主要以磷酸根离子或化合物的形态存在,该形态下的P元素极易在淋溶作用下损失[26]。第6 d后,植物残体TP变化平缓,交替上下波动,这可能与P相关微生物活动有关。
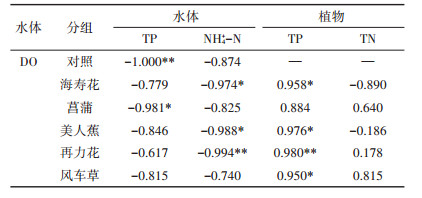
3.2 植物腐解对水质的影响本研究中,5种挺水植物腐解过程对水质的影响过程较为相似,在试验初期,均出现较大的水质波动,但水质理化参数的变化幅度因植物种类不同而有所差异。水体pH变化趋势与之前的研究相似[7-8],呈现先下降后上升。在试验初期,植物快速腐解,向水体环境释放有机酸,导致水体pH快速下降,在第2 d各处理组均出现最低值。另一方面,植物腐解过程会产生CO2,从而导致水体pH下降,系统内硝化反应对碱度的消耗也是导致水体pH下降的原因之一。随着腐解速率的降低,单位时间进入水体的有机物减少,同时体系中存在的反硝化反应会产生一定碱度,综合作用下促使水体pH逐渐上升,并恢复到初始水平。皮尔逊线性相关性分析表明(表 3),各处理组水体pH与植物腐解速率呈负相关且极显著(P < 0.01),说明植物腐解过程对水体pH的变化具有较大影响。
|
|
表 3 皮尔逊线性相关性分析(0~60 d) Table 3 Pearson linear correlation analysis(0~60 d) |
如表 3所示,各组水体TP的变化与水体pH呈负相关,其中菖蒲和风车草呈极显著相关(P < 0.01)。研究表明[19],植物中的P主要以无机磷酸盐的形式进入水体,而磷酸盐在中性或弱碱性环境下会以沉淀的形式进入沉积物。试验初期,水体环境pH较低,同时植物腐解速率较快,水体TP快速上升,随着pH的逐渐回升和腐解速率的快速下降以及水体中DO浓度的恢复,水体磷酸盐以沉淀形式快速向沉积物迁移,最终恢复到初始水平,该结论与之前的研究结果一致[8, 18, 21]。此外,皮尔逊线性相关性分析表明,在整个试验周期内,各处理组植物腐解速率与水体TP呈正相关趋势,但仅菖蒲组(P < 0.05)和风车草组(P < 0.01)具有显著性,说明植物腐解过程对水体TP的影响趋势一致,但影响程度因植物不同而各异。仅菖蒲组植物残体TP含量与水体TP含量的线性相关性显著(负相关,P < 0.05)。
水体DO在初期持续下降,这是由于植物腐解过程向水体释放了大量溶解性有机物,有机物在微生物的作用下分解导致DO的消耗,随着腐解速率的减缓,复氧速率大于耗氧速率,水体DO浓度逐渐恢复。植物腐解对水体DO的影响是间接产生的,对试验初期(0~12 d)数据进行皮尔逊线性相关性分析(表 4),各组水体DO的变化与水体TP均呈负相关,其中对照组(P < 0.01)和菖蒲组(P < 0.05)具有显著相关性;各组水体DO的变化与植物TP呈正相关,且除菖蒲组外均呈现出显著相关性(P < 0.01或P < 0.05)。同时,水体TP和植物残体TP变化趋势呈负相关趋势,但仅菖蒲组具有显著的相关性(P < 0.05)。此外,试验初期(0~ 12 d)水体DO的变化与水体NH4+-N均呈负相关,且与海寿花组(P < 0.05)、美人蕉组(P < 0.05)和再力花组(P < 0.01)呈显著相关性,但与植物TN并无显著相关性。
|
|
表 4 皮尔逊线性相关性分析(0~12 d) Table 4 Pearson linear correlation analysis(0~12 d) |
在湿地生态环境中,N素的存在形式有:有机氮、NH4+-N、NO3--N和NO2--N,并且主要贮存在沉积物中。有机氮主要来源于植物腐解过程的释放,并主要集中在沉积物表层。有研究表明[4],有机氮在湿地沉积物中的含量占总N含量的97%以上。无机氮(NH4+-N、NO3--N和NO2--N)主要是通过微生物的氨化、硝化、反硝化以及厌氧氨氧化作用在水体、沉积物和植物之间迁移转化。植物生长过程,不同植物对无机氮的需求存在差异[27],其根系分泌物对微生物也有一定影响。植物腐解过程也是如此,不同种类植物的成分存在差异,释放到水体环境的成分和总量不同,对水质的影响程度必然存在差异。本研究中,水体NH4+-N来自两部分:一部分来自植物腐解过程产生的大量有机氮,在微生物作用下分解生成氨氮;另一部分来自沉积物氨氮的释放以及有机氮的分解。大量有机氮的分解,造成试验初期水体NH4+-N快速上升。随着植物腐解速率降低,水体氨氮的变化也趋于平缓,最终与对照组差异较小,仅风车草显著高于对照组(P < 0.05)。皮尔逊线性相关性分析表明,海寿花组植物残体TN与水体NH4+-N呈显著负相关(P < 0.05),风车草组植物残体TN与水体NH4+-N呈显著正相关(P < 0.05),而其余各处理组未展现出显著相关性。这可能是因为植物体内N并不是整体降解,其降解过程是从边缘开始,逐渐延伸到中心,并且植物体内N浓度的变化并不均匀,因此不能简单地将植物残体TN的变化与水体无机氮的变化看作是线性相关的。
水体NO3--N的变化与反硝化反应相关,在试验初期随着DO的消耗,反硝化细菌活性增强,导致水体NO3--N短暂升高后快速下降。皮尔逊线性相关性分析表明,植物腐解速率与菖蒲组和美人蕉组NO3--N呈显著正相关(P < 0.05)。水体NO2--N作为硝化和反硝化的中间产物,稳定性较差,变化幅度较大。植物腐解过程释放出的N素可通过硝化、反硝化和厌氧氨氧化等微生物作用生成N2和N2O等气体逸出,亦可在氮素的不同存在形式之间相互转化,总之氮的迁移转化每一步都离不开微生物的作用。在湿地生态环境中,虽然有植物吸收作用参与N的循环,但微生物的作用依然是最主要的。
4 结论(1)不同种类植物其腐解速率存在差异,菖蒲和美人蕉最快,海寿花次之,风车草和再力花最慢。试验初期,各处理组质量损失率快速上升,第6 d时,海寿花、菖蒲、美人蕉、再力花和风车草质量损失率分别为15.57%、35.85%、44.24%、22.63%和18.29%,随后进入缓慢分解阶段,在第60 d时,植物质量损失率分别达到46.72%、69.40%、68.42%、33.73%和34.33%。
(2)试验周期内,5种挺水植物TN呈窄幅波动,未发现植物残体TN含量与腐解速率的显著相关性。植物TP在试验初期快速下降,随后趋于平缓,海寿花、菖蒲和风车草的腐解速率与其残体TP含量呈显著的线性正相关(P < 0.05)。
(3)5种挺水植物腐解过程对水质的影响存在差异,但均在试验初期引起水质较大的波动,且整体变化趋势相似。试验初期,水体pH和DO快速下降,TP快速上升,试验结束时,恢复到初始水平。水体NH4+-N、NO3--N和NO2--N变化因植物种类不同存在差异,微生物在水体N素转化过程中发挥着重要作用,沉积物作为潜在污染源对水体N素变化也具有一定影响。挺水植物腐解对湿地水质的影响具有时效性,为避免水质剧烈波动,应在植物衰亡初期进行有计划地收割。
| [1] |
俞琳莺, 孙志高, 孙文广, 等. 外源氮输入对生长季黄河口碱蓬-土壤系统磷分布规律的影响[J]. 环境科学研究, 2019, 32(6): 1052-1062. YU Lin-ying, SUN Zhi-gao, SUN Wen-guang, et al. Effects of exogenous nitrogen enrichment on distributions of total phosphorus in plantsoil system of Suaeda salsa marsh in the Yellow River estuary during the growing season[J]. Research of Environmental Sciences, 2019, 32(6): 1052-1062. |
| [2] |
李家兵, 张党玉, 吴春山, 等. pH对闽江河口湿地沉积物氮素转化关键过程的影响[J]. 水土保持学报, 2017, 31(1): 272-278. LI Jia-bing, ZHANG Dang-yu, WU Chun-shan, et al. Effects of pH on the key nitrogen transformation processes of the wetland sediment in the Min River estuary[J]. Journal of Soil and Water Conservation, 2017, 31(1): 272-278. |
| [3] |
王雨, 祝贵兵. 水陆交错带氮循环热区效应与厌氧氨氧化过程[J]. 生物产业技术, 2015, 3(5): 30-34. WANG Yu, ZHU Gui-bing. Thermal zone effect of nitrogen cycle and anaerobic ammonia oxidation process in land/inland water ecotones[J]. Biotechnology and Business, 2015, 3(5): 30-34. |
| [4] |
牛翠云, 王树涛, 郭艳杰, 等. 白洋淀湿地芦苇型水陆交错带土壤氮素形态变化和N2O排放特征及氮储量研究[J]. 河北农业大学学报, 2017, 40(3): 72-79. NIU Cui-yun, WANG Shu-tao, GUO Yan-jie, et al. Studies on variation characteristics of soil nitrogen forms, nitrous oxide emission and nitrogen storage of the Phragmites australis-dominated land/inland water ecotones in Baiyangdian wetland[J]. Journal of Agricultural University of Hebei, 2017, 40(3): 72-79. |
| [5] |
张来甲, 叶春, 李春华, 等. 沉水植物腐解对水体水质的影响[J]. 环境科学研究, 2013, 26(2): 145-151. ZHANG Lai-jia, YE Chun, LI Chun-hua, et al. The effect of submerged macrophytes decomposition on water quality[J]. Research of Environmental Sciences, 2013, 26(2): 145-151. |
| [6] |
亓鹏玉, 刘金明. 挺水植物芦苇的腐解对水体水质的影响[J]. 环境工程技术学报, 2016, 6(6): 591-599. QI Peng-yu, LIU Jin-ming. The influence of bulrush litter decomposition on water quality[J]. Journal of Environmental Engineering Technology, 2016, 6(6): 591-599. DOI:10.3969/j.issn.1674-991X.2016.06.085 |
| [7] |
刘彪, 杨晓玉, 孙华鹏. 芦苇腐解对白龟湖湿地水质的影响研究[J]. 河南城建学院学报, 2016, 25(5): 61-67. LIU Biao, YANG Xiao-yu, SUN Hua-peng. Decomposition of Phragmites australis and its influence on water quality of Baigui Lake wetland[J]. Journal of Henan University of Urban Construction, 2016, 25(5): 61-67. |
| [8] |
唐金艳, 曹培培, 徐驰, 等. 水生植物腐烂分解对水质的影响[J]. 应用生态学报, 2013, 24(1): 83-89. TANG Jin-yan, CAO Pei-pei, XU Chi, et al. Effects of aquatic plants during their decay and decomposition on water quality[J]. Chinese Journal of Applied Ecology, 2013, 24(1): 83-89. |
| [9] |
Olson J S. Energy storage and the balance of producers and decomposers in ecological systems[J]. Ecology, 1963, 44(2): 322-331. DOI:10.2307/1932179 |
| [10] |
藕翔, 崔康平, 汤海燕, 等. 不同水环境下苦草腐解对水质的影响[J]. 环境科学研究, 2017, 30(10): 1553-1560. OU Xiang, CUI Kang-ping, TANG Hai-yan, et al. Impacts of decomposition of Vallisneria natans on nutrient speciation concentration in two kinds of water environments[J]. Research of Environmental Sciences, 2017, 30(10): 1553-1560. |
| [11] |
杨飞, 姚佳, 张毅敏, 等. 温度对沉水植物腐解释放DOM及微生物群落多样性的影响[J]. 中国环境科学, 2018, 38(10): 3904-3913. YANG Fei, YAO Jia, ZHANG Yi-min, et al. Research on the dissolved organic matter and microbial community diversity of submerged macrophytes decomposed under different temperature[J]. China Environmental Science, 2018, 38(10): 3904-3913. DOI:10.3969/j.issn.1000-6923.2018.10.038 |
| [12] |
付贤钟, 崔康平, 藕翔, 等. 不同生物量苦草残体腐解对水体水质的影响[J]. 净水技术, 2018, 37(1): 123-128. FU Xian-zhong, CUI Kang-ping, OU Xiang, et al. Effect of residues decomposition of Vallisneria natans on water quality under different biomass levels in water body[J]. Water Purification Technology, 2018, 37(1): 123-128. |
| [13] |
Taylor B R, Parkinson D. Nitrogen and lignin content as predictors of litter decay rates:A microcosm test[J]. Ecology, 1989, 70(1): 97-104. DOI:10.2307/1938416 |
| [14] |
Berg B, Staaf H. Decomposition rate and chemical changes of Scots pine needle litter[J]. Ecological Bulletins, 1980, 32(32): 363-372. |
| [15] |
周林飞, 关秀婷, 王铁良. 几种水生植物对湿地底泥中营养物质含量变化的影响[J]. 水土保持学报, 2016, 30(1): 278-284. ZHOU Lin-fei, GUAN Xiu-ting, WANG Tie-liang. Influence of several aquatic plants on nutrient content in bottom mud of wetland[J]. Journal of Soil and Water Conservation, 2016, 30(1): 278-284. |
| [16] |
李倩, 田翠翠, 肖邦定. 黑藻根际对沉积物中氨氧化细菌和古菌的影响[J]. 环境工程学报, 2014, 8(10): 4209-4214. LI Qian, TIAN Cui-cui, XIAO Bang-ding. Effect of Hydrilla verticillata rhizosphere on ammonia oxidizing bacteria and archaea in sediment[J]. Chinese Journal of Environmental Engineering, 2014, 8(10): 4209-4214. |
| [17] |
李菲菲, 褚淑祎, 崔灵周, 等. 沉水植物生长和腐解对富营养化水体氮磷的影响机制研究进展[J]. 生态科学, 2018, 37(4): 225-230. LI Fei-fei, CHU Shu-yi, CUI Ling-zhou, et al. Research advances on the influence mechanisms of submerged plants growth and decomposition on nitrogen and phosphorus in eutrophic water[J]. Ecological Science, 2018, 37(4): 225-230. |
| [18] |
曹培培, 刘茂松, 唐金艳, 等. 几种水生植物腐解过程的比较研究[J]. 生态学报, 2014, 34(14): 3848-3858. CAO Pei-pei, LIU Mao-song, TANG Jin-yan, et al. A comparative study on the decomposition processes among some aquatic plants[J]. Acta Ecologica Sinica, 2014, 34(14): 3848-3858. |
| [19] |
汤志凯, 张毅敏, 杨飞, 等. 3种水生植物腐解过程中磷营养物质迁移、转化过程研究[J]. 环境科学学报, 2019, 39(3): 716-721. TANG Zhi-kai, ZHANG Yi-min, YANG Fei, et al. Migration and transformation of phosphorus nutrients in the decomposition process of three aquatic plants[J]. Acta Scientiae Circumstantiae, 2019, 39(3): 716-721. |
| [20] |
Fog K. The effect of added nitrogen on the rate of decomposition of organic matter[J]. Biological Reviews, 2010, 63(3): 433-462. |
| [21] |
曹勋, 韩睿明, 章婷曦, 等. 冬季水生植物分解过程及其对水质的影响研究[J]. 农业环境科学学报, 2015, 34(2): 361-369. CAO Xun, HAN Rui-ming, ZHANG Ting-xi, et al. Decomposition of aquatic plants during winter and its influence on water quality[J]. Journal of Agro-Environment Science, 2015, 34(2): 361-369. |
| [22] |
王瑾, 黄建辉. 暖温带地区主要树种叶片凋落物分解过程中主要元素释放的比较[J]. 植物生态学报, 2001, 25(3): 375-380. WANG Jin, HUANG Jian-hui. Comparison of major nutrient release patterns in leaf litter decomposition in warm temperate zone of China[J]. Acta Phytoecologica Sinica, 2001, 25(3): 375-380. DOI:10.3321/j.issn:1005-264X.2001.03.019 |
| [23] |
Melillo J M, Aber J D, Muratore J F. Nitrogen and lignin control of hardwood leaf litter decomposition dynamics[J]. Ecology, 1982, 63(3): 621-626. DOI:10.2307/1936780 |
| [24] |
杨继松, 刘景双, 于君宝, 等. 三江平原沼泽湿地枯落物分解及其营养动态[J]. 生态学报, 2006, 26(5): 1297-1302. YANG Ji-song, LIU Jing-shuang, WANG Jun-bao, et al. Decomposition and nutrient dynamics of marsh litter in the Sanjiang Plain, China[J]. Acta Ecologica Sinica, 2006, 26(5): 1297-1302. DOI:10.3321/j.issn:1000-0933.2006.05.001 |
| [25] |
Hernes P J, Benner R, Cowie G L, et al. Tannin diagenesis in mangrove leaves from a tropical estuary:A novel molecular approach[J]. Geochimica Et Cosmochimica Acta, 2001, 65(18): 3109-3122. DOI:10.1016/S0016-7037(01)00641-X |
| [26] |
温达志, 魏平, 张佑昌, 等. 鼎湖山南亚热带森林细根分解干物质损失和元素动态[J]. 生态学杂志, 1998, 17(2): 1-6. WEN Da-zhi, WEI Ping, ZHANG You-chang, et al. Dry mass loss and chemical changes of decomposed fine roots in three China south subtropical forests at Dinghushan[J]. Chinese Journal of Ecology, 1998, 17(2): 1-6. DOI:10.3321/j.issn:1000-4890.1998.02.001 |
| [27] |
陈韬, 张本, 李剑沣, 等. 几种生物滞留植物对雨水中营养物的吸收动力学特征[J]. 环境工程, 2018, 36(9): 21-25. CHEN Tao, ZHANG Ben, LI Jian-feng, et al. Absorption kinetics of nutrient in stormwater by several bioretention plants[J]. Environmental Engineering, 2018, 36(9): 21-25. |
 2019, Vol. 38
2019, Vol. 38