20世纪末期,由于生产生活中大量排放氟氯烃类化合物,平流层臭氧层开始变得稀薄,导致了到达地表的紫外线强度增加[1]。近年来,得益于《蒙特利尔条约》的签订,氟氯烃类化合物被限制使用,臭氧层衰减速度减慢[1]。但部分地区地表UV-B辐射仍在增强[2]。地表UV-B辐射增强会影响植物的生长发育、生理代谢和紫外吸收物质[3]。植物通过增加黄酮类物质含量抵御UV-B辐射侵害[4]。研究表明UV-B辐射对植物的生长效应具有双重性,低强度的UV-B辐射可以作为调控因子,超过植物耐受度则表现为胁迫因子[5]。适量补充UV-B辐射,可以作为信号调节因子,通过高等植物的UV-B受体(UV resistance locus 8,UVR8)激活体内修复机制[6]。
原花青素是一种紫外吸收物质,主要由黄酮-3-醇单元(儿茶素、表儿茶素及其3-O-没食子酸酯和表没食子酸酯)组成的聚合酚类化合物[7]。类黄酮代谢途径可以生产黄酮醇、花青素和原花青素[8]。目前研究主要集中在UV-B辐射对花青素[9]和总黄酮[10]的影响,关于UV-B辐射对原花青素影响的研究较少。原花青素具有极强的抗氧化活性和自由基清除功能,能够防治因自由基引起的心血管疾病[11]、糖尿病[12]、阿尔兹海默症[13]、炎症[14]等疾病。被广泛应用于食品、保健品、药品和化妆品等领域,是极具市场开发价值和经济价值的天然产物,近年来,原花青素已成为国内外研究的热点。已有研究表明UV-B辐射可以诱导植物体内的原花青素合成,并且原花青素在植物器官和组织中的含量呈动态变化[15],已有研究表明原花青素在葡萄中主要分布在果皮和种子中[16]。但是不同UV-B辐射强度下植物体内的原花青素含量的变化特征、植物体内原花青素的分布特征鲜有报道。
稻米是我国传统主食之一,目前中国的水稻种质资源中,有10%左右属于有色稻,其中红米稻种质有8963份,占有色稻的首位[17]。红米中富含大量花青素、原花青素等生物活性物质[18],目前,大多数的研究都关注与蓝莓[19]、葡萄[20]等水果中的原花青素含量,对水稻中原花青素的研究较少。为了明确地表UVB辐射增强对水稻的生长发育和原花青素含量与分布的影响,本研究以元阳梯田传统稻种“白脚老粳”为材料,通过原位种植模式下增加不同强度的UV-B辐射,研究不同UV-B辐射强度对红米生长和籽粒中原花青素含量和分布的变化特征,为研究UV-B辐射对籽粒中原花青素含量和分布的影响提供理论依据。
1 材料与方法 1.1 试验地概况试验地位于云南省红河州元阳县新街镇箐口村(23°07′ N、102°44′ E),该地区海拔高度为1600 m,UV-B辐射背景强度为10 kJ·m-2·d-1。当地土壤为水耕人为土,土壤pH值为6.45,有机质含量为26.8 g· kg-1,全N为2.48 g·kg-1,全P为0.74 g·kg-1,全K为6.03 g·kg-1,碱解N为67.9 mg·kg-1,速效P为20.5 mg· kg-1,速效K为150.7 mg·kg-1。种植的水稻品种为白脚老粳,种子由云南省红河州元阳县新街镇农科站提供,白脚老粳在当地已有300多年的种植历史,是目前主要的培育品种之一。
1.2 试验设计水稻种植处理:白脚老粳于2017年3月20日播种育苗,5月15日移栽至试验小区。试验点共布置12个小区,每个小区面积为390 cm×225 cm,小区间隔50 cm,每个小区种植10行水稻,每行10株,行距30 cm,株距15 cm,每丛为一株秧苗,外围设置保护行(2行3列)。在水稻生长期内不使用任何化肥和农药,整个生育期处于淹水状态。
UV-B辐射处理:每行水稻上方安装一个可调节长度的灯架,架设UV-B灯管(40 W,波长280~320 nm,上海顾村仪器厂提供),用UV-B辐射测定仪(北京师范大学光电仪器厂提供)测定水稻植株顶端辐射强度。设自然光(0 kJ·m-2·d-1)和UV-B辐射(2.5、5.0、7.5 kJ·m-2·d-1)4组处理,分别相当于当地0%、10%、20%、30%的臭氧衰减。每日辐照时间为7 h(10:00—17:00),阴天或雨天不进行UV-B辐射处理。随着水稻的生长调节灯架高度,保持辐射强度不变。6月25日水稻抽穗期开始照灯,9月28日收获水稻后停止试验。
1.3 指标测定 1.3.1 生长指标9月28日水稻收获后,对水稻千粒质量、生物量、产量、粒长、粒宽、籽粒长宽比进行测量。每个小区随机取10株水稻测定千粒质量、生物量、粒长、粒宽并计算长宽比,测量方式为常规测量。籽粒收获后经自然风干再测定产量。
每株籽粒生物量的测定:待收获时,用自来水将水稻籽粒轻轻的冲洗干净,然后在通风且无阳光直射的室内自然风干。装入牛皮纸袋内,放入烘箱在80 ℃烘至恒质量。烘干时,每隔24 h测定一次直到质量恒定,迅速称量烘干后的籽粒质量。
1.3.2 原花青素含量的测定参照刘连新等[21]的方法,用高效液相色谱法(HPLC)测定原花青素含量。色谱条件:色谱柱为Diamonsil C18柱(4.6 mm×250 mm,5 μm);流动相为甲醇:水:乙腈=75:5:20;流速:1.0 mL·min-1;紫外检测波长:280 nm;进样量:20 μL;柱温:室温。
对照品溶液的制备:精密称取原花青素对照品0.002 5 g,置于25 mL容量瓶中,先用部分甲醇溶解,超声10 min,定容,超声,用0.25 μm微孔滤膜过滤,得100 μg·mL-1的对照品贮备溶液。
样品溶液的配制:将白脚老粳的稻壳和糙米分离,分别取稻壳和糙米样品1.500 0 g,切碎,加入不低于80%的甲醇15 mL,加入磷酸调节pH=3.5,温度控制在80 ℃,微波提取45 min。过滤提取液体,取上清液0.5 mL,用甲醇稀释到50 mL。样品用0.25 μm的微孔滤膜过滤,得待测样品溶液,装入样品瓶中,备用。
标准曲线的绘制:分别精密移取对照品溶液1.00、2.00、3.00、4.00 mL,分别置于5 mL的棕色容量瓶中用甲醇稀释,超声,定容,用0.25 μm微孔滤膜过滤,注入样品瓶。按照上述液相方法测定,记录峰面积。以对照品进样浓度(X,μg·mL-1)为横坐标、峰面积(Y)为纵坐标,绘制标准曲线。
1.3.3 红米籽粒石蜡切片的制作参照康海岐等[22]的方法,并进行改进,具体操作步骤如下:
取水稻籽粒分别进行横切(垂直于芒和小穗轴连线切开)和纵切(水平于芒和小穗轴连线切开),切成数段后依次放入5%、10%、20%、30%、50%、70%的酒精中各5 min,最后将材料放入FAA固定液中(每100 mL含38%甲醇5 mL、冰醋酸5 mL、70%酒精90 mL)中保存。将固定好的材料依次用70%、80%、90%、95%的酒精脱水30 min,最后用纯酒精脱水2 h(重复3次)。取脱水后的材料,依次放入1: 2、1: 1、2:1的二甲苯:酒精中各浸泡3 h,然后转入纯二甲苯中浸泡6 h(重复2次)。从二甲苯中取出材料,放入融化的石蜡(60 ℃)中恒温浸蜡2 h(重复3次),必须保持恒温,并且温度不能过高。浸蜡后,将材料封入蜡块中。将包埋的材料经过修整后,使用专用切片机(LEICA RM 2016)切成厚度为3 μm的连续切片。在切片过程中,向材料中心处喷少量水,快速切片可以防止中心淀粉部分脱落,将切片放入水中,然后用载玻片捞取。将有材料的载玻片放入纯二甲苯中30 min(重复3次),然后依次在100%、95%、90%、80%、70%、60%、50%、30%、0的酒精中清洗15 min。放入脱色剂(乙醇:冰乙酸=3:1)中脱色,再放入0.1% 4-(二甲基氨基)肉桂醛(DMACA)染剂中染色,后依次放入0、30%、50%、60%、70%、80%、90%、95%、100%酒精中清洗15 min。DMACA染剂(0.1%)的配制:称取0.05 g DMACA加入50 mL的酸化乙醇中(现配)。酸化乙醇:将36%浓盐酸(12.5 mL)、12.5 mL蒸馏水和75 mL乙醇(91%)混合,18~25 ℃中保存。粘片:取出染色后的拨片,立即用中性树胶封固成永久切片,然后放入40 ℃烘箱中烘48 h。观察:在光学显微镜下观察(YS100,Nikon Japan),并拍照。
1.4 数据统计分析使用Microsoft Excel对数据进行整理,计算平均值和方差。使用统计软件SPSS 20通过单因素差异分析,采用Duncan检验法,P < 0.05水平进行处理间的差异性分析。用Origin 9.1作图。
2 结果与分析 2.1 不同UV-B强度对白脚老粳籽粒形态的影响UV-B辐射会影响白脚老粳籽粒形态(表 1)。随着UV-B辐射强度的增加,白脚老粳的粒长、粒宽、千粒质量、籽粒生物量和产量,都出现不同程度的下降。UV-B辐射增强使籽粒粒长显著降低。不同UV-B辐射间差异没有达到显著水平,在7.5 kJ·m-2·d-1时粒长降幅达到了最大11.6%。UV-B辐射为2.5 kJ·m-2·d-1和5.0 kJ·m-2·d-1时白脚老粳的粒宽无显著变化,当UV-B辐射强度增加到7.5 kJ·m-2·d-1时,粒宽显著降低了7.8%。在不同UV-B辐射处理下,只有2.5 kJ· m-2·d-1时籽粒长宽比与自然光照下存在显著差异,降幅为8.7%。千粒质量和每株籽粒生物量随着UV-B辐射增强持续降低,当UV-B辐射增加到2.5 kJ·m-2· d-1时千粒质量和每株籽粒生物量显著降低,伴随着UV-B辐射强度增加,抑制效应更加明显,当UV-B辐射强度增加到7.5 kJ · m-2 · d-1时,千粒质量降低36.1%,每株籽粒生物量下降44.5%。UV-B辐射增强,水稻产量显著降低,但是不同UV-B辐射间差异没有达到显著水平,在7.5 kJ·m-2·d-1时产量降幅达到最大22.8%。
|
|
表 1 不同UV-B辐射强度对白脚老粳生长的影响 Table 1 Effect of different UV-B radiation intensities on the growth of the "baijiaolaojing" |
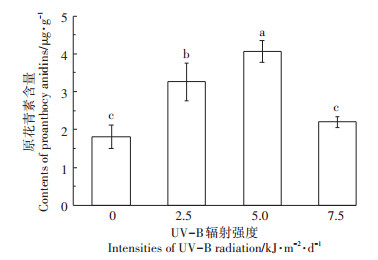
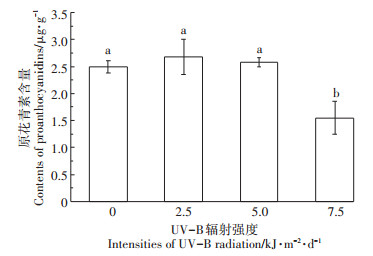
白脚老粳稻壳和糙米中原花青素含量随着UVB辐射强度变化而变化。如图 1所示,稻壳中原花青素含量随着UV-B辐射增加先增后减,在5.0 kJ·m-2· d-1时稻壳中原花青素含量达到最大值4.06 μg·g-1,相对于自然光照下增加了124.7%。随着UV-B辐射强度的继续增加,当辐射强度达到7.5 kJ·m-2·d-1时,稻壳中原花青素含量显著降低,稻壳中原花青素含量与自然光相比无显著差异,比7.5 kJ·m-2·d-1显著降低了45.9%。这说明UV-B辐射对水稻稻壳中原花青素含量有着低强度促进,高强度抑制的效果。如图 2所示,糙米中原花青素含量在2.5 kJ·m-2·d-1与5.0 kJ· m-2·d-1 UV-B辐射强度下无显著变化,当UV-B辐射强度增加到7.5 kJ·m-2·d-1时,糙米中原花青素含量显著降低,降幅为37.9%。低强度UV-B辐射(2.5 kJ·m-2·d-1和5.0 kJ·m-2·d-1)对糙米中原花青素含量无影响,但是高UV-B辐射(7.5 kJ·m-2·d-1)下糙米中原花青素含量显著降低。
|
不同小写字母表示处理间差异显著(P < 0.05)。下同 Different lowercase letters indicate significant differences among different treatments (P < 0.05). The same below 图 1 不同UV-B辐射对水稻稻壳中原花青素含量的影响 Figure 1 Effect of different UV-B radiations on proanthocyanidins content in husk of rice |
|
图 2 不同UV-B辐射对水稻糙米中原花青素含量的影响 Figure 2 Effects of different UV-B radiations on proanthocyanidins content in brown of rice |
水稻籽粒中的原花青素分布如图 3所示,原花青素主要聚集在果皮中以及胚乳周边;越靠近中心区域,原花青素分布越少。不同强度UV-B辐射下,籽粒中原花青素分布都呈现由外到内,逐渐减少的规律。但是,UV-B辐射对原花青素的面积占比有显著影响(图 4)。对水稻籽粒进行横切后发现,UV-B辐射在水平层面上会促进原花青素的分布,在2.5 kJ· m-2·d-1 UV-B辐射强度下,原花青素面积占比都显著上升,增幅为39.5%,占比达到31.8%。但是对籽粒进行纵切后发现,UV-B辐射在垂直层面上会抑制原花青素的分布,在5.0 kJ·m-2·d-1和7.5 kJ·m-2·d-1的条件下,原花青素面积占比都显著降低,降幅分别为24%和32.5%。自然光照下,原花青素占比最大,达到了22.8%,7.5 kJ·m-2·d-1时籽粒原花青素占比最小,仅有15.4%。不同UV-B辐射强度处理下,原花青素在水平层面占比全部显著大于垂直层面占比。

|
图中红色部位为原花青素 The red part in the picture is proanthocyanidins 图 3 水稻籽粒中原花青素分布示意图 Figure 3 Schematic diagram of proanthocyanidins distribution in rice grains |

|
图 4 不同UV-B辐射下水稻籽粒中原花青素分布 Figure 4 Schematic diagram of proanthocyanidins distribution in rice grains |
UV-B辐射作为非生物因子对水稻籽粒形态和原花青素含量有显著影响。水稻籽粒形态是受多基因、多途径调控的复杂形状[23]。本研究发现UV-B辐射会影响籽粒的粒长、粒宽和粒质量。UV-B辐射对水稻籽粒形态的影响机理尚不明确。UV-B辐射可以影响基因的表达,高等植物的UV-B受体UVR8可以感知到UV-B信号[24],在植物没有受到UV-B照射时,UVR8在细胞核与细胞质中以二聚体的形式存在,在接受到UV-B信号后,UVR8从细胞质中转移到细胞核中,与组成型光形态建成1(Constitutively photomorphogenic 1,COP1)蛋白发生作用,开启UV-B信号通道,引起下游应答和转录调节[25-26],从而影响籽粒形态。也可能是增强UV-B辐射使植物体内发生强烈的自由基反应,产生大量的自由基,伤害植物光系统Ⅱ,使净光合速率降低,同时脱落酸(ABA)的含量升高,可抑制光合作用,引起植株光合能力下降,降低生物量[27],从而影响籽粒形态。
UV-B辐射能导致作物植株有效穗数、穗总粒数、结实率、千粒质量下降,最终导致产量下降[28]。农作物产量是评估臭氧衰减影响的关键指标,UV-B辐射改变了作物群体的形态特征和产量的形成过程,最终导致产量降低。在大田或温室条件下,增强UV-B辐射都会影响作物的产量,大多数研究结果是增强UV-B辐射使作物产量降低[29],但也有报道表明增强UV-B辐射对作物产量没有影响或使作物产量显著增高[30]。本试验中,增强UV-B辐射使得白脚老粳水稻产量降低,符合大多数研究结果,说明水稻在抵御外界胁迫、提高自身抗性的同时,消耗了生长所需的能量和水稻发育早期阶段用于合成蛋白质的光合产物[29],最终导致水稻产量下降。
环境因素会诱导植物中原花青素合成,过高或过低的条件都达不到诱导作用[31]。本研究中,在5.0 kJ· m-2·d-1 UV-B辐射增强效果下,稻壳中原花青素含量显著增加,而糙米中原花青素含量无显著变化,稻壳作为稻米外层覆盖物可以保护内部不受外界生物作用和非生物作用[32],当UV-B辐射增加到7.5 kJ·m-2· d-1时,稻壳和糙米中原花青素含量都显著降低。这可能是UV-B辐射强度过大,超过了稻壳耐性范围,稻壳失去了保护能力,所以稻壳和糙米中原花青素都显著降低。在一定温度范围(10~15 ℃)内,温差越大,温度越低,黑果枸杞中原花青素含量就越大[33]。温度超过这个范围后,原花青素含量显著降低。异常温度和UV-B辐射都属于逆境,植物在逆境中会促进原花青素合成,超过耐性范围后,原花青素含量开始下降。原花青素代谢途径的关键酶之一是黄烷酮- 3-羟化酶(Flavanone3-hydroxylase,F3H),处于类黄酮生物合成途径中的分叉点。研究发现,荒漠植物红砂在增强的UV-B辐射胁迫下类黄酮代谢途径的关键酶F3H的活性先显著升高后显著降低,但仍显著高于处理前水平。这表明UV-B辐射诱导了类黄酮生物合成途径中酶活性的增强,合成大量的类黄酮物质,参与抗氧化反应,提高植物在UV-B辐射胁迫下的自我保护能力[34]。UV-B辐射可能诱导了白脚老粳稻壳中F3H酶、抗氧化酶活性的增强,稻壳中合成大量的原花青素,参与抗氧化反应。耿艳艳等[35]研究表明黑米中原花青素二聚体等物质的含量与其抗氧化活性高度相关,保护颖果,提高了水稻UV-B辐射胁迫下的自我保护能力。
原花青素在植物果实中的分布存在显著差异,芒果果皮中原花青素含量显著高于果肉中原花青素含量[36]。山葡萄果皮中原花青素含量随着果实成熟含量显著增加,而种子中原花青素含量随着果实成熟无显著变化[37]。本研究发现水稻籽粒原花青素主要分布在皮层和胚乳表层,也有研究表明有色稻的花青素主要沉积在果皮细胞中,但是在胚乳中未发现花青素沉积[38],而李凤英等[39]研究发现原花青素普遍存在于植物的皮、壳、核中。UV-B辐射增强对籽粒原花青素垂直分布和水平分布的影响应该与籽粒不同部位接受UV-B辐射不均匀有关,还有待进一步研究。
4 结论UV-B辐射增强会抑制水稻生长,对水稻籽实的粒长、粒宽、千粒质量、籽粒生物量和产量有显著影响。稻壳中原花青素含量在不同UV-B辐射下呈现单峰曲线;当UV-B辐射达到7.5 kJ·m-2·d-1时,对糙米中原花青素含量有显著降低作用。原花青素在水稻籽粒中呈现由外到内逐渐减少的规律,原花青素主要聚集在果皮和胚乳表层。UV-B辐射对水稻籽实中原花青素分布有显著影响,在垂直结构上,UV-B辐射增强会抑制原花青素面积占比,在水平结构上,UV-B辐射增强会促进原花青素面积占比。稻壳中原花青素含量随UV-B辐射呈抛物线关系,在增加5.0 kJ·m-2·d-1UV-B辐射处理下稻壳中原花青素含量达到最大4.06 μg·g-1,随后降低。糙米中原花青素含量在低强度UV-B辐射处理下无显著变化,在7.5 kJ· m-2·d-1时显著降低。
| [1] |
Hossaini R, Chipperfield M P, Montzka S A, et al. The increasing threat to stratospheric ozone from dichloromethane[J]. Nature Communications, 2017, 8: 15962. DOI:10.1038/ncomms15962 |
| [2] |
Ball W T, Alsing J, Mortlock D J, et al. Evidence for a continuous decline in lower stratospheric ozone offsetting ozone layer recovery[J]. Atmospheric Chemistry and Physics, 2018, 18(2): 1-36. |
| [3] |
何永美, 湛方栋, 徐渭渭, 等. 镉和UV-B辐射增强复合胁迫对冬小麦幼苗生长和生理的影响[J]. 农业环境科学学报, 2013, 32(3): 450-455. HE Yong-mei, ZHAN Fang-dong, XU Wei-wei, et al. Combined effects of Cd and enhanced UV-B radiation on growth and physiology of winter wheat seedling[J]. Journal of Agro-Environment Science, 2013, 32(3): 450-455. |
| [4] |
He Y M, Li X, Zhan F D, et al. Resistance-related physiological response of rice leaves to the compound stress of enhanced UV-B radiation and Magnaporthe oryzae[J]. Journal of Plant Interactions, 2018, 13(1): 321-328. DOI:10.1080/17429145.2018.1478007 |
| [5] |
Frohnmeyer H. Ultraviolet-B radiation-mediated responses in plants. Balancing damage and protection[J]. Plant Physiology, 2003, 133(4): 1420-1428. DOI:10.1104/pp.103.030049 |
| [6] |
Parul P, Samiksha S, Rachana S, et al. Changing scenario in plant UVB research:UV-B from a generic stressor to a specific regulator[J]. Journal of Photochemistry and Photobiology B:Biology, 2015, 153: 334-343. DOI:10.1016/j.jphotobiol.2015.10.004 |
| [7] |
Goufo P, Trindade H. Rice antioxidants:Phenolic acids, flavonoids, anthocyanins, proanthocyanidins, tocopherols, tocotrienols, γ-oryzanol, and phytic acid[J]. Food Science & Nutrition, 2014, 2(2): 75-104. |
| [8] |
Henry-Kirk R A, Plunkett B, Hall M, et al. Solar UV light regulates flavonoid metabolism in apple(Malus x domestica)[J]. Plant Cell and Environment, 2018, 41(3): 675-688. DOI:10.1111/pce.13125 |
| [9] |
齐艳, 邢燕霞, 郑禾, 等. UV-A和UV-B提高甘蓝幼苗花青素含量以及调控基因表达分析[J]. 中国农业大学学报, 2014, 19(2): 86-94. QI Yan, XING Yan-xia, ZHENG He, et al. UV-A and UV-B involved in induction and regulation of anthocyanin biosynthesis in cabbage[J]. Journal of China Agricultural University, 2014, 19(2): 86-94. |
| [10] |
何永美, 湛方栋, 祖艳群, 等. 大田条件下UV-B辐射对元阳梯田2个地方水稻品种硅、类黄酮和总酚含量的影响[J]. 农业环境科学学报, 2013, 32(8): 1500-1506. HE Yong-mei, ZHAN Fang-dong, ZU Yan-qun, et al. Effects of UVB radiation on the contents of silicon, flavonoids and total phenolic of two local rice varieties in Yuanyang Terrace under field conditions[J]. Journal of Agro-Environment Science, 2013, 32(8): 1500-1506. |
| [11] |
Downing L E, Edgar D, Ellison P A, et al. Mechanistic insight into nuclear receptor-mediated regulation of bile acid metabolism and lipid homeostasis by grape seed procyanidin extract(GSPE)[J]. Cell Biochemistry and Function, 2017, 35(1): 12-32. DOI:10.1002/cbf.3247 |
| [12] |
Sonia R, Martín María, Luis G. Effects of cocoa antioxidants in type 2 diabetes mellitus[J]. Antioxidants, 2017, 6(4): 84. DOI:10.3390/antiox6040084 |
| [13] |
汪琴, 杨燕, 王东, 等. 原花青素对Aβ25-35作用下PC12细胞的保护作用[J]. 中国病理生理杂志, 2018, 34(2): 294-299. WANG Qin, YANG Yan, WANG Dong, et al. Protective effect of procyanidins on PC12 cells exposed to Aβ25-35[J]. Chinese Journal of Pathophysiology, 2018, 34(2): 294-299. DOI:10.3969/j.issn.1000-4718.2018.02.017 |
| [14] |
Ogura K, Ogura M, Shoji T, et al. Oral administration of apple procyanidins ameliorates insulin resistance via suppression of pro-inflammatory cytokines expression in liver of diabetic ob/ob mice[J]. Journal of Agricultural and Food Chemistry, 2016, acs. jafc. 6b03424. |
| [15] |
杨俊枫, 史文君, 杨乐, 等. 紫外光对'北陆'越橘转色果花青苷积累、关键酶活性及其基因表达的影响[J]. 园艺学报, 2016, 43(4): 663-673. YANG Jun-feng, SHI Wen-jun, YANG Le, et al. Effects of UV irradiation on accumulation of anthocyanins and the activity, expression of key enzyme in veraison'northland'blueberry[J]. Acta Horticulturae Sinica, 2016, 43(4): 663-673. |
| [16] |
Cohen S D, Tarara J M, Gambetta G A, et al. Impact of diurnal temperature variation on grape berry development, proanthocyanidin accumulation, and the expression of flavonoid pathway genes[J]. Journal of Experimental Botany, 2012, 63(7): 2655-2665. DOI:10.1093/jxb/err449 |
| [17] |
全刚, 刘志. 有色稻研究现状[J]. 种子, 2017, 36(4): 51-53. QUAN Gang, LIU Zhi. Research status of colored rice[J]. Seed, 2017, 36(4): 51-53. DOI:10.3969/j.issn.1005-2690.2017.04.035 |
| [18] |
汤翠凤, 董超, 阿新祥, 等. 云南不同种皮色地方稻种的总黄酮含量及其对种子萌发的影响[J]. 植物遗传资源学报, 2016, 17(5): 883-888. TANG Cui-feng, DONG Chao, A Xin-xiang, et al. Flavonoids content of rice landraces with different seed coat color in Yunnan and their effects on seed germination[J]. Journal of Plant Genetic Resources, 2016, 17(5): 883-888. |
| [19] |
习霞, 明亮, 屠一锋. 电化学发光法测定蓝莓果酱中原花青素含量[J]. 分析试验室, 2019, 38(5): 519-522. XI Xia, MING Liang, TU Yi-feng. Determination of proanthocyanidins content in blueberry jam by electrochemiluminescence[J]. Chinese Journal of Analysis Laboratory, 2019, 38(5): 519-522. |
| [20] |
徐孟川, 李述刚, 丁玉松, 等. 葡萄籽原花青素提取物对砷诱导人肝细胞HL-7702损伤的保护作用及其机制[J]. 食品科学, 2018, 39(3): 176-181. XU Meng-chuan, LI Shu-gang, DING Yu-song, et al. Protective mechanism of grape seed proanthocyanidin extract against oxidative damage induced by arsenic in HL-7702 cells[J]. Food Science, 2018, 39(3): 176-181. |
| [21] |
刘连新, 刘郁, 何伟平, 等. 高效液相色谱法测定蓝莓干中的原花青素含量[J]. 食品研究与开发, 2016, 37(17): 121-123. LIU Lian-xin, LIU Yu, HE Wei-ping, et al. Determination of proanthocyanidin in blueberry by HPLC[J]. Food Research and Development, 2016, 37(17): 121-123. DOI:10.3969/j.issn.1005-6521.2016.17.029 |
| [22] |
康海岐, 常红叶, 许育彬, 等. 水稻籽粒胚乳的石蜡切片方法改良及其结构发育观察[J]. 西北植物学报, 2008(5): 1069-1074. KAN Hai-qi, CHANG Hong-ye, XU Yu-bin, et al. Improvement of paraffin section methods and structural observation to endosperm development of rice kernel[J]. Acta Botanica Boreali-Occidentalia Sinica, 2008(5): 1069-1074. DOI:10.3321/j.issn:1000-4025.2008.05.035 |
| [23] |
周梦玉, 宋昕蔚, 徐静, 等. 籼稻C84和粳稻春江16B重组自交系遗传图谱构建及籽粒性状QTL定位与验证[J]. 中国水稻科学, 2018, 32(3): 207-218. ZHOU Meng-yu, SONG Xin-wei, XU Jing, et al. Construction of genetic map and mapping and verification of grain Traits QTLs using recombinant inbred lines derived from a cross between indica C84 and japonica CJ16B[J]. Chinese Journal of Rice Science, 2018, 32(3): 207-218. |
| [24] |
Li Y Y, Mao K, Zhao C, et al. MdCOP1 ubiquitin E3 ligases interact with MdMYB1 to regulate light-induced anthocyanin biosynthesis and red fruit coloration in apple[J]. Plant Physiol, 2012, 160(2): 1011-1022. DOI:10.1104/pp.112.199703 |
| [25] |
Favory J J, Stec A, Gruber H, et al. Interaction of COP1 and UVR8 regulates UV-B-induced photomorphogenesis and stress acclimation in Arabidopsis[J]. EMBO Journal, 2009, 28: 591-601. DOI:10.1038/emboj.2009.4 |
| [26] |
Rizzini L, Favory J J, Cloix C, et al. Perception of UV-B by the Arabidopsis UVR8 protein[J]. Science, 2011, 332: 103-106. DOI:10.1126/science.1200660 |
| [27] |
徐佳妮, 雷梦琦, 鲁瑞琪, 等. UV-B辐射增强对植物影响的研究进展[J]. 基因组学与应用生物学, 2015, 34(6): 1347-1352. XU Jia-ni, LEI Meng-qi, LU Rui-qi, et al. Research progress on the effect of enhanced UV-B radiation on plants[J]. Genomics and Applied Biology, 2015, 34(6): 1347-1352. |
| [28] |
Kim H Y, Kobayashi K, Nouch I, et al. Enhanced UV-B radiation has little effect on growth. Vc values and pigments of pit grown ices(Oryza sativa) in the field[J]. Physiologia Plantarum, 1996, 96: 1-5. DOI:10.1111/j.1399-3054.1996.tb00175.x |
| [29] |
李想, 谢春梅, 何永美, 等. UV-B辐射与稻瘟病菌复合胁迫对元阳梯田水稻生长和光合特性的影响[J]. 农业环境科学学报, 2018, 37(4): 613-620. LI Xiang, XIE Chun-mei, HE Yong-mei, et al. Effects of complex UV-B radiation and Magnaporthe oryzae stresses on the growth and photosynthetic characteristics of rice in Yuanyang Terrace, China[J]. Journal of Agro-Environment Science, 2018, 37(4): 613-620. |
| [30] |
李元, 何永美, 祖艳群. 增强UV-B辐射对作物生理代谢、DNA和蛋白质的影响研究进展[J]. 应用生态学报, 2006, 17(1): 123-126. LI Yuan, HE Yong-mei, ZU Yan-qun. Effects of enhanced UV-B radiation on physiological metabolism, DNA and protein of crops:A review[J]. Chinese Journal of Applied Ecology, 2006, 17(1): 123-126. DOI:10.3321/j.issn:1001-9332.2006.01.025 |
| [31] |
潘红, 赖呈纯, 黄贤贵, 等. 不同处理对刺葡萄愈伤组织花青素和原花青素生物合成的影响[J]. 热带作物学报, 2018, 39(12): 2404-2409. PAN Hong, LAI Cheng-chun, HUANG Xian-gui, et al. Effects of different treatments on anthocyanins and procyanidins biosynthesis in spine grape callus[J]. Chinese Journal of Tropical Crops, 2018, 39(12): 2404-2409. DOI:10.3969/j.issn.1000-2561.2018.12.012 |
| [32] |
Estevez M, Vargas S, Castaño V M, et al. Silica nano-particles produced by worms through a bio-digestion process of rice husk[J]. Journal of Non-Crystalline Solids, 2009, 355(14): 844-850. |
| [33] |
刘翔, 乔梅梅, 吕国华. 采收时间气温对野生黑果枸杞花青素和原花青素的影响[J]. 农业与技术, 2018, 38(7): 1-5. LIU Xiang, QIAO Mei-mei, LÜ Guo-hua. Effects of harvest time and air temperature on anthocyanin and procyanidins in Lycium ruthenicum Murr.[J]. Agriculture and Technology, 2018, 38(7): 1-5. |
| [34] |
刘美玲, 曹波, 刘玉冰, 等. 红砂(Reaumuria soongorica)黄酮类物质代谢及其抗氧化活性对UV-B辐射的响应[J]. 中国沙漠, 2014, 32(2): 426-432. LIU Mei-ling, CAO Bo, LIU Yu-bing, et al. Responses of the flavonoid pathway and antioxidant ability to UV-B radiation stress in Reaumuria soongorica[J]. Journal of Desert Research, 2014, 32(2): 426-432. |
| [35] |
耿艳艳, 常世敏, 李卫霞, 等. 红米红花青素功效调查研究[J]. 北方农业学报, 2017, 45(6): 112-117. GENG Yan-yan, CHANG Shi-min, LI Wei-xia, et al. Investigation on the efficacy of anthocyanin in red kernel color[J]. Journal of Northern Agriculture, 2017, 45(6): 112-117. DOI:10.3969/j.issn.2096-1197.2017.06.21 |
| [36] |
谭琳, 周兆禧, 郭素霞, 等. '台农'、'红芒'芒果果皮和果肉原花青素含量差异及其生物学活性评价[J]. 分子植物育种, 2018, 16(14): 4802-4808. TAN Lin, ZHOU Zhao-xi, GUO Su-xia, et al. Proanthocyanidins content differences and its bioactivity evaluation of the peel and pulp of 'tainong'and'hongguifei'mango[J]. Molecular Plant Breeding, 2018, 16(14): 4802-4808. |
| [37] |
王新伟, 秦红艳, 赵滢, 等. 山葡萄种质资源原花青素分布及其含量动态变化[J]. 北方园艺, 2011(11): 12-16. WANG Xin-wei, QIN Hong-yan, ZHAO Ying, et al. The distribution and dynamic changes of procyanidin contents in Vitis amurensis germplasm resources[J]. Northern Horticulture, 2011(11): 12-16. |
| [38] |
柳敏, 王忠, 顾蕴洁. 有色稻颖果的发育和色素沉积[J]. 中国水稻科学, 2011, 25(4): 392-398. LIU Min, WANG Zhong, GU Yun-jie. Caryopsis development and anthocyanidin accumulation of colored rice[J]. Chinese Journal of Rice Science, 2011, 25(4): 392-398. DOI:10.3969/j.issn.1001-7216.2011.04.008 |
| [39] |
李凤英, 崔蕊静, 郑立红, 等. 植物中原花青素含量的分析测定[J]. 食品与发酵工业, 2004(5): 147-149. LI Feng-ying, CUI Rui-jing, ZHENG Li-hong, et al. Study on deter mination of contents of proanthocyanidins in plants[J]. Food and Fermentation Engineering, 2004(5): 147-149. DOI:10.3321/j.issn:0253-990X.2004.05.035 |
 2019, Vol. 38
2019, Vol. 38