2. 农业农村部环境保护科研监测所, 天津 300191
2. Agro-Environmental Protection Institute, Ministry of Agriculture and Rural Affairs, Tianjin 300191, China
生物炭(Biochar)是由作物秸秆、木屑、粪便等废弃生物质,在绝氧条件下经高温热解产生的黑色固态炭质,一般呈碱性[1]。具有比表面积大、孔径大[2]和离子交换量大[3]等特性的生物炭,不仅可以减少土壤中氮素的流失,减少N2O和CO2等气体的排放,而且具有长久的碳贮存能力[4]。生物炭丰富的孔隙结构可以吸附无机离子、可溶性有机物质及挥发性气体,为土壤中的微生物提供良好的栖息环境,从而改变微生物的群落结构[5-6]。土壤微生物作为土壤的重要组成成分,其群落结构与土壤化学循环密切相关,并且直接影响着土壤肥力[7]。已有研究表明,生物炭的多孔性结构能够显著增加土壤通气性,影响反硝化微生物组分,抑制硝态氮(NO3--N)的反硝化损失[8];生物炭表面富含有机阴离子官能团,负电荷伴随着芳环结构形成的多交换位点,使得生物炭具有较高的阳离子交换量(CEC),有利于吸附铵态氮(NH4+-N),减少NH4+-N的生物可利用性及其向NO3--N的转化[9]。但生物炭的种类和用量对土壤微生物数量及组成的影响以及微生物-土壤氮素养分循环之间的关联,仍是科学研究的难点。
磷脂脂肪酸(PLFA)是活体微生物细胞膜的主要成分,具有生物特异性,因此测定土壤PLFA可揭示土壤微生物量及其结构组成信息。近年来PLFA法也成为分析土壤微生物群落组成的常用方法[10]。Xu等[11]研究发现,玉米秸秆生物炭能够改变土柱淋溶试验后潮褐土中细菌群落结构组成。Bamminger等[12]通过37 d的培养试验发现,生物炭添加能显著提高微生物PLFA总含量和细菌类、真菌类PLFA含量。并且,已有研究发现,不同性质的生物炭添加到土壤中会被不同的微生物群落利用,其引起的微生物群落结构变化也存在明显的差异[13]。Ameloot等[14]研究发现添加生物炭(350 ℃热解柳树、猪粪)使土壤革兰氏阳性细菌和革兰氏阴性细菌的丰度增加。Farrell等[15]研究发现添加450 ℃热解小麦秸秆生物炭会极显著提高细菌生物量,而真菌则偏向利用桉树生物炭。
不同原料生物炭及其对土壤微生物群落结构的影响差异较大,这种差异可能与生物炭的组成结构、理化性质以及生物炭的用量有关[5, 16]。本研究选用原料差异较大的花生壳生物炭(PBC)、玉米秆生物炭(MBC)、杨木屑生物炭(ABC)以及竹屑生物炭(BBC),分别按0(对照)、20.0、40.0、80.0、160.0 g·kg-1施入华北地区菜地潮土,采用室内培养试验,测定不同处理对土壤微生物群落结构的影响。结合生物炭自身性质、土壤理化性质与微生物群落特征综合分析,研究不同原料生物炭、不同施入量对土壤及其微生物的影响及可能的作用机制,以期为生物炭的实际应用提供施生物炭土壤与微生物反馈作用的理论参考。
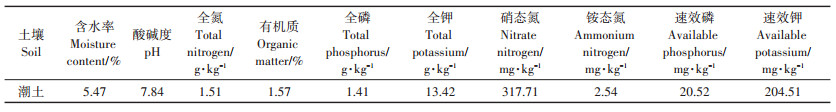
1 材料与方法 1.1 供试土壤性质供试土壤采集自天津西青区益利来生态农场(39°14′6″N,116°9′53.5″ E)设施大棚,种植作物为黄瓜等蔬菜。土样剔除动、植物残体后充分混合,过20目筛后待用。土壤基本理化性质如表 1所示。
|
|
表 1 土壤基本理化性质 Table 1 Basic physical and chemical properties of soil |
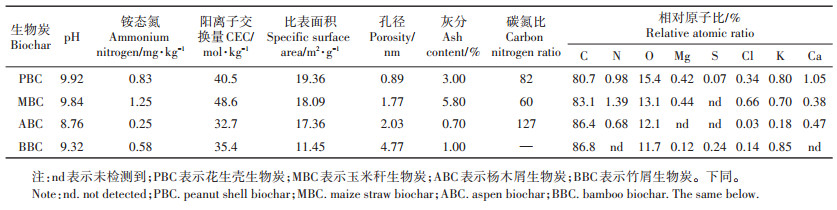
以宋婷婷等[17]试验为基础,用玉米秆、花生壳、杨木屑、竹屑四种生物质作为供试材料。收集玉米秆、花生壳、杨木屑和竹屑,将其风干、粉碎、研磨后过20目筛,于HBYQ马弗炉2200中通N2状态500 ℃烧制120 min,冷却至室温,过100目筛,干燥保存备用。不同材料制备的生物炭的理化性质如表 2、图 1和图 2所示。
|
|
表 2 生物炭理化性质与工业分析 Table 2 The proximate analysis and chemical properties of biochar |
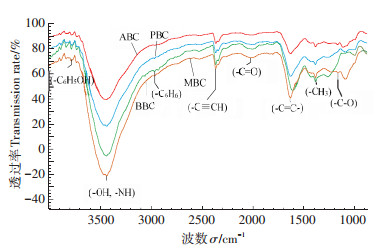
|
图 1 四种不同原料生物炭的傅里叶红外光谱图 Figure 1 FT-IR spectra of biochar of different raw materials |

|
图 2 四种不同原料生物炭的电镜扫描图(×2000倍) Figure 2 SEM (×2000 times) of different raw materials biochar |
土壤基本理化性质测定参照鲍士旦的《土壤农化分析》[18]。土壤pH值、电导率参照NY/T 1377—2007、HJ 802—2016进行测定。土壤NO3--N和NH4+-N浓度采用全自动连续流动分析仪(AA3,Bran + Luebbe Corp.)测定。生物炭pH值测定参考GB/T 12496.7—1999;阳离子交换量采用火焰分光光度计进行测定;生物炭的比表面积采用比表面积分析仪测定;灰分含量采用缓慢灰化法测定;挥发分的测定参照GB/T2001—2013;固定碳的计算方法为固定碳(%)=100-灰分-挥发分;生物炭相对原子含量(%)测定使用X射线光电子能谱(XPS)的方法。傅里叶变换红外光谱分析(FITR):用傅里叶变换红外光谱仪(Nicolet 380,Nicolet Corp.,美国)测定生物炭的红外光谱,采用KBr压片制样,扫描波数范围为400~4500 cm-1。扫面电镜图(SEM):采用TM-1000型扫描电镜(Hitachi,日本),冷场发射式,对生物炭进行表征。
1.4 培养试验称取100 g新鲜潮土,根据处理分别称取20.0、40.0、80.0、160.0 g·kg-1四种不同生物炭,混合均匀后置于平底玻璃筒中,每个处理3次重复。调节水分至田间持水量的45%,封口膜封口,并在封口膜中间留一个小孔,将其置于25 ℃恒温培养箱中培养45 d,用称重法定期校正土壤水分含量。在培养试验的1、3、6、9、14、20、30、45 d破坏性取样,测定土壤中的NO3--N和NH4+-N。培养结束后,测定微生物PLFAs。
1.5 PLFA测定土壤微生物群落结构分析采用PLFA方法进行分析[10]。称取冻干土样3 g加入氯仿:甲醇:柠檬酸= 1:2:0.8单相提取剂15.8 mL,室温振荡离心,收集上清液,二次振荡提取离心,合并上清液,加入柠檬酸缓冲液和氯仿,静置过夜后氯仿相(下层)氮气吹干。将脂类转移到SPE柱中,萃取纯化PLFA。利用安捷伦GC-MS(6890-5975C)检测样品。脂肪酸定量用内标法,十九脂肪酸甲酯(C19:0)作为内标,PLFA含量用nmol·g-1表示。根据不同微生物群落脂肪酸的分子结构和基团位置,Kulmatiski等[10]将微生物群落分为真菌、放线菌、细菌(革兰氏阳性菌G+和阴性菌G-)等,PLFA总量以检测得到的脂肪酸加和表示。不同类型脂肪酸和微生物的对应关系见表 3。
|
|
表 3 磷脂脂肪酸命名归属 Table 3 PLFA interpretations |
采用Excel 2016对数据进行处理,SPSS 22进行显著性分析、双因素方差Duncan's分析(Two-ways ANOVA)和相关性分析等比较生物炭种类与添加量对土壤微生物群落的影响,Origin Pro 2017作图,Canoco 5.0进行冗余分析排列诸多因素中对土壤微生物影响较大的理化指标。文中出现的数值均为平均值±标准误差。
2 结果与分析 2.1 生物炭对土壤pH值和电导率的影响添加生物炭对土壤pH值和电导率的影响均呈增加趋势,但因用量与种类不同,处理间差异显著。与对照相比,随生物炭用量增加,施入四种生物炭处理的土壤pH值和电导率均显著升高(表 4、表 5);土壤pH增幅在5.01%~7.19%,电导率增幅在- 7.60%~ 65.79%。其中MBC处理二者增幅最大,随着MBC添加量的增加,pH最高为8.35,同时土壤EC值由3.42 mS·cm-1升高到5.67 mS·cm-1,增幅达65.79%;而ABC和PBC处理对土壤pH值和EC值影响较小。
|
|
表 4 不同种类生物炭对土壤pH值的影响 Table 4 The effect of different types of biochar on soil pH |
|
|
表 5 不同种类生物炭对土壤电导率的影响(mS·cm-1) Table 5 The effect of different types of biochar on soil EC (mS·cm-1) |
如图 3所示,在培养初期,随生物炭用量的增加,供试潮土NO3--N含量显著降低。与对照时313.056 mg·kg-1的土壤NO3--N含量相比,160 g·kg-1不同生物炭处理的土壤NO3--N含量分别降低至201.1、149.8、125.2、177.0 mg·kg-1。在培养的9~14 d,对照与添加20~80 g·kg-1生物炭处理的土壤NO3--N含量呈快速下降趋势;而培养20 d后,各处理土壤NO3--N含量总体上稳定在200 mg·kg-1。其中培养初期,160 g·kg-1PBC处理土壤NO3--N含量下降幅度最大,为41.96%(图 3a);随培养时间延长,160 g·kg-1MBC、ABC和BBC处理呈持续下降趋势,其土壤NO3--N含量最低降至58.68、60.93、42.95 mg·kg-1,分别较对照降低69.98%、68.83%和78.02%。
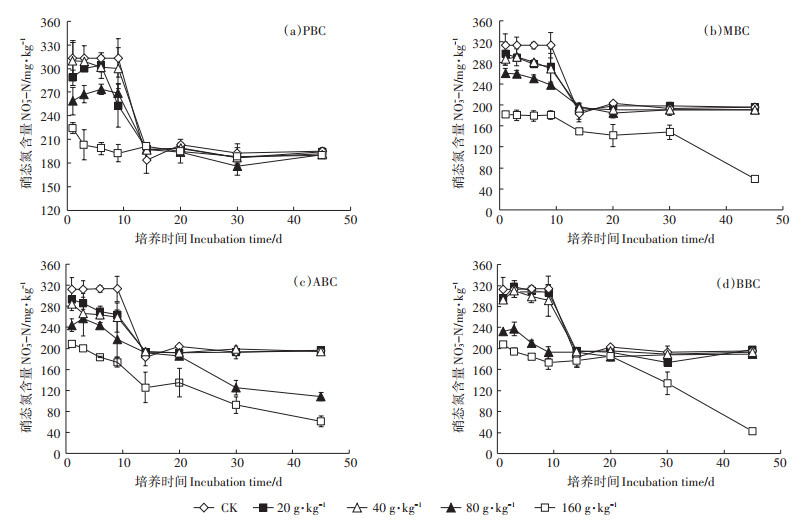
|
图 3 不同种类生物炭对土壤硝态氮含量的影响 Figure 3 The effect of different types of biochar on soil nitrite nitrogen |
由图 4可知,各处理土壤NH4+-N含量在1.6~4.8 mg·kg-1区间波动。与对照组相比,加入生物炭培养使各处理土壤NH4+-N含量随生物炭添加量的增加而显著降低,但随时间的延长,NH4+-N含量显著回升。培养45 d时,与对照相比,增幅最大的处理分别是160 g·kg-1时的PBC、20 g·kg-1时的MBC、40 g·kg-1时的ABC和40 g·kg-1时的BBC,增幅达159.2%、79.66%、35.02%和12.74%。
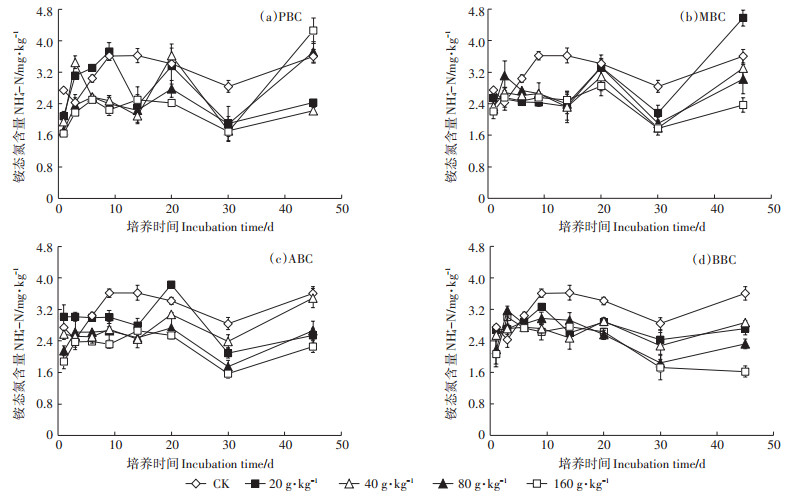
|
图 4 不同种类生物炭对土壤铵态氮含量的影响 Figure 4 The effect of different types of biochar on soil ammonium nitrogen |
土壤微生物PLFA总量及细菌、真菌、放线菌等土壤微生物群落组分PLFA表征结果(图 5)显示,供试PLFA碳原子数从14~22共26种PLFA被检测出,基于含量较高的PLFA进行微生物类型划分,发现供试土壤表现为细菌含量最高,其次为真菌和放线菌。添加生物炭的结果显示,不同种类生物炭对土壤微生物群落组成和结构,整体呈“低量促进,高量抑制”的趋势。其中施用PBC、MBC和ABC 20 g·kg-1和40 g· kg-1时可显著提高土壤微生物PLFA总量,PLFA总量最高;而BBC则对微生物PLFA总量表现出显著的抑制作用。

|
图 5 不同种类生物炭处理下土壤微生物群落组成变化 Figure 5 Change on microbial community by different biochar treatment |
进一步对细菌、真菌和放线菌等土壤微生物群落组分PLFA指标进行分析,结果显示,不同生物炭对土壤微生物各组分的影响显著,进而导致土壤微生物PLFAs总量和结构的变化。在20 g·kg-1和40 g·kg-1PBC处理中,细菌PLFA量极显著增加,分别较对照增幅为72.68%和34.3%,占该处理土壤微生物PLFA总量的58.51%和49.60%。而随PBC添加量的增加,细菌PLFA量在80 g·kg-1PBC处理快速降低,导致其真菌细菌比值在20 g·kg-1和40 g·kg-1时较小,80 g·kg-1添加下出现0.72的峰值(图 6)。
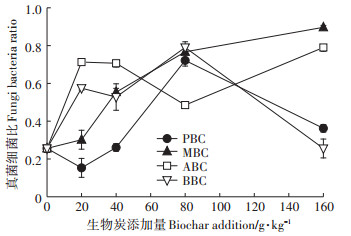
|
图 6 生物炭添加对土壤微生物群落结构(真菌细菌比)的影响 Figure 6 The effect of biochar to fungi-to-bacteria ratio |
ABC显著提高了真菌PLFA含量。其中,ABC添加量为20 g·kg-1和40 g·kg-1时,真菌PLFA量为9.35 nmol·g-1和8.55 nmol·g-1,占该处理土壤微生物PLFA总量的27.91%和30.29%,该添加量下的各生物炭处理相比,ABC真菌细菌比显著高于其他三种生物炭。
MBC是四种生物炭中唯一大幅度提高放线菌生物量的处理。20 g·kg-1添加量下,PLFA达到3.06 nmol·g-1,显著高于其他处理。BBC显著抑制了土壤细菌和真菌PLFA量,导致相同添加量下其土壤微生物PLFA总量显著低于其他处理。
2.4 生物炭种类与添加量对土壤微生物群落组分PLFA的影响由表 6可知,生物炭种类和添加量对土壤微生物群落总PLFA量,及其细菌、真菌、革兰氏阳性菌PLFA和真菌细菌比的影响显著,而对放线菌PLFA含量影响不显著。其中生物炭种类与添加量对细菌、真菌和真菌细菌比产生显著交互作用。生物炭种类和添加量均对革兰氏阳性菌产生了极显著的影响,但革兰氏阴性菌PLFA仅与生物炭种类显著相关,且交互作用不显著。
|
|
表 6 生物炭种类(B)与添加量(M)对土壤微生物群落影响的双因素方差分析 Table 6 Two-way-ANOVA for soil microbial community with biochar types (B) and addition content (M) |
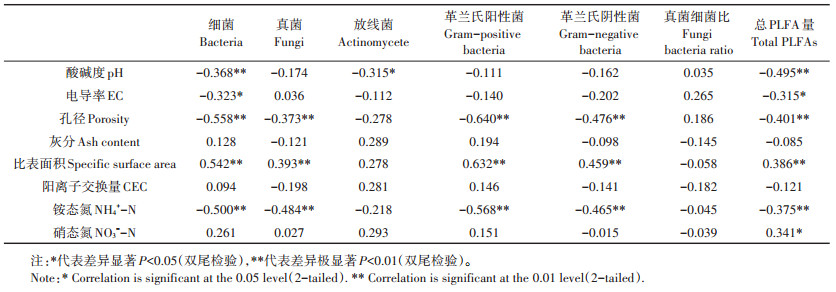
以土壤各菌群PLFA量作为生物样本,土壤和生物炭理化性质作为环境变量对各因素进行相关性分析(表 7)。结果显示,pH、EC、孔径、比表面积和矿质态氮含量是影响微生物PLFA总量的主要控制因素,其中,细菌PLFA含量与pH、EC、孔径、NH4+-N呈显著负相关,与比表面积呈显著正相关;真菌、革兰氏阳性、阴性菌PLFA含量和生物炭孔径及土壤NH4+-N呈显著负相关,与比表面积呈显著正相关;而放线菌PLFA含量与pH呈显著负相关。
|
|
表 7 皮尔逊相关性分析 Table 7 Pearson's correlations between microbial quantities and the properties of biochar and its amendment soils |
冗余参数如表 8所示,环境变量解释了总变量的82.52%,不同种类生物炭分布在不同象限,说明生物炭种类对土壤微生物群落组成的影响差异显著(图 7)。结果显示,PBC、ABC和20、40 g·kg-1MBC的添加提高土壤真菌、细菌、放线菌和革兰氏阴性菌、阳性菌PLFA含量,其中孔径、比表面积、CEC、灰分和矿质态氮是促进其土壤各菌群PLFA含量的主要控制因素;而BBC和80、160 g·kg-1MBC处理则降低土壤真菌、细菌、放线菌和革兰氏阴性菌、阳性菌PLFA含量,其中pH、EC、孔径是控制其土壤各菌群PLFA含量的主要控制因素。
|
|
表 8 冗余分析参数表 Table 8 Redundancy analysis summary table |
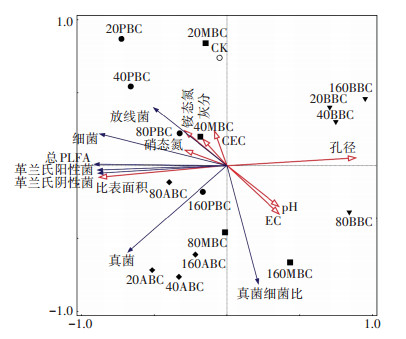
|
图 7 不同环境变量对微生物群落的影响 Figure 7 Effects of different environmental variables on microbial community |
生物炭具富碳、孔隙度高、表面负载官能团等特点,施入土壤通常会影响其理化性质,阻控养分淋失,同时扰动土壤微生物群落[1, 5]。诸多研究指出,生物炭制备过程产生的灰分物质,是导致土壤pH值和电导率升高的主要因素[3, 19-20]。由于生物炭灰分物质中含有Na、Ca和Mg等碱金属元素,且表面负载丰富的-COO-、-O-等有机阴离子官能团[21],故生物炭一般呈碱性。在本研究中,PBC、MBC、ABC、BBC的pH值分别为9.92、9.84、8.76和9.32;随着生物炭添加量的增加,土壤pH值升高(表 4)。这与Zhang等[22]和雷海迪等[23]的研究相近,其认为生物炭含有的碱性灰分物质多呈可溶态,增加土壤盐基饱和度,降低土壤交换性氢离子和铝离子的水平。但一些研究[24]也指出,潮土本身偏碱性,具有较高的盐基饱和度,且具有一定缓冲性,因此,生物炭对潮土pH值影响可能不显著。本研究供试潮土为连续种植的设施菜地土壤,其土壤pH值为7.79,明显低于文献[24]中的8.30的土壤pH。此外,本研究仅发现MBC对供试土壤pH值和电导率影响明显,MBC在四种生物炭中灰分最高,说明可能其本身含有较多的可溶性盐或在有机质分解的时候释放出矿质盐分,从而提高供试土壤电导率。
在快速热解条件下制备生物炭时,原材料花生壳、玉米秸秆、杨木屑及竹屑中的N、P、S等非金属元素会在该过程中挥发损失,因此,生物炭自身矿质态氮含量可忽略不计。前期研究指出[16],四种生物炭表面分布的含氧官能团(-OH、-C=O、-C-O)均参与了对NO3--N、NH4+-N的吸附。本研究中,添加MBC处理土壤NO3--N下降幅度最大,这可能与MBC参与NO3--N吸附的含氧官能团有关,从红外谱图中可以看出,与其他三种生物炭相比,MBC在3156~3800、1620 cm-1和1300~1000 cm-1处出现的醇羟基、芳香环羰基和醚类伸缩振动最为明显(图 1),一定程度说明了在MBC对NO3--N的吸附过程中,含氧官能团的参与作用更为显著。另一些研究指出生物炭对土壤矿质态氮变化的影响,也与生物炭可提供富含电子供体的有机物质及高碳氮比间接影响反硝化细菌的能量转化相关[25]。一方面,生物炭表面的阴离子含氧官能团通过络合或静电作用与Ca2+、Mg2+等金属离子结合形成金属桥,增加对土壤NO3--N的吸附潜力[22],另一方面这些官能团还可以提供丰富的电子供体与受体,促进土壤厌氧反硝化作用,进而导致土壤NO3--N含量的降低[26-27]。本研究培养初期,随各生物炭添加量增加,土壤NO3--N含量呈显著降低的趋势,与上述学者研究结果相似。而经过一段时间培养,土壤NO3--N含量趋于平稳,可能是因为生物炭逐渐向土壤底层沉积,或者是由于生物炭表面吸附不稳定态碳,使反应底物浓度降低的缘故[28]。
随生物炭的输入,土壤碳氮比和pH值的提高,一定程度上能改变土壤微生物碳氮利用率[29]。生物炭提高了土壤pH值,打破了土壤溶液中NH3与NH4+的转化平衡,碱性环境更利于NH4+向NH3转化[8],因此,本试验随生物炭用量的增加,培养初期土壤NH4+-N含量下降。韩光明[30]对潮土施加玉米芯生物炭的研究显示,添加生物炭明显提高氨氧化细菌与固氮微生物数量,加快对胺类碳源的利用。
本试验生物炭对土壤NO3--N与NH4+-N的影响与微生物变化相关。生物炭提高土壤含碳量、碳氮比、厌氧氨氧化菌活性,缩短了厌氧氨氧化反应时间,加快土壤速效氮的利用[31],本研究中供试BBC具有较高的碳氮比(表 2),同时其处理土壤NO3--N、NH4+-N含量更低(图 3、图 4);因此,生物炭对土壤理化性状的影响,不仅与生物炭自身属性和吸附特征相关,也与其他土壤微生物群落的扰动密切相关。
3.2 土壤微生物对四种生物炭的响应及其机制探讨生物炭的输入改变了土壤理化条件,影响土壤微生物的生存环境,进而影响微生物群落分布,引起土壤微生物群落变化[5]。本研究结果显示,PBC、MBC和ABC可显著提高土壤微生物PLFA含量,该结果与梁韵等[32]和张又弛等[33]的报道一致。研究表明,生物炭疏松、多孔的特殊表面结构以及自身易分解的成分,能够为微生物的生存提供栖息场所和养分来源,促进特定种类微生物的生长和繁殖[34]。
添加不同种类生物炭,能被不同的土壤微生物群落利用,其引起的微生物群落结构变化也存在显著差异[35]。有研究指出生物炭表面的氢键或静电作用能使细菌留在生物炭的孔隙中,不受土壤淋洗的影响,从而增加土壤细菌的数量[5, 36]。在本研究中,PBC有较大的比表面积,且PBC施入量为20 g·kg-1时细菌PLFA量达到最大,这可能与PBC有易产生氢键的灰分、合适的CEC及孔隙大小有关。
生物炭对真菌的影响与比表面积、孔径、含水量、pH、灰分、高碳氮比等因素密切相关[5, 37]。本试验PLFA结果显示,相同施用量下,ABC各处理真菌PLFA量总能保持较高水平,这可能是因为ABC的pH值、表面粗糙有序的孔隙和较大的孔径更适宜真菌定植。
放线菌能分泌胞外酶,参与复杂芳香类物质的降解过程[38],红外谱图显示,只有MBC在2000~1600 cm-1处有较明显的芳香族物质的泛频峰,说明MBC对芳香烃类基团有较强的吸附性,因此一定程度上可以促进利用该类物质的放线菌的生长。此外,BBC对微生物PLFA总量起显著抑制作用,通过电镜扫描与理化分析结果显示,与其他生物炭相比,BBC具有比表面积、CEC较小,孔径较大和表面结构不规则等特点,可能对微生物的生长繁殖和定植有不利影响[39]。真菌细菌比可以反映真菌和细菌相对含量的变
化及其相对丰富度,是判断土壤微生物群落结构的重要指标。本研究显示,与空白对照相比,除20 g·kg-1 PBC和160 g·kg-1 BBC处理外,其余生物炭处理的土壤真菌细菌比值显著增加,说明生物炭改善了土壤微生物群落结构,有利于土壤生态系统的稳定性[40]。
综上所述,不同种类生物炭和用量对土壤养分与微生物群落结构特征影响显著。因此需根据不同生物炭材料,考虑土壤微生物组成和结构,确定安全用量,为生物炭安全施用提供理论依据。此外,本试验为室内培养实验,后期也应该进一步开展长期田间试验,探索生物炭对土壤氮素行为和微生物群落之间的作用与机制。
4 结论(1)不同种类生物炭孔径、比表面积、CEC及灰分等自身理化性质的不同,显著影响土壤pH值和电导率,也直接影响土壤NO3--N与NH4+-N的动态变化。
(2)添加PBC、ABC、MBC可提高土壤微生物PLFA总量及真菌、细菌、放线菌和革兰氏阳性菌、阴性菌等组分的PLFA含量;而BBC则降低土壤微生物总PLFA含量及各组分PLFA含量。
(3)通过相关性和冗余分析可知,土壤pH、EC和矿质态氮含量,及孔径、比表面积和灰分等生物炭属性是影响各处理土壤PLFA总量和各菌群PLFA含量的主要控制因素。
| [1] |
Whitman T, Lehmann J. Biochar:One way forward for soil carbon in offset mechanisms in Africa?[J]. Environmental Science & Policy, 2009, 12(7): 1024-1027. |
| [2] |
Jośko I, Oleszczuk P, Pranagal J, et al. Effect of biochars, activated carbon and multiwalled carbon nanotubes on phytotoxicity of sediment contaminated by inorganic and organic pollutants[J]. Ecological Engineering, 2013, 60(11): 50-59. |
| [3] |
Tang J C, Zhu W Y, Kookana R, et al. Characteristics of biochar and its application in remediation of contaminated soil[J]. Bioscience and Bioengineering, 2013, 116(6): 653-659. DOI:10.1016/j.jbiosc.2013.05.035 |
| [4] |
Lehmann J. A handful of carbon[J]. Nature, 2007, 447(10): 143-144. |
| [5] |
Lehmann J, Rillig M C, Thies J, et al. Biochar effects on soil biota:A review[J]. Soil Biology and Biochemistry, 2011, 43(9): 1812-1836. DOI:10.1016/j.soilbio.2011.04.022 |
| [6] |
Chen H, Ma J, Wei J, et al. Biochar increases plant growth and alters microbial communities via regulating the moisture and temperature of green roof substrates[J]. Science of the Total Environment, 2018, 635: 333-342. DOI:10.1016/j.scitotenv.2018.04.127 |
| [7] |
林先贵. 土壤微生物研究原理与方法[M]. 北京: 高等教育出版社, 2010. LIN Xian-gui. Soil microbial research principles and methods[M]. Beijing: Higher Education Press, 2010. |
| [8] |
Cayuela M L, van Zwieten L, Singh B P, et al. Biochar's role in mitigating soil nitrous oxide emissions:A review and meta-analysis[J]. Agriculture, Ecosystems & Environment, 2006, 191: 5-16. |
| [9] |
Cheng C H, Lehmann J, Thies J E, et al. Oxidation of black carbon by biotic and abiotic processes[J]. Organic Geochemistry, 2006, 37(11): 1477-1488. DOI:10.1016/j.orggeochem.2006.06.022 |
| [10] |
Kulmatiski A, Bearcl K H. Long-term plant growth legacies overwhelm short-term plant growth effects on soil microbial community structure[J]. Soil Biology & Biochemistry, 2011, 43(4): 823-830. |
| [11] |
Xu N, Tan G C, Wang H Y, et al. Effect of biochar additions to soil on nitrogen leaching, microbial biomass and bacterial community structure[J]. European Journal of Soil Biology, 2016, 74: 1-8. DOI:10.1016/j.ejsobi.2016.02.004 |
| [12] |
Bamminger C, Zaiser N, Zinsser P, et al. Effects of biochar, earthworms, and litter addition on soil microbial activity and abundance in a temperate agricultural soil[J]. Biology and Fertility of Soils, 2014, 50(8): 1189-1200. DOI:10.1007/s00374-014-0968-x |
| [13] |
Steinbeiss S, Gleixner G. Effect of biochar amendment on soil carbon balance and soil microbial activity[J]. Soil Biology and Biochemistry, 2009, 41(6): 1301-1310. DOI:10.1016/j.soilbio.2009.03.016 |
| [14] |
Ameloot N, De Neve S, Jegajeevagan K, et al. Short-term CO2 and N2O emissions and microbial properties of biochar amended sandy loam soils[J]. Soil Biology and Biochemistry, 2013, 57(3): 401-410. |
| [15] |
Farrell M, Kuhn T K, Macdonald L M, et al. Microbial utilisation of biochar-derived carbon[J]. Science of the Total Environment, 2013, 465: 288-297. DOI:10.1016/j.scitotenv.2013.03.090 |
| [16] |
Dai Z M, Webster T M, Enders A, et al. DNA extraction efficiency from soil as affected by pyrolysis temperature and extractable organic carbon of high-ash biochar[J]. Soil Biology and Biochemistry, 2017, 115: 129-136. DOI:10.1016/j.soilbio.2017.08.016 |
| [17] |
宋婷婷, 赖欣, 王知文, 等. 不同原料生物炭对铵态氮的吸附性能研究[J]. 农业环境科学学报, 2018, 37(3): 576-584. SONG Ting-ting, LAI Xin, WANG Zhi-wen, et al. Adsorption of ammonium nitrogen by biochars produced from different biomasses[J]. Journal of Agro-Environment Science, 2018, 37(3): 576-584. |
| [18] |
鲍士旦. 土壤农化分析[M]. 三版. 北京: 中国农业出版社, 2007. BAO Shi-dan. Soil agro-chemistrical analysis[M]. 3rd ed. Beijing: China Agriculture Press, 2007. |
| [19] |
Enders A, Hanley K, Whitman T. Characterization of biochars to evaluate recalcitrance and agronomic performance[J]. Bioresource Technology, 2012, 114(3): 644-653. |
| [20] |
Yamato M, Okimori Y, Wibowo I F, et al. Effects of the application of charred bark of Acacia mangium on the yield of maize, cowpea and peanut, and soil chemical properties in South Sumatra, Indonesia[J]. Soil Science and Plant Nutrition, 2006, 52(4): 489-495. DOI:10.1111/j.1747-0765.2006.00065.x |
| [21] |
Solomon D, Lehmann J, Wang J, et al. Micro- and nano-environments of C sequestration in soil:A multi-elemental STXM-NEXAFS assessment of black C and organomineral associations[J]. Science of the Total Environment, 2012, 438(3): 372-388. |
| [22] |
Zhang A, Cui L Q, Pan G X, et al. Effect of biochar amendment on yield and methane and nitrous oxide emissions from a rice paddy from Tai Lake plain, China[J]. Agriculture, Ecosystems and Environment, 2010, 139(4): 469-475. DOI:10.1016/j.agee.2010.09.003 |
| [23] |
雷海迪, 尹云锋, 刘岩, 等. 杉木凋落物及其生物炭对土壤微生物群落结构的影响[J]. 土壤学报, 2016, 53(3): 790-799. LEI Hai-di, YIN Yun-feng, LIU Yan, et al. Effects of fir (Cunninghamia Lanceolata) litter and its biochar on soil microbial community structure[J]. Acta Pedologia Sinica, 2016, 53(3): 790-799. |
| [24] |
刘园, Jamal Khan M., 靳海洋, 等. 秸秆生物炭对潮土作物产量和土壤性状的影响[J]. 土壤学报, 2015, 52(4): 849-858. LIU Yuan, Jamal Khan M., JIN Hai-yang, et al. Effect of successive application of crop-straw biochar on crop yield and soil properties in camnosols[J]. Acta Pedologia Sinica, 2015, 52(4): 849-858. |
| [25] |
Schepers J S, Raun W. Nitrogen in agricultural systems[M]. Madison WI: American Society of Agronomy, 2008.
|
| [26] |
Troy S M, Lawlor P G, O'Flynn C J, et al. The impact of biochar addition on nutrient leaching and soil properties from tillage soil amended with pig manure[J]. Water, Air, & Soil Pollution, 2014, 225(3): 1-15. |
| [27] |
Anderson C R, Condron L M, Clough T J, et al. Biochar induced soil microbial community change:Implications for biogeochemical cycling of carbon, nitrogen and phosphorus[J]. Pedobiologia, 2011, 54(5/6): 309-320. |
| [28] |
Felber R, Leifeld J, Horák J, et al. Nitrous oxide emission reduction with greenwaste biochar:Comparison of laboratory and field experiments[J]. European Journal of Soil Science, 2014, 65: 128-138. DOI:10.1111/ejss.12093 |
| [29] |
Cusack D F, Silver W, Mcdowell W H. Biological nitrogen fixation in two tropical forests:Ecosystem-level patterns and effects of nitrogen fertilization[J]. Ecosystems, 2009, 12(8): 1299-1315. DOI:10.1007/s10021-009-9290-0 |
| [30] |
韩光明.生物炭对不同类型土壤理化性质和微生物多样性的影响[D].沈阳: 沈阳农业大学, 2013. HAN Guang-ming. Effect of biochar on soil physicochemical property and microbial diversity in different soil types[D]. Shenyang: Shenyang Agriculture University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10157-1013289790.htm |
| [31] |
Chen C, Huang X, Lei C, et al. Improving anammox start-up with bamboo charcoal[J]. Chemosphere, 2012, 89(10): 1224-1229. DOI:10.1016/j.chemosphere.2012.07.045 |
| [32] |
梁韵, 廖健利, Muhammad Khalid, 等. 生物炭与有机肥对菜田土壤氨氧化菌丰度的影响[J]. 上海交通大学学报(农业科学版), 2017, 35(5): 36-43. LIANG Yun, LIAO Jian-li, Muhammad Khalid, et al. Effects of biochar and organic fertilizer on the abundance of ammonia oxidizer in vegetable production soil[J]. Journal of Shanghai Jiaotong University (Agriculture Science), 2017, 35(5): 36-43. DOI:10.3969/J.ISSN.1671-9964.2017.05.005 |
| [33] |
张又弛, 李会丹. 生物炭对土壤中微生物群落结构及其生物地球化学功能的影响[J]. 生态环境学报, 2015, 24(5): 898-905. ZHANG You-chi, LI Hui-dan. Influence of biochar on the community structure and biogeochemical functions of microorganisms in soils[J]. Ecology and Environmental Sciences, 2015, 24(5): 898-905. |
| [34] |
Novak J M, Busscher W J, Watts D W, et al. Short-term CO2 mineralization after additions of biochar and switchgrass to a Typic Kandiudult[J]. Geoderma, 2010, 154(3/4): 281-288. |
| [35] |
李明, 李忠佩, 刘明, 等. 不同秸秆生物炭对红壤性水稻土养分及微生物群落结构的影响[J]. 中国农业科学, 2015, 48(7): 1361-1369. LI Ming, LI Zhong-pei, LIU Ming, et al. Effects of different straw biochar on nutrient and microbial community structure of a red paddy soil[J]. Scientia Agricultura Sinica, 2015, 48(7): 1361-1369. |
| [36] |
Pietikäinen J, Kiikkilä O, Fritze H. Charcoal as a habitat for microbes and its effect on the microbial community of the underlying humus[J]. Oikos, 2000, 89(2): 231-242. DOI:10.1034/j.1600-0706.2000.890203.x |
| [37] |
Jin H. Characterization of microbial life colonizing biochar and biochar-amended soils[D]. Ithaca: Cornell University, 2010.
|
| [38] |
Prayogo C, Jones J E, Baeyens J, et al. Impact of biochar on mineralisation of C and N from soil and willow litter and its relationship with microbial community biomass and structure[J]. Biology & Fertility of Soils, 2014, 50(4): 695-702. |
| [39] |
Chen J, Li S, Liang C, et al. Response of microbial community structure and function to short-term biochar amendment in an intensively managed bamboo (Phyllostachys praecox) plantation soil:Effect of particle size and addition rate[J]. Science of the Total Environment, 2017, 574: 24-33. DOI:10.1016/j.scitotenv.2016.08.190 |
| [40] |
De Vries F T, Hoffland E, van Eekeren N, et al. Fungal/bacterial ratios in grasslands with contrasting nitrogen management[J]. Soil Biology and Biochemistry, 2006, 38(8): 2092-2103. DOI:10.1016/j.soilbio.2006.01.008 |
 2019, Vol. 38
2019, Vol. 38