稻瘟病是我国影响水稻生产最严重的病害之一,是由稻瘟病菌(Magnaporthe grisea)引起的水稻真菌性病害,是制约水稻生产的重要因子,导致水稻减产或品质严重下降[1]。适当剂量的UV-B(波长280~ 315 nm的紫外光)能有效减少病害,与此同时还能增加水稻苯丙氨酸解氨酶活性和类黄酮含量,在2.5 kJ· m-2和5 kJ·m-2 UV-B辐射条件下会显著增加,这将有效抵御UV-B胁迫,减轻UV-B对水稻带来的伤害[2]。虽然在高强度UV-B辐射如4.0 kJ·m-2和8.0 kJ·m-2时,根据水稻品种、温度和降雨频率不同等原因,会对水稻生长和产量有不同的影响,但其影响程度远低于稻瘟病害[3]。
紫外线对真菌有很多影响,如死亡、抑制孢子萌发,生长延迟和突变[4]。UV-B对稻瘟病菌的生长、产孢[5]和稻瘟病菌侵染生长[6]有着延缓的作用,并根据辐射剂量不同而影响程度不同。UV-B对植物病原菌疾病、分生孢子及其萌发物,毒力都存在影响,如小麦条锈病[7]、番茄花叶病[8]、十字花科黑腐病[9]、玉米大斑病,这取决于UV-B处理时间、品种、接种水平和植物年龄,一定剂量的UV-B使分生孢子产孢时间滞后,致病力下降[10]。同时也发现随着UV-B辐射的增强,球孢白僵菌[11]、丝孢菌绿僵菌[12]、蝗绿僵菌萌发时间滞后,毒力降低[13]。
紫外线作为诱变剂主要针对生物大分子DNA[14],使其发生诱变,造成基因突变,这必然会影响基因转录和蛋白质的合成,这或许也会影响病菌的致病力[15]。例如木黴菌和米曲霉黑色素合成基因在低剂量UV-B辐射下表达水平的增加,减少了UV-B辐射带来伤害的同时提高了致病力[16],而十字花科黑腐病菌,在受射线如紫外光、X光照射后,Lon基因突变,细胞会因抑制细胞分裂蛋白累积,无法形成隔壁[17]而无法致病,玉米大斑病菌黑色素合成基因Stscd经UV-B照射45 min后表达量明显上升,1 h时表达量达到最高峰,之后开始下降[18]。这些由UV-B引起的基因表达改变,通过改变各种表型来影响侵染致病力[19]。研究发现,NUV(近紫外光)对病原菌的基因表达也会有重要的影响,水稻褐斑病NUV照射可以抑制产生孢子并使PHR1表达增强[20]。除致病基因外,响应NUV的光解酶基因表达水平被NUV辐射会特异性增强,这些反应由蓝/UVA吸收光感受器介导[21],在米曲霉[22]和粗糙脉孢菌[23]中,也发现了相似的真菌蓝光调节蛋白,由此来应对UV辐射[24]。
目前,国内外对于水稻稻瘟病菌致病基因已有大量报道,光胁迫如紫外和近紫外辐射对各类植物和昆虫病原菌致病基因的影响研究也屡见不鲜。但对于UV-B处理稻瘟病菌,对致病基因表达影响的报道尚少。在我国云南元阳梯田地区,高海拔下增强的紫外辐射条件下,稻瘟病病情指数远低于其他地区,其中在5 kJ·m-2强度下病情指数降到最低[6]。在稻瘟病菌侵染整个过程中,从芽管伸长到入侵宿主都涉及细胞壁的合成和变化,已知几丁质为真菌细胞壁的主要组分,几丁质酶是其中重要的胞壁修饰酶[25],Chitinase参与合成几丁质酶,同时也与菌丝生长及孢子的萌发密切相关[26],参与稻瘟病菌生长发育及形态建成以至侵染致病过程[27]。在稻瘟病菌穿透寄主表皮之前,MPG1基因能感知水稻表皮的疏水信号,这是稻瘟病菌能形成附着胞的必要条件之一[28];感知疏水信号后,MAGB基因诱导产生附着胞[29],形成附着胞后所需的侵入机械压力受cAMP途径调节,而此信号途径依赖由CPKA基因编码的蛋白激酶A的活性[30]。为了探寻其中增强的UV-B辐射能有效减少稻瘟病害的分子机理,本研究通过UV-B处理稻瘟病菌,利用实时荧光定量PCR对4个稻瘟病菌致病相关基因(Chitinase、MGP1、MAGB、CPKA)进行表达分析,以期通过分析其表达水平来解释UV-B能如何影响稻瘟病菌的致病力,为在分子层面探索UV-B影响稻瘟病害提供理论依据。
1 材料与方法 1.1 试验材料与使用仪器 1.1.1 供试材料本试验供试菌株为田间稻瘟病发病水稻上分离保存所得的YN737。
水稻品种:白脚老粳。
1.1.2 试剂购自Invitrogen的Trizol Reagent、购自Roche的Universal cDNA Master反转录试剂盒和Essential DNA Green Master,购自Sigma公司的曲利苯兰。
1.1.3 仪器本试验采用的仪器:Eppendorf Centrifuge 5424 R、Thermo Nanodrop 2000、BIO-RAD Molecular Imager、Roche LightCycler 96 Instrument和OLYMPUS BH-2显微镜等。
1.2 试验方法 1.2.1 菌株及水稻的培养将水稻稻瘟病菌株YN737在米糠培养基上纯化培养7 d,用8 mm打孔器切取菌饼放置在铺有玻璃纸的PDA平板培养基上,28 ℃与22 ℃的光暗循环交替培养5 d至菌丝长满覆盖玻璃纸进行UV-B辐射处理。
挑选饱满健康的白脚老粳水稻种子进行催芽,待种子露白,将水稻播种于10 cm×20 cm×7 cm的方盆中,置于温室中培养。
1.2.2 UV-B辐射处理将培养皿皿盖打开放置在0.5 h预热稳定后的紫外灯(波长280~320 nm,北京电光源研究所提供)正下方,通过调整紫外灯与培养皿的垂直距离来调整辐射强度,其中灯管用0.13 mm醋酸纤维素膜包被,以去除小于290 nm的短波辐射,用UV-B辐射测定仪(北京师范大学光电仪器厂)测定植株顶端辐射强度。辐射强度为0、2.5 kJ·m-2和5 kJ·m-2,辐射处理时间为10、60、120 min,以及辐射120 min后黑布包被避光放置6、24 h,未做辐射处理即辐射处理时间0 min为CK。
待水稻长至三叶一心期,剪取叶片分别制成长3 cm的叶段,采用滴液法将孢子悬浮液接种于水稻叶段上(黑暗保湿24 h),每片叶滴3滴孢子悬浮液,每滴5 μL,接种后2、8、32 h、3 d采样染色,接种同时对水稻进行UV-B辐射处理,强度为0、2.5 kJ·m-2和5 kJ·m-2。
1.2.3 材料收集与染色UV-B辐射处理后,一部分用灭菌的玻片将玻璃纸上的菌丝刮下放入盛有液氮的研钵迅速冷冻研磨;另一部分用无菌水小心洗下孢子,灭菌纱布滤掉菌丝,将孢子浓度调至1×106个·mL-1,将孢子悬浮液均匀喷洒在疏水表面,26 ℃黑暗保湿培养2、8 h后液氮速冻刮取表面培养物进行研磨。
接种观察试验为每一处理设置3次重复,每一重复为10个叶段,对叶段采用曲利苯兰-酒精乳酚油染色观察。在曲利苯兰-酒精乳酚油(无水乙醇20 mL,苯酚10 mL,83%乳酸10 mL,水10 mL,曲利苯兰10 mg)中沸水浴10 min;将染色后的叶段置于水合饱和氯醛溶液中脱色过夜;保存于50%甘油中。在OLYMPUS BH-2显微镜下观察叶段,接种后2、8 h和3 d照相记录稻瘟病菌萌发形成芽管、附着胞、侵染菌丝侵入水稻细胞的过程。
1.2.4 RNA的提取取50~100 mg样品,加入1 mL Trizol(样本的量不宜超过Trizol体积的10%)充分摇匀后室温静置15 min,4 ℃ 13 000 r·min-1离心10 min;小心吸取上清液至新的无酶管,加入200 μL氯仿摇匀,室温静置5 min,4 ℃ 13 000 r·min-1离心15 min;吸取上清液,加入异丙醇200 μL,室温静置2~5 min,4 ℃ 13 000 r· min-1离心15 min;去上清,加入1 mL 70%乙醇,4 ℃ 13 000 r·min-1离心5 min;去上清,小心吸取残余液体,室温静置2~10 min;加50~200 μL无核酸酶水,于-80 ℃保存。
1.2.5 RNA质量和浓度的检测用1.2%的琼脂糖凝胶电泳检测RNA的完整性,利用Thermo Nanodrop 2000对RNA进行浓度检测和纯度检测。
1.2.6 cDNA模板的合成用Universal cDNA Master反转录试剂盒对样品进行反转录,Reaction Buffer(5× conc)4 μL,Enzyme Mix(10×conc)2 μL,根据RNA浓度调整模板RNA和水的用量,反转体系终体积为20 μL,42、85、65 ℃分别水浴15、5、15 min,完成反转录。
1.2.7 引物设计利用Primer Premier和NCBI/Primer-BLAST,分别设计了看家基因Actin和其他目的基因的引物(表 1),由擎科昆明公司合成提供。
|
|
表 1 引物序列 Table 1 Primer sequence |
以Actin为内参,按照20 μL体系(水3 μL、10× conc PCR Primer 2 μL、Master Mix10 μL、DNA Temlate 5 μL)进行qRT-PCR扩增,反应程序分别为95 ℃预变性600 s,三步95 ℃~60 ℃~72 ℃扩增,45个循环,95 ℃~65 ℃~97 ℃退火溶解。
1.3 数据处理与统计分析数据用Excel 2010和LC 96进行整理作图,差异显著性检验采用SPSS 22.0 Duncan检验法(P < 0.05)。
2 结果与分析 2.1 RNA的质量与浓度的检测经过1.2%凝胶琼脂糖电泳,结果如图 1所示,RNA18 S、28 S条带清晰,5 S模糊,说明RNA完整性良好。260、280 nm下测定RNA的吸光度,其中A260/ A280值均在1.82~2.04之间,说明RNA有机污染少,降解少,质量较好,满足后续实验要求。4个目的基因与内参基因Actin的溶解曲线平滑,单一峰,无引物二聚体,温度介于85~88 ℃之间,说明引物具有特异性,扩增结果可靠。
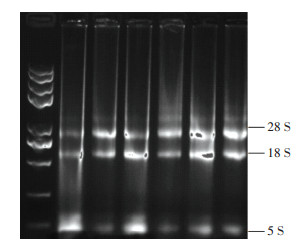
|
图 1 凝胶琼脂糖电泳图 Figure 1 Gel agarose electrophoresis |
从图 2 Chitinase的表达变化来看,在2.5 kJ·m-2辐射强度下,Chitinase只在辐射时间为60 min处理下与对照相比表达有显著升高,上调了93%,其余时间均没有显著变化,而在5 kJ·m-2辐射强度下,随着辐射时间的延长,Chitinase表达逐渐降低,在120 min处理下,相对表达量降到最低,从辐射10 min开始到辐射120 min结束,表达较对照分别下调了64%、22%和94%,而在放置6、24 h后,其表达量逐渐回升为对照的48%和54%。
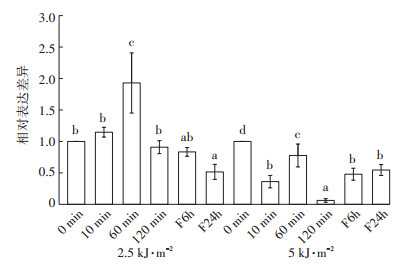
|
图中处理间标注的不同小写字母表示差异显著(P < 0.05)。F6 h:撤去UV-B辐射避光放置6 h;F24 h:撤去UV-B辐射避光放置24 h。下同 Different lowercase letters indicate significant differences (P < 0.05). F6 h and F24 h: remove UV-B radiation and avoid light for 6 hours and 24 hours. The same below 图 2 不同UV-B处理Chitinase的表达变化 Figure 2 Changes of Chitinase expression under different UV-B treatments |
对于MGP1,两个辐射强度下(图 3),各个处理时间对MGP1表达的影响不大,2.5 kJ·m-2辐射处理时,表达量在各处理时间并没有显著变化,仅在5 kJ·m-2辐射处理时,随着辐射时间的增加,表达量缓慢下调,到120 min处理时,表达量较对照下调了19%,并且在辐射结束后放置6 h和24 h,表达恢复至正常水平。
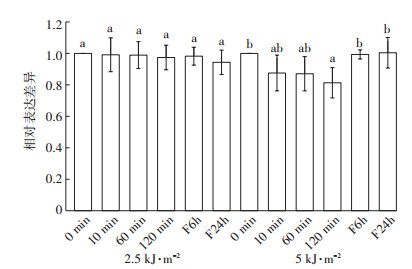
|
图 3 不同UV-B处理MGP1的表达变化 Figure 3 Changes of MGP1 expression under different UV-B treatments |
而MAGB(图 4)则是在5 kJ·m-2辐射强度下,各处理时间没有显著变化,在2.5 kJ·m-2强度下,表达会在辐射10~120 min受到显著抑制,与对照相比分别下调了57%、17%和40%,去除辐射放置6 h后,MAGB的表达会回升为对照水平,放置24 h,表达回升且较对照上调了14%。
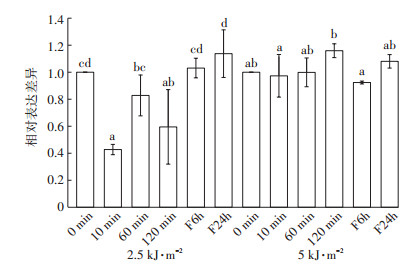
|
图 4 不同UV-B处理MAGB的表达变化 Figure 4 Changes of MAGB expression under different UV-B treatments |
在两个辐射强度下,CPKA呈相似的表达趋势(图 5),在5 kJ·m-2处理时的表达整体低于2.5 kJ·m-2。短时间的辐射使CPKA的表达上升,与对照相比,2.5 kJ· m-2辐射时,10 min与60 min的辐射处理与撤去辐射后放置6、24 h表达上调了1~2倍。5 kJ·m-2辐射时,10 min辐射处理时,CPKA的表达与对照相比上调了49%,辐射60 min和120 min时,表达下调了82%和61%,在撤去辐射后放置6、24 h,表达恢复至对照水平。以上结果表明,UV-B辐射剂量的增加对MGP1的表达没有显著影响,而Chitinase、MAGB、CPKA 3个基因的表达均有所下调,在去除辐射后,表达回升。

|
图 5 不同UV-B处理CPKA的表达变化 Figure 5 Changes of CPKA expression under different UV-B treatments |
芽管、附着胞和菌丝侵入形成菌落的过程中,5 kJ·m-2处理比2.5 kJ·m-2处理能更大程度地抑制病原菌的侵染(图 6)。2.5 kJ·m-2处理下稻瘟病菌各侵染阶段的生长量在芽管形成阶段没有显著差异,在附着胞和菌落形成阶段与对照相比下降了31%和28.6%;而在5 kJ·m-2处理下,3个阶段都有显著下降,分别减少了45.1%、82.2%和75.2%。

|
图 6 UV-B处理下各侵染阶段稻瘟病菌生长量 Figure 6 Growth of Magnaporthe grisea in different stages of infection under UV-B treatment |
UV-B辐射处理能使菌丝生长变得致密、紧凑,产孢量也随着辐射强度的增加而显著下降[5],在5 kJ· m-2处理时,Chitinase的表达一致。2.5 kJ·m-2辐射处理,在辐射60 min时,Chitinase的表达显著升高,可能是由于低辐射强度的UV-B让病菌对此做出了反应来保护自身,是病菌产生的防护措施[31],如加快细胞的合成与分解来减轻UV-B带来的伤害。黑色素广泛存在于各种真菌体内[16],黑色素基因表达的升高能降低病原菌受到的UV伤害[32],并且发现玉米大斑病黑色素基因在紫外辐射后也表现出相同的趋势,会在辐射处理60 min时,表达量上升至最高峰,随后下降[18],与本试验Chitinase表达趋势相似,辐射下Chitinase与玉米大斑病黑色素基因表达变化的相似,可能是由于激发了相似的代谢途径来进行自我保护。
而对于MGP1,不同辐射剂量对其表达不产生显著影响,仅在高辐射剂量表达才会有少量下调,推测MGP1对UV-B辐射耐受。细胞已经开发出许多修复或耐受机制来抵消UV或任何其他应激物造成的分子损伤[19],在光解酶的帮助下光还原是各种生物体中最重要且经常发生的修复机制之一[33],此外,切除修复可分别借助多种糖基化酶和聚合酶在几种生物体分子修复中也起重要作用[34]。诱变修复或二聚体旁路、重组修复、细胞周期检查点,细胞凋亡和某些替代性修复途径等机制也存在于各种生物体[22],推测在UV-B处理下可能激发了其中的修复机制,最终免于MGP1表达的改变,但其中可能存在的路径尚不明确。
MAGB则受2.5 kJ·m-2辐射强度的UV-B时有较5 kJ·m-2辐射强度更明显的变化,可能是由于MAGB对低辐射强度较敏感。致病基因的表达除取决于分生孢子的生理状态之外,还取决于辐射剂量[12]。CPKA在两种辐射强度下有着一致趋势的表达变化,在5 kJ·m-2辐射强度处理CPKA的表达量整体低于2.5 kJ·m-2处理,随辐射剂量的增加,基因转录受到破坏,其表达受到抑制。CPKA编码合成致病性所必需的蛋白激酶A的催化亚基单位PKA-c,而cAMP途径依赖于蛋白激酶A的活性,这也可能导致cAMP途径受到影响[35],进一步影响稻瘟病菌的致病力,cAMP信号通路对外界压力胁迫如热激、紫外线辐射、电离辐射等都会做出应答[36]。结合本试验,得知只有高强度辐射处理时能抑制CPKA的表达,撤去辐射,放置6 h和24 h都能发现CPKA的表达恢复对照水平,从白化酵母菌中也能得出,辐射后的光复活和黑暗处理都能产生光还原[37]。
从Chitinase、MAGB、CPKA的表达变化不难发现,在去除UV-B辐射后,降低的表达量会有所回升,所以推测通过逆境筛选留存的稻瘟菌株有适应而产生的修复功能——光还原[37],所以持续或者更长时间的UV-B照射才能使稻瘟病菌降低或丧失致病力。从本文的试验结果可以看到,Chitinase、MAGB、CPKA在UV-B辐射处理下,表达都有显著变化,大致趋势都是在5 kJ·m-2处理强度时表达量相对于对照降低了,变化程度有所不同,已有的研究中就发现光响应基因中2.8%的基因是光敏感的,2%诱导和0.8%抑制[38]。
3.2 UV-B辐射下致病基因表达水平变化与稻瘟病菌侵染力的关系试验结果印证了UV-B辐射能减轻稻瘟病害以及影响其致病力的假说,其中Chitinase在稻瘟病菌各生长期都有重要作用,说明UV-B对其影响可能贯穿整个生育阶段,低强度辐射时,其表达上升来减轻紫外辐射带来的伤害,随着辐射强度增强和时间的延长,表达下降以致稻瘟病整个生育阶段都有可能受到伤害和抑制,例如产孢量的减少、芽管、附着胞、侵染菌丝形成受阻等等;MAGB与CPKA的表达都影响着cAMP途径[35],该途径与稻瘟病菌的生长发育、孢子萌发、侵染结构形成与致病性都具有重要作用[39-41]。MAGB和CPKA基因的表达变化表示,适当的紫外辐射能让附着胞形成受阻以及侵染机械压力的不足或丧失。从试验结果可以得出,这4个基因在UV-B辐射处理下,其表达都有显著改变,其中5 kJ·m-2处理时,更加显著抑制了表达水平,这与试验结果5 kJ· m-2的UV-B辐射能更大程度减少芽管、附着胞和菌丝侵染,从而更大程度地减少稻瘟病害相一致。
虽然近年对稻瘟病菌致病力相关基因[42]和UV-B辐射对动植物真菌病害影响的研究已较为丰富,但是在分子水平验证UV-B辐射对稻瘟病菌影响的研究尚少,机理尚不清晰,UV-B调节基因的功能尚不清楚,还需进一步探索生物学细节来验证。如调查过度表达,基因破坏或引入反义RNA等实验[23]等,将有助于揭示稻瘟病菌在UV-B作用下分子层面的机理。
4 结论(1)UV-B辐射能有效减轻水稻稻瘟病的病情指数,减少病害,控制好辐射剂量(如5 kJ·m-2辐射处理)能使病害程度显著降低。
(2)UV-B辐射能有效降低水稻稻瘟病病害的重要机理是UV-B辐射能使稻瘟病菌致病基因的表达发生变化,尤其在5 kJ·m-2辐射处理120 min时,能显著减少致病基因的表达,从而降低病菌入侵对应各个发育阶段的生长量来减少病害。
| [1] |
李杨, 王耀雯, 王育荣, 等. 水稻稻瘟病菌研究进展[J]. 广西农业科学, 2010, 41(8): 789-792. LI Yang, WANG Yao-wen, WANG Yu-rong, et al. Research progress of rice blast fungus[J]. Guangxi Agricultural Sciences, 2010, 41(8): 789-792. DOI:10.3969/j.issn.2095-1191.2010.08.014 |
| [2] |
李元, 高潇潇, 高召华, 等. UV-B辐射和稻瘟病菌胁迫对水稻幼苗苯丙氨酸解氨酶活性和类黄酮含量的影响[J]. 中国生态农业学报, 2010, 18(4): 856-860. LI Yuan, GAO Xiao-xiao, GAO Zhao-hua, et al. Effects of UV-B radiation and rice blast pathogen stress on phenylalanine ammonia-lyase activity and flavonoid content in rice seedlings[J]. Chinese Journal of Eco-Agriculture, 2010, 18(4): 856-860. |
| [3] |
何永美, 湛方栋, 高召华, 等. 水稻对UV-B辐射响应的敏感性差异[J]. 生态环境学报, 2012, 21(3): 489-495. HE Yong-mei, ZHAN Fang-dong, GAO Zhao-hua, et al. Sensitivity difference of rice to UV-B radiation[J]. Ecology and Environmental Sciences, 2012, 21(3): 489-495. |
| [4] |
Kihara J, Moriwaki A N, Arase S, et al. Cloning, functional characterization, and near-ultraviolet radiation-enhanced expression of a photolyase gene (PHR1) from the phytopathogenic fungus Bipolaris oryzae[J]. Current Genetics, 2004, 46(1): 37-46. |
| [5] |
赵颖, 祖艳群, 李元. UV-B辐射增强对水稻稻瘟病菌(Magnaporthe grisea)生长和产孢的影响[J]. 农业环境科学学报, 2010, 29(3): 1-5. ZHAO Ying, ZU Yan -qun, LI Yuan. Effects of UV-B radiation on growth and sporulation of Magnaporthe grisea[J]. Journal of Agro-Environment Science, 2010, 29(3): 1-5. |
| [6] |
Li X, He Y, Xie C, et al. Effects of UV-B radiation on the infectivity of Magnaporthe oryzae and rice disease-resistant physiology in Yuanyang terraces[J]. Photochemical & Photobiological Sciences, 2018(17): 8-17. |
| [7] |
韩国菲, 王海光, 马占鸿. CO2浓度升高和UV-B辐射增强对小麦条锈病流行组分的影响[J]. 中国农业科学, 2011, 44(20): 4326-4332. HAN Guo-fei, WANG Hai-guang, MA Zhan-hong. Effects of CO2 concentration and UV-B radiation on epidemic components of wheat stripe rust[J]. Scientia Agricultura Sinica, 2011, 44(20): 4326-4332. |
| [8] |
Matsuura S, Ishikura S. Suppression of Tomato mosaic virus disease in tomato plants by deep ultraviolet irradiation using light-emitting diodes[J]. Letters in Applied Microbiology, 2014, 59(5): 457-63. DOI:10.1111/lam.12301 |
| [9] |
杨国奎, 祁艳华, 朱艳宁, 等. 十字花科黑腐病菌中一个与黄色素合成相关基因的鉴定[J]. 基因组学与应用生物学, 2014, 33(4): 802-807. YANG Guo-kui, QI Yan-hua, ZHU Yan-ning, et al. Identification of a gene related to yellow pigment synthesis in cruciferous black rot fungus[J]. Genomics and Applied Biology, 2014, 33(4): 802-807. |
| [10] |
Kumagai T. Action spectra for the blue and near ultraviolet reversible photoreaction in the induction of fungal conidiation[J]. Physiologia Plantarum, 2010, 35(1): 123-125. |
| [11] |
李静馨.球孢白僵菌α-葡萄糖苷转运蛋白(BbATG1)的功能分析与热激响应基因的分离鉴定[D].杭州: 浙江大学, 2011. LI Jing -xin. Functional analysis and isolation and identification of heat shock response genes of α-glucoside transporter of Beauveria bassiana[D]. Hangzhou: Zhejiang University, 2011. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1854767 |
| [12] |
Braga G U L, Flint S D, Messias C L, et al. Effects of UVB irradiance on conidia and germinants of the entomopathogenic Hyphomycete Metarhizium anisopliae:A study of reciprocity and recovery[J]. Photochemistry & Photobiology, 2001, 73(2): 140-146. |
| [13] |
石佑慧.蝗绿僵菌MabrlA在产孢调控作用和致病机制中的功能研究[D].重庆: 重庆大学, 2016. SHI You-hui. Studies on the function of Metarhizium anisopliae MabrlA in the regulation of sporulation and pathogenicity[D]. Chongqing: Chongqing University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10611-1016731746.htm |
| [14] |
Das S, Saha S K, De A, et al. Potential of the homeopathic remedy, Arnica Montana 30C, to reduce DNA damage in Escherichia coli exposed to ultraviolet irradiation through up-regulation of nucleotide excision repair genes[J]. Journal of Chinese Integrative Medicine, 2012, 10(3): 337-346. DOI:10.3736/jcim |
| [15] |
张文会, 王明卓, 苗秀莲, 等. 短时间不同剂量UV-B辐射处理对冬小麦幼苗生理指标的影响[J]. 安徽农业科学, 2010, 38(2): 648-650. ZHANG Wen-hui, WANG Ming-zhuo, MIAO Xiu-lian, et al. Effects of different doses of UV-B radiation on physiological indexes of winter wheat seedling[J]. Journal of Anhui Agricultural Sciences, 2010, 38(2): 648-650. DOI:10.3969/j.issn.0517-6611.2010.02.039 |
| [16] |
王淞民.基转超寄生菌Trichoderma spp.黑色素生合成基因以提升其逆境抗性与致病力[D].台北: 台湾大学, 2009. WANG Song-min. Trichoderma spp. melanin biosynthesis gene to enhance its stress resistance and pathogenicity[D]. Taipei: National Taiwan University, 2009. |
| [17] |
夏代威.十字花科黑腐病菌lon基因的选殖与分析[D].台中: "国立"中兴大学分子生物研究所, 2001. XIA Dai-wei. Selection and analysis of lon gene in cruciferous black rot fungus[D]. Taichung: Institute of Molecular Biology, Zhongxing University, 2001. |
| [18] |
姚晓霞.光调控与玉米大斑病菌黑色素合成途径基因的表达关系研究[D].保定: 河北农业大学, 2010. YAO Xiao-xia. Study on the relationship between light regulation and the expression of melanin biosynthesis pathway gene of Maize spot fungus[D]. Baoding: Agricultural University of Hebei, 2010. http://cdmd.cnki.com.cn/Article/CDMD-11920-2010138767.htm |
| [19] |
Kihara J, Moriwaki A, Ito M, et al. Expression of THR1, a 1, 3, 8-trihydroxynaphthalene reductase gene involved in melanin biosynthesis in the phytopathogenic fungus Bipolaris oryzae, is enhanced by nearultraviolet radiation[J]. Pigment Cell & Melanoma Research, 2004, 17(1): 15-23. |
| [20] |
Moriwaki A, Katsube H, Ueno M, et al. Cloning and characterization of the BLR2, the homologue of the blue-light regulator of neurospora crassa, WC-2, in the phytopathogenic fungus Bipolaris oryzae[J]. Current Microbiology, 2008, 56(2): 115-121. DOI:10.1007/s00284-007-9080-x |
| [21] |
Kihara J, Moriwaki A, Ueno M, et al. Cloning, functional analysis and expression of a scytalone dehydratase gene(SCD1)involved in melanin biosynthesis of the phytopathogenic fungus Bipolaris oryzae[J]. Current Genetics, 2004, 45(4): 197-204. DOI:10.1007/s00294-003-0477-1 |
| [22] |
Kihara J, Moriwaki A, Tanaka N, et al. Characterization of the BLR1 gene encoding a putative blue-light regulator in the phytopathogenic fungus Bipolaris oryzae[J]. Fems Microbiology Letters, 2010, 266(1): 110-118. |
| [23] |
Kihara J, Tanaka N, Ueno M, et al. Identification and expression analysis of regulatory genes induced by near-ultraviolet irradiation in Bipolaris oryzae[J]. Advances in Microbiology, 2014, 4(5): 233-241. DOI:10.4236/aim.2014.45030 |
| [24] |
Rosales-Saavedra T, Esquivel-Naranjo E U, Casas-Flores S, et al. Novel light-regulated genes in trichoderma atroviride:A dissection by cDNA microarrays[J]. Microbiology, 2006, 152(11): 3305-3317. DOI:10.1099/mic.0.29000-0 |
| [25] |
韩艺娟, 林成增, 王琴秋, 等. 稻瘟病菌假定几丁质酶家族基因的表达特点[J]. 热带作物学报, 2013, 34(8): 1544-1551. HAN Yi-juan, LIN Cheng-zeng, WANG Qin-qiu, et al. Expression characteristics of assumed chitinase family genes in Magnaporthe oryzae[J]. Tropical Crop Journals, 2013, 34(8): 1544-1551. DOI:10.3969/j.issn.1000-2561.2013.08.025 |
| [26] |
Yamazaki H, Tanaka A, Kaneko J, et al. Aspergillus nidulans ChiA is a glycosylphosphatidylinositol(GPI)-anchored chitinase specifically localized at polarized growth sites[J]. Fungal Genetics & Biology, 2008, 45(6): 963-972. |
| [27] |
林成增.稻瘟病菌假定几丁质酶基因功能分析[D].福州: 福建农林大学, 2010. LIN Cheng-zeng. Functional analysis of assumed chitinase gene in rice blast fungus[D]. Fuzhou: University of Agriculture and Forestry in Fujian, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10389-2010181982.htm |
| [28] |
王洪凯, 林福呈, 李德葆. 稻瘟病菌致病相关基因研究进展[J]. 菌物系统, 2002, 21(3): 459-464. WANG Hong-kai, LIN Fu-cheng, LI De-bao. Research progress on pathogenicity related genes of Magnaporthe grisea[J]. Mycosystema, 2002, 21(3): 459-464. DOI:10.3969/j.issn.1672-6472.2002.03.032 |
| [29] |
Rodriguez-Martin M, Martin-Ezquerra G, Man M Q, et al. Expression of epidermal CAMP changes in parallel with permeability barrier status[J]. Journal of Investigative Dermatology, 2011, 131(11): 2263-2270. DOI:10.1038/jid.2011.210 |
| [30] |
Franck W L, Gokce E, Oh Y, et al. Temporal analysis of the Magnaporthe oryzae proteome during conidial germination and cAMP-mediated appressorium formation[J]. Molecular & Cellular Proteomics, 2013, 12(8): 2249-2265. |
| [31] |
李元, 李想, 何永美, 等. UV-B辐射增强对植物-病原菌互作体系的影响及评价[J]. 植物生理学报, 2015(10): 1557-1566. LI Yuan, LI Xiang, HE Yong-mei, et al. Effect of UV-B radiation enhancement on plant -pathogen interaction system and its evaluation[J]. Plant Physiology Journal, 2015(10): 1557-1566. |
| [32] |
Moriwaki A, Kihara J, Kobayashi T, et al. Insertional mutagenesis and characterization of a polyketide synthase gene(PKS1) required for melanin biosynthesis in Bipolaris oryzaea[J]. Fems Microbiology Letters, 2010, 238(1): 1-8. |
| [33] |
Kihara J, Sato A, Okajima S, et al. Molecular cloning, sequence analysis and expression of a novel Gene induced by near-UV light in Bipolaris oryzae[J]. Molecular Genetics & Genomics Mgg, 2001, 266(1): 64-71. |
| [34] |
Sinha R P, Häder D P. UV-induced DNA damage and repair:A review[J]. Photochemical & Photobiological, 2002, 1(4): 225-236. |
| [35] |
Stein B, Angel P, Dam H V, et al. Ultraviolet-radiation induced c-jun gene transcription:Two ap-1 like binding sites mediate the response[J]. Photochemistry & Photobiology, 2010, 55(3): 409-415. |
| [36] |
马琴思.绿僵菌ENAP型-ATPase基因MaENA1的克隆与功能研究[D].重庆: 重庆大学, 2014. MA Qin-si. Cloning and functional study of ENAP-ATPase MaENA1 from Metarhizium anisopliae[D]. Chongqing: Chongqing University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10611-1014044527.htm |
| [37] |
Marcia, Tatiana. Production and evaluation of albino mutants of Sporothrix schenckii[J]. Acta Scientice Veterinariae, 2004, 32(4): 119-123. |
| [38] |
刘鹏, 李强, 李云云, 等. UV-B对人工气候室内黄瓜苗期生长、生理及抗氧化系统的影响(英文)[J]. 农业工程学报, 2017, 33(17): 181-186. LIU Peng, Li Qiang, LI Yun -yun, et al. Effect of UV-B radiation treatments on growth, physiology and antioxidant systems of cucumber seedlings in artificial climate chamber[J]. Transactions of the Chinese Society of Agricultural Engineering, 2017, 33(17): 181-186. DOI:10.11975/j.issn.1002-6819.2017.17.024 |
| [39] |
叶幸, 孙群, 刘柱. 稻瘟菌侵染过程相关信号通路研究进展[J]. 中国农业科技导报, 2015, 17(1): 87-94. YE Xing, SUN Qun, LIU Zhu. Research progress of signal pathway related to the infection of Magnaporthe oryzae[J]. Journal of Agricultural Science and Techology, 2015, 17(1): 87-94. |
| [40] |
Justine K K.水稻CO39品种及其5个近等基因系对稻瘟病感染应答的转录组分析[D].福州: 福建农林大学, 2016. Justine K K. Transcriptome analysis of rice blast infection response to rice CO39 and its five near-isogenic lines[D]. Fuzhou: University of Agriculture and Forestry in Fujian, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10389-1017023590.htm |
| [41] |
李媛.稻曲病菌不同颜色厚垣孢子萌发与cAMP和黑色素含量相关性研究[D].长沙: 湖南农业大学, 2013. LI Yuan. Study on the relationship between chlamydospore germination and cAMP and melanin content in different colors of Aspergillus oryzae[D]. Changsha: Hunan Agricultural University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10537-1014182944.htm |
| [42] |
王伟, 杨惠, 王政逸, 等. 在水稻纹枯病菌菌核形成中5个基因的表达差异分析[J]. 浙江大学学报(农业与生命科学版), 2013, 39(1): 18-25. WANG Wei, YANG Hui, WANG Zheng-yi, et al. Differential expression of five genes in the sclerotia formation of Rhizoctonia solani[J]. Journal of Zhejiang University(Agriculture and Life Sciences), 2013, 39(1): 18-25. |
 2019, Vol. 38
2019, Vol. 38



