2. 海峡两岸红壤区水土保持协同创新中心, 福州 350002;
3. 南方红壤区水土保持国家林业局重点实验室, 福州 350002
2. Co-innovation Center for Soil and Water Conservation in Red Soil Region of the Cross-straits, Fuzhou 350002, China;
3. Key Laboratory of Soil and Water Conservation in South China Red Soil Region of State Forestry Administration, College of Forestry, Fujian Agriculture and Forestry University, Fuzhou 350002, China
福建长汀是稀土资源储量最多和稀土产业发展最早的县,属典型的离子型稀土矿区[1]。近年来随稀土价格攀升,稀土矿开采加剧产生大面积废弃地,不但使土壤结构遭到破坏,引起植被破坏、水土流失,同时还造成土壤酸化、重金属污染,成为当前亟需解决的重大环境问题[2-3]。长汀重金属污染主要为Pb、Cd,在废弃堆浸池Pb含量达重度污染水平;在原地浸废弃地、废弃堆浸池、取土场的Cd含量分别为福建省土壤背景值的141、69、97倍,综合潜在生态风险指数均大于1200,污染程度达极重水平。长汀稀土矿开采主要是采用加入硫酸铵或草酸等强酸溶液浸提,将吸附在黏土矿物表面的稀土离子交换出来,因此导致长汀废弃地土壤酸化,矿区生态环境恶化[1, 4-6]。土壤酸化和重金属污染成为限制稀土矿废弃地的生态恢复的限制因子。其中植物修复技术具有安全、经济、环保等优点备受关注[7]。
大量研究表明,可溶性糖和可溶性蛋白是植物体内两种重要的渗透调节物质。当植物受到外部环境胁迫时,可溶性糖在植物体内迅速积累,以维持植物体与外部环境的相对渗透平衡。可溶性蛋白也是植物重要的生理活性物质,其含量变化与外部环境的变化密切相关,可溶性蛋白的升高,是植物在逆境下的一种防御机制[8-9]。如刘玉艳等[10]发现重金属Cd、Pb、Ni胁迫降低了地肤(Kochia scoparia)种子可溶性蛋白含量,极显著提高了可溶性糖含量。在种子萌发过程中,种子内部淀粉酶催化贮藏淀粉水解,为后期植株幼苗的形态建成及生长发育提供主要的物质和能量来源[10]。近年来,傅里叶红外光谱分析技术在环境生物修复和重金属污染对植物营养的影响等方面也有较多应用[11]。另一方面,细胞壁的固定和液泡区室化在植物应对重金属的毒性方面起着相当重要的作用。Weng B S等[12]研究证实了大部分Cd都储存在秋茄树[Kandeliaobovata(S.,L.)]的细胞壁中,细胞壁的固定作用是其抗Cd毒性的重要策略之一。
枫香(Liquidambar formosana Hance)系金缕梅科枫香树属的高大落叶乔木,分布于我国秦岭及淮河以南,有“荒山先锋”树种之称,其生长快、用途广、适应性强、生态效益好,已成为林种、树种结构调整的首选树种,能在长汀稀土矿废弃地正常生长[13-15]。目前已有学者就温度和时间对枫香种子萌发的影响、枫香种子形状特征进行了研究[16-17],然而,重金属及酸胁迫对枫香种子萌发过程中的生理变化尚未见报道。鉴于此,研究不同Pb、Cd及酸胁迫对枫香种子萌发过程中可溶性蛋白、可溶性糖、还原糖含量,淀粉酶活性等的影响,通过傅里叶红外光谱变化及对胚乳的超微结构进行观察。探讨重金属Pb、Cd及酸胁迫条件下枫香种子萌发过程中内含物的变化机制,旨在为该种子在酸性废弃矿地和重金属污染地萌发机制研究提供基础数据。
1 材料与方法 1.1 试验材料枫香种子采购自江西省九江县林木种苗公司,存储于4 ℃冰箱。
1.2 试验设计根据稀土矿废弃地土壤酸化及重金属污染程度,设置pH值及Pb、Cd浓度[1, 18-19],pH调节采用CH3COOH,分别为3.5、4.5、5.5、CK(去离子水对照)。Pb胁迫采用分析纯(CH3COO)2Pb配制,浓度为0(去离子水对照)、250、500、1000 mg·L-1(文中以CK、Pb- 250、Pb-500、Pb-1000表示)的Pb溶液;Cd胁迫采用分析纯(CH3COO)2Cd·3H2O配制,浓度分别为:0(以去离子水对照)、25、50、100 mg·L-1(文中以CK、Cd- 25、Cd-50、Cd-100表示)。
1.3 试验条件及过程用0.3%的KMnO4溶液消毒浸泡30 min后,超纯水冲洗5遍,选用籽粒饱满的枫香种子,用于胁迫试验。将经过高温灭菌处理的直径为9 cm的玻璃培养皿编号,每个培养皿铺有两张滤纸,并分别加入5 mL各浓度的Cd、Pb和酸胁迫溶液,使滤纸湿润并浸没了种子体积的1/3,每皿均匀摆放100粒种子,每种处理3个重复。于温度25 ℃、空气相对湿度70%、14 h/10 h(光照/黑暗)、光强100%的人工气候箱中培养(RXZ-160A智能型人工气候箱,宁波江南仪器厂)。每2 d更换一次滤纸,每日称重法添加少量纯水,保持滤纸湿润。
1.4 测定指标与方法取发芽第0、4、7 d和10 d的发芽种子及发芽结束后的未萌发种子,参考王学奎[20]的方法采用3,5-二硝基水杨酸(DNS)法测定还原糖含量;可溶性蛋白含量的测定采用考马斯亮蓝法;可溶性糖测定用蒽酮比色法;α-淀粉酶活性、β-淀粉酶活性测定采用DNS法,淀粉酶的活性以每分钟每克样品水解淀粉释放出的麦芽糖毫克数表示(mg·g-1·min-1)。取发芽结束后未萌发种子,Pb-1000、Cd-100、CK处理的发芽种子,参照廖卓毅等[21]的方法对枫香种子胚乳细胞的结构进行透射电镜观察(TEM)并拍照(JEM-100CX,上海秉新生物科技有限公司)。放大倍数为1900、2900、4800倍和6800倍。傅里叶红外光谱仪(型号:VERTEX 70,德国Bruker公司,光谱范围4000~400 cm-1,分辨率4 cm-1),扫描次数32次,测定样品的光谱信息。
1.5 数据分析试验数据采用SPSS 19.0的单因子方差分析(One-way ANOVA)和多重比较法进行统计分析,用Tukey-HSD法对数据进行差异显著性分析。FTIR分析[22]根据枫香发芽种子吸收峰的吸光度值的特点筛选出多个比较典型的吸收峰,并记录不同波数的吸光度。原始数据采用Origin 9.0软件进行作图。
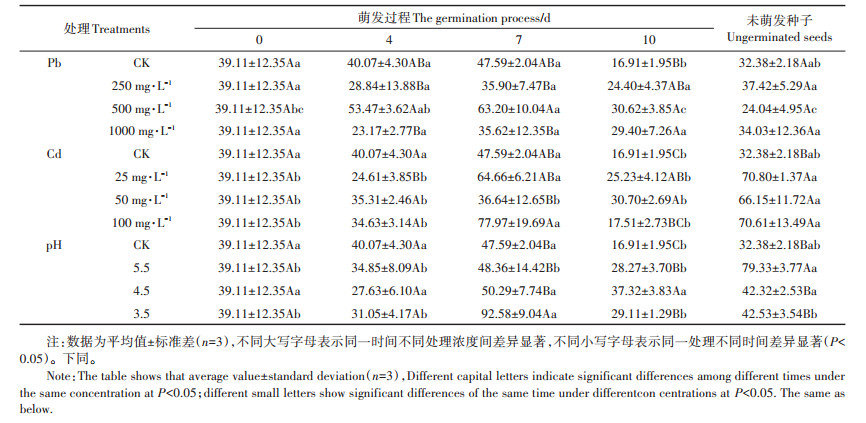
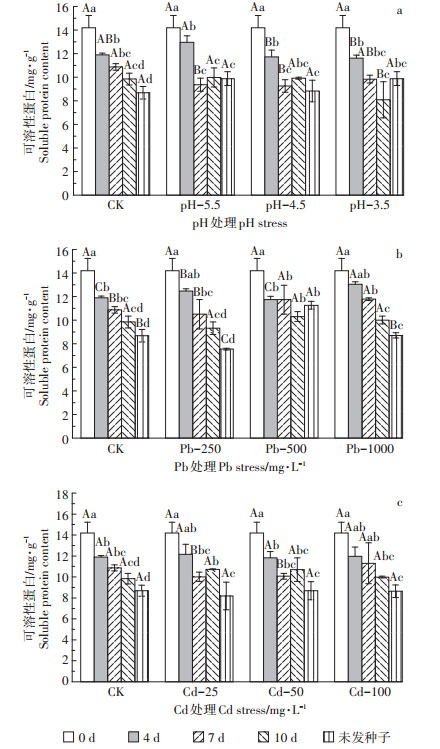
2 结果与分析 2.1 Pb、Cd和酸胁迫对枫香种子萌发中可溶性蛋白的影响如图 1所示随萌发时间的延长,可溶性蛋白整体均呈下降趋势,且同处理下各萌发时段之间差异显著(除Pb-500外)。其中随pH值减小(图 1a),第4 d可溶性蛋白含量先增后减,第7 d则相反。第10 d时pH-3.5处理显著低于CK(P < 0.05)。可溶性蛋白含量随萌发时间的增加仍呈整体下降趋势,胁迫组在萌发后期(10 d)略有提高。Pb胁迫下(图 1b)萌发初期(4 d)各胁迫组之间差异显著(P < 0.05),呈先增后减再增趋势,Pb-1000时达最大值,相比CK提高了9.78%。未萌发种子可溶性蛋白含量与发芽第4 d的变化规律相反,各组间差异同样显著。发芽第7 d时Pb-500及Pb-1000处理下可溶性蛋白含量显著高于CK(P < 0.05),可见可溶性蛋白含量的升高是枫香种子在高浓度Pb胁迫下的防御机制之一。而发芽第7 d的Cd-25、Cd-50则显著低于CK,其余萌发时间段内可溶性蛋白含量与CK相比均无显著差异。
|
图中不同大写字母表示同一时间不同处理浓度间差异显著,不同小写字母表示同一处理不同时间差异显著(P < 0.05)。下同 Different capital letters indicate significant differences among different times under the same concentration at P < 0.05;different small letters indicate significant differences of the same time under different concentrations at P < 0.05. The same as below 图 1 酸、Pb、Cd胁迫对枫香种子可溶性蛋白含量的影响 Figure 1 Effects of acid, Pb, Cd stresses on soluble protein content in Liquidambar formosana seed germination process |
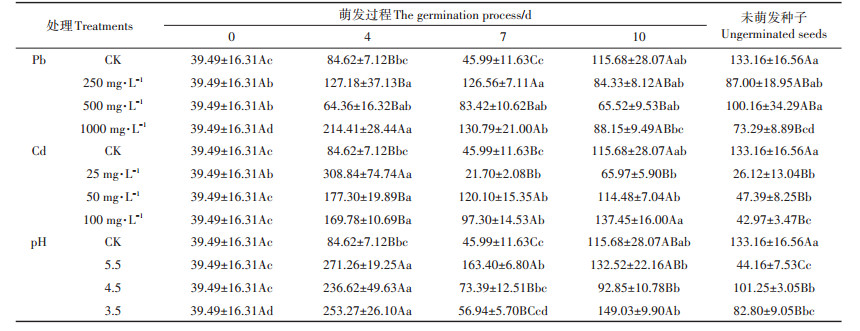
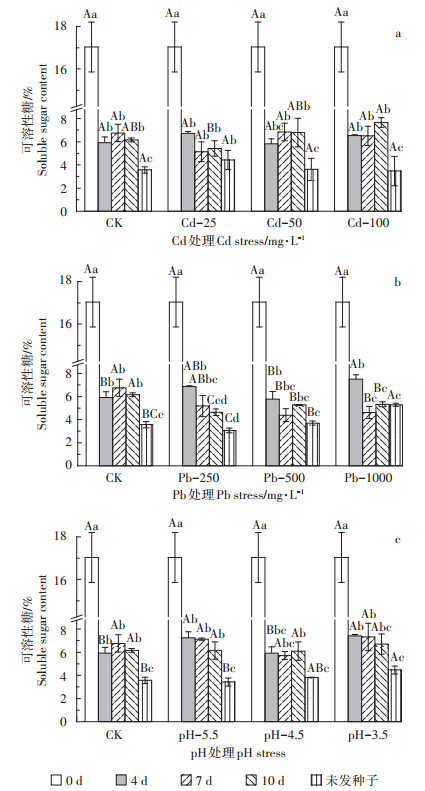
如图 2所示,相同处理下枫香种子萌发过程中第0 d(干种子)的可溶性糖含量显著高于其余萌发阶段(P < 0.05),且未萌发种子的可溶性糖均是最低含量(图 2a)。Cd胁迫第10 d时可溶性糖含量先减后增,Cd-25显著低于CK。发芽第4 d时随pH值减小,可溶性糖含量呈先增后减再增趋势,与第4 d Pb胁迫变化趋势一致,其中pH-3.5、pH-5.5、Pb-250和Pb- 1000显著高于CK(P < 0.05),相比CK分别提高了25.28%、22.56%、16.12%、26.82%。Pb胁迫第7 d时可溶性糖含量呈下降趋势,第10 d时则呈先降后增变化,CK均显著高于胁迫组(P < 0.05)。
|
图 2 酸、Pb、Cd胁迫对枫香种子可溶性糖含量的影响 Figure 2 Effects of acid, Pb, Cd stresses on soluble sugar content in Liquidambar formosana seed germination process |
枫香种子在萌发初期还原糖含量较低,在萌发过程中还原糖含量总体呈上升趋势,说明种子中的储藏物质发生水解形成还原性糖类(图 3),萌发中期(7 d)pH-5.5的还原糖含量和萌发后期(10 d)pH-4.5的还原糖含量均显著高于CK,分别比CK提高了62.19%、97.22%。Pb胁迫初期(4 d)及后期(10 d)Pb-250处理下还原糖含量均高于CK,其中第10 d达到显著水平(P < 0.05),呈多项式变化规律且波动范围大。Cd胁迫时,Cd-25处理在整个萌发进程中还原糖含量均高于CK(P < 0.05),可见Cd-25处理能促进枫香种子萌发过程中营养物质的水解,使还原糖含量高于CK。未萌发种子还原糖含量整体较低。
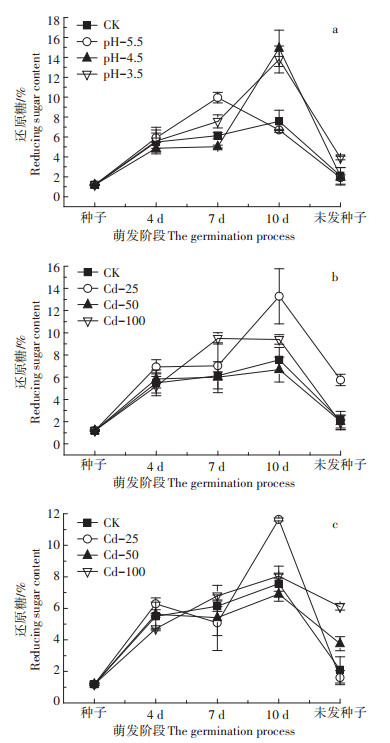
|
图 3 酸、Pb、Cd胁迫对枫香种子还原糖含量的影响 Figure 3 Effects of acid, Pb, Cd stresses on reducing sugar content in Liquidambar formosana seed germination process |
傅里叶变换红外光谱(FTIR)是一种基于化合物中官能团和极性键振动的结构分析技术,已被广泛应用于生物学。图 4~图 6为不同酸、Pb和Cd处理枫香种子各主要化学成分的综合反应,可以依据其所含化学成分的官能团特征信息,找到相应红外光谱吸收峰的归属。其中3 410.55 cm-1处附近的峰是分子间氢键O-H自由羟基的伸缩振动峰,主要来自于纤维素、半纤维素、多糖等碳水化合物。随着酸胁迫的增强,吸收峰移向高频3 428.87 cm-1,同时峰形变宽(图 4)。2 926.497 cm-1附近是羧酸O-H与甲基饱和C-H键的伸缩振动重叠峰,主要来自于碳水化合物、维生素和各种生物膜及细胞壁的组织等成分。2 855.142 cm-1处是CH2对称伸缩振动,来自长链烷基。不同处理下,枫香种子的光谱在1 746.225~1 162.885 cm-1波数范围内差异较大,特征峰的数量和相对吸光度值变化幅度均最为剧烈。1 746.225~1 652.723 cm-1波数主要为氨基酸蛋白质类C=O键伸缩振动,为酰胺Ⅰ带,1 652.723~1 541.835 cm-1是-NH弯曲振动,为酰胺Ⅱ带[16]。1 162.885 cm-1波数是蛋白质分子氨基酸残基、纤维素糖苷中C-O键的伸缩振动。720.294 2 cm-1是强特征性的脂肪族吸收峰,峰弱且宽。
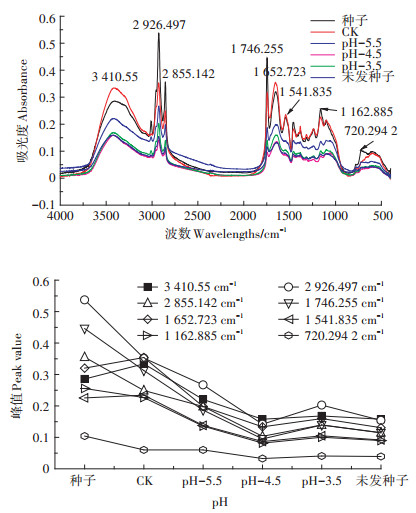
|
图 4 酸胁迫下枫香种子傅里叶红外光谱图、特征峰变化谱图 Figure 4 Effect of acid stress on FTIR spectra and band height changes of Liquidambar formosana seed |
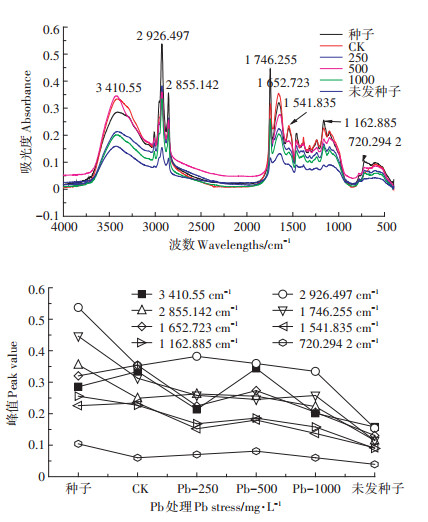
|
图 5 Pb胁迫下枫香种子傅里叶红外光谱图、特征峰变化谱图 Figure 5 Effect of lead stress on FTIR Spectra and band height changes of Liquidambar formosana seed |
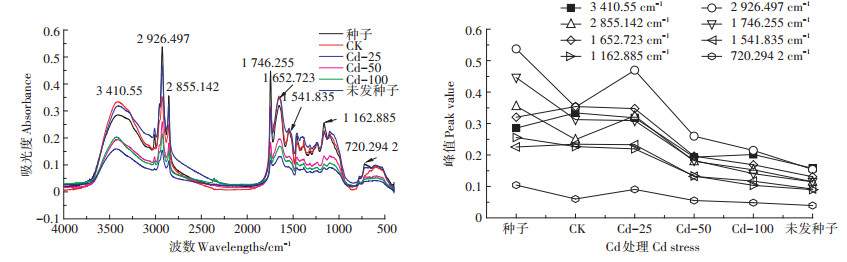
|
图 6 Cd胁迫下枫香种子傅里叶红外光谱图、特征峰变化谱图 Figure 6 Effect of Cd stress on FTIR spectra and band height changes of Liquidambar formosana seed |
图 4~图 6中种子吸光度最高的波数为2 926.497、2 855.142、1 746.225、1 162.885、720.294 2 cm-1表明干种子内总糖、含油脂化合物、蛋白质、维生素、脂肪等各有机质含量达最大值。种子萌发后,随酸胁迫(图 4)的增强特征峰变化值整体呈下降趋势,pH-3.5处理组峰值略有提升。H+浓度升高,小分子有机物质(碳水化合物)、多糖组分上含有的主要基团为-OH和COO-与H+结合,含量减少。为了降低H+的毒害,刺激发芽种子内其他物质转化为富含O-H的小分子有机物,其含量在pH-3.5略有增加。
图 5中Pb-250处理下2 926.497 cm-1对应的吸光度大于CK,饱和C-H的伸缩振动,刺激膜脂和细胞壁果胶中常见的酯类化合物合成。在3 410.55、2855.142 cm-1波数附近Pb-500处理下吸光度大于CK,同时峰形变窄,由此可见Pb-500处理利于纤维素、半纤维素、多糖等碳水化合物的合成。这说明高浓度的Pb促进了多糖、纤维素、半纤维素等有机物的分泌和运输,枫香种子则通过渗透作用来增强对Pb的抗逆性。Pb-1000时各波数吸收峰值再次下降,但吸光度变化幅度不大。
Cd-25胁迫组在2 926.497、2 855.142、720.294 2 cm-1等波数处的吸光度均大于CK,该峰的吸光度上升,可能通过提高所含的自由羟基数量参与结合重金属离子;分泌有机酸螯合Cr2+及分泌氨基酸、多肽类物质、蛋白质及醇、酯基、醚基或酚类等化合物,减少Cr2+的毒害。当Cr2+浓度大于50 mg·L-1时,峰值又呈下降趋势,原因是高Cr2+胁迫抑制了枫香种子分泌碳水化合物、有机酸、氨基酸、多肽类物质和蛋白质。说明低浓度Cd处理对枫香种子萌发过程中多糖、蛋白质、纤维素等有机质合成均有促进作用。
2.5 Pb、Cd和酸胁迫对枫香种子淀粉酶活性的影响 2.5.1 Pb、Cd和酸胁迫对枫香种子α-淀粉酶活性的影响淀粉是种子的主要储藏物质,种子萌发的过程中在淀粉酶的作用下转变为小分子糖类,为幼苗生长提供能量和物质合成碳架。因此,淀粉酶活力大小与种子的萌发关系密切。由表 1可知随Pb浓度的增加,枫香种子α-淀粉酶活性均在Pb-500时达最大值。α-淀粉酶在萌发过程中由糊粉层细胞合成并转运到胚乳参与淀粉的降解,随时间的延长快速上升,各Pb胁迫浓度下均在发芽第7 d时达最大值,后期活性下降。Cd胁迫下发芽初期(4 d)Cd-25处理组α-淀粉酶活性显著低于CK,发芽中后期(7、10 d)则显著高于CK(P < 0.05)。酸胁迫萌发过程中,α-淀粉酶活性呈先增后减趋势,均在第7 d达最大值。随pH值减小,发芽初期(4 d)α-淀粉酶活性并无显著差异(P> 0.05),第7 d时pH-3.5处理组显著大于CK,第10 d时同样呈先增后减趋势,胁迫处理均大于CK组。
|
|
表 1 Pb、Cd和酸胁迫下枫香种子α-淀粉酶活性(mg·g-1·min-1) Table 1 Activity of α-amylase in Liquidambar formosana seeds under Pb, Cd and acid stress(mg·g-1·min-1) |
β-淀粉酶可以以酶原的形式存在于干种子中,且酶活性在萌发过程中快速上升。由表 2可知,Pb胁迫下发芽初中期(4、7 d)β-淀粉酶活性呈多项式变化-增加-降低-增加趋势,Pb-1000显著大于CK(P < 0.05)。随时间的延长除CK外各Pb胁迫组均呈先增后减趋势。Cd处理下,萌发过程中除Cd-50外均呈先增后减再增变化。第4 d时Cd-25处理显著大于CK,而第10 d时却显著低于CK,说明萌发初期低浓度的Cd的胁迫促进枫香种子β-淀粉酶活性的增加,到后期却转为抑制。随pH值减小,第4 d时酸胁迫组β-淀粉酶含量均显著高于CK,第7 d时pH-4.5、pH- 5.5处理均显著高于CK(P < 0.05)。
|
|
表 2 Pb、Cd和酸胁迫下枫香种子β-淀粉酶活性(mg·g-1·min-1) Table 2 Activity of β-amylase in Liquidambar formosana seeds under Pb, Cd and acid stress(mg·g-1·min-1) |
未经胁迫处理的枫香种子胚乳细胞微观结构如图 7(a~d)所示,胚乳细胞的细胞壁边缘规则平整,轮廓清晰,细胞质基质浓厚,线粒体及其嵴结构清晰,液泡内分布着聚积成较大块状的高电子致密物质,其主要成分是脂蛋白,脂蛋白的数量较多,体积也较大,并有少量淀粉粒堆积,细胞代谢旺盛。图 7(e~h)中Pb胁迫下枫香种子胚乳细胞的细胞核向细胞壁靠拢,使细胞核一侧凹陷、变形,排布在细胞核周围的线粒体内部空泡化呈解体症状,脊突排列无序,被膜出现破裂,细胞中出现少量的黑色沙粒状的高电子致密物质,细胞壁与细胞膜出现严重质壁分离现象且细胞间隙有黑色颗粒沉淀,可能是大量Pb2+沉积的结果。Cd胁迫下(图 7i~l)细胞壁及细胞膜结构模糊、严重断裂,细胞质体中较多的类囊体出现解体,线粒体也开始降解,形状变得较为模糊,细胞壁及细胞质中有聚集的黑斑,推测是Cd2+沉积。在未萌发的种子中细胞内的膜系统空泡化严重,各细胞器出现不可逆的损伤(图 7m~p),并伴有大量脂滴,有研究认为:在种子成熟过程中,胚乳内脂类物质迅速增加可能是导致该种子萌发困难的主要原因[18],细胞核核膜、核质、核仁出现不同程度的破坏,其中核仁逐渐消失,降解产物与核质中已被破坏的染色体凝聚成为染色较深的纤维状颗粒。
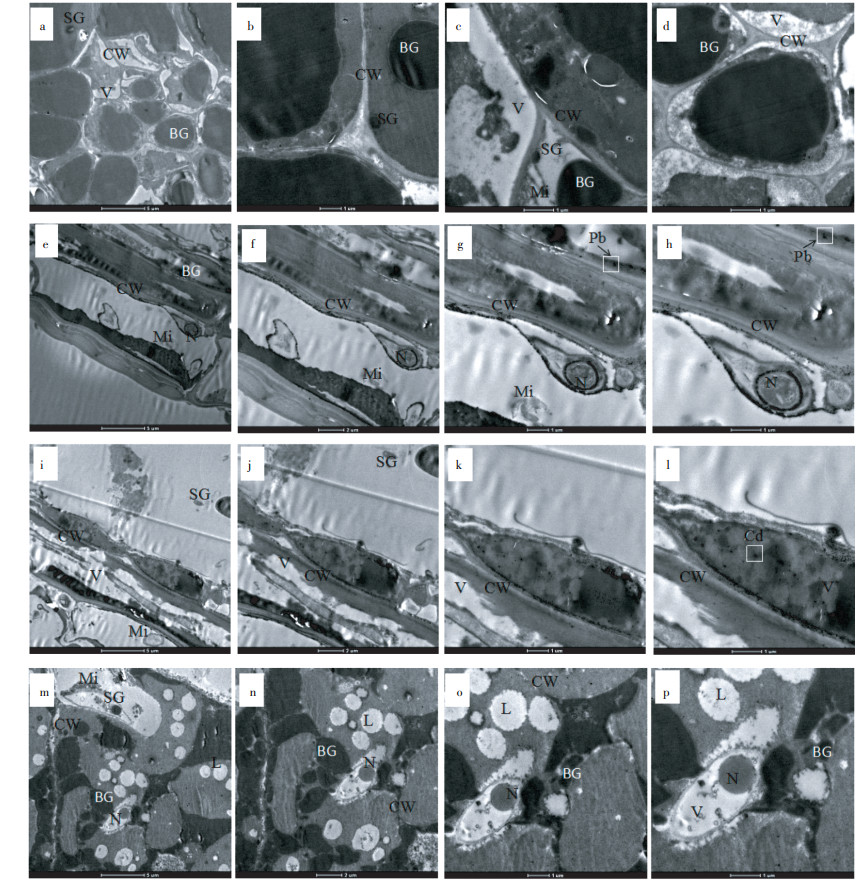
|
a,e,i,m×1900;b,f,j,n×2800;c,g,k,o×4800;d,h,l,p×6800。(a)、(b)、(c)、(d)为对照CK;(e)、(f)、(g)、(h)为Pb-1000 mg·L-1处理Pb Treatments;(i)、(j)、(k)、(l)为Cd-100 mg·L-1处理Cd Treatments;(m)、(n)、(o)、(p)为未萌发种子Ungerminated seeds;CW.细胞壁Cell wall;Mi.线粒体Mitochondria;BG高电子致密物质High electron-densed substances;N.细胞核Nucleus;V.液泡Vacuole;SG.淀粉粒Starch granule;L.脂滴Lipid droplet 图 7 不同处理下枫香种子胚乳细胞透射电镜图 Figure 7 Ultrastructure of endosperm cells of Isachne globosa in the different control treatments |
种子萌发是植物个体发育的最初阶段,而萌发所需要的物质和能量来源于淀粉和贮存蛋白等贮存物质的氧化分解和能量的释放。丁婉等[23]发现白三叶(Trifolium repens L.)种子的总糖含量在Zn胁迫下降低,同时萌发种子还原糖的含量会增高,以此来适应重金属Zn的胁迫;Zn胁迫对α-淀粉酶活性有促进作用。植物体内的可溶性蛋白质大多数是参与各种代谢的酶类,其含量的变化一定程度上反映了植物体内各种代谢活动的强弱[24]。刘玉艳等[10]发现Cd、Pb、Ni处理后,萌发初期降低地肤(Kochia scoparia)种子中的可溶性蛋白含量,随着处理时间的延长,处理的蛋白质含量逐渐高于CK;除了短期Cd处理可溶性糖含量极显著降低外,其余各处理均极显著提高了地肤萌发种子中的可溶性糖含量。本研究中3种胁迫条件下,随萌发时间的延长可溶性蛋白含量、可溶性糖含量均减少,还原糖则增加,α-淀粉酶活性及β-淀粉酶活性均呈先增后减趋势。其中随Pb浓度的增加,萌发初中期(4、7 d)高浓度的Pb胁迫促进了可溶性蛋白含量及β-淀粉酶活性降低,α-淀粉酶活性则在Pb-500时达最大值。第4 d的可溶性糖含量增加,第7 d则相反。发芽后期(10 d)还原糖含量整体较大,其中低浓度Pb-250处理下还原糖含量达最大值。说明枫香种子不同萌发时段内对Pb胁迫的响应表现为渗透物质之间相互协调,发芽初中期可溶性蛋白含量、及淀粉酶活性增加以保证前期Pb胁迫下种子的萌发。重金属Pb、Cd处理下后期还原糖含量均先增后减再增,造成这种现象的原因可能为,一是在种子萌发初期,由于大量的多糖在各种酶的催化作用下转化为还原糖,使种子中还原糖含量增加;二是由于种子萌发迅速,大量的还原糖被利用,而高浓度的Pb、Cd处理的种子萌发缓慢,消耗还原糖较少,造成还原糖的积累。Cd胁迫条件下渗透物质变化规律与Pb胁迫不同,发芽初期除淀粉酶活性外均无显著变化,第7 d的可溶性蛋白和还原糖及第10 d的可溶性糖含量均有显著的先减后增变化。可见随胁迫加深,萌发中后期对Cd的响应逐渐加强。酸胁迫下,各萌发阶段可溶性蛋白含量均呈下降趋势。萌发初中期可溶性糖、还原糖及β-淀粉酶活性均在pH-5.5时达最大值,萌发后期α-淀粉酶活性和还原糖含量则在pH- 4.5时达最大值。表明一定程度的弱酸(pH-5.5、pH- 4.5)能促进枫香种子萌发过程中渗透物质的合成。
傅里叶红外光谱技术(FTIR)是研究植物生长发育的一项重要且方便快捷的技术,不仅能够基于化合物中官能团和极性键的振动进行定量分析,还可以帮助判断分子中含有何种官能团,更重要的是从不同样品的红外光谱差异反映其在植物化学组成上的差异程度[22]。目前国内学者已经应用FTIR技术研究植物对重金属的耐性机制[25]。如李新等[22]应用傅里叶变换红外光谱技术研究了黄豆[Glycine max(Linn.)Merr]生理特性,通过增加糖类和氨基酸等有机物含量来响应Cr6+胁迫。王成等[25]通过FTIR技术揭示了构树(Broussonetia papyrifera L.)试管苗叶片通过合成更多的纤维素、蛋白质、羧酸以及部分酯类有机物来响应Cd胁迫。本研究中也发现Pb-250处理刺激膜脂和细胞壁果胶中常见的酯类化合物合成,Pb-500处理利于纤维素、半纤维素、多糖等碳水化合物的合成,以此来增强对Pb的抗逆性。低浓度Cd处理对枫香种子萌发过程中多糖、蛋白质、纤维素等有机质均有促进作用。这与前人研究结论一致[22, 25]。不同的是随酸胁迫的增强特征峰变化值整体呈下降趋势,而pH-3.5处理组峰值略有提升。为了降低H+的毒害,刺激发芽种子内其他物质转化为富含O-H的小分子有机物与H+结合,使其含量略有增加。
碳水化合物、半纤维素、蛋白质、脂肪和油脂是胚乳的主要贮藏物质。高浓度Pb、Cd胁迫下枫香种子胚乳细胞均受到不同程度的损伤,其中细胞核凹陷、变形,线粒体内部空泡化呈解体症状,脊突排列无序,被膜出现破裂,细胞中出现少量的黑色沙粒状的高电子致密物质。细胞壁及细胞膜结构模糊、严重断裂。这与徐义昆等[26]通过对Pb胁迫下的香蒲(Typha orientalis Presl)细胞超微结构观察的结论和陈丽鹃等[27]对烟草(Nicotiana tabacum L.)在Cd胁迫下的各细胞器变化以及通过扫描电镜观察小麦(Triticum aestivum Linn.)种子微波辐射前后胚乳微观结构[28]研究成果类似。细胞壁及细胞质中有聚集的黑斑,推测是Pb2+、Cd2+沉积,这对提高枫香对抗Pb、Cd毒害具有重要意义,其各细胞器沉积的Pb、Cd含量还有待进一步的研究。
4 结论(1)枫香种子对重金属Pb、Cd存在不同的阶段性响应,发芽第4、7 d可溶性糖、可溶性蛋白含量及淀粉酶活性增加,对Pb的抗逆性起主导作用,保证了前期Pb胁迫下种子的萌发。Cd处理发芽第7 d可溶性蛋白增加,而发芽第10 d则是可溶性糖含量升高。相比Cd胁迫枫香种子对Pb胁迫的响应更快速。
(2)大部分Pb2+、Cd2+沉积在枫香种子胚乳细胞的细胞壁及细胞质中,细胞区室化作用显著。
(3)Pb-250处理刺激膜脂和细胞壁果胶中常见的酯类化合物合成,Pb-500、Cd-25处理利于纤维素、半纤维素、蛋白质、多糖等有机质的合成,以此来增强对Pb、Cd的抗逆性。
(4)酸胁迫降低了可溶性蛋白含量,一定程度的弱酸(pH-5.5、pH-4.5)却能提高枫香种子萌发过程中可溶性糖、还原糖含量及淀粉酶活性。为了降低H+的毒害,刺激发芽种子内其他物质转化为富含O-H的小分子有机物,特征峰峰值在pH-3.5略有增加。综上,枫香可在重金属及酸污染的长汀稀土矿废弃地正常生长,其种子通过渗透物质相互协调及细胞区室化作用对Pb、Cd和酸胁迫有积极的响应。
| [1] |
王友生, 侯晓龙, 吴鹏飞, 等. 长汀稀土矿废弃地土壤重金属污染特征及其评价[J]. 安全与环境学报, 2014, 14(4): 259-262. WANG You-sheng, HOU Xiao-long, WU Peng-fei, et al. Analysis of the characteristics and the evaluation of heavy metal pollutions in the deserted land-area left-over by the rare earth miningin Changting, Fujian[J]. Journal of Safety and Environment, 2014, 14(4): 259-262. |
| [2] |
苏文湫, 祝怡斌. 赣州稀土矿山废弃地土壤重金属污染现状评价[J]. 有色金属, 2016, 68(4): 81-85. SU Wen-qiu, ZHU Yi-bin. Valuation of the soil heavy metal pollution in Ganzhou rare earth mine wasteland[J]. Nonferrous Metals, 2016, 68(4): 81-85. |
| [3] |
关军洪, 郝培尧, 董丽, 等. 矿山废弃地生态修复研究进展[J]. 生态科学, 2017, 36(2): 193-200. GUAN Jun-hong, HAO Pei-yao, DONG Li, et al. Review on ecological restoration of mine wasteland[J]. Ecological Science, 2017, 36(2): 193-200. |
| [4] |
李伟.离子型稀土废弃地景观生态恢复研究[D].福州: 福建农林大学, 2014. LI Wei. Research on landscape and ecology restoration of wasted ionic rare earth deposit in south China[D]. Fuzhou: Fujian Agriculture and Forestry University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10389-1015525039.htm |
| [5] |
仇荣亮, 仇浩, 雷梅, 等. 矿山及周边地区多金属污染土壤修复研究进展[J]. 农业环境科学学报, 2009, 28(6): 1085-1091. QIU Rong-liang, QIU Hao, LEI Mei, et al. Advances in research on remediation of multi-metal contaminated soil in mine and surrounding area[J]. Journal of Agro-Environment Science, 2009, 28(6): 1085-1091. DOI:10.3321/j.issn:1672-2043.2009.06.001 |
| [6] |
陈雪娇, 韩航, 侯晓龙, 等. 水土保持植物类芦对土壤酸胁迫的形态生理响应[J]. 草业学报, 2017, 26(4): 143-149. CHEN Xue-jiao, HAN Hang, HOU Xiao-long, et al. The morphological and physiological responses of the soil and water conservation plant Neyraudia reynaudiana to acid stress[J]. Acta Prataculturae Sinica, 2017, 26(4): 143-149. |
| [7] |
董文洪, 杨海, 令狐文生, 等. 土壤重金属污染及修复技术研究进展[J]. 化学试剂, 2016, 38(12): 1170-1174. DONG Wen-hong, YANG Hai, LINGHU Wen-sheng, et al. Current progress on remediation of heavy metal contaminated soil[J]. Chemical Reagents, 2016, 38(12): 1170-1174. |
| [8] |
蔡春婷, 汤克丽, 许旭萍, 等. 镉铅复合胁迫下根表铁锰氧化胶膜厚度对美洲商陆富集镉的影响[J]. 环境科学学报, 2017, 37(1): 298-307. CAI Chun-ting, TANG Ke-li, XU Xu-ping, et al. Effects of iron-manganese plaque thickness on Cd accumulation in Phytolacca americana under Cd-Pb combined stress[J]. Acta Scientiae Circumstantiae, 2017, 37(1): 298-307. |
| [9] |
胡国涛, 杨兴, 陈小米, 等. 速生树种竹柳对重金属胁迫的生理响应[J]. 环境科学学报, 2016, 36(10): 3870-3875. HU Guo -tao, YANG Xing, CHEN Xiao-mi, et al. Physiological responses of bamboo-willow plants to heavy metal stress[J]. Acta Scientiae Circumstantiae, 2016, 36(10): 3870-3875. |
| [10] |
刘玉艳, 于凤鸣, 陆鸣, 等. Cd, Pb, Ni胁迫对地肤种子萌发及其生理特性的影响[J]. 河北科技师范学院学报, 2013, 27(2): 7-11, 80. LIU Yu-yan, YU Feng-ming, LU Ming, et al. Effect of Cd, Pb, Ni on seed germination and physiology indexes of Kochia scoparia[J]. Hebei Normal University of Science, 2013, 27(2): 7-11, 80. |
| [11] |
Díaz L L, Bonilla P A, Reynel H E, et al. Sorption of heavy metal ions from aqueous solution using acid-treated avocado kernel seeds and its FTIR spectroscopy characterization[J]. Journal of Molecular Liquids, 2016, 215(3): 555-564. |
| [12] |
Weng B S, Xie X Y, Weiss D J, et al. Kandelia obovata(S., L.)Yong tolerance mechanisms to cadmium:Subcellular distribution, chemical forms and thiol pools[J]. Marine Pollution Bulletin, 2012, 64(11): 2453-2460. DOI:10.1016/j.marpolbul.2012.07.047 |
| [13] |
Insook L, Kyunghwa B, Hyunhee K, et al. Phytoremediation of soil cocontaminated with heavy metals and TNT using four plant species[J]. Journal of Environmental Science and Health, 2007, 42(3): 2039-2045. |
| [14] |
王满莲, 文香英, 韦霄, 等. 温度对3种金缕梅科植物种子萌发特性的影响[J]. 种子, 2016, 35(10): 79-83. WANG Man-lian, WEN Xiang-ying, WEI Xiao, et al. Effects of temperature on seed germination of three species of Hamamelidaceae[J]. Seed, 2016, 35(10): 79-83. DOI:10.3969/j.issn.1005-2690.2016.10.050 |
| [15] |
王友生, 吴鹏飞, 侯晓龙, 等. 稀土矿废弃地不同植被恢复模式对土壤肥力的影响[J]. 生态环境学报, 2015, 24(11): 1831-1836. WANG You-sheng, WU Peng-fei, HOU Xiao-long, et al. Effect of different revegetation model on soil properties in abandon mine area of rare earth[J]. Ecology and Environmental Sciences, 2015, 24(11): 1831-1836. |
| [16] |
韦美华. 不同播种时间对枫香种子萌发特性的影响[J]. 福建农业科技, 2016, 12(2): 31-33. WEI Mei -hua. Effects of different sowing time on seed germination characteristics of Liquidambar formosana[J]. Fujian Agricultural Science and Technology, 2016, 12(2): 31-33. |
| [17] |
Zhang L, Zhu M F, Tu Z C, et al. a-Glucosidase inhibition, antiglycation and antioxidant activities of Liquidambar formosana Hance leaf, and identification of phytochemical profile[J]. South African Journal of Botany, 2017, 113(9): 239-247. |
| [18] |
刘胜洪, 张雅君, 杨妙贤, 等. 稀土尾矿区土壤重金属污染与优势植物累积特征[J]. 生态环境学报, 2014, 23(6): 1042-1045. LIU Sheng-hong, ZHANG Ya-jun, YANG Miao-xian, et al. Heavy metal contamination of soil and concentration of dominant plants in rare earth mine tailing area[J]. Ecology and Environmental Sciences, 2014, 23(6): 1042-1045. DOI:10.3969/j.issn.1674-5906.2014.06.021 |
| [19] |
许亚夫, 李银保, 陈海花. 定南县废弃稀土矿区土壤中重金属元素Pb、Cr和Cu的测定[J]. 广东微量元素科学, 2012, 19(10): 10-14. XU Ya-fu, LI Yin-bao, CHEN Hai-hua. Determination of the content of heavy metal elements Pb, Cr and Cu in soil from abandoned rare earth mine in Dingnan county[J]. Guangdong Trace Elements Science, 2012, 19(10): 10-14. DOI:10.3969/j.issn.1006-446X.2012.10.003 |
| [20] |
王学奎. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2006. WANG Xue-kui. Principle and technology of plant physiology and biochemistry experiment[M]. Beijing: Higher Education Press, 2006. |
| [21] |
廖卓毅, 钱存梦, 马秋月, 等. 乌桕种子成熟过程中种皮和胚乳超微结构观察[J]. 南京林业大学学报(自然科学版), 2014, 38(6): 43-47. LIAO Zhuo-yi, QIAN Cun-meng, MA Qiu-yue, et al. Ultrastructure of seed coat and endosperm in the development of Sapium sebiferum seed mature[J]. Journal of Nanjing Forestry University(Natural Sciences Edition), 2014, 38(6): 43-47. |
| [22] |
李新, 刘正学, 余顺慧, 等. 铬胁迫对黄豆生理特性的FTIR研究和铬积累特征[J]. 中国农学通报, 2018, 34(4): 27-31. LI Xin, LIU Zheng-xue, YU Shun-hui, et al. Physiological response of Glycine max L. to Cr stress by FTIR spectroscopy and Cr accumulation characteristics[J]. Chinese Agricultural Science Bulletin, 2018, 34(4): 27-31. |
| [23] |
丁婉, 王梦娇, 王秀鹭, 等. 锌胁迫对白三叶种子萌发的影响[J]. 山西农业科学, 2015, 43(5): 532-535. DING Wan, WANG Meng-jiao, WANG Xiu-lu, et al. Effects of zinc stress on seed germination of Trifolium repens[J]. Journal of Shanxi Agricultural Sciences, 2015, 43(5): 532-535. DOI:10.3969/j.issn.1002-2481.2015.05.09 |
| [24] |
黄承玲, 高贵龙, 陈训, 等. 迷人杜鹃种子萌发过程中的生理变化[J]. 种子, 2010, 29(5): 94-96. HUANG Cheng-ling, GAO Gui-long, CHEN Xun, et al. Physiological changes of Rhododendron agastum Ba f. f. etW. W. Smduring seed germination[J]. Seed, 2010, 29(5): 94-96. DOI:10.3969/j.issn.1001-4705.2010.05.029 |
| [25] |
王成, 蒋泽平, 李文青, 等. FTIR-NIR研究镉胁迫对构树试管幼苗生长的影响与机理[J]. 农业环境科学学报, 2014, 33(4): 673-679. WANG Cheng, JIANG Ze-ping, LI Wen-qing, et al. FTIR-NIR spectrum study on response and mechanism of Broussonetia papyrifera L. sprout under cadmium stresses[J]. Journal of Agro-Environment Science, 2014, 33(4): 673-679. |
| [26] |
徐义昆, 徐小颖, 池源, 等. 香蒲对不同浓度Pb2+胁迫的生理应答及其细胞超微结构变化[J]. 西北植物学报, 2015, 35(10): 2018-2025. XU Yi-kun, XU Xiao-ying, CHI Yuan, et al. Physiological responses and ultrastructural changes of Typhaorientalis presl under Pb2+ stress[J]. Acta Botanica Boreali-Occidentalia Sinica, 2015, 35(10): 2018-2025. DOI:10.7606/j.issn.1000-4025.2015.10.2018 |
| [27] |
陈丽鹃, 周冀衡, 李强, 等. 镉对烟草的毒害及烟草抗镉机理研究进展[J]. 中国烟草科学, 2014, 35(6): 93-97. CHEN Li-juan, ZHOU Ji-heng, LI Qiang, et al. Advance in cadmium toxicity to tobacco and its resistance mechanism[J]. Chinese Tobacco Science, 2014, 35(6): 93-97. |
| [28] |
渠琛玲, 刘胜强, 王芳婷, 等. 微波辐射对小麦种子微观结构的影响[J]. 食品工业科技, 2017, 38(1): 125-128, 146. QU Chen-ling, LIU Sheng-qiang, WANG Fang-ting, et al. Influence of microwave radiation on wheat seed microstructure[J]. Science and Technology of Food Industry, 2017, 38(1): 125-128, 146. |
 2019, Vol. 38
2019, Vol. 38