利用硫酸盐还原菌(Sulfate reducing bacteria,SRB)进行污水处理的过程中外加碳源是保证处理效果的手段之一,传统碳源乳酸钠、乙醇等不仅成本高、不易运输,而且液体碳源往往具有一定毒性[1-3]。为此,近年来相关学者纷纷提出很多可代替传统碳源的新型碳源,其中生物质材料基于安全性和经济性成为研究的热点[4-9]。张雅琳等[10]利用甘蔗渣发酵液为SRB生长碳源处理含低浓度Cu2+的模拟矿山淋滤水,SRB对硫酸根还原率可达92.4%。而生物质在发酵过程中不仅浪费时间,也占用大量空间,因此,有相关学者对生物质材料浸泡液中碳源释放规律进行研究。邵留等[11]监测玉米芯、甘蔗渣、花生壳等6种生物质材料在16 d内蒸馏水浸泡液中总有机碳(TOC)和总碳(TC),结果发现6种材料浸出液中TOC含量均占TC的90%以上,均能释放出大量有机碳。张雯等[12]利用甘蔗渣等10种农业废弃物开展为期70 d的长效浸出实验,发现溶液中含有的有机质多为小分子结构物质和糖类物质,有利于微生物的代谢活动,保证了其作为碳源的可利用性。但直接利用生物质材料为SRB生长碳源的研究却很少,且SRB利用生物质材料处理废水过程中,生物质材料除了给SRB提供必要的生长碳源,其材料本身也具有较好的吸附性。考虑到甘蔗渣具有的高纤维素含量及碳源溶出性和吸附性,因此,本研究将其与SRB结合处理含硫酸盐废水,探讨甘蔗渣碳源释放和对SRB生长代谢活性影响规律,以期为SRB利用新型生物质碳源提供理论依据。
1 材料及方法 1.1 试验材料实验用菌土壤取自阜新市新邱区某煤矸石山下,为煤矸石覆盖20~40 cm深的土壤中,后将土壤菌悬液通过修正的Postgate培养基[13]富集,通过数次培养直到SRB为优势菌种后用于试验。试验用甘蔗渣来自广东惠州某制糖厂,甘蔗渣按试验设置粒径进行打磨、筛分。
1.2 试验方法 1.2.1 不同因素条件下甘蔗渣碳源释放规律不同pH对甘蔗渣碳源释放规律的影响:选取5目甘蔗渣5 g投放于200 mL蒸馏水中,用1%的NaOH和1%的HCl调节各体系pH分别为3、4、5、6、7,分别对应编号为1#~5#,密闭后放于35 ℃恒温摇床100 r·min-1,每隔一定时间检测1#~5#体系中的还原糖、化学需氧量(COD)释放量以及pH变化,考察不同pH条件下甘蔗渣碳源释放规律。
不同粒径对甘蔗渣碳源释放规律的影响:选取5、14、32、60、100目的甘蔗渣5 g投放于200 mL蒸馏水中,分别编号为1#~5#。用1%的NaOH和1%的HCl调节各体系pH为7,密闭后放于35 ℃恒温摇床100 r·min-1,每隔一定时间检测1#~5#体系中的还原糖、COD释放量以及pH变化,考察不同粒径条件下甘蔗渣碳源释放规律。
不同投加量对甘蔗渣碳源释放规律的影响:试验选取5目的甘蔗渣1、3、5、7、9 g投放于200 mL蒸馏水中,相应编号为1#~5#。用1%的NaOH和1%的HCl调节各体系pH为7,密闭后放于35 ℃恒温摇床100 r·min-1,每隔一定时间检测1#~5#体系中的还原糖和COD释放量以及pH变化,考察不同投加量条件下甘蔗渣碳源释放规律。
1.2.2 SRB以甘蔗渣为碳源时的生长活性正交试验配制只含有SO42-的废水,以SRB生物投加量,甘蔗渣的粒径和投加量为因素,其中SRB为含Fe2+培养基中生长60 h的SRB,此时其生物量最大为712 mg·L-1,分别投加5%、10%、15%的菌液体积,即100 mL废水对应投加生物量分别为35.6、71.2、106.8 mg,甘蔗渣的粒径和投加量分别按照32、60、100目和2.5、3.5、4.5 g投加至100 mL废水中,进行L9(33)正交试验,调节初始pH为7。评价指标为SO42-去除率、甘蔗渣还原糖水解速率和pH值,试验每24 h取样检测各指标,并取96 h的试验检测数据进行正交试验设计与结果分析,确定SRB以甘蔗渣为碳源条件下去除SO42-的最优配比。正交试验因素水平见表 1,L9(33)试验设计与结果分析见表 2。
|
|
表 1 L9(33)正交试验因素水平表 Table 1 L9(33) orthogonal test factor level table |
|
|
表 2 L9(33)试验设计与结果分析 Table 2 Results and analysis of L9(33) orthogonal test |
根据正交试验分析得到的SRB以甘蔗渣为碳源时的最优配比,即100 mL的废水中SRB投加量为71.2 mg,甘蔗渣粒径为100目,甘蔗渣投加量为4.5 g,用Na2SO4调节废水中SO42-初始浓度为1240 mg·L-1于500 mL锥形瓶中,密闭后放于恒温摇床100 r·min-1,35 ℃条件下培养,调节培养液的pH为7,每隔一定时间测培养基中剩余硫酸根浓度、氧化还原电位(ORP)和还原糖释放量。
1.3 检测项目及方法SO42-:铬酸钡分光光度法(HJ/T 432—2007);pH:采用PHS-3C型精密pH计进行测定;还原糖:苯酚-硫酸法;ORP:CT-8022氧化还原电位测量仪。
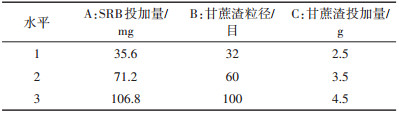
2 结果与分析 2.1 不同因素条件下甘蔗渣碳源释放规律 2.1.1 不同pH对甘蔗渣碳源释放规律的影响图 1(a)、图 1(b)是不同初始pH条件下甘蔗渣还原糖和COD释放曲线图,前10 h,由于甘蔗渣表层纤维素的快速溶出导致1#~5#体系中还原糖和COD释放量快速上升,10 h后,各体系中还原糖和COD释放量开始减少,最终1#~5#体系中还原糖和COD释放量分别为25.7、24.6、24.1、23.8、21.9 mg·g-1和270、267、260、297、251 mg·L-1。图 1(c)是10~96 h还原糖水解速率拟合直线,前10 h,甘蔗渣表层纤维素快速水解,甘蔗渣释碳不稳定,10 h后还原糖发生水解反应,从12~96 h还原糖水解速率拟合直线可以得出1#~5#体系还原糖水解速率斜率k分别为-0.014、-0.011、-0.007、-0.005、-0.004。还原糖水解速率拟合直线越平缓,斜率|k|值越接近于0,说明还原糖水解速率越缓慢。从图 1(d)可见,不同初始pH条件下,试验第2 d以后,1#~5#体系中pH逐渐趋近于并保持在4~4.5范围内。
|
图 1 不同初始pH条件下甘蔗渣各指标变化规律 Figure 1 The change rule of various indexes of bagasse under the initial pH condition |
甘蔗渣纤维素水解生成还原糖,主要包括葡萄糖、果糖、纤维二糖等[12]。闫加贺[14]在生物质材料两步法水解转化研究中发现葡萄糖在积累到一定浓度后会产生乙酸、乙酰丙酸、5-羟甲基糠醛等降解产物,乙酰丙酸为纤维素水解的终产物。杨茜[15]发现生物质材料的纤维素转化是一个连续一级反应,纤维素在转化成葡萄糖的同时,葡萄糖也在发生水解反应。因此,在还原糖水解反应中葡萄糖的水解反应起主导作用。张雯等[12]发现甘蔗渣浸出液pH值均处于较低水平,其浸出液中乙酸含量明显高于其他废弃物,并推测乙酸可能是导致其浸出液pH较低的主要因素。在低pH条件下,由于H+的存在一方面对葡萄糖水解产酸反应具有催化作用[16],加快葡萄糖水解速率,另一方面,由于β-1,4糖苷键链接D-葡萄糖形成的纤维素在水解过程中,β-1,4糖苷键是一种对酸敏感的缩醛键,H+可对β-1,4糖苷键的氧原子进行质子化,使水分子进攻α-C原子,导致β-1,4糖苷键发生断裂[17-18]。由此低pH值1#体系中,纤维素水解速率和葡萄糖水解速率均较快,不利于还原糖的持续积累,而较高pH值5#体系中,纤维素水解速率和葡萄糖水解速率均较慢,有利于还原糖的持续积累。因此,在正交试验和SRB生长代谢活性试验中均采用pH值为7的反应体系。
2.1.2 不同粒径对甘蔗渣碳源释放规律的影响图 2(a)、图 2(b)是不同粒径条件下甘蔗渣还原糖释放量和COD释放量变化曲线,前10 h,1#~5#体系中还原糖和COD释放量快速的波动上升,10 h后,各体系中还原糖和COD释放量缓慢减少,最终1#~5#体系中还原糖和COD释放量分别为25.1、21、16.8、27.8、32.5 mg·g-1和735、619、549、948、1051 mg·L-1。图 2(c)是12~96 h甘蔗渣还原糖水解速率拟合直线,1#~5#体系还原糖水解速率拟合直线的斜率k分别为-0.012、-0.013、-0.044、-0.005、-0.017,其拟合直线越平缓,斜率|k|值越接近于0,还原糖水解速率的减小幅度越小,葡萄糖水解反应越缓慢。从图 2(d)可见,在1#~5#初始pH为7的条件下,第1 d后1#~5#体系的pH降至4.43~4.99。

|
图 2 不同粒径甘蔗渣各指标变化规律 Figure 2 Changes in various indexes of different particle size bagasse |
不同粒径的甘蔗渣体系中均存在甘蔗渣纤维素生成还原糖的水解反应,从图 2(a)可见,在甘蔗渣粒径较小的4#、5#体系中,前10 h,其纤维素水解生成还原糖的速率较快,还原糖浓度逐渐升高,因此,葡萄糖浓度也在不断的增加,当葡萄糖积累到一定浓度时,纤维素水解生成葡萄糖的同时,葡萄糖也会水解成乙酸、乙酰丙酸、5-羟甲基糠醛等降解产物,表观还原糖浓度有所下降,说明10 h后葡萄糖水解速率大于纤维素水解速率。有研究表明SRB不易利用乙酸等葡萄糖水解产物进行生长代谢[19],乙酸在非解离状态下对SRB有一定的毒害作用。因此,葡萄糖水解速率越缓慢,甘蔗渣浸泡液中乙酸含量越低,葡萄糖浓度越高,越有利于SRB生长代谢活动,在4#体系中,60目的甘蔗渣浸泡液中还原糖的水解速率拟合直线的斜率|k|较其他体系更接近于0,其葡萄糖水解产酸反应缓慢,浸泡液中可积累较多的葡萄糖供后续试验SRB的生长代谢。因此,选取60目甘蔗渣为最佳粒径进行后续正交试验。
2.1.3 不同投加量对甘蔗渣碳源释放规律的影响图 3(a)、图 3(b)是不同投加量条件下甘蔗渣还原糖和COD释放量变化曲线图,前10 h,1#~5#体系中还原糖和COD释放量快速的波动上升,10 h后,各体系中还原糖和COD释放量有缓慢减少趋势,最终1#~5#体系中还原糖和COD释放量分别为25.97、25.21、19.1、23.19、15.2 mg·g-1和107、356、582、723、771 mg·L-1。图 3(c)是12~96 h甘蔗渣还原糖水解速率拟合直线,1#~5#体系还原糖水解速率拟合直线的斜率k分别为-0.018、-0.008、-0.009、-0.003、-0.004,其中斜率|k|值越接近于0,还原糖水解速率减小幅度越小,说明其在12~96 h内具有较高的碳源供应。从图 3(d)可见,在1#~5#初始pH为7的条件下,第1 d后1#~5#体系的pH有所下降。

|
图 3 不同投加量甘蔗渣各指标变化规律 Figure 3 The variation of various indexes of different dosages of bagasse |
不同甘蔗渣投加量的体系中,甘蔗渣纤维素水解生成还原糖的同时,葡萄糖也存在水解反应,在4#体系中,其还原糖水解速率拟合直线斜率|k|值较其他体系更接近于0,葡萄糖水解速率较慢,有利于葡萄糖的积累。同时不同投加量甘蔗渣水解液中pH变化规律相似,1#体系中第1 d后pH在5~6之间波动,2#~ 5#体系中第1 d后pH在4~5之间波动,说明甘蔗渣投加量越大,葡萄糖水解产酸越多,溶液中H+增加较多,不利于后续试验菌种SRB的生长代谢。因此,选取100 mL废水投加3.5 g甘蔗渣进行后续正交试验。
2.2 SRB以甘蔗渣为碳源时的生长活性正交试验 2.2.1 正交试验SO42-去除效果结果分析正交试验SO42-去除率极差分析见表 3。由表 3极差R可知,3个因素对SO42-去除率影响大小顺序为:B > C > A。根据均值大小确定SO42-去除率的最佳因素组合为A2B3C3。
|
|
表 3 SO42-去除效果直观分析(%) Table 3 SO42- removal effect visual analysis (%) |
正交试验还原糖水解速率极差分析见表 4。由表 4极差R可知,3个因素对还原糖水解速率影响大小顺序为:A > B > C。根据均值大小确定还原糖水解速率的最佳因素组合为A2B3C3。
|
|
表 4 还原糖水解速率直观分析(mg·g-1·h-1) Table 4 Visual analysis of hydrolysis rate of reducing sugar (mg·g-1·h-1) |
正交试验pH变化极差分析见表 5。由表 5极差R可知,3个因素对pH变化影响大小顺序为:A > B > C。根据均值大小确定调节pH的最佳因素组合为A3B1C2。
|
|
表 5 pH直观分析 Table 5 pH visual analysis |
综上所述,正交试验最优组合分别为A2B3C3、A2B3C3、A3B1C2,考虑到SO42-去除效果及还原糖水解速率等问题,选取正交组合A2B3C3进行后续试验,即100 mL的废水中SRB投加量为71.2 mg,甘蔗渣粒径为100目,甘蔗渣投加量为4.5 g。
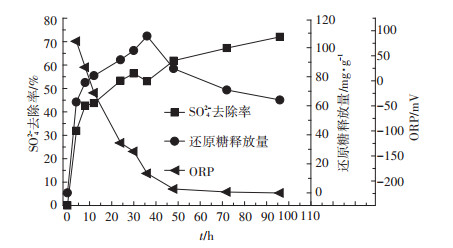
2.3 SRB利用甘蔗渣为碳源时生长代谢活性图 4是SRB以甘蔗渣为碳源时SRB对SO42-的去除率、甘蔗渣还原糖释放量和SRB生长ORP变化规律,试验初始SO42-浓度为1240 mg·L-1。由图 4可知,甘蔗渣水解液中的还原糖释放量先上升后下降,是由于生物质纤维素的水解过程中葡萄糖的快速积累会转化成乙酸、丙醛、糠醛、乙酰丙酸等物质及SRB对还原糖的利用,导致后期还原糖释放量有下降现象,最终还原糖释放量为64.03 mg·g-1。由于甘蔗渣对SO42-的快速吸附作用,前期SO42-去除率迅速增大,但是随着纤维素的水解反应,部分SO42-反溶回溶液当中,使在24 h时SO42-去除率小幅度下降,但是随着SRB对试验环境的适应,生长代谢活性增强,开始异化还原SO42-,SO42-去除率逐渐增大,最终SO42-去除率为75.23%。ORP逐渐下降,最终ORP为-224 mV,说明在试验后期,甘蔗渣也能为SRB提供较充足碳源。
|
图 4 以甘蔗渣为碳源时SRB生长活性 Figure 4 SRB growth activity under carbon source of bagasse |
(1)不同pH、不同甘蔗渣粒径和不同投加量条件下的碳源释放试验表明,在pH值为7的体系、甘蔗渣粒径和投量分别为60目、3.5 g·100 mL-1废水时,甘蔗渣中纤维素水解速率及葡萄糖水解速率均较慢,有利于还原糖的持续积累。
(2)在不同SRB投加量、不同甘蔗渣粒径及其不同投加量条件下的正交试验表明,当SRB投加量、甘蔗渣粒径和其投加量分别为71.2 mg、100目和4.5 g时,体系中SO42-去除效果最好、还原糖水解速率最小,为正交试验的最佳组合。
(3)SRB利用甘蔗渣为碳源时生长代谢活性试验表明,反应进行了96 h后,体系中SO42-去除率和还原糖释放量仍分别高达75.23%、64.03 mg·g-1,ORP低至-224 mV,说明甘蔗渣有持续供给碳源以保证SRB生长活性的能力。
| [1] |
姜烈, 何江涛, 许真, 等. 硝酸盐污染地下水原位碳源注入生物修复优化方案研究[J]. 农业环境科学学报, 2014, 33(10): 2014-2021. JIANG Lie, HE Jiang-tao, XU Zhen, et al. Study on bioremediation optimization scheme of in-situ carbon source injection of nitrate contaminated groundwater[J]. Journal of Agro-Environment Science, 2014, 33(10): 2014-2021. DOI:10.11654/jaes.2014.10.019 |
| [2] |
李洪静, 陈银广, 顾国维. 丙酸/乙酸对低能耗生物除磷脱氮系统的影响[J]. 中国环境科学, 2008(8): 673-678. LI Hong-jing, CHEN Yin-guang, GU Guo-wei. Effect of propionic acid/acetic acid on low energy consumption biological phosphorus and nitrogen removal system[J]. China Environmental Science, 2008(8): 673-678. DOI:10.3321/j.issn:1000-6923.2008.08.001 |
| [3] |
邵留, 徐祖信, 尹海龙. 污染水体脱氮工艺中外加碳源的研究进展[J]. 工业水处理, 2007(12): 10-14. SHAO Liu, XU Zu-xin, YIN Hai-long. Research progress on carbon source in denitrification process of polluted water bodies[J]. Industrial Water Treatment, 2007(12): 10-14. |
| [4] |
赵联芳, 朱伟, 高青. 补充植物碳源提高人工湿地脱氮效率[J]. 解放军理工大学学报(自然科学版), 2009, 10(6): 644-649. ZHAO Lian-fang, ZHU Wei, GAO Qing. Supplementing plant carbon source to improve nitrogen removal efficiency of constructed wetland[J]. Journal of PLA University of Science and Technology(Natural Science Edition), 2009, 10(6): 644-649. |
| [5] |
Ovez B. Batch biological denitrification using Arundo donax, Glycyrrhiza glabra, and Gracilaria verrucosa as carbon source[J]. Process Biochemistry, 2005, 41: 1289-1295. |
| [6] |
Ovez B, Ozgen S, Yuksel M. Biological denitrification in drinking water using Glycyrrhiza glabra and Arundo donax as the carbon source[J]. Process Biochemistry, 2006, 41: 1539-1544. DOI:10.1016/j.procbio.2006.02.015 |
| [7] |
邵留, 徐祖信, 金伟, 等. 以稻草为碳源和生物膜载体去除水中的硝酸盐[J]. 环境科学, 2009, 30(5): 1414-1419. SHAO Liu, XU Zu-xin, JIN Wei, et al. Removal of nitrate from water by using rice straw as carbon source and biofilm carrier[J]. Environmental Science, 2009, 30(5): 1414-1419. DOI:10.3321/j.issn:0250-3301.2009.05.027 |
| [8] |
李晔, 章旻, 陈家宏, 等. 污水反硝化脱氮的固态有机碳源选择实验研究[J]. 武汉理工大学学报, 2010, 32(6): 27-31. LI Ye, ZHANG Min, CHEN Jia-hong, et al. Experimental study on selection of solid organic carbon source for denitrification and denitrification of wastewater[J]. Journal of Wuhan University of Technology, 2010, 32(6): 27-31. DOI:10.3963/j.issn.1671-4431.2010.06.007 |
| [9] |
曹文平, 张永明, 李亚峰, 等. 竹丝填充床对高有机负荷及低C/N水质的脱氮特性[J]. 中国环境科学, 2010, 30(8): 1067-1072. CAO Wen-ping, ZHANG Yong-ming, LI Ya-feng, et al. Denitrification characteristics of bamboo filled bed for high organic load and low C/N water quality[J]. China Environmental Science, 2010, 30(8): 1067-1072. |
| [10] |
张雅琳, 胡学伟, 夏丽娟, 等. 甘蔗渣为缓释碳源负载SRB处理模拟矿山淋滤水[J]. 环境工程学报, 2016, 10(5): 2355-2360. ZHANG Ya-lin, HU Xue-wei, XIA Li-juan, et al. Sugarcane bagasse for slow release carbon source loading SRB treatment simulated mine leaching water[J]. Journal of Environmental Engineering, 2016, 10(5): 2355-2360. |
| [11] |
邵留, 徐祖信, 金伟, 等. 农业废物反硝化固体碳源的优选[J]. 中国环境科学, 2011, 31(5): 748-754. SHAO Liu, XU Zu -xin, JIN Wei, et al. Optimization of denitrifying solid carbon source for agricultural waste[J]. China Environmental Science, 2011, 31(5): 748-754. |
| [12] |
张雯, 张亚平, 尹琳, 等. 以10种农业废弃物为基料的地下水反硝化碳源属性的实验研究[J]. 环境科学学报, 2017, 37(5): 1787-1797. ZHANG Wen, ZHANG Ya-ping, YIN Lin, et al. Experimental study on the properties of denitrifying carbon source in groundwater based on 10 kinds of agricultural wastes[J]. Acta Scientiae Circumstantiae, 2017, 37(5): 1787-1797. |
| [13] |
赵莹.硫酸盐还原菌的分离及金属离子去除机理的研究[D].吉林: 吉林大学, 2016. ZHAO Ying. Separation of sulfate-reducing bacteria and mechanism of metal ion removal[D]. Jilin: Jilin University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10183-1016091454.htm |
| [14] |
闫加贺.生物质在H2O-SO2体系中两步法水解转化的研究[D].北京: 北京化工大学, 2014. YAN Jia -he. Study on two-step hydrolysis of biomass in H2O-SO2 system[D]. Beijing: Beijing University of Chemical Technology, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10010-1015515952.htm |
| [15] |
杨茜.可渗透固定化硫酸盐还原菌反应墙的碳源缓释规律与可利用性研究[D].芜湖: 安徽工程大学, 2014. YANG Qian. Study on the slow release law and availability of carbon source in permeable sulfate-reducing bacteria reaction wall[D]. Wuhu: Anhui Polytechnic University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10363-1015559920.htm |
| [16] |
姜楠, 谢楠, 齐崴, 等. 硫酸催化葡萄糖制备乙酰丙酸的过程强化[J]. 化工进展, 2014, 33(11): 2888-2893. JIANG Nan, XIE Nan, QI Wei, et al. Process Strengthening of glucose catalyzed by glucose to prepare levulinic acid[J]. Chemical Industry and Engineering Progress, 2014, 33(11): 2888-2893. |
| [17] |
Kumar S, Gupta R, Lee Y Y, et al. Cellulose pretreatment in subcritical water:Effect of temperature on molecular structure and enzymatic reactivity[J]. Bioresource Technol, 2010, 101(4): 1337-1347. DOI:10.1016/j.biortech.2009.09.035 |
| [18] |
邓奥杰.玉米芯两步法高效制备糠醛的研究[D].广州: 华南理工大学, 2016. DENG Ao -jie. Study on the efficient preparation of furfural by corn cob two-step method[D]. Guangzhou: South China University of Technology, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10561-1016736880.htm |
| [19] |
曹雅俊, 张广积, 毛在砂. 硫酸盐还原菌对不同碳源的利用率[J]. 中国有色金属学报, 2008, 18(1): 96-100. CAO Ya-jun, ZHANG Guang-ji, MAO Zai-sha. The utilization ratio of sulfate reducing bacteria to different carbon sources[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(1): 96-100. DOI:10.3321/j.issn:1004-0609.2008.01.017 |
 2019, Vol. 38
2019, Vol. 38