石油对土壤造成的污染一直是国内外所关注的环境问题,由于石油化工行业往往产生大量高盐度废水,因而石油污染土壤常伴有盐碱化的发生。作为石油中的一类重要成分,多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)具有低水溶性、高毒性、生物蓄积性、半挥发性和难降解性,有些成分有“三致”效应,其中16种PAHs被美国环保局(US EPA)列为“优先控制污染物”[1]。一些具有4个及4个以上苯环数的高分子量的PAHs在土壤中的半衰期达数十年甚至更长[2]。PAHs在高盐度环境中的疏水性更强,从而延长了在环境中的半衰期,对生态环境会造成更大的危害[3]。
微生物修复在PAHs去除中起着重要作用。微生物作为生物修复的功能主体,其种类、群落组成、活性、数量等对有机物的降解效率和生物利用途径起着决定性作用[4]。可降解PAHs的微生物包括细菌、真菌和藻类,其中细菌在大多数环境中发挥主要作用。此外,PAHs的生物降解很大程度上还取决于其自身分子结构的复杂性[5]。对于低环PAHs,即一些2、3环的PAHs,如萘、蒽、菲、芴等,此类PAHs分子结构简单,具有较高的水溶性,因此容易从自然界分离得到适用的降解菌株[6]。对于4环及4环以上的PAHs,由于其分子结构复杂、电子云密度高、很难被氧化,而且水溶性差、热稳定性强、固-水分配系数高,较难分离得到适用的降解菌[7]。在实际应用中,由于污染物性质、土壤成分不同,导致外源微生物对PAHs的降解率偏低。如非嗜盐微生物不适合于高盐环境中的PAHs生物降解,这是因为高盐度可能会引起非嗜盐微生物体内蛋白质等大分子物质构象变形,进而影响蛋白质的活性,抑制一些重要的生物反应;高盐度也可能使环境中氧浓度减少,从而降低微生物代谢活性[8]。一般根据适宜生长的盐度范围,可将嗜盐菌分为轻度嗜盐菌、中度嗜盐菌和极端嗜盐菌。其中,适宜盐度为1%~3%的菌株为轻度嗜盐菌,3%~15%为中度嗜盐菌,大于15%为极端嗜盐菌[9]。目前,从石油污染土壤、工业含盐废水、海水和海洋沉积物中已分离出了一些PAHs嗜盐菌,但大部分嗜盐菌只能以低环PAHs为唯一碳源和氮源生长。Hedlund等[10]从海湾沉积物中筛选出两株能以萘为唯一碳源和能源生长的嗜盐菌NAG-2N-113和NAG-2N-26,经生态学观察、生理生化特性及16S rDNA比对表明其属于Neptunomonas naphthovorans,两株菌可在pH 6.5~8.5以及盐度1.75%~7.0%的范围内生长。Cui等[11]以高盐培养基驯化、分离获得一株嗜盐菌AD-3,经16Sr DNA比对鉴定为Martelella,该菌能在3%的盐度下,6 d内将200 mg·L-1的菲完全降解,但其不能利用荧蒽、芘及苯并芘等高环PAHs。厉阗等[12]研究表明拟香味菌Y6(Myroides odoratimimus strain)能以硝基苯为单一碳源和氮源进行代谢,在硝基苯初始含量200 mg· L-1和NaCl含量7%的条件下,最佳降解温度28 ℃,pH值6.0,D600=1,168 h硝基苯降解率达到67.5%。Wang等[13]从石油污染盐土中分离出一个在10%的盐度条件下能以菲为唯一碳源生长的菌团CY-1,其主要以中度嗜盐菌Marinobacter为主。已分离到的能够在盐环境中降解高环PAHs的菌株还比较少,主要集中在Bacillus、Halomonas、Cycloclasticus、Mycobacterium、Pseudoalteromonas、Thalassospirasp等菌属[14-16]。因此,针对PAHs污染盐碱土壤,必须开发嗜盐碱微生物资源以保证高盐碱环境中PAHs的降解效果。
本研究以芘为唯一碳源和能源,从长期受石油污染的油田土壤中筛选出可利用高环PAHs的嗜盐碱菌,并从降解能力、耐盐碱特性、不同盐碱条件对降解效率的影响等方面对其进行了初步研究,对丰富降解高环PAHs的微生物资源和指导盐碱环境中PAHs污染土壤的微生物修复具有重要意义。
1 材料与方法 1.1 试验材料 1.1.1 石油污染土壤石油污染土壤采自延长油田子北采油厂。
1.1.2 污染物以芘和苯并[a]芘分别作为4环和5环PAHs的代表性污染物。纯度均>98%,购自上海笛柏生物科技有限公司。
芘和苯并[a]芘母液的配制:以丙酮为溶剂,分别配制5 g·L-1和0.5 g·L-1的芘的丙酮溶液和苯并[a]芘的丙酮溶液,并用已灭菌(121 ℃,20 min)的0.22 μm有机滤膜过滤除菌,4 ℃冰箱保存备用。
1.1.3 培养基盐度为5%的各培养基的配制方法如下:
无机盐培养液:(NH4)2SO4 1 g、K2HPO4 0.8 g、KH2PO4 0.2 g、MgSO4·7H2O 0.2 g、CaCl2·2H2O 0.1 g、葡萄糖0.05 g、NaCl 43.5 g、MgCl2·6H2O 6.5 g和微量元素FeSO4·7H2O 0.012 g、MnSO4·7H2O 0.003 g、ZnSO4· 7H2O 0.003 g、CoSO4 · 7H2O 0.001 g、(NH4)6Mo7O24 · 4H2O 0.001 g,蒸馏水定容至1 L,调节pH为8.6,121 ℃灭菌20 min。
无机盐固体培养基:上述无机盐培养液中加入2%的琼脂,pH 8.6,121 ℃灭菌20 min,制作培养基平板,待其凝固后取0.5 mL已过滤除菌的芘母液(5 g· L-1)涂于表面,待丙酮挥发后形成一层芘的固体膜。
牛肉膏蛋白胨培养基:牛肉膏5 g,蛋白胨10 g,NaCl 43.5 g,MgCl2·6H2O 6.5 g,蒸馏水定容至1 L,pH 8.6。
1.2 试验方法 1.2.1 嗜盐碱高环PAHs降解菌的富集、纯化以芘为唯一碳源,采用定时定量转接、逐步提高碳源浓度的方法对PAHs降解菌进行富集。称取5 g石油污染土壤,加入到45 mL无机盐培养液中,加入0.25 mL芘母液使芘的终浓度为25 mg·L-1,30 ℃恒温摇床避光富集培养5 d;取菌液5 mL,加入到45 mL新鲜的无机盐培养液中,加入0.5 mL芘母液,使芘的终浓度为50 mg·L-1,30 ℃恒温摇床避光富集培养5 d。采用同样的方法,将芘的浓度依次提高至75、100 mg·L-1,并分别在30 ℃恒温摇床避光富集培养5 d。
将最后一次富集培养的菌液用无机盐培养液进行梯度稀释,取10-1、10-2、10-3稀释液各100 μL涂布于无机盐固体培养基上,30 ℃培养至有肉眼可见的明显菌落,根据菌落外部形态,挑取其中生长旺盛的单菌落进一步于无机盐固体培养基平板中纯化,如此反复多次,直至分离出纯菌。再将该菌落接种于含芘的无机盐培养液中培养以验证其是否能以芘为唯一碳源生长。纯化后的菌种保存于盐度为5%的牛肉膏蛋白胨培养基斜面中。
1.2.2 菌株耐盐碱特性分析通过分析各菌株在pH为8.6时不同盐度条件以及盐度为5%时不同pH环境中的生长特性,研究其耐盐碱特性。在无机盐培养液的基础上调整盐浓度(0、1%、5%、8%、10%、15%、20%)和pH(5、6、7、8、9、10、11),121 ℃灭菌20 min,冷却后加入已过滤除菌的芘母液,使其终浓度为50 mg·L-1。将已纯化的菌分别接入不同盐度和pH的培养液中,30 ℃、140 r·min-1振荡培养,3 d后测定降解菌生长情况(OD600 nm)。每个处理设3个重复。
1.2.3 分离菌株对PAHs降解能力分析菌悬液的制备:将芘母液过滤除菌,取1 mL添加到100 mL无机盐培养液中,使芘的终浓度为50 mg· L-1,将其放置于恒温振荡培养箱中振荡,使丙酮挥发尽。无菌条件下,挑取已纯化的菌株,接种于含芘的无机盐培养液中,30 ℃、140 r·min-1培养7 d,5000 r· min-1离心5 min,弃掉上清液,用适量新鲜无机盐培养液重悬,再次离心、重悬,获得OD600 nm值约0.25的菌悬液。
各菌株对芘和苯并[a]芘的降解:向含有芘(初始浓度为50 mg·L-1)和苯并[a]芘(初始浓度为5 mg·L-1)的5 mL无机盐培养液中,接种1 mL菌悬液,30 ℃,140 r·min-1避光振荡培养,分别测定0 d和7 d时芘和苯并[a]芘的含量。每处理设3个重复,以不接种菌液为对照组。
1.2.4 不同盐度和pH条件下各菌株对PAHs降解特性分析菌悬液的制备同1.2.3。
在无机盐培养液的基础上调整盐浓度(0、1%、5%、8%、10%、15%、20%)和pH(5、6、7、8、9、10、11),121 ℃灭菌20 min,冷却后加入已过滤除菌的芘母液,使其终浓度为100 mg·L-1。置于恒温振荡培养箱中振荡,使丙酮挥发尽。取1 mL菌悬液接种至5 mL该培养液中,30 ℃,140 r·min-1避光振荡培养,分别测定0 d和7 d时芘的含量。
1.3 分析方法 1.3.1 菌株鉴定对筛选出的菌株进行菌落形态、细胞形态的观察以及生理生化试验(吲哚试验、硝酸盐还原试验、亚硝酸盐反应试验、明胶水解试验、吐温80试验,接触酶试验和淀粉水解试验等),其方法均参考《常见细菌系统鉴定手册》[17]。
将筛选出的高效菌株交由华大基因科技有限公司进行16S rRNA序列测定,将序列信息输入NCBI(www.ncbi.nlm.nih.gov)数据库进行BLAST分析,挑选模式菌种序列,利用MEGA软件和Neighbor-Joining法构建系统发育树,发育树根据邻位法建立,所取bootstraps值为1000,Flavobacterium antarcticum DSM 19726(AT1026)为外源菌株。
1.3.2 溶液中芘和苯并[a]芘含量的测定向反应体系中加入10 mL二氯甲烷,180 r·min-1振荡萃取5 min,转移至分液漏斗中,静置,将有机相经无水硫酸钠(400 ℃,2~3 h)过滤除水,萃取2次,合并萃取液,待溶剂挥干,用色谱纯乙腈定容至1 mL。采用HPLC法(Agilent-1220高效液相色谱仪)测定。色谱条件:进样体积10 μL;柱温25 ℃;流速1 mL· min-1;流动相为水和乙腈;流动相梯度比例为0 min,10:90水/乙腈;1 min,100%乙腈;9 min,10:90水/乙腈;VWD检测波长:254 nm。用外标法以峰面积对目标化合物进行定量。通过下式计算芘或苯并[a]芘的降解率:
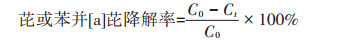
|
式中:C0为0 d时所测定的芘或苯并[a]芘的实际浓度;Ct为7 d后芘或苯并[a]芘的浓度。
2 结果与分析 2.1 嗜盐碱高环PAHs降解菌的分离鉴定以芘为唯一碳源和能源,通过逐步提高碳源浓度的方法,在含盐量为5%、pH为8.6的无机盐培养液中逐渐富集降解菌,培养液中悬浮的芘化合物逐步减少直至消失,同时,培养液明显变浑浊,说明微生物利用了底物芘,并大量繁殖。在表面涂有芘的无机盐固体培养基上,经转接5代后,分离出6株形状、大小、颜色等不同,且能在菌落周围产生透明圈的菌株,编号为SYP-1、SYP-2、SYP-3、SYP-4、SYP-5、SYP-11,其在无机盐固体培养基上培养5 d后的形态特征如表 1所示。
|
|
表 1 分离菌株形态特征 Table 1 Morphological characteristics of isolated strains |
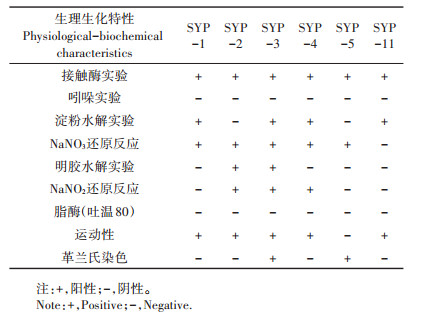
通过生理生化特征分析(表 2),结合16S rRNA基因序列对比(表 3),对所分离的菌株进行了鉴定。结果表明,该6株菌归为3个不同的属。其中,SYP-1与代尔夫特菌属(Delftia sp.)中的多个菌种基因序列相似性达99%以上,SYP-2、SYP-4和SYP-11与海杆菌属(Marinobacter sp.)中的多个菌种基因序列相似性达99%以上,SYP-3和SYP-5与芽孢杆菌属(Bacillus sp.)中的多个菌种基因序列相似性达99%以上。通过与基因库中典型模式菌株序列构建系统发育树(图 1),分析了各菌株的进化地位,进一步确定,SYP-1为Delftia sp.属,SYP -2、SYP-4和SYP - 11为Marinobacter sp.属,SYP-3和SYP-5为Bacillus sp.属。
|
|
表 2 分离菌株的生理生化特性 Table 2 Physiological-biochemical characteristics of isolated strains |
|
|
表 3 16S rRNA基因序列对比结果 Table 3 Alignment results of 16S rRNA sequences |

|
图 1 基于16S rRNA基因序列的系统发育树 Figure 1 Phylogenetic tree of 16S rRNA sequences |
通过改变无机盐培养液的盐度和pH值,测试了所筛菌株的耐盐碱特性,结果如表 4所示。菌株SYP-1、SYP-2、SYP-3和SYP-11的盐度生长范围为0~20%,菌株SYP-4和SYP-5的盐度生长范围为0~ 15%。SYP-1、SYP-2和SYP-3的最适生长盐度达5%,SYP-4、SYP-5和SYP-11的最适生长盐度达8%。6株菌均可在pH为5~10的环境中生长,菌株SYP-1和SYP-5的最适生长pH为10,菌株SYP-2、SYP-3、SYP-4和SYP-11的最适生长pH为9。
|
|
表 4 分离菌株的耐盐碱特性 Table 4 Salt and alkali resistance properties of the isolated strains |
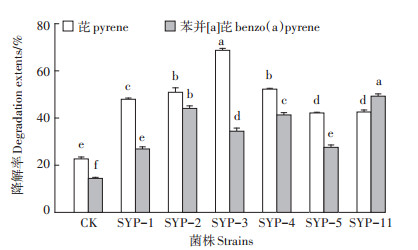
将各菌株接种到分别含有芘(50 mg·L-1)和苯并[a]芘(5 mg·L-1)的无机盐培养液中,研究其对PAHs的降解情况。结果表明(图 2),7 d后,各菌株对芘和苯并[a]芘均有不同程度的降解,其中SYP-3对芘的降解效率最高,达到68.8%;其次分别为SYP-2和SYP- 4,可使芘的降解率达52.3%和51.0%,SYP-1、SYP- 11和SYP-5可使芘的降解率分别达48.1%、42.7%和42.3%;SYP-11对苯并[a]芘的降解效率最高,达到49.4%;其次分别为SYP-2和SYP-4,使苯并[a]芘的降解率达44.2%和41.4%。SYP-3、SYP-5和SYP-1可使苯并[a]芘的降解率分别达34.5%、27.7%和27.0%。
|
图 2 各菌株对芘和苯并[a]芘的降解能力 Figure 2 Degradation effects of different strains on pyrene and benzo(a)pyrene |
综合不同菌株对芘和苯并[a]芘的降解能力,选用SYP-2、SYP-3、SYP-4和SYP-11这4株对芘和苯并[a]芘菌具有较高降解能力的菌株,研究了不同盐度和pH条件下其对芘降解效率的影响。
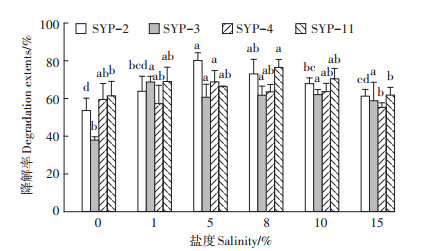
2.4.1 不同盐度条件下菌株对PAHs降解特性在芘浓度为50 mg·L-1,pH为8.6,盐度为0~15%的范围内,菌株SYP-2、SYP-3、SYP-4和SYP-11对芘的降解效率如图 3所示。可以看出,4株菌对芘降解具广泛的盐度范围和较高的耐盐性。菌株SYP-2在5%的盐度条件下对芘的降解率达到80.1%;SYP- 3在1%~15%的盐度条件下对芘的降解效率达58.8%~68.8%;SYP-4在0~10%的盐度条件下对芘的降解效率没有显著差异,在该盐度范围内,芘降解率达到57.3%~68.8%;SYP-11在1%~10%的盐度范围内对芘的降解效率无明显差异,该盐度条件下芘的降解率达66.2%~76.4%。
|
图 3 不同盐度条件下菌株对芘的降解效果 Figure 3 Degradation effects of strains on pyrene under different salinity conditions |
在芘浓度为50 mg·L-1,盐度为5%,pH为5~10的范围内,菌株SYP-2、SYP-3、SYP-4和SYP-11对芘的降解效率如图 4所示。可以看出,在5~10的pH范围内,4株菌对芘均具有良好的降解效果。具体来看,芘的最大降解率主要集中在pH 8~9的范围内,其中菌株SYP-2、SYP-3和SYP-4在pH为9时对芘的降解率分别达59.9%、64.9%和65.5%;SYP-11在pH为8时对芘的降解率达69.6%。
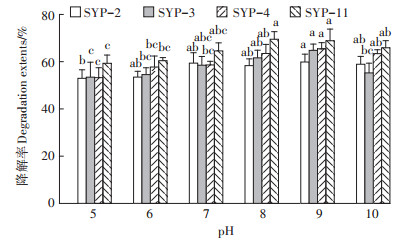
|
图 4 不同pH条件下菌株对芘的降解效果 Figure 4 Degradation effects of strains on pyrene under different pH conditions |
目前,已分离到的能够在盐碱环境中降解PAHs尤其是高环PAHs的菌株还比较少。因而,有必要针对盐碱环境中的PAHs,开发嗜盐碱微生物资源以保证其降解效果。Wu等[18]从石化污水排放点分离出一株代尔夫特菌Delftia lacustris strain LZ-C,研究发现该菌株可降解萘酚、萘、2-甲基萘和甲苯等多环芳烃,并可在2.5 mol·L-1的盐度下生长。李倩等[19]从黄海沉积物中分离到一株石油烃降解菌Marinobacter sp. PY97S,该菌株能降解多种多环芳烃和烷烃,其NaCl浓度生长范围是0~10%(最适为0),初始pH生长范围为6~9(最适为7)。Zhou等[20]从黄海沿岸土壤中分离出的嗜盐菌株Thalassospira sp.strain TSL5-1可在0.5%~19.5%的盐度范围内以芘为唯一碳源生长。本研究所筛选的6株PAHs降解菌中,4株菌(SYP-1、SYP-2、SYP-3、SYP-11)的可生长盐度范围为0~20%,2株菌(SYP-4、SYP-5)的可生长盐度范围为0~15%,它们的最适生长盐度达5%~8%,6株菌均可在pH为5~10的环境中生长,最适生长pH达9~10。相较而言,本研究所筛选的6株降解菌均具有较宽的耐盐碱谱和较高的耐盐碱性。
盐度和pH是影响PAHs降解菌降解效率的重要因素[21]。有研究表明,当盐浓度高于3%,pH大于9时,非嗜盐碱微生物的代谢会受到限制,使其生物修复效率明显降低,甚至丧失修复能力[22]。Minai等[23]研究表明,石油污染土壤中微生物在1.0%的盐度下对菲、蒽和芘的降解率最高,当超过最适盐度1%时,PAHs的降解率随盐度的增加而降低。Arulazhagan等[24]从盐制造公司的工业污泥中富集出可在盐环境中以菲为唯一碳源的菌团,当以菲为苯并[e]芘的共代谢底物时,NaCl浓度为30 g·L-1的条件下,该菌团7 d内可将苯并[e]芘降解80%,5 d内可将菲降解99%;当NaCl浓度提高至60 g·L-1时,苯并[e]芘和菲的降解率明显降低(苯并[e]芘10 d的降解率为65%,菲8 d的降解率为97%);当NaCl浓度提高至90 g·L-1时,菲和苯并[e]芘6 d的降解率分别降低了30.3%和9%。也有研究表明,微生物在中性条件下对PAHs降解效果最佳[25-26]。顾平等[27]从长期受石油烃和PAHs污染的土壤中分离获得一株能以苯并[a]芘为唯一碳源的降解菌株BB-1,研究发现强酸、强碱条件对该菌株的生长均具有抑制作用,而当培养基初始pH值为7时,其对苯并[a]芘的降解率最大。本文通过研究不同盐度和pH条件下4株菌(SYP-2、SYP-3、SYP-4、SYP-11)对芘降解效率的影响,结果发现,尽管不同盐度和pH条件下4株菌对芘的降解效果存在一定差异,但无论在0~15%的盐度范围内还是在5~10的pH范围内,4株菌对芘均具有良好的降解效果,表明所筛选菌株对芘的降解也具有广泛的盐度和pH范围以及较高的耐盐碱性。
本研究所分离的6株降解菌,在5%的盐度下,除对4环的芘具有良好的降解作用外,对5环的苯并[a]芘也具有较高的降解能力,表明在高盐碱的胁迫作用下,所分离菌株对降解4环以上高环PAHs具有很大潜力,可应用到高环PAHs污染盐碱土壤的修复中。Cui等[28]研究表明,菌株Marinobacter sp. D15-8W几乎不能降解芘、荧蒽等,但其与Cycloclasticus PY97M组成的复合菌团在21 d内可分别将初始浓度为20 mg· L-1的芘和荧蒽分别降解76%和83%。Deng等[29]从大亚湾石油污染海水中分离获得一株菌株HZ01,鉴定为Achromobacter sp.,其在pH 7.0、NaCl浓度为3%、温度28 ℃的条件下,30 d对蒽、菲和芘的降解率分别为29.8%、50.6%和38.4%。王慧等[15]从石油污染土壤中富集分离出的嗜盐菌Thalassospira sp.strain TSL5-2,在5%盐度下,25 d内,对菲、芘、荧蒽(初始质量浓度均为20 mg·L-1)、苯并蒽(初始质量浓度为8 mg·L-1)的降解率分别为100%、53.3%、60%、18.1%,但不能降解苯并芘。本研究所分离的菌株,在5%的盐度下,7 d内可使初始浓度为50 mg·L-1的芘降解率达42.3%~ 68.8%,使初始浓度为5 mg·L-1的苯并[a]芘降解率达27.0%~49.4%。从降解效率看,所分离的菌株对芘(初始浓度为50 mg·L-1)的降解能力明显高于苯并[a]芘(初始浓度为5 mg·L-1),这是由于PAHs环的数量与排列特征都影响其稳定性,高环PAHs在环境中的半衰期远大于低环PAHs[30],随着多环芳烃环数增加,其疏水性也随之增强、生物毒性更大、生物可降解性减弱[31]。
本研究结果为丰富降解高环PAHs的微生物资源和指导高环PAHs污染盐碱土壤的微生物修复具有重要意义。
4 结论(1)从延长油田石油污染土壤中分离出6株能以芘为唯一碳源和能源的嗜盐碱菌,该6株菌分属于3个不同菌属,即代尔夫特菌属(Delftia sp.)、海杆菌属(Marinobacter sp.)和芽孢杆菌属(Bacillus sp.)。
(2)所分离菌株对降解4环以上高环PAHs具有很大潜力,且6株降解菌对芘的降解具有广泛的盐度和pH范围以及较高的耐盐碱性。
| [1] |
Venny, Gan S, Ng H K. Current status and prospects of Fenton oxidation for the decontamination of persistent organic pollutants(POPs)in soils[J]. Chemical Engineering Journal, 2012, 213(12): 295-317. |
| [2] |
Wise S A, Sander L C, Schantz M M. Analytical methods for determination of polycyclic aromatic hydrocarbons(PAHs)-A historical perspective on the 16 U. S. EPA priority pollutant PAHs[J]. Polycyclic Aromatic Compounds, 2015, 35(2/3/4): 187-247. |
| [3] |
Means J C. Influence of salinity upon sediment-water partitioning of aromatic hydrocarbons[J]. Marine Chemistry, 1995, 51(1): 3-16. |
| [4] |
Brinda Lakshmi M, Anandaraj V P, Velan M. Bioremediation of phenanthrene by Mycoplana sp. MVMB2 isolated from contaminated soil[J]. Clean-Soil, Air, Water, 2013, 41(1): 86-93. DOI:10.1002/clen.201000472 |
| [5] |
范瑞娟, 郭书海, 李凤梅. 石油降解菌群的构建及其对混合烃的降解特性[J]. 农业环境科学学报, 2017, 36(3): 522-530. FAN Rui-juan, GUO Shu-hai, LI Feng-mei. Construction of petroleum degrading bacteria consortium and its degradation properties of mixed hydrocarbons[J]. Journal of Agro-Environment Science, 2017, 36(3): 522-530. |
| [6] |
李凤梅, 郭书海, 张灿灿, 等. 多环芳烃降解菌的筛选及其在焦化场地污染土壤修复中的应用[J]. 环境污染与防治, 2016, 38(4): 1-5. LI Feng-mei, GUO Shu-hai, ZHANG Can-can, et al. Isolation of PAHs degrading bacteria and its application to mediation of pulluted soil in coking site[J]. Environmental Pollution & Control, 2016, 38(4): 1-5. |
| [7] |
姜岩, 杨颖, 张贤明. 典型多环芳烃生物降解及转化机制的研究进展[J]. 石油学报(石油加工), 2014, 30(6): 1137-1150. JIANG Yan, YANG Ying, ZHANG Xian-ming. Review on the biodegradation and conversion mechanism of typical polycyclic aromatic hydrocarbons[J]. Acta Petrolei Sinica(Petroleum Processing Section), 2014, 30(6): 1137-1150. DOI:10.3969/j.issn.1001-8719.2014.06.026 |
| [8] |
Woo N Y S, Chung K C. Tolerance of pomacanthus imperator to hypoosmotic salinities:Changes in body composition and hepatic enzyme activities[J]. Journal of Fish Biology, 1995, 47(1): 70-81. |
| [9] |
Onishi H, Fuchi H, Konomi K, et al. Isolation and distribution of a variety of halophilic bacteria and their classification by salt-response[J]. Journal of the Agricultural Chemical Society of Japan, 1980, 44(6): 1253-1258. |
| [10] |
Hedlund B P, Geiselbrecht A D, Bair T J, et al. Polycyclic aromatic hydrocarbon degradation by a new marine bacterium, Neptunomonas naphthovorans gen. nov., sp. nov[J]. Applied and Environmental Microbiology, 1999, 65(1): 251-259. |
| [11] |
Cui C Z, Feng T C, Yu Y Q, et al. Isolation, charcaterization of an anthracene degrading bacterium Martelella sp. AD-3 and cloning of dioxygenase gene[J]. Environmental Science, 2012, 33(11): 4062-4068. |
| [12] |
厉阗, 钱坤, 肖伟, 等. 嗜盐拟香味菌Y6降解硝基苯的特性研究[J]. 环境科学, 2013, 34(2): 753-759. LI Tian, QIAN Kun, XIAO Wei, et al. Biodegradation of nitrobenzene by a Halophilic Myroides odoratimimus strain Y6[J]. Environmental Science, 2013, 34(2): 753-759. |
| [13] |
Wang C, Guo G, Huang Y, et al. Salt adaptation and evolutionary implication of a Nah-related PAHs dioxygenase cloned from a halophilic phenanthrene degrading consortium[J]. Scientific Reports, 2017, 7(1): 1-13. DOI:10.1038/s41598-016-0028-x |
| [14] |
Dastgheib S M, Amoozegar M A, Khajeh K, et al. Biodegradation of polycyclic aromatic hydrocarbons by a halophilic microbial consortium[J]. Applied Microbiology and Biotechnology, 2012, 95(3): 789-798. DOI:10.1007/s00253-011-3706-4 |
| [15] |
王慧, 周海燕, 黄勇, 等. 一株高环多环芳烃降解嗜盐菌Thalassospira sp.的分离及降解特性[J]. 清华大学学报(自然科学版), 2015, 55(1): 87-92. WANG Hui, ZHOU Hai-yan, HUANG Yong, et al. Isolation and degradation characteristics of a HMW-PAHs degrading halophilic strain Thalassospira sp.[J]. Journal of Tsinghua University(Science and Technology), 2015, 55(1): 87-92. |
| [16] |
李康, 范文玉, 郭光, 等. 盐环境下降解菌群对芘的降解特性研究[J]. 环境污染与防治, 2018, 40(7): 755-759. LI Kang, FAN Wen-yu, GUO Guang, et al. Degradation characteristics of pyrene by bacteria consortium in saline environment[J]. Environmental Pollution & Control, 2018, 40(7): 755-759. |
| [17] |
蔡妙英, 东秀珠. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. CAI Miao-ying, DONG Xiu-zhu. Common bacterial system identification manual[M]. Beijing: Science Press, 2001. |
| [18] |
Wu W Y, Huang H Y, Ling Z M, et al. Genome sequencing reveals mechanisms for heavy metal resistance and polycyclic aromatic hydrocarbon degradation in Delftia lacustris strain LZ-C[J]. Ecotoxicology, 2016, 25(1): 234-247. DOI:10.1007/s10646-015-1583-9 |
| [19] |
李倩, 崔志松, 赵爱芬, 等. 一株石油烃降解菌新种Marinobacter sp. PY97S的鉴定[J]. 微生物学报, 2011, 51(5): 648-655. LI Qian, CUI Zhi-song, ZHAO Ai-fen, et al. Identification and characterization of a novel hydrocarbon -degrading Marinobacter sp. PY97S[J]. Acta Microbiologica Sinica, 2011, 51(5): 648-655. |
| [20] |
Zhou H, Wang H, Huang Y, et al. Characterization of pyrene degradation by halophilic Thalassospira sp. strain TSL5-1 isolated from the coastal soil of Yellow Sea, China[J]. International Biodeterioration & Biodegradation, 2016, 107: 62-69. |
| [21] |
Boopathy R. Factors limiting bioremediation technologies[J]. Bioresource Technology, 2000, 74(1): 63-67. DOI:10.1016/S0960-8524(99)00144-3 |
| [22] |
赵百锁, 王慧, 毛心慰. 嗜盐微生物在环境修复中的研究进展[J]. 微生物学通报, 2007, 34(6): 1209-1212. ZHAO Bai-suo, WANG Hui, MAO Xin-wei. The recent advances in halophilic microorganisms for environmental bioremediation[J]. Microbiology China, 2007, 34(6): 1209-1212. DOI:10.3969/j.issn.0253-2654.2007.06.038 |
| [23] |
Minai-Tehrani D, Minoui S, Herfatmanesh A. Effect of salinity on biodegradation of polycyclic aromatic hydrocarbons(PAHs) of heavy crude oil in soil[J]. Bulletin of Environmental Contamination and Toxicology, 2009, 82(2): 179-184. |
| [24] |
Arulazhagan P, Sivaraman C, Kumar S A, et al. Co-metabolic degradation of benzo(e) pyrene by halophilic bacterial consortium at different saline conditions[J]. Journal of Environmental Biology, 2014, 35(3): 445-453. |
| [25] |
Qi Y B, Wang C Y, Lv C Y, et al. Removal capacities of polycyclic aromatic hydrocarbons(PAHs)by a newly isolated strain from oilfield produced water[J]. International Journal of Environmental Research & Public Health, 2017, 14(2): 215. |
| [26] |
宋立超, 李培军, 刘宛, 等. 盐碱土壤PAHs降解菌的筛选鉴定及其降解特性[J]. 微生物学通报, 2011, 38(2): 282-287. SONG Li-chao, LI Pei-jun, LIU Wan, et al. Isolation, identification and degradation characteristics of a PAHs-degrading bacteria from salt-alkaline soil[J]. Microbiology China, 2011, 38(2): 282-287. |
| [27] |
顾平, 周启星, 王鑫, 等. 一株土著B[a]P降解菌的筛选及降解特性研究[J]. 农业环境科学学报, 2018, 37(5): 926-932. GU Ping, ZHOU Qi-xing, WANG Xin, et al. The screening-out and degradation character of an indigenous benzo[J]. Journal of Agro-Environment Science, 2018, 37(5): 926-932. |
| [28] |
Cui Z, Yang B, Xu G, et al. Isolation and characterization of Cycloclasticus strains from Yellow Sea sediments and biodegradation of pyrene and fluoranthene by their syntrophic association with Marinobacter strains[J]. International Biodeterioration & Biodegradation, 2014, 91: 45-51. |
| [29] |
Deng M C, Li J, Liang F R, et al. Isolation and characterization of a novel hydrocarbon-degrading bacterium Achromobacter sp. HZ01 from the crude oil-contaminated seawater at the Daya Bay, southern China[J]. Marine Pollution Bulletin, 2014, 83(1): 79-86. DOI:10.1016/j.marpolbul.2014.04.018 |
| [30] |
Liu T, Zhang Z, Dong W, et al. Bioremediation of PAHs contaminated river sediment by an integrated approach with sequential injection of co-substrate and electron acceptor:Lab-scale study[J]. Environmental Pollution, 2017, 230: 413-421. DOI:10.1016/j.envpol.2017.06.063 |
| [31] |
Lu X Y, Li B, Zhang T, et al. Enhanced anoxic bioremediation of PAHs-contaminated sediment[J]. Bioresource Technology, 2012, 104(1): 51-58. |
 2019, Vol. 38
2019, Vol. 38