2. 江苏省有机固废废弃物资源化协同创新中心, 江苏 扬州 225127
2. Jiangsu Collaborative Innovation Center for Solid Organic Waste Resource Utilization, Yangzhou University, Yangzhou 225127, China
花生是我国重要的油料和经济作物,由于土壤利用的限制以及其经济效益相对较高,在花生主要种植区其连作现象十分普遍。然而,花生连作会产生连作障碍效应,即连作年限越长,产量和品质下降越厉害,这严重影响了花生生产的持续发展[1-2]。自毒作用是花生连作障碍的重要原因之一[3]。自毒作用是指根系分泌和植株残茬释放的化感物质对植物生长产生的抑制作用[4-5]。花生[6]、烟草[7]、黄瓜[8]等根系分泌的化感物质对植株幼苗的株高、根长和根系活力都表现出抑制作用,并且抑制程度随着化感物质浓度增加而增强。Li等[9]研究发现花生根系分泌的化感物质会影响根系微生物群落结构,从而导致花生土传病害的加重。王小兵等[10]通过根系分泌物循环收集系统结合GC-MS鉴定出花生根系分泌物中有苯甲酸、苯乙酮、丙三醇、3、5-二甲基苯甲醛、硬脂酸、棕榈酸和乳酸等7种化感物质。袁云云等[11]采用GC-MS鉴定出花生根系分泌物中含有邻苯二甲酸、硬脂酸、油酸、十二酸、十四酸、十六酸等化感物质。
1988年,Schmidt等[12]开展了土壤中胡桃醌的微生物降解试验,提出微生物降解土壤中化感物质的主要原理是微生物利用化感物质作为碳源进行同化降解。Dong等[13]从人参幼苗根际土壤中分离到邻苯二甲酸二异丁酯降解菌鞘氨醇杆菌PG-1,该菌在72 h内降解了90%以上的邻苯二甲酸二异丁酯。Liu等[14]从尾叶桉根中分离出3株柔膜菌(Helotiales sp.)Eu03、Eu04和Eu05,其中Eu04菌株能够显著降解苯甲酸、对羟基苯甲酸和香草酸3种混合酚酸。Chen等[15]从黄瓜根际土壤中筛选一株对羟基苯甲酸降解菌CSYP1,该菌应用于对羟基苯甲酸污染的黄瓜种植土后,土壤中某些酶活性增加,对羟基苯甲酸浓度降低。目前,针对花生化感物质降解菌的研究较少[16-17]。苯甲酸及其衍生物是一类比较重要的化感物质,在多种植物根系分泌物中均有检测到[18],而且前期研究发现苯甲酸对花生发芽以及幼苗生长有显著抑制作用。本研究拟从连作花生试验地健康植株根际土壤中筛选苯甲酸降解菌,并研究其降解特性,为利用降解菌缓解花生连作障碍提供资源保障和科学依据。
1 材料与方法 1.1 试验材料 1.1.1 样品来源从中国科学院红壤生态实验站花生连作长期定位试验地,于花生开花期挖取5棵健康植株,去除根部大颗粒土块,采用抖动法采集根际土壤,分别装袋后带回实验室,4 ℃保存备用。
1.1.2 培养基种子培养基(LB):牛肉浸膏5 g,蛋白胨10 g,NaCl 5 g,加去离子水定容至1 L,pH 7.2~7.4。
无机盐培养基(MS):KH2PO4 3 g,Na2HPO4 5 g,NaCl 0.001 g,CaCl2·H2O 0.003 g,MgSO4·5H2O 0.003 g,加去离子水定容至1 L,pH 7.0。
选择培养基:在无机盐培养基上按浓度要求加入0.22 μm微孔滤膜过滤的苯甲酸母液(10 g·L-1)。
以上固体培养基需加入2%琼脂,经121 ℃、20 min高压灭菌备用。
1.2 试验方法 1.2.1 降解菌的筛选降解菌的筛选采用以苯甲酸为唯一碳源,逐渐提高苯甲酸浓度的驯化方法[19]。具体操作如下:准确称取10 g土样,加入装有90 mL无菌水的三角瓶中,恒温摇床中充分振荡30 min,制成1:10浓度的土壤悬浊液。待土粒沉淀后,吸取1 mL上清液,移入装有9 mL无菌水的试管中,制成10-2菌悬液,以此类推,制成10-3、10-4、10-5、10-6、10-7的菌悬液。选择10-4、10-5、10-6、10-7四个浓度各100 μL,加入到苯甲酸选择培养基中,苯甲酸浓度按5、10、15、20 mg·L-1依次提高梯度驯化与富集降解菌。经过多次转接培养,梯度稀释培养液并涂布于20 mg·L-1苯甲酸固体选择培养基上,在30 ℃恒温培养箱中倒置培养48 h。挑取菌落形态不同的单菌落接种至LB固体培养基上,反复划线分离纯化得到纯菌株,菌株经试管斜面富集培养后保存于4 ℃冰箱中备用。
1.2.2 降解菌的鉴定 1.2.2.1 降解菌形态特征鉴定降解菌经LB培养基培养18 h后,观察其菌落形状、大小、颜色、透明度、黏稠度、湿润度、隆起和边缘特征及是否产色素等,菌体染色后用高倍显微镜观察菌体革兰氏染色、鞭毛、荚膜、芽孢等结构。菌液经戊二醛固定乙醇脱水和冷冻干燥后,扫描电镜观察菌体大小和表面结构。
1.2.2.2 降解菌生理生化特性测定降解菌经LB培养基培养18 h后,按照文献[20]进行石蕊牛奶、葡萄糖、甲基红反应、V-P试验、吲哚反应、柠檬酸盐、淀粉水解、明胶液化、接触酶、氧化酶、需氧性、产生H2S和硝酸盐还原等生理生化试验。
1.2.2.3 降解菌16S rDNA基因序列的测定及分子系统发育树的构建降解菌基因组DNA采用试剂盒(快速提取盒)提取菌株的总DNA[21],用16S rDNA通用引物27 F(正向引物)[22]:5′ -AGAGTTTGATCCTGGCTCAG-3′;1492 R(反向引物):5′ -TACGGGTACCTTGTTACGACTT- 3′,以分离降解菌的总DNA为模板进行PCR扩增。PCR反应体系(50 μL):DNA模板1 μL,10 ×PCR Buffer 5 μL,dNTP(2.5 mmol·L-1)4 μL,引物(10 μmol· L-1)各1 μL,Tap酶(5 U · μL-1)0.5 μL,双蒸水37.5 μL。扩增程序:95 ℃ 5 min,94 ℃ 45 s,50 ℃ 45 s,72 ℃ 75 s;32次循环,72 ℃ 10 min;反应完成后,经1%琼脂糖电泳,检测扩增片段的大小和特异性。PCR产物经琼脂糖电泳检测纯化,送上海生工进行双向测序并拼接输出全序列,16S rDNA序列与Genebank中已收录的16S rDNA序列进行同源性比对,采用ClustalX 1.8进行序列匹配分析,通过MEGA 6.0软件使用邻接法(Neighbor-Joining method)构建系统发育树,利用Bootstrap(1000次重复)检验各分支的置信度。
1.2.3 环境因子对降解菌降解特性的影响 1.2.3.1 培养初始pH降解菌按0.1%(OD600 nm=0.8)接种量接种到含20 mg·L-1苯甲酸的无机盐培养液中,pH分别为4、5、6、7、8、9、10,30 ℃,180 r·min-1振荡培养48 h后测定菌体生长量和苯甲酸的降解率,菌体生长量是以不接种降解菌的培养基作对照,每处理3次重复。测定处理后600 nm处的吸光度值,苯甲酸的降解率为处理前后苯甲酸浓度差与起始苯甲酸浓度的百分比。
1.2.3.2 培养温度降解菌按0.1%(OD600 nm=0.8)接种量接种到pH 7.0、含20 mg·L-1苯甲酸的无机盐培养基中,控制培养温度为25、30、35、40、45 ℃,180 r·min-1振荡培养48 h后测定菌体生长量和苯甲酸的降解率,菌体生长量是以不接种降解菌的培养基作对照,每处理3次重复。
1.2.3.3 NaCl浓度降解菌按0.1%(OD600 nm=0.8)接种量接种到pH 7.0、含20 mg·L-1苯甲酸的无机盐培养基中,控制NaCl浓度为0、2、4、6、8、10 mg·kg-1,30 ℃,180 r·min-1振荡培养,48 h后测定菌体生长量和苯甲酸的降解率,菌体生长量是以不接种降解菌的培养基作对照,每处理3次重复。
1.2.4 化感物质的提取与分析用1:1的乙醇乙醚混合萃取液萃取苯甲酸、苯乙酮、硬脂酸、棕榈酸、乳酸、3,5-二甲基苯甲醛和丙三醇处理前后培养液3次,合并萃取液,旋转蒸发,甲酯化,冷却后用正己烷萃取,用气相色谱仪检测其降解率。气相色谱法(GC)测定条件:GC分析在Agilent气相色谱仪上进行,采用FID检测器;柱子型号HPFFAP,规格30 m×0.32 mm×0.25 μm,不分流,载气N2(99%),流量14.0 mL· min-1,柱温220 ℃,程序升温10 ℃·min-1,并在220 ℃时保持10 min,进样口温度260 ℃,检测器温度260 ℃,进样量1 μL。每处理3次重复。
1.2.5 底物专一性降解菌按0.1%(OD600 nm=0.8)接种量接种到以苯乙酮、硬脂酸、棕榈酸、乳酸、3,5-二甲基苯甲醛和丙三醇等化感物质为唯一碳源的无机盐培养基中(20 mg·L-1),30 ℃,180 r·min-1振荡培养48 h后测定菌体生长量和化感物质降解率,菌体生长量是以不接种降解菌的培养基作对照,每处理3次重复。
1.3 数据分析采用Excel 2016作图;SPSS 13.0进行数据分析,One way ANOVA进行差异显著性分析。
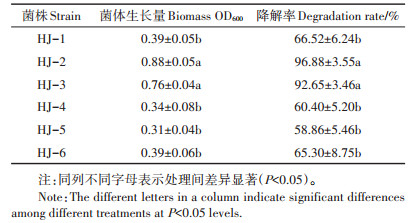
2 结果与分析 2.1 花生化感物质降解菌的筛选降解菌初筛结果见表 1,以苯甲酸为唯一碳源,按5、10、15、20 mg·L-1浓度依次提高梯度驯化与富集共筛选出6株降解菌。其中降解菌HJ-2和HJ-3生物量最大,OD值分别达到0.88和0.76,对苯甲酸的降解率达到96.88%和92.65%。
|
|
表 1 不同菌株对苯甲酸的降解率 Table 1 Degradation rate of benzoic acid by different strains |
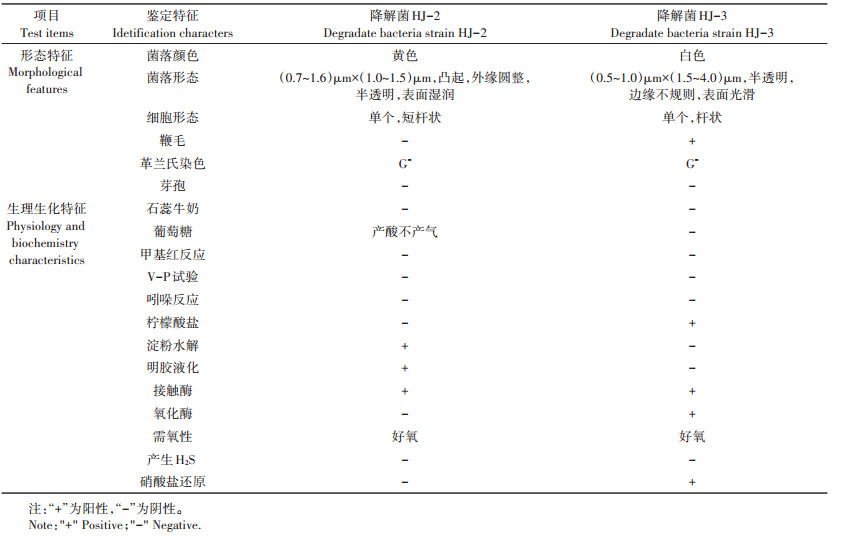
降解菌HJ-2在LB培养基上呈黄色,凸起,外缘圆整,半透明,表面湿润,革兰氏阴性,短杆状,大小为(0.7~1.6)μm×(1.0~1.5)μm(图 1A)。降解菌HJ-3在LB培养基上呈白色,半透明,边缘不规则,表面光滑,革兰氏阴性,杆状,大小为(0.5~1.0)μm×(1.5~ 4.0)μm(图 1B)。降解菌HJ-2能与葡萄糖反应产酸不产气,能水解淀粉,液化明胶,接触酶阳性,好氧。降解菌HJ-3接触酶试验、氧化酶试验、硝酸盐还原试验、柠檬酸盐试验均为阳性(表 2)。

|
图 1 降解菌HJ-2和HJ-3的透射电镜图 Figure 1 Transmission electron microscopy(TEM)images of strain HJ-2 and stain HJ-3 |
|
|
表 2 降解菌HJ-2和HJ-3的形态和生理生化特征 Table 2 Morphological features and biochemical, physiological of degrading bacteria HJ-2 and HJ-3 |
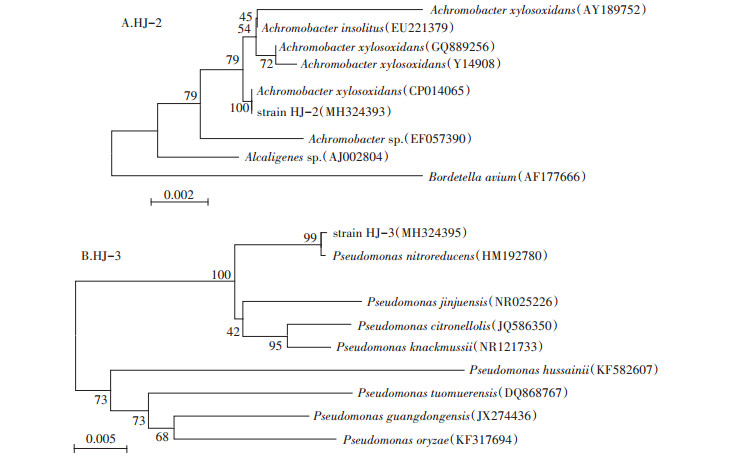
对降解菌进行基因组DNA的提取,并完成16S rDNA基因测序,将得到的序列与GenBank中已知序列进行比对,并对两种未知的降解菌HJ-2和HJ-3分别构建系统发育树,结果如图 2所示。16S rDNA序列同源性比对表明,降解菌HJ-2与木糖氧化无色杆菌(Achromobacter xylosoxidans)同源性最近,序列相似性高达100%;HJ-3则与硝基还原假单胞菌(Pseudomonas nitroreducens)同源性最近,序列相似性达99%。结合细菌的主要形态特征和生理生化特征,将降解菌HJ-2和HJ-3所测序列结果提交到GenBank数据库,获得序列登录号分别为MH324393和MH324395。
|
图 2 基于降解菌HJ-2和降解菌HJ-3基因序列构建的系统发育树 Figure 2 Neighbour-Joining phylogenetic tree based on 16S rRNA gene sequences of strains HJ-2 and HJ-3 |
为了研究不同环境条件下降解菌HJ-2和HJ-3对苯甲酸的降解情况,选择初始pH、温度、NaCl浓度3个影响因素作为研究对象,进行单因素实验。实验结果如图 3所示,pH对2株降解菌均有影响,降解菌HJ-2最适宜的pH在6.0~9.0之间,而降解菌HJ-3最适宜的pH在6.0~8.0之间,pH过高或过低都会对两株菌产生抑制(图 3A)。由图 3B可知,降解菌HJ-2适宜生长温度范围较广,在30~45 ℃下生长良好;降解菌HJ-3适宜生长温度为30~35 ℃,不耐受高温。降解菌HJ-3对NaCl浓度的变化较为敏感(图 3C),当NaCl浓度大于4%时,其生长受到抑制,最适宜生长NaCl浓度为0~4%;降解菌HJ-2耐受NaCl能力较强,适宜NaCl浓度为0~6%。总之,降解菌HJ-2对逆境的耐受能力较降解菌HJ-3强。
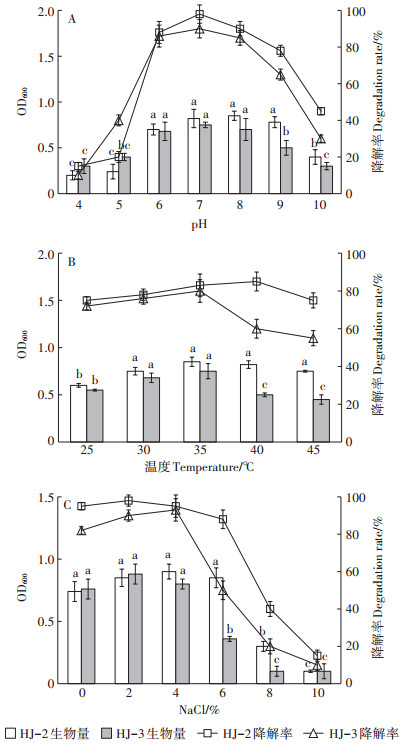
|
不同字母表示处理间差异显著(P<0.05) he different letters indicate significant differences among different treatments at P<0.05 levels 图 3 不同pH、温度和NaCl浓度对降解菌HJ-2和HJ-3生长的影响 Figure 3 Biomass of strain HJ-2 and strain HJ-3 in the condition of different pH, temperature and salinity |
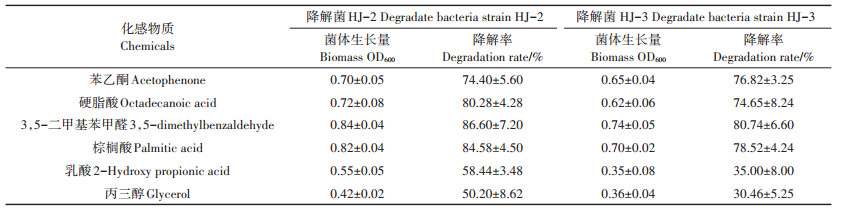
为了研究筛选的降解菌对其他化感物质是否有降解作用,利用前期鉴定的苯乙酮、硬脂酸、3,5-二甲基苯甲醛、棕榈酸和乳酸和丙三醇等6种花生化感物质进行降解试验,结果见表 3。在以化感物质为唯一碳源的无机盐中,降解菌HJ-2除了在丙三醇中生长较差以外,其他5种化感物质均能有效降解;降解菌HJ-3在以3,5-二甲基苯甲醛、硬脂酸、棕榈酸和苯乙酮为唯一碳源中的生长较好,而在乳酸和丙三醇中生长最弱。由此可见这两株降解菌均可以利用其他化感物质为碳源生长,具有广谱的降解功能。
|
|
表 3 两株降解菌对不同化感物质的降解性能 Table 3 Degradation rate of strain HJ-2 and strain HJ-3 |
李晓芝等[23]认为采用生物降解技术是克服植株自毒作用的一种有效措施,其优点在于对作物生长没有影响的情况下进行修复,而且没有二次污染,是一种高效环保的生物修复方法,而筛选和分离化感物质高效降解菌是该项技术的关键环节。本研究通过富集培养的方法筛选到两株高效化感物质降解菌HJ-2和HJ-3,经鉴定为木糖氧化无色杆菌(Achromobacter xylosoxidans)和硝基还原假单胞菌(Pseudomonas nitroreducens)。
微生物对烯烃类有机物最容易降解,其次是烷烃类有机物,而对芳烃类物质较难降解,特别是多环芳烃以及脂环芳烃最难降解。木糖氧化无色杆菌和硝基还原假单胞菌对较难降解的有机物质均有显著降解作用,前期研究表明木糖氧化无色杆菌对直烷烃类[24]和苯甲酰脲类[25]降解率达90%,对具有苯环类有机物如四环素类抗生素降解率为60%左右[26],另外该菌对多环芳烃[27]和芘[28]也有显著降解作用;硝基还原假单胞菌对三唑类[29]和氯苯类化合物等[30]降解率达90%,对双酚A[31]和邻苯二酚[32]等酚类有机物也有显著降解效果,降解率分别达80%和95%。前期关于这两类菌株在化感物质降解方面的研究较少[33],本研究发现木糖氧化无色杆菌HJ-2和硝基还原假单胞菌HJ-3能够显著降解苯甲酸、苯乙酮和3,5-二甲基苯甲醛等带有苯环类以及硬脂酸、棕榈酸等长链饱和脂肪酸的化感物质,丰富了化感物质降解菌的种类,为缓解植物自毒作用提供了可靠资源保障。
降解效率的高低是降解菌能否应用的前提条件。祁国振等[34]从苹果根际筛选了多株自毒物质降解菌,降解效率最好的降解菌BL2对邻苯二甲酸、对羟基苯甲酸、根皮苷、焦性没食子酸的降解率分别为66%、72%、84%和84%。何志刚等[17]分离的3株苯甲酸降解菌对苯甲酸的降解率只有95.32%、91.63%和90.15%。而本研究分离的降解菌HJ-2和HJ-3对苯甲酸的降解率分别达到96.88%和92.65%,其中降解菌HJ-2与已研究的降解菌相比具有较高的降解效率。
降解菌必须有较强的环境适应能力才有实际应用意义。本研究分析了两株降解菌对pH、温度以及NaCl浓度等环境因子的适应情况。pH对细胞酶活性有较大影响,强酸或强碱都会引起蛋白变性、破坏细胞膜。赵东岳等[35]筛选到的5株人参自毒物质降解菌在pH 6.0~7.0时生长状态最好,而本研究中降解菌HJ-2适宜pH为6.0~9.0,降解菌HJ-3适应pH为6.0~ 8.0,两株降解菌均有较好的pH耐受范围,而且降解菌HJ-2对pH耐受范围更宽;温度过高或过低均会抑制细胞酶活性,进而影响微生物的生长,也会导致化感物质降解菌降解效率的降低。黄兴如等[36]筛选的几株可降解多环芳烃降解菌适宜温度均低于40 ℃,本研究中降解菌HJ-2适宜温度为30~45 ℃,具有较宽的温度范围;微生物生长环境中NaCl浓度太高会使微生物在细胞外界渗透压过高,造成细胞缺水死亡,另外过量的钠离子会抑制细胞酶的活性,因此微生物都有一定的NaCl浓度范围,降解菌HJ-2在NaCl浓度升高到6%后降解率显著下降,而降解菌HJ-3在NaCl浓度升高到4%以后降解率显著下降,这可能与细胞受到NaCl的抑制有关。朱星等[27]筛选了一株降解萘的无色杆菌,能够耐受1%~2% NaCl浓度,本研究中降解菌HJ-2也是无色杆菌属,而该菌能够耐受更高的NaCl浓度,具有更好的环境适应能力。
花生根系分泌多种化感物质,环境中化感物质均以混合形式存在,筛选的降解菌能否对其他化感物质有降解作用更具有实际应用意义。有研究表明,里拉微球菌、紫金牛叶杆菌和理氏勒米诺氏菌降解油酸、十六烷酸、邻苯二甲酸等为花生主要化感物质[16]。何志刚等[17]分离的3株苯甲酸降解菌能够降解多种醛酸类物质。本研究筛选的两株降解菌均能降解多种花生化感物质,特别是降解菌HJ-2降解能力更强,表明该菌是一株用于防治花生自毒作用的理想菌株。
4 结论(1)从连作花生长期定位试验基地健康花生根际土壤中分离到两株高效化感物质降解菌HJ-2和HJ- 3,通过鉴定分别为木糖氧化无色杆菌(Achromobacter xylosoxidans HJ-2)和硝基还原假单胞菌(Pseudomonas nitroreducens HJ-3)。
(2)通过单因素试验对降解菌进行降解特性测定,降解菌HJ-2的适宜降解条件为pH 6.0~9.0,温度30~45 ℃,NaCl浓度0~6%;降解菌HJ-3适宜降解条件为pH 6.0~8.0,温度30~35 ℃,NaCl浓度0~4%。
(3)两株降解菌能够降解多种化感物质,具有广谱降解化感物质的特性。
| [1] |
王明珠, 陈学南. 低丘红壤区花生持续高产的障碍及对策[J]. 花生学报, 2005, 34(2): 17-22. WANG Ming-zhu, CHEN Xue-nan. Obstacle and countermeasure of sustainable high yield for peanut in low-hilly red soil region[J]. Journal of Peanut Science, 2005, 34(2): 17-22. DOI:10.3969/j.issn.1002-4093.2005.02.004 |
| [2] |
滕应, 任文杰, 李振高, 等. 花生连作障碍发生机理研究进展[J]. 土壤, 2015, 47(2): 259-265. TENG Ying, REN Wen-jie, LI Zhen-gao, et al. Advance in mechanism of peanut continuous cropping obstacle[J]. Soils, 2015, 47(2): 259-265. |
| [3] |
王兴祥, 张桃林, 戴传超. 连作花生土壤障碍原因及消除技术研究进展[J]. 土壤, 2010, 42(4): 505-512. WANG Xing-xiang, ZHANG Tao-lin, DAI Chuan-chao. Advance in mechanism and countermeasures of peanut succession monocropping obstacles[J]. Soils, 2010, 42(4): 505-512. |
| [4] |
Huang L F, Song L X, Xia X J, et al. Plant-soil feedbacks and soil sickness:From mechanisms to application in agriculture[J]. Journal of Chemical Ecology, 2013, 39(2): 232-242. DOI:10.1007/s10886-013-0244-9 |
| [5] |
刘苹, 赵海军, 李庆凯, 等. 三种酚酸类化感物质对花生根际土壤微生物及产量的影响[J]. 中国油料作物学报, 2018, 40(1): 101-109. LIU Ping, ZHAO Hai-jun, LI Qing-kai, et al. Effects of three phenolic acid allelochemicals on rhizosphere soil microbes and pod yield of peanut(Arachis hypogaea L.)[J]. Chinese Journal of Oil Crop Sciences, 2018, 40(1): 101-109. |
| [6] |
李培栋, 王兴祥, 李奕林, 等. 连作花生土壤中酚酸类物质的检测及其对花生的化感作用[J]. 生态学报, 2010, 30(8): 2128-2134. LI Pei-dong, WANG Xing-xiang, LI Yi-lin, et al. The contents of phenolic acids in continuous cropping peanut and their allelopathy[J]. Acta Ecologica Sinica, 2010, 30(8): 2128-2134. |
| [7] |
Deng J J, Zhang Y L, Hu J W, et al. Autotoxicity of phthalate esters in tobacco root exudates:Effects on seed germination and seedling growth[J]. Pedosphere, 2017, 27(6): 1073-1082. DOI:10.1016/S1002-0160(17)60374-6 |
| [8] |
Yu J Q, Matsui Y. Phytotoxic substances in root exudates of cucumber (Cucumis sativus L.)[J]. Journal of Chemical Ecology, 1994, 20(1): 21-31. DOI:10.1007/BF02065988 |
| [9] |
Li X G, Ding C F, Hua K, et al. Soil sickness of peanuts is attributable to modifications in soil microbes induced by peanut root exudates rather than to direct allelopathy[J]. Soil Biology and Biochemistry, 2014, 78: 149-159. DOI:10.1016/j.soilbio.2014.07.019 |
| [10] |
王小兵, 骆永明, 刘五星, 等. 花生根分泌物的鉴定及其化感作用[J]. 生态学杂志, 2011, 30(12): 2803-2808. WANG Xiao-bing, LUO Yong-ming, LIU Wu-xing, et al. Identification of peanut root exudates and their allelopathic effects[J]. Chinese Journal of Ecology, 2011, 30(12): 2803-2808. |
| [11] |
袁云云, 咸洪泉, 洪永聪, 等. 花生根系分泌物的鉴定及其化感效应分析[J]. 花生学报, 2011, 40(3): 24-29. YUAN Yun-yun, XIAN Hong-quan, HONG Yong-cong, et al. Identification of peanut root exudates and the analysis of its allelopathy effect[J]. Journal of Peanut Science, 2011, 40(3): 24-29. DOI:10.3969/j.issn.1002-4093.2011.03.007 |
| [12] |
Schmidt S K. Degradation of juglone by soil bacteria[J]. Journal of Chemical Ecology, 1988, 14(7): 1561-1571. DOI:10.1007/BF01012522 |
| [13] |
Dong L L, Xu J, Li Y, et al. Manipulation of microbial community in the rhizosphere alleviates the replanting issues in Panax ginseng[J]. Soil Biology and Biochemistry, 2018, 125: 64-74. DOI:10.1016/j.soilbio.2018.06.028 |
| [14] |
Liu S, Qin F, Yu S. Eucalyptus urophylla, root-associated fungi can counteract the negative influence of phenolic acid allelochemicals[J]. Applied Soil Ecology, 2018, 127: 1-7. DOI:10.1016/j.apsoil.2018.02.028 |
| [15] |
Chen S Y, Guo L Y, Bai J G, et al. Biodegradation of p-hydroxybenzoic acid in soil by Pseudomonas putida CSY-P1 isolated from cucumber rhizosphere soil[J]. Plant and Soil, 2014, 389(1): 197-210. |
| [16] |
赵亚慧, 华雪洁, 杜海岩, 等. 花生化感物质降解菌和抗连作拮抗菌复合菌剂应用效果的研究[J]. 土壤通报, 2016, 47(3): 599-604. ZHAO Ya-hui, HUA Xue-jie, DU Hai-yan, et al. Research on the application effect of compound bacterium agent for allelochemicals degradation bacteria and antagonistic bacteria resistance to continuous cropping[J]. Chinese Journal of Soil Science, 2016, 47(3): 599-604. |
| [17] |
何志刚, 汪仁, 王秀娟, 等. 花生自毒物质降解菌的筛选及其降解效果初步研究[J]. 中国农学通报, 2014, 30(21): 224-227. HE Zhi-gang, WANG Ren, WANG Xiu-juan, et al. Preliminary study of screening of peanut autotoxicity degrading microorganism and the degradation effect[J]. Chinese Agricultural Science Bulletin, 2014, 30(21): 224-227. DOI:10.11924/j.issn.1000-6850.2013-3193 |
| [18] |
Pramanik M H R, Nagai M, Asao T, et al. Effects of temperature and photoperiod on the phytotoxic root exudates of cucumber(Cucumis sativus)in hydroponic culture[J]. Journal of Chemical Ecology, 2000, 26(8): 1953-1967. DOI:10.1023/A:1005509110317 |
| [19] |
贺强礼, 刘文斌, 杨海君, 等. 一株苯酚降解菌的筛选鉴定及响应面法优化其降解[J]. 环境科学学报, 2016, 36(1): 112-123. HE Qiang-li, LIU Wen-bin, YANG Hai-jun, et al. Isolation, identification of a phenol-degradation using response surface methodology[J]. Acta Scientiae Cirecumstantiae, 2016, 36(1): 112-123. |
| [20] |
Etal E H. Bergey's manual of determinative bacteriology[M]. 9th ed. , Lippincott, Williams & Wilkins, 1994.
|
| [21] |
Janso J E, Carter G T. Phylogenetically unique endophytic actinomycetes from tropical plants possess great biosynthetic potential[J]. Applied & Environmental Microbiology, 2010, 76(13): 4377-4386. |
| [22] |
Lloyd-Jones G, Laurie A D, Hunter D W F, et al. Analysis of catabolic genes for naphthalene and phenanthrene degradation in contaminated New Zealand soils[J]. FEMS Microbiology Ecology, 2010, 29(1): 69-79. |
| [23] |
李晓芝, 王占武, 张翠绵, 等. 设施蔬菜连作障碍成因分析与防治对策[J]. 河北农业科学, 2006, 10(1): 113-116. LI Xiao-zhi, WANG Zhan-wu, ZHANG Cui-mian, et al. The problems caused by monoculture and the solutions in protected vegetables cultivation[J]. Journal of Hebei Agricultural Sciences, 2006, 10(1): 113-116. |
| [24] |
刘虹, 张朋朋, 刘娜, 等. 三种细菌降解直链烷烃的效果及降解动力学研究[J]. 安全与环境工程, 2017, 24(3): 66-70. LIU Hong, ZHANG Peng-peng, LIU Na, et al. Degradation efficiency and dynamics of straight-chain alkane degraded by three kinds of bacteria[J]. Safety & Environmental Engineering, 2017, 24(3): 66-70. |
| [25] |
李怡, 李勤奋, 邓晓, 等. 苯甲酰脲类杀虫剂降解菌的分离鉴定及其降解特性研究[J]. 应用与环境生物学报, 2018, 24(4): 928-933. LI Yi, LI Qin-fen, DENG Xiao, et al. Isolation, identification, and the biodegradation characteristics of a benzoylurea insecticides-degrading strain[J]. Chinese Journal of Applied & Environmental Biology, 2018, 24(4): 928-933. |
| [26] |
成洁, 杜慧玲, 张天宝, 等. 四环素类抗生素降解菌的分离与鉴定[J]. 核农学报, 2017, 31(5): 884-888. CHENG Jie, DU Hui-ling, ZHANG Tian-bao, et al. Isolation and identification of tetracyclines degrading bacteria[J]. Journal of Nuclear Agricultural Sciences, 2017, 31(5): 884-888. |
| [27] |
朱星, 王若宇, 汪锐, 等. 萘降解菌的分离鉴定、生长特性和降解途径探究[J]. 环境污染与防治, 2017, 39(4): 379-383. ZHU Xing, WANG Ruo -yu, WANG Rui, et al. Isolation, identification, growth characteristics and degradation pathway of naphthalene degrading bacteria[J]. Environmental Pollution & Control, 2017, 39(4): 379-383. |
| [28] |
田雪, 范鹏浩, 邹鹏, 等. 木糖氧化无色杆菌P1对芘降解的研究及其在两相分配生物反应系统中的应用[J]. 北京化工大学学报(自然科学版), 2016, 43(5): 63-68. TIAN Xue, FAN Peng-hao, ZOU Peng, et al. Degradation of pyrene by Achromobacter xylosoxidans P1 and its application in a two-phase partitioning bioreactor[J]. Journal of Beijing University of Chemical Technology (Natural Science), 2016, 43(5): 63-68. |
| [29] |
蔡慧敏, 曹之富, 赵建庄, 等. 苯醚甲环唑降解菌BMJHZ-01的分离鉴定及降解影响因素[J]. 农药学学报, 2015, 17(5): 590-595. CAI Hui-min, CAO Zhi-fu, ZHAO Jian-zhuang, et al. Isolation, identification and degradative characters of difenoconazole-degrading bacteria BMJHZ-01[J]. Chinese Journal of Pesticide Science, 2015, 17(5): 590-595. DOI:10.3969/j.issn.1008-7303.2015.05.13 |
| [30] |
姜健, 王慧, 高静思, 等. 1, 2, 4-三氯苯双加氧酶和脱氢酶基因克隆与序列分析[J]. 环境科学, 2008, 29(6): 1655-1659. JIANG Jian, WANG Hui, GAO Jing-si, et al. Cloning and sequence analysis of 1, 2, 4-trichlorobenzene dioxygenase and dehydrogenase genes[J]. Environmental Science, 2008, 29(6): 1655-1659. DOI:10.3321/j.issn:0250-3301.2008.06.035 |
| [31] |
Zhang C, Zeng G M, Yu L, et al. Aerobic degradation of bisphenol A by Achromobacter xylosoxidans, strain B-16 isolated from compost leachate of municipal solid waste[J]. Chemosphere, 2007, 68(1): 181-190. DOI:10.1016/j.chemosphere.2006.12.012 |
| [32] |
高亮, 谭德星. 中国酵素菌技术[M]. 北京: 中国农业出版社, 2016: 46-54. GAO Liang, TANG De-xing. Enzyme technology of China[M]. Beijing: China Agriculture Press, 2016: 46-54. |
| [33] |
Bramhachari P V, Reddy D R S, Kotresha D. Biodegradation of catechol by free and immobilized cells of Achromobacter xylosoxidans, strain 15DKVB isolated from paper and pulp industrial effluents[J]. Biocatalysis & Agricultural Biotechnology, 2016, 7: 36-44. |
| [34] |
祁国振, 毛志泉, 胡秀娜, 等. 苹果根际自毒物质降解菌的筛选鉴定及降解特性研究[J]. 微生物学通报, 2016, 43(2): 330-342. QI Guo-zhen, MAO Zhi-quan, HU Xiu-na, et al. Isolation, identification and degradation characteristics of apple rhizosphere autotoxicitic compounds-degrading bacteria[J]. Microbiology China, 2016, 43(2): 330-342. |
| [35] |
赵东岳, 李勇, 丁万隆. 人参自毒物质降解细菌的筛选及其降解特性研究[J]. 中国中药杂志, 2013, 38(11): 1703-1706. ZHAO Dong-yue, LI Yong, DING Wan-long. Isolation and characteristics of Panax ginseng autotoxin-degrading bacterial strains[J]. China Journal of Chinese Materia Medica, 2013, 38(11): 1703-1706. |
| [36] |
黄兴如, 张彩文, 张瑞杰, 等. 多环芳烃降解菌的筛选、鉴定及降解特性[J]. 微生物学通报, 2016, 43(5): 965-973. HUANG Xing-ru, ZHANG Cai-wen, ZHANG Rui-jie, et al. Isolation, identification and degrading properties of PAHs-degrading bacteria[J]. Microbiology China, 2016, 43(5): 965-973. |
 2019, Vol. 38
2019, Vol. 38