2. 上海交通大学农业与生物学院, 上海 200240
2. College of Agriculture and Biology, Shanghai Jiao Tong University, Shanghai 200240, China
邻苯二甲酸二甲酯(Dimethyl phthalate,DMP)是一类被广泛应用的人工合成有机化合物[1]。DMP对生物体具有致畸、致癌、致突变的性质,因此已被美国环保署及中国环境保护局列为优先控制污染物[2]。DMP与聚合物通过非共价键结合,因此很容易渗透到环境当中。到目前为止,土壤[3]、大气[4]、水环境[5]均已检测出DMP,可见其污染的广泛性。汕头蔬菜产区土壤样品中DMP的含量已超过美国土壤优先控制标准,超标率为38.1%[6];青岛市两种土壤中DMP的浓度分别为0.07 mg·L-1和0.04 mg·L-1[7];天津大气PM10样品中DMP占总肽酸酯含量的0.72%~6.72%[8];黄河兰州断面[9]水体中DMP最高检测浓度为6.3×10-2 mg· L-1;青岛海岸带表层沉积物中DMP的浓度范围为1.7×10-3~9.5×10-2 mg·L-1[10]。
荧光假单胞菌(Pseudomonas fluorescens)是一类广泛分布于自然界的革兰氏阴性菌,可作为植物抗病菌,其产生的挥发性化合物、硝吡咯菌素等抗生素可抵抗病原真菌对植物造成的病害[11-12];又可作为植物根际促生菌,促进植物更好地吸收营养物质,同时还能产生各种酶和代谢物用以抵抗各种生物和非生物的胁迫[13-14]。
有研究指出DMP污染改变了土壤中微生物的代谢活性和功能多样性,增加了与氮素代谢有关的某些菌属的百分比,从而使土壤有益菌属的百分比降低,对土壤环境产生了不良影响[3, 15-17]。DMP污染严重抑制了黑土中P. fluorescens的生长[3],但DMP对细菌细胞的毒理作用尚不清楚。因此,本试验以DMP与P. fluorescens为研究对象,探讨DMP污染对P. fluorescens细胞的损伤机制,为探究DMP生态毒理效应和生物修复技术提供理论基础。
1 材料与方法 1.1 试验材料及试剂P. fluorescens ATCC13525由中国普通微生物菌种保藏管理中心提供。
牛肉膏蛋白胨培养基:3 g牛肉膏、10 g蛋白胨、5 g NaCl和1 L双蒸水,pH 7.0。加入不同量的DMP,使DMP的终浓度分别为0、10、20、40 mg·L-1。
实验所用主要试剂如表 1所示。
|
|
表 1 试验试剂 Table 1 Test reagents |
P. fluorescens 30 ℃,130 r·min-1过夜培养,将细菌培养液按1%的接种量分别接种到含有0、10、20、40 mg·L-1 DMP的100 mL灭菌牛肉膏蛋白胨培养基中。以不加DMP的处理为对照组(CK),10、20、40 mg· L-1DMP浓度为实验组。30 ℃,130 r·min-1振荡培养细菌至对数生长中期(8 h),进行试验。
1.2.2 平板计数试验分别取1 mL在不同浓度DMP(0、10、20、40 mg· L-1)条件下培养5 h和8 h的细菌,再分别将其加入装有9 mL灭菌的去离子水试管中,依次进行浓度稀释,最终取稀释度为108和109的菌悬液100 μL进行平板涂布试验,根据对数生长的数学模型计算细菌比生长速率与代时和DMP污染浓度的相互关系。比生长速率(μ)和代时(G)公式如下:
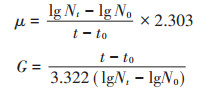
|
式中:Nt和N0分别代表时间8 h和5 h时的细胞数量。
1.2.3 细菌表面Zeta电位试验取5 mL在不同浓度DMP(0、10、20、40 mg·L-1)条件下培养8 h的P. fluorescens,于4000 r·min-1离心10 min,收集菌体,用灭菌的去离子水清洗并且重悬,制备成终浓度为OD600=0.8的菌悬液。利用Zeta电位仪测定细菌表面电位[18]。
1.2.4 细菌膜流动性试验取10 mL在不同浓度DMP(0、10、20、40 mg·L-1)条件下培养8 h的P. fluorescens,于4000 r·min-1离心10 min,弃上清,用灭菌的去离子水清洗并且重悬,制备成终浓度OD600=0.8的菌悬液。加入新配制的100 μmol·L-1的DPH四氢呋喃溶液5 μL,室温避光染色细菌30 min,得到DPH标记的细菌。再利用带有偏振装置的荧光分光光度计测定荧光偏振度P。检测条件:激发波长Ex=360 nm;发射波长Ex=427 nm;激发狭缝5 nm;发射狭缝10 nm[19]。
1.2.5 透射电镜(TEM)试验取1.5 mL在不同浓度DMP(0、10、20、40 mg·L-1)条件下培养8 h的P. fluorescens,用灭菌的去离子水清洗并且重悬。取菌悬液100 μL于锡箔纸上,自然风干后分别在2.5%戊二醛与1%锇酸中于4 ℃下固定4 h,然后用30%、50%、70%、85%和95%的乙醇梯度脱水,再经100%乙醇脱水2次,脱水后冻干。将冻干的样品经Eponate 812环氧树脂包埋,超薄切片(70 nm左右)后,经醋酸铀-柠檬酸铅双染,透射电子显微镜观察菌体表面形态变化[20]。
1.2.6 DMP在P. fluorescens细胞内外的分布取10 mL在不同浓度DMP(0、10、20、40 mg·L-1)条件下培养8 h的P. fluorescens,4000 r·min-1离心10 min,收集上清液于干净的试管中,再加入5 mL灭菌的去离子水洗涤一次,将上清液与试管中的溶液合并,用于测定细胞外DMP浓度;剩余沉淀细菌加5 mL灭菌的去离子水重悬,通过超声波细胞粉碎机破碎细胞,11 000 r·min-1离心10 min后收集上清液,用以测定细胞内DMP浓度[21]。每个样品分别用相同体积的乙酸乙酯萃取,取上层有机相于旋转蒸发仪中蒸干,再用色谱级甲醇定容至10 mL,取1 mL溶液置于液相小瓶中,通过高效液相色谱检测其中的DMP含量。检测条件为流动相:90%甲醇,10%水;柱温:30 ℃;流速:0.5 mL·min-1;检测波长228 nm[22]。
1.3 数据处理所有实验均进行3次平行处理,实验数据以平均值±标准差表示,数据采用SigmaPlot 12.5进行图表绘制,SPSS 22.0软件进行统计分析,P < 0.05具有统计学意义。
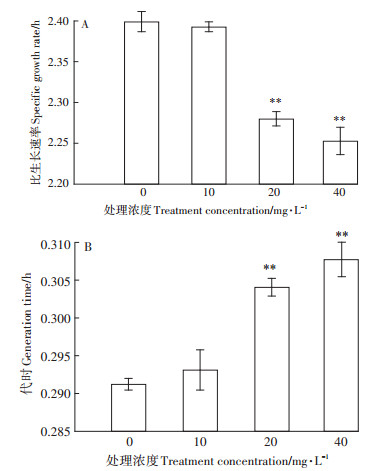
2 结果与讨论 2.1 P. fluorescens比生长速率与代时和污染浓度的关系对数生长的数学模型在现代微生物学中的应用越来越重要,它能较明确地表达生命现象的动态过程。如图 1A所示,与CK相比,随着DMP污染浓度增加,比生长速率逐渐减小,说明DMP污染浓度越大,细菌每小时增加的数量越少,即生长速度缓慢。从图 1B可以看出,随着DMP污染浓度增加,代时(每个细菌分裂繁殖一代所需的时间)越长。此试验表明随着DMP污染浓度增加,细菌个体繁殖速度迟缓且生长速率缓慢。这与Wang等[23]研究表明较大的DMP浓度对P. fluorescens的生长和葡萄糖的利用有很大抑制作用的结果一致。
|
**表示差异极显著(P < 0.01)。下同 ** indicate extremely significant difference(P < 0.01).The same below 图 1 P. fluorescens在不同浓度DMP处理下的比生长速率(A)及代时(B) Figure 1 The specific growth rate(A)and generation time(B)of P. fluorescens treated with different concentrations of DMP |
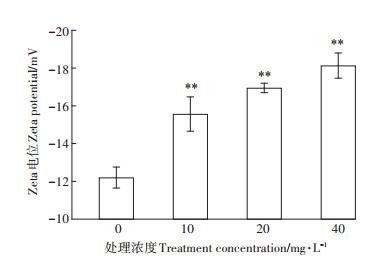
细胞壁是细菌的重要结构,同时也是保护细胞免受外界损伤的第一层保障[24]。P. fluorescens表面Zeta电位变化如图 2所示,CK的表面电势为-12.21±0.56 mV。随DMP污染浓度增加,细菌表面Zeta电位逐渐减小,最低为-18.13±0.67 mV。细菌含有独特的细胞壁结构,包括肽链和氨基糖链组成的肽聚糖及其他蛋白质、多糖类物质,这是细菌表面带有负电荷的原因。Liu等[18]用低浓度全氟辛烷磺酸和全氟辛酸处理大肠杆菌后细菌表面Zeta电位降低,与本研究结果一致。可能是细菌免疫产生蛋白和脂多糖以减少自身损伤的结果,或由于细胞内电荷的内容物流出,附着在细菌表面,降低细胞表面所带的负电荷,导致Zeta电位的减小[25]。DMP对P. fluorescens的毒理作用机制,在微观上首先表现为DMP对细菌细胞壁结构的破坏。
|
图 2 P. fluorescens表面Zeta电位变化 Figure 2 Changes of Zeta potential on the surface of P. fluorescens |
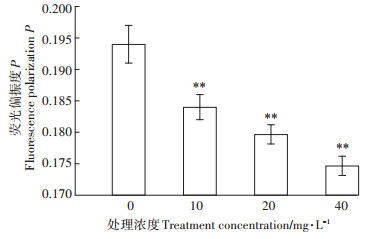
生物细胞膜是细胞与外界环境之间的重要屏障,可维持细胞的基本代谢,保护细胞免受外界干扰,其中流动性是维持细胞膜发挥正常功能的关键。疏水性荧光探针DPH已经被广泛用于细胞膜流动性的研究,DPH荧光偏振度与目标生物膜的流动性密切相关:膜流动性增加会降低荧光偏振度P,反之亦然[26-28]。如图 3所示,经DMP污染后,P. fluorescens细胞膜流动性明显改变,随着DMP处理浓度的增加,DPH的荧光偏振度从0.194逐渐降低到0.174,细胞膜流动性显著增加。膜流动性的增加可能会破坏细菌细胞的结构,导致细胞质壁分离,同时细胞内含物会暴露在外部环境中,这也可能是电负性下降的原因[18]。有报道称化合物全氟辛烷磺酸、蒎烯和四氢萘也会引起细菌细胞膜流动性增加[29-30],因此我们猜测P. fluorescens膜流动性的增加可能是因为DMP导致细菌的脂肪酸链排列松散,破坏细菌的脂双层结构,进而影响膜的功能[19]。
|
图 3 P. fluorescens膜荧光偏振度变化 Figure 3 Changes of fluorescence polarization on membrane of P. fluorescens |
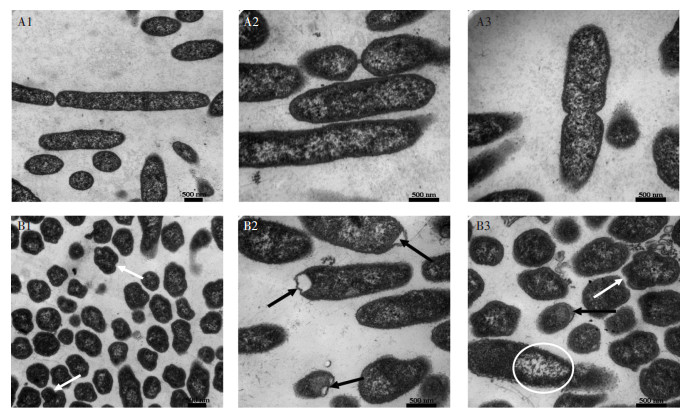
TEM电镜观察结果如图 4所示,可以看出未经DMP污染的P. fluorescens纵切面细胞壁和细胞膜完整;横切面表面光滑,无明显变形。而DMP污染后,P. fluorescens纵表面出现明显的质壁分离、表面褶皱(黑色箭头);横切面凹凸变形明显(白色箭头);同时出现了某些细胞内容物的释放(白色圆圈)。TEM图明显说明了P. fluorescens受到DMP污染后,细胞壁和细胞膜遭到破坏。
|
(A1~A3:0 mg·L-1; B1~B3:40 mg·L-1) 图 4 P. fluorescens的TEM图(×50 000倍) Figure 4 TEM images of P. fluorescens (×50 000 times) |
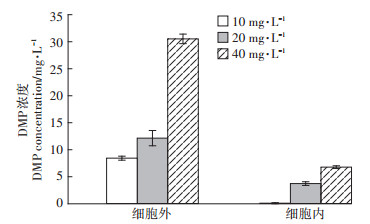
赵晓松等[31]发现DMP可以与DNA进行嵌插性的结合,改变DNA的结构。王志刚等[32]研究发现DMP污染会抑制Bacillus subtilis B19、Escherichia coli K12生长,对细菌产生氧化损伤,引起细菌氧化应激。DMP在P. fluorescens细胞内外的分布见图 5。由图可知,培养基中的DMP浓度随着DMP添加量的增加而增加。在DMP处理浓度为40 mg·L-1时,培养基中的DMP检测值达到最大,检测浓度为30.52±0.88 mg· L-1。从图中还可以看出,在10、20、40 mg·L-1DMP浓度处理下的P. fluorescens细胞内检测到的DMP浓度越来越高,从0.11±0.10 mg·L-1升高到了6.78±0.25 mg·L-1。这说明当P. fluorescens受到DMP污染时,DMP会破坏细胞壁和细胞膜后进入到细胞内,并且随着DMP浓度的增加,细胞壁和细胞膜的破坏程度越大,进入细胞内的DMP浓度越高。
|
图 5 DMP在细胞内外含量 Figure 5 DMP content inside and outside the cell |
(1)DMP污染P. fluorescens,导致细菌细胞膜特性改变,其中膜流动性、通透性增加,同时也导致细胞壁表面电位降低,细胞内容物泄露。
(2)DMP污染导致了P. fluorescens比生长速率减小,代时增加。
(3)DMP可以破坏P. fluorescens的细胞壁和细胞膜后渗透进入细菌内,影响细菌正常生长。
| [1] |
韩文辉, 赵颖, 党晋华, 等. 汾河流域邻苯二甲酸酯的分布特征及生态风险评价[J]. 环境化学, 2017, 36(6): 1377-1387. HAN Wen-hui, ZHAO Ying, DANG Jin-hua, et al. Distribution and ecological risk evaluation of phthalate esters in Fenhe River basin[J]. Environmental Chemistry, 2017, 36(6): 1377-1387. |
| [2] |
Jin D, Kong X, Cui B, et al. Biodegradation of di-n-butyl phthalate by a newly isolated halotolerant Sphingobium sp.[J]. International Journal of Molecular Sciences, 2013, 41(12): 24046-24054. |
| [3] |
Wang Z G, Hu Y L, Xu W H, et al. Impacts of dimethyl phthalate on the bacterial community and functions in black soils[J]. Frontiers in Microbiology, 2015, 6: 405. |
| [4] |
Wang P, Wang S L, Fan C Q. Atmospheric distribution of particulateand gas-phase phthalic esters(PAEs)in a Metropolitan City, Nanjing, east China[J]. Chemosphere, 2008, 72(10): 1567-1572. |
| [5] |
Zheng X, Zhang B T, Teng Y. Distribution of phthalate acid esters in lakes of Beijing and its relationship with anthropogenic activities[J]. Science of the Total Environment, 2014, 476/477: 107-113. DOI:10.1016/j.scitotenv.2013.12.111 |
| [6] |
吴山, 李彬, 梁金明, 等. 汕头市蔬菜产区土壤-蔬菜中邻苯二甲酸酯(PAEs)污染分布特征研究[J]. 农业环境科学学报, 2015, 34(10): 1889-1896. WU Shan, LI Bin, LIANG Jin-ming, et al. Distribution characteristics of phthalic acid esters in soils and vegetables in vegetable producing areas of Shantou City, China[J]. Journal of Agro-Environment Science, 2015, 34(10): 1889-1896. DOI:10.11654/jaes.2015.10.008 |
| [7] |
张海光, 孙国帅, 孙磊, 等. 典型覆膜作物土壤中邻苯二甲酸酯污染的初步研究[J]. 中国环境监测, 2013, 29(4): 60-63. ZHANG Hai-guang, SUN Guo-shuai, SUN Lei, et al. Preliminary study on phthalic add esters pollution of typical plastic mulched crops soils[J]. EnvironmentaI Monitoring in China, 2013, 29(4): 60-63. DOI:10.3969/j.issn.1002-6002.2013.04.013 |
| [8] |
朱振宇, 姬亚芹, 赵静波, 等. 天津市大气PM10与降尘中邻苯二甲酸酯的污染特征及相关性分析[J]. 环境污染与防治, 2015, 37(12): 24-28. ZHU Zhen-yu, JI Ya-qin, ZHAO Jing-bo, et al. Pollution characteristics and correlation analysis of PAEs in atmospheric PM10 and dust in Tianjin[J]. Environmental Pollution and Prevention, 2015, 37(12): 24-28. |
| [9] |
高莉, 赵开楼, 田义静. 黄河兰州断面半挥发性有机污染物分布特征研究[J]. 华东地质, 2008, 29(4): 315-318. GAO Li, ZHAO Kai-lou, TIAN Yi-jing. Study on distribution characteristics of semi-volatile organic pollutants in Lanzhou section of the Yellow River[J]. East China Geology, 2008, 29(4): 315-318. |
| [10] |
张道来, 刘娜, 朱志刚, 等. 青岛市典型海岸带表层沉积物中邻苯二甲酸酯的组成、分布特征及生态风险评价[J]. 海洋环境科学, 2016, 35(5): 652-657. ZHANG Dao-lai, LIU Na, ZHU Zhi-gang, et al. Composition, distribution characteristics and ecological risk assessment of phthalate esters in surface sediments of typical coastal zones in Qingdao[J]. Marine Environmental Science, 2016, 35(5): 652-657. |
| [11] |
Wallace R L, Hirkala D L, Nelson L M. Postharvest biological control of blue mold of apple by Pseudomonas fluorescens during commercial storage and potential modes of action[J]. Postharvest Biology & Technology, 2017, 133: 1-11. |
| [12] |
Kai M, Effmert U, Berg G, et al. Volatiles of bacterial antagonists inhibit mycelial growth of the plant pathogen Rhizoctonia solani[J]. Archives of Microbiology, 2007, 187(5): 351-360. DOI:10.1007/s00203-006-0199-0 |
| [13] |
Mayak S, Tirosh T, Glick B R. Plant growth-promoting bacteria that confer resistance to water stress in tomatoes and peppers[J]. Plant Science, 2004, 166(2): 525-530. DOI:10.1016/j.plantsci.2003.10.025 |
| [14] |
Manaf H H, Zayed M S. Productivity of cowpea as affected by salt stress in presence of endomycorrhizae and Pseudomonas fluorescens[J]. Annals of Agricultural Sciences, 2015, 60(2): 219-226. DOI:10.1016/j.aoas.2015.10.013 |
| [15] |
Wang Z, Liu S, Xu W, et al. The microbiome and functions of black soils are altered by dibutyl phthalate contamination[J]. Applied Soil Ecology, 2016, 99: 51-61. DOI:10.1016/j.apsoil.2015.11.024 |
| [16] |
王志刚, 由义敏, 徐伟慧, 等. 黑土微生物丰度和多样性对邻苯二甲酸二丁酯污染的响应[J]. 生态环境学报, 2015, 24(10): 1725-1730. WANG Zhi-gang, YOU Yi-min, XU Wei-hui, et al. Response of the abundance and diversity of microbes in black soil to di-n-butyl phthalate contamination[J]. Ecology and Environmental Sciences, 2015, 24(10): 1725-1730. |
| [17] |
王志刚, 胡云龙, 徐伟慧, 等. 邻苯二甲酸二甲酯污染对黑土微生物丰度和多样性的影响[J]. 生态与农村环境学报, 2015, 31(5): 779-783. WANG Zhi-gang, HU Yun-long, XU Wei-hui, et al. Impacts of dimethyl phthalate contamination on abundance and diversity of microbes in black soil[J]. Journal of Ecology and Rural Environment, 2015, 31(5): 779-783. |
| [18] |
Liu G, Zhang S, Yang K, et al. Toxicity of perfluorooctane sulfonate and perfluorooctanoic acid to Escherichia coli:Membrane disruption, oxidative stress, and DNA damage induced cell inactivation and/or death[J]. Environmental Pollution, 2016, 214: 806-815. DOI:10.1016/j.envpol.2016.04.089 |
| [19] |
窦京娇.北极海冰细菌脂肪酸系统在生境适应性中的作用研究[D].济南: 齐鲁工业大学, 2013. DOU Jing-jiao. A researsh on the role of arctic sea-ice bacteria fatty acid system in environment adaptability[D]. Jinan: Qilu University of Technology, 2013. http://cdmd.cnki.com.cn/article/cdmd-10431-1014104369.htm |
| [20] |
魏玉利, 邹宁. 光合细菌的透射电镜观察[J]. 生命科学仪器, 2007, 5(5): 16-18. WEI Yu-li, ZOU Ning. Observation of photosynthetic bacteria by transmission electron microscopic[J]. Life Science Instruments, 2007, 5(5): 16-18. DOI:10.3969/j.issn.1671-7929.2007.05.004 |
| [21] |
徐国发, 陈平, 张建博, 等. RP-HPLC法测定PC12细胞内外液中甜味剂赤藓糖醇的含量变化[J]. 中国食品添加剂, 2016(1): 133-136. XU Guo-fa, CHEN Ping, ZHANG Jian-bo, et al. Determination of erythritol content change in intracellular and extracellular fluid of PC12 cells by RP-HPLC[J]. China Food Additives, 2016(1): 133-136. DOI:10.3969/j.issn.1006-2513.2016.01.016 |
| [22] |
Cavaliere B, Macchione B, Sindona G, et al. Tandem mass spectrometry in food safety assessment:The determination of phthalates in olive oil[J]. Journal of Chromatography A, 2008, 1205(1/2): 137-143. |
| [23] |
Wang Z, Wang C, You Y, et al. Response of Pseudomonas fluorescens to dimethyl phthalate[J]. Ecotoxicology and Environmental Safety, 2019, 167: 36-43. DOI:10.1016/j.ecoenv.2018.09.078 |
| [24] |
向思琴. 细菌细胞壁肽聚糖的结构与作用[J]. 技术与市场, 2017(1): 169. XIANG Si-qin. Structure and function of peptidoglycan in bacterial cell wall[J]. Technology and Market, 2017(1): 169. DOI:10.3969/j.issn.1006-8554.2017.01.108 |
| [25] |
叶淑娟, 何占航, 洪广峰, 等. 化学消毒剂对污水处理系统中游离细菌表面zeta电位的影响[J]. 中国消毒学杂志, 2006, 23(5): 415-418. YE Shu-juan, HE Zhan-hang, HONG Guang-feng, et al. Influence of chemical disinfectant on zeta potential of free bacterial surface in sewage treatment system[J]. Chinese Journal of Disinfection, 2006, 23(5): 415-418. DOI:10.3969/j.issn.1001-7658.2006.05.011 |
| [26] |
Learmonth R P. Membrane fluidity in yeast adaptation:Insights from fluorescence spectroscopy and microscopy[M]. New York: Springer, 2012: 67-93.
|
| [27] |
Brejchovã J, SãKora J, Dlouhã K, et al. Fluorescence spectroscopy studies of HEK293 cells expressing DOR-Gi1α fusion protein; the effect of cholesterol depletion[J]. Biochim Biophys Acta, 2011, 1808(12): 2819-2829. DOI:10.1016/j.bbamem.2011.08.010 |
| [28] |
Li J, Chikindas M L, Ludescher R D, et al. Temperature-and surfactant-induced membrane modifications that alter listeria monocytogenes nisin sensitivity by different mechanisms[J]. Applied & Environmental Microbiology, 2002, 68(12): 5904-5910. |
| [29] |
Sikkema J, De Bont J A, Poolman B. Interactions of cyclic hydrocarbons with biological membranes[J]. Journal of Biological Chemistry, 1994, 269(11): 8022-8028. |
| [30] |
Xie W, Ludewig G, Wang K, et al. Model and cell membrane partitioning of perfluorooctanesulfonate is independent of the lipid chain length[J]. Colloids Surf B Biointerfaces, 2010, 76(1): 128-136. DOI:10.1016/j.colsurfb.2009.10.025 |
| [31] |
赵晓松, 王志刚, 王春龙, 等. 采用光谱学技术分析邻苯二甲酸酯与DNA互作机制[J]. 生态毒理学报, 2017, 12(4): 385-391. ZHAO Xiao-song, WANG Zhi-gang, WANG Chun-long, et al. Bonding mechanism between phthalic acid esters and DNA by spectroscopy technologies[J]. Asian Journal of Ecotoxicology, 2017, 12(4): 385-391. |
| [32] |
王志刚, 胡影, 崔竞文. 邻苯二甲酸二甲酯对典型细菌生长和氧化应激酶系的影响[J]. 生态毒理学报, 2015, 10(3): 297-303. WANG Zhi-gang, HU Ying, CUI Jing-wen. Impact of dimethyl phthalate on the activities of oxidative stress enzymes and growth of typical bacteria[J]. Asian Journal of Ecotoxicology, 2015, 10(3): 297-303. |
 2019, Vol. 38
2019, Vol. 38