2. 湖南省灌溉水源水质污染净化工程技术研究中心, 长沙 410128;
3. 重金属污染耕地安全高效利用湖南省工程研究中心, 长沙 410128
2. Engineering Research Center for Water Pollution Purification of Irrigation Source in Hunan Province, Changsha 410128, China;
3. Hunan Engineering Research Center for Safe and High-Efficient Utilization of Heavy Metal Pollution Farmland, Changsha 410128, China
土壤重金属污染是当今最为突出的环境问题之一,其中,镉(Cd)已成为我国受污染土壤中最主要的重金属类污染物[1]。20世纪60年代,日本富山县神通川流域出现“痛痛病”,就是由Cd引起的公害事件,引起人们对重金属污染问题的高度重视[2]。Cd对人类和其他动植物均有毒害作用。研究发现,Cd容易被植物尤其是一些农作物吸收并富集,Cd胁迫下的植物会表现出一系列不良症状,如生长抑制、植株矮小、萎黄病等,这都可能导致植物生物量大幅降低[3-5]。彭鸥等[6]研究发现水培条件下,当Cd2+浓度为0.2~1 mg·L-1时,水稻各农艺性状与不加Cd的对照组相比均显著降低,且Cd2+浓度越高,水稻产量越低。Cd会通过食物链在动物体肝、肾等器官中累积,影响生理代谢,从而对动物体各大系统产生不同程度的损害[7-9]。
近年来,微生物修复技术因其环境友好性和投入低等优点受到广泛关注。微生物作为土壤中的重要组成部分,具有比表面积大、带电荷、代谢活动旺盛、种类繁多、数量大等特点,有的土壤微生物不仅参与土壤中污染物的降解或转化过程,还可作为环境载体吸附重金属污染物[10]。本文使用的细菌(Delftia sp. B9)是从Cd污染土壤中筛选分离的一株耐镉细菌[11],该菌株已被证明能使土壤中的Cd从弱酸可溶态向可还原态和残渣态转化。已有大量研究报道该菌属细菌能够降解或转化有机和无机污染物[12-14]。Prakash等[15]报道了D.tsuruhatensis AR-7可以通过胞内积累或细胞膜吸附将Se4+转化为Se0,Caravaglia等[16]和Ubalde等[17]报道了Cr(Ⅵ)抗性菌D. acidovorans AR和Delftia sp. JD2对Cr(Ⅵ)的生物转化,可将Cr(Ⅵ)还原成毒性较低的Cr(Ⅲ)。此外,有相关研究[18-19]表明,Delftia菌属菌株能够产生植物促生物质,有效抑制病原菌活性,提升作物质量和产量。然而,重金属Cd胁迫下Delftia菌属菌株对水稻生长及积累Cd的研究较少,Delftia sp. B9在促进水稻生长及减少累积Cd中具有很大的发展潜力和应用价值。
本文使用耐镉细菌Delftia sp. B9,研究不同Cd浓度对菌体产铁载体和产吲哚乙酸(IAA)能力的影响,并将菌体添加于Cd胁迫下水稻种子发芽及幼苗试验,研究其对水稻种子萌发及幼苗积累Cd的影响,为耐镉菌株的应用提供理论参考。
1 材料与方法 1.1 试验材料液体培养基:牛肉膏3 g、蛋白胨10 g、氯化钠5 g、蒸馏水1 L,pH 7.2~7.4,121 ℃高压灭菌锅灭菌30 min。
菌株及菌悬液制备:测试菌株为Delftia sp. B9(基因登录号为MF679148,菌种保藏号为CGMCC No.16073,简称B9)。将Delftia sp. B9接种于液体培养基中30 ℃、120 r·min-1培养24 h,用无菌水洗涤两次后制成OD600=1.6(7.6×108 cfu·mL-1)的菌悬液(菌悬液1,菌液浓度设置参考王秋菊等[20]),然后用无菌水将菌悬液1稀释10倍(菌悬液2,7.6×107 cfu·mL-1)、100倍(菌悬液3,7.6×106 cfu·mL-1)、1000倍(菌悬液4,7.6×105 cfu·mL-1)的稀释液,备用。
水稻品种:华润2号(常规稻,全生育期119 d);深两优5814(籼型两系杂交水稻,全生育期137 d)。
1.2 Cd胁迫对Delftia sp. B9产铁载体和产IAA能力的测定用MKB液体培养基[21]培养菌株,采用CAS检验法[21]测定菌株合成铁载体的能力。菌株产铁载体的能力用铁载体活性单位(Siderophore unit,SU)表示,铁载体活性单位的计算公式:
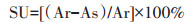
|
式中:Ar表示未接种菌液下的OD630值,As表示接种菌液下的OD630值。SU数值大小与菌株产铁载体能力呈正相关。
菌株分泌IAA的能力采用Salkowski比色法[22]测定。
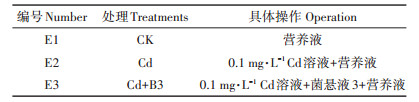
试验各处理如下:(1)B9;(2)B9+Cd1(0.01 mg·L-1 Cd);(3)B9+Cd2(0.1 mg·L-1 Cd)。Cd浓度设置根据《农田灌溉水质标准》(GB 5084—2005),灌溉水中Cd允许的最大排放浓度为0.01 mg·L-1,以此作为Cd胁迫处理的低浓度,同时设置0.1 mg·L-1作为Cd胁迫处理的高浓度。
1.3 种子萌发试验 1.3.1 不同浓度Delftia sp. B9菌液对水稻种子萌发的影响试验采用光照培养箱培养方法。选取大小一致、籽粒饱满的水稻种子用2%的H2O2消毒6 min,再用去离子水反复冲洗3~5遍,将种子放入去离子水中浸种24 h后,均匀播于铺有2层滤纸的培养皿(直径为12 cm)中,每皿铺放30粒。分别加入1.1中制备的不同浓度的菌悬液20 mL,以添加无菌水的处理作为对照。各处理如下:(1)CK:无菌水;(2)B1:菌悬液1;(3)B2:菌悬液2;(4)B3:菌悬液3;(5)B4:菌悬液4。盖上培养皿盖,置于培养箱内以光照16 h、黑暗8 h进行培养,条件控制温度为30 ℃。于培养7 d后统计发芽数,以幼芽达到种子长度一半,幼根与种子等长作为发芽标准,1次支根数以根长与种子等长为标准[23]。培养期间喷洒菌液使滤纸保持湿润。
1.3.2 Delftia sp. B9菌液对Cd胁迫下水稻种子萌发及幼苗耐Cd性试验种子萌发的方法按照1.3.1中进行,分别加入20 mL不同处理溶液浸润的种子,盖上培养皿盖,置于培养箱内以光照16 h、黑暗8 h进行培养,条件控制温度为30 ℃。培养期间每日记录种子发芽数,并在培养7 d后统计发芽数、幼根及幼芽长度,根系、幼芽长度用1/10 cm尺子人工测量。培养期间喷洒菌液使滤纸保持湿润(菌液浓度根据1.3.1结果选择7.6×106 cfu·mL-1)。各处理具体操作见表 1。水稻种子的发芽率、发芽指数、活力指数、耐性系数和胁迫指数的计算公式为:

|
|
|
表 1 Cd胁迫下水稻种子发芽试验 Table 1 Experiment on germination of rice seeds under Cd stress |
幼苗培养使用营养液:1 L木村B营养液中添加1 mL Arnon A-Z微量元素营养液[26-27]。
种子萌发的方法按照1.3.1中进行,种子萌发时每日适当补充蒸馏水。待水稻幼苗长到两叶一心时移栽到烧杯中,移栽后加入培养液进行培养,初始移栽时用1/3营养液,15 d后用1/2营养液。营养液中Cd以CdCl2·2.5H2O的形式加入,菌悬液经无菌水洗涤后加入并保持一定浓度(菌悬液浓度根据1.3.1结果选择7.6×106 cfu·mL-1)。培养液每5 d更换一次,调节pH至5.5~6.0。培养条件如表 2所示,每个处理3个重复。分别在水稻移栽后的第1、3、5、10、15、20、30 d对水稻幼苗苗长和根长进行测量。
|
|
表 2 幼苗生长试验处理 Table 2 Experiment on growth of rice seedlings |
培养条件如表 2所示,分别在水稻移栽后的第1、3、5、10、15、20、30 d采集水稻幼苗,叶绿素含量测定参照王备芳等[28]的方法进行,叶绿素a(Chlorophyll-a,Chl a)、叶绿素b(Chlorophyll-b,Chl b)计算公式:
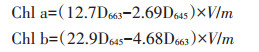
|
式中:V表示提取液的体积,10-3 L;W表示叶片的质量,g。
1.5 Delftia sp. B9对Cd胁迫下水稻转运和吸收Cd的影响试验培养条件如表 2所示,在水稻移栽后的第30 d收集水稻样品,用自来水洗净水稻植株,将植株根、茎、叶进行手工分离,并置于105±2 ℃烘箱内杀青1 h,然后在65±2 ℃下烘干至恒质量。水稻样品采用混合酸(HClO4:HNO3=1:4)湿法进行消解,消解时每个样品3个重复,每一台消解仪上有3个空白样品和3个质控样品。Cd浓度在0.1 mg·L -1以上的样品用ICP-OES(美国PE8300)进行测定,Cd浓度在0.1 mg·L-1及以下的样品采用原子吸收分光光度计-石墨炉法(GTA120,美国Varian)测定。消解液不能及时测定时应放入冰柜冷藏保存。
1.6 数据处理试验数据采用Office 2013、SPSS 22.0软件进行分析与作图,差异显著性采用ANOVA单因素方差分析。
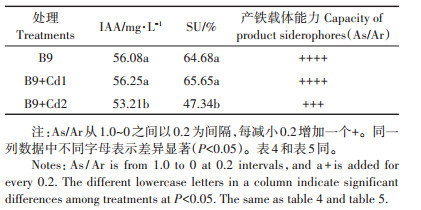
2 结果与分析 2.1 Cd胁迫对Delftia sp. B9产铁载体IAA能力的影响由表 3可知,Delftia sp. B9具有产铁载体和产IAA的能力,其中,铁载体活性单位(SU)为64.68%,OD630的As/Ar为0.35,As/Ar代表细菌产铁载体的相对含量,该值越低SU值越高,表明产生的铁载体的含量越高。一般产铁载体能力较高的细菌As/Ar值低于0.5[29],因此,Delftia sp. B9是一株高产铁载体的细菌。Delftia sp. B9中产生的IAA质量浓度为56.08 mg·L-1。当培养基中Cd浓度为0.01 mg·L-1时,均能提高B9产铁载体和产IAA的能力,但未出现显著性差异。当培养基中Cd浓度为0.1 mg·L-1时,B9产铁载体和产IAA的能力显著下降,As/Ar值为0.53,为中等产铁载体能力。
|
|
表 3 Cd胁迫对Delftia sp. B9产铁载体和产IAA能力的影响 Table 3 Effects of siderophore and IAA production by Delftia sp. B9 under Cd stress |
不同浓度菌液对不同品种水稻种子发芽率的影响见图 1,添加B1和B2的两个处理对两个水稻品种的萌发有明显的抑制作用。与CK组相比,添加B1和B2使华润2号种子发芽率分别降低40.10%、16.87%;深两优5814种子发芽率分别降低40.44%、20.22%。添加B3和B4的处理对两个品种水稻种子的发芽率与CK相比无显著差异。后续实验中考虑到Cd浓度的胁迫作用,选用菌液B3(7.6×106 cfu·mL-1)作为添加量。
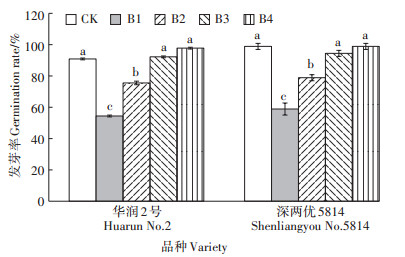
|
不同小写字母表示不同处理间差异显著(P<0.05)。下同 The different lowercase letters represent the significant difference within each treatment using one-way ANOVA(P < 0.05). The same below 图 1 不同浓度Delftia sp. B9菌液对水稻种子发芽率的影响 Figure 1 Effects of different concentrations of Delftia sp. B9 on germination rate of rice seeds |
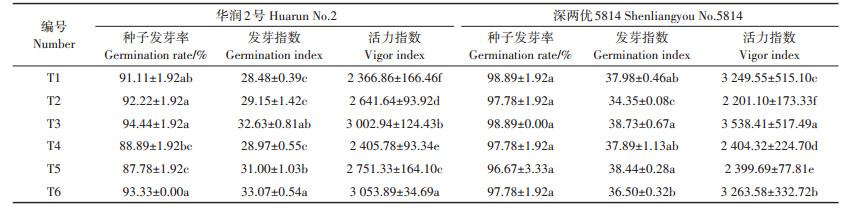
如表 4所示,Cd处理浓度为0.01 mg·L-1时(T3),华润2号的种子发芽指数和活力指数与对照T1相比都有显著提高,种子发芽率与T1相比虽有提高,但未达到显著差异;深两优5814的种子发芽率、发芽指数与T1相比无显著差异,活力指数显著增加。当Cd处理浓度为0.01 mg·L-1并且添加Delftia sp. B9菌液时(T4),华润2号的种子发芽率、发芽指数、活力指数与T3相比均显著降低;深两优5814的活力指数与T3相比显著降低。
|
|
表 4 不同浓度Cd胁迫下添加Delftia sp. B9对水稻种子萌发的影响 Table 4 The effects of Delftia sp. B9 on seed germination under Cd stress |
Cd处理浓度为0.1 mg·L-1时(T5),华润2号的种子发芽率与T1相比显著降低,发芽指数、活力指数与T1相比显著提高;深两优5814的种子发芽率、发芽指数与T1相比无显著差异,活力指数显著降低。当Cd处理浓度为0.1 mg·L-1并且添加Delftia sp. B9菌液时(T6),华润2号的种子发芽率、发芽指数、活力指数与T5相比均显著增加;深两优5814的活力指数与T5相比显著增加。T6处理下华润2号的种子发芽指数和活力指数与T1相比显著提高。
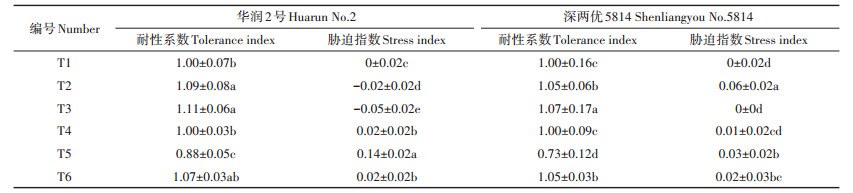
由表 5可以看出,当Cd处理浓度为0.01、0.1 mg·L-1时,华润2号T3处理的耐性系数显著高于T1,T6处理的耐性系数与T1相比未出现显著差异,但显著高于T5处理,T2、T3处理的胁迫指数比T1分别减小0.02、0.05,T4、T5、T6处理的胁迫指数与T1相比分别显著增加0.02、0.14、0.02;深两优5814的T3、T6耐性系数均显著高于T1,T2、T5、T6处理的胁迫指数均高于T1。Cd胁迫浓度高时(0.1 mg·L-1),对水稻种子发芽的胁迫指数:华润2号>深两优5814。添加菌液对水稻种子发芽的胁迫指数:华润2号>深两优5814。
|
|
表 5 不同浓度Cd胁迫下添加Delftia sp. B9对水稻幼苗耐Cd性的影响 Table 5 The effects of Delftia sp. B9 on Cd-tolerance of rice seedlings under Cd stress |
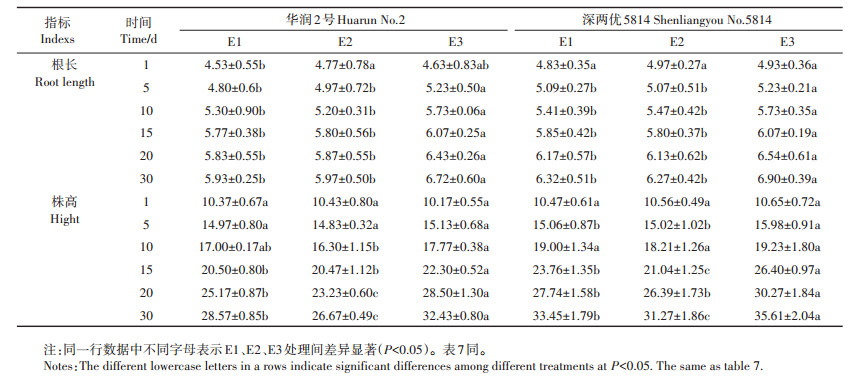
由表 6可知,在水稻移栽培养后的第5 d,华润2号和深两优5814的3个处理水稻根长出现差异,E2与E1相比未出现显著差异,E3与E2、E1相比根长均显著增加,且这种差异一直到培养的第30 d。华润2号在培养15 d时,E3与E1、E2相比株高显著增加;第30 d时E3处理比E1、E2处理株高分别增加3.86、5.76 cm;在培养第20 d时,E2处理与E1相比株高显著降低,第30 d时E2处理比E1处理株高减少1.90 cm。深两优5814在培养15 d时,3个处理的株高之间出现显著差异,大小为E3>E1>E2;第30 d时E3处理比E1、E2处理株高分别增加2.16、4.34 cm,E2处理比E1处理株高减少2.18 cm。
|
|
表 6 不同处理下水稻幼苗长势(cm) Table 6 The effects of Delftia sp. B9 on Cd-tolerance of growth tendency of rice seedling(cm) |
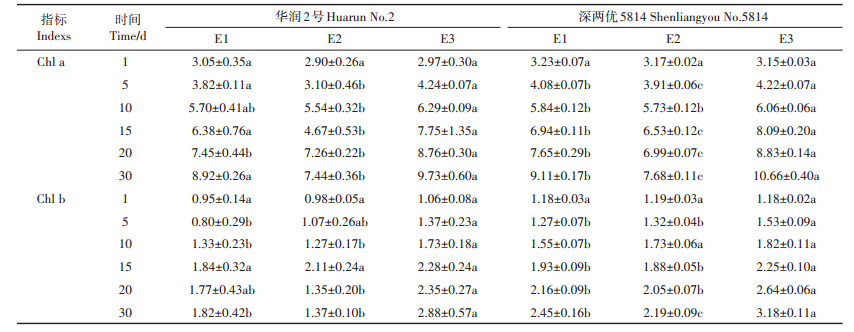
由表 7可知,水稻华润2号幼苗在移栽后第5 d,E2处理与E1、E3相比Chl a含量显著减少;培养到第20 d时,E3处理与E1、E2相比显著增加;到培养的第30 d,E3处理与E1、E2相比Chl a分别增加了0.81、2.29 mg·g-1,E2处理与E1相比Chl a显著减少1.48 mg·g-1。深两优5814幼苗在移栽后第5 d,Chl a含量在3个处理间出现显著差异,到培养的第30 d,Chl a含量为E3>E1>E2,E3处理与E1、E2相比Chl a分别增加了1.55、2.98 mg·g-1,E2处理与E1相比Chl a显著减少1.43 mg·g-1。
|
|
表 7 不同处理下水稻叶绿素含量(mg·g-1) Table 7 The differences of chlorophyll contents among different treatments(mg·g-1) |
华润2号幼苗在移栽后第5 d,E3处理与E1相比Chl b含量显著增加,到培养的第30 d,E3处理与E1、E2相比Chl b分别增加了1.06、1.51 mg·g-1,E1处理与E2之间Chl b有所差异,但未达到显著水平。深两优5814幼苗在移栽后第5 d,E3处理与E1、E2相比Chl b含量显著增加,到培养的第30 d,E3处理与E1、E2相比Chl b分别增加了0.73、0.99 mg·g-1,E2处理与E1相比Chl b显著减少0.26 mg·g-1。
2.4 Delftia sp. B9对Cd胁迫下水稻转运和吸收Cd的影响由图 2可知,两种水稻在移栽培养30 d后各部位Cd含量相差较大,且同一部位3个处理间Cd含量也相差很大。对照组(E1)根、茎、叶中也含有Cd,其可能来源于营养液配制所需使用的药品,其中含有微量的Cd。在Cd胁迫下(E2)华润2号根、茎、叶中Cd含量分别达到129.26、47.43、16.87 mg·kg-1,添加Delftia sp. B9菌液的处理(E3)中Cd含量分别达到46.78、15.37、4.92 mg·kg-1,与E2相比分别减少了82.48、32.06、11.95 mg·kg-1,减少率分别达到63.81%、67.59%、70.84%。深两优5814在T2处理下根、茎、叶中Cd含量分别达到89.35、30.29、9.64 mg·kg-1,E3中Cd含量与E2相比分别减少了67.86、22.67、7.79 mg·kg-1,减少率分别达到75.95%、74.84%、80.81%。同时,深两优5814各部位Cd含量均低于华润2号。
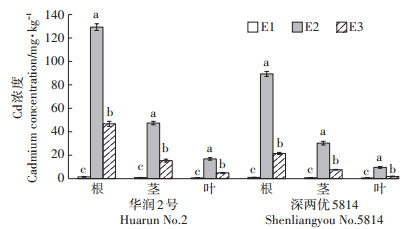
|
图 2 不同处理水稻幼苗各部位Cd含量 Figure 2 Cadmium concentration in various parts of rice seedling of different treatments |
种子萌发是植物实现天然更新的关键环节[30],是植物个体发育早期的生活史特征,影响结实率和成活率等后期生活史特征[31]。水稻是我国主要粮食作物之一,水稻萌发时期生长状况直接影响作物以后的生长和产量。Liu等[32]提出选育水稻品种时,不应只关注水稻的Cd吸收积累特性,还要关注水稻幼苗时期的生长情况。种子发芽率、发芽指数是衡量农作物种子发芽能力的重要指标,反映了种子发芽速度与整齐度的潜势,发芽指数能够反映种子在整个发芽期的综合活力。活力指数是反映种子品质的重要参数,既能反映种子发芽率、发芽速度,又能反映生长活力。这些指标能够从不同角度反映出水稻苗期耐镉性的强弱[33-35]。低Cd浓度(0.01 mg·L-1)增加了华润2号和深两优5814两个水稻品种的种子发芽率、发芽指数和活力指数,同时华润2号胁迫指数表现为促进作用;高浓度Cd胁迫(0.1 mg·L-1)可以降低两种水稻的发芽率耐性系数,胁迫指数显著增大(表 4、表 5)。出现这种低促高抑现象的原因可能是低浓度Cd提高胚的生理活性,从而促进种子萌发,高浓度Cd使得种子中淀粉酶和蛋白酶活性受到抑制,种子萌发和幼苗生长中物质和能量供应不足,抑制种子的正常萌发和幼苗生长[36-37]。另外,已有研究表明,Cd胁迫下植物细胞中DNA和RNA活性降低,核酸含量下降,有丝分裂过程受阻,从而影响种子发芽过程[38]。高浓度Cd胁迫对两个水稻品种的耐性系数和胁迫指数大小均表现为华润2号>深两优5814,这也表明Cd胁迫对不同品种水稻种子萌发的影响有差异,不同水稻品种的Cd耐性差异很大[39]。目前认为植物的耐Cd途径主要有限制Cd吸收、螯合沉淀和区域化作用[40]。邬飞波等[41]研究表明植物对重金属的耐性和积累在种间和基因型之间存在差异,在重金属胁迫下植物螯合态合成是植物对胁迫的一种适应性反应,耐性基因型合成较多的植物螯合态,植物螯合态可与重金属螯合,进一步转运至液泡贮存,从而达到解毒效果。深两优5814在0.1 mg·L-1Cd胁迫下种子发芽率和发芽指数均高于华润2号,同时幼苗培养中Chl a、Chl b以及株高、根长等都高于华润2号(表 6、表 7),可能是因为深两优5814是低积累Cd品种,幼苗培养后各部位Cd含量均远小于华润2号(图 2)。
本实验中Cd胁迫下添加Delftia sp. B9菌液能提高水稻幼苗的叶绿素含量,增加植株株高,并能显著减少水稻植株各部位Cd含量,可能是由于菌株对Cd2+的吸附,Delftia sp. B9对Cd2+具有较高的耐性和吸附能力[11],从而减少了Cd2+对水稻幼苗的胁迫,同时减少水稻幼苗对Cd2+的吸收和积累;另外,Delftia sp.能产生与植物促生菌(PGP)相关的代谢产物,如铁载体及IAA等促生物质,这些促生物质能促进植物生长,同时减少植物对Cd2+的吸收,减缓Cd对植物的胁迫。陆仲烟等[42]研究发现,Cd胁迫浓度在10 mg·L-1时接种伯克氏菌能显著提高水稻种子的活力指数、耐性系数和根系鲜质量。王立等[43]发现接种丛枝菌根真菌显著减轻Cd胁迫对水稻生长的抑制程度,水稻株高比对照组增加10%~13%。植物促生菌对植物生长发育有积极的影响,不仅为植物提供营养物质,固氮、溶磷、溶铁,并产生植物激素,还能提高植物抗逆性,抵抗致病生物体的感染[18, 44]。庞海东等[45]、杨丽等[46]的研究表明,促生菌产生的IAA和铁载体可以促进植物生长、提高植物对重金属的耐受性。铁载体不仅具有运输铁离子的作用,还可以与多种重金属离子进行络合,形成稳定的络合物,降低环境中重金属离子的浓度。Piotrowska-Niczyporuk等[47]研究发现IAA能够通过抑制重金属吸附来恢复植物的生长,缓解重金属对植物的毒害。经试验测定,Delftia sp. B9菌液能产生56.08 mg·L-1IAA,是一株高产铁载体的细菌(表 3),高浓度Cd胁迫会显著降低Delftia sp. B9产铁载体和产IAA的能力。添加不同浓度的Delftia sp. B9菌液对水稻种子萌发影响不同(图 1),高浓度菌液会抑制水稻种子萌发,这可能是由于菌液浓度过高产生某些有害的中间代谢产物,抑制了种子萌发。稀释后低浓度的菌液对种子萌发无抑制作用,也没有显著的促进作用,但能显著增加水稻株高和叶绿素含量。Morel等[44]研究表明,接种Delftia sp.JD2虽然不能增加苜蓿的苗产量,但能促进其根系的发育,同时能够增加4%~5%的作物产量。低浓度Cd胁迫下添加菌液没有增加种子的发芽率,这可能是因为菌液对Cd进行吸附使Cd浓度降低,减少了低浓度Cd对水稻种子萌发的促进作用;高浓度Cd胁迫下添加菌液比不添加的处理水稻种子的发芽率显著提高,可能是菌液对Cd进行吸附使Cd浓度降低,缓解了对种子的毒害,也可能是菌液产生铁载体降低了水稻种子对Cd的吸收。
4 结论(1)Cd胁迫浓度为0.1 mg·L-1时,添加Delftia sp. B9菌液可以提高水稻华润2号、深两优5814种子发芽率、活力指数和耐性系数,耐性系数分别显著增加0.19、0.32。
(2)Cd胁迫浓度为0.1 mg·L-1时,添加Delftia sp. B9菌液的处理能使两种水稻幼苗的Chl a含量分别增加2.29、2.98 mg·g-1,Chl b含量分别增加1.51、0.99 mg·g-1,植株株高分别增加5.76、4.34 cm。
(3)Cd胁迫浓度为0.1 mg·L-1时,添加Delftia sp. B9菌液的处理使华润2号根、茎、叶中Cd含量分别降低63.81%、67.59%、70.84%,深两优5814根、茎、叶中Cd含量分别降低75.95%、74.84%、80.81%。
| [1] |
杨扬, 王晓燕, 王江, 等. 物种多样性对植物生长与土壤镉污染修复的影响[J]. 环境科学学报, 2016, 36(6): 2103-2113. YANG Yang, WANG Xiao-yan, WANG Jiang, et al. Effects of species diversity on plant growth and remediation of Cd contamination in soil[J]. Acta Scientiae Circumstantiae, 2016, 36(6): 2103-2113. |
| [2] |
刘莉莉, 林岚, 殷霄, 等. 镉毒性研究进展[J]. 中国职业医学, 2012, 39(5): 445-447. LIU Li -li, LIN Lan, YIN Xiao, et al. Research progress on cadmium toxicity[J]. China Occupational Medicine, 2012, 39(5): 445-447. |
| [3] |
Dias M C, Monteiro C, Moutinho-Pereira J, et al. Cadmium toxicity affects photosynthesis and plant growth at different levels[J]. Acta Physiologiae Plantarum, 2013, 35(4): 1281-1289. DOI:10.1007/s11738-012-1167-8 |
| [4] |
Rizwan M, Ali S, Adrees M, et al. Cadmium stress in rice:Toxic effects, tolerance mechanisms, and management:A critical review[J]. Environmental Science and Pollution Research, 2016, 23(18): 17859-17879. DOI:10.1007/s11356-016-6436-4 |
| [5] |
陈虎, 郭笃发, 郭峰, 等. 作物吸收富集镉研究进展[J]. 中国农学通报, 2013, 29(3): 6-11. CHEN Hu, GUO Du-fa, GUO Feng, et al. Research advances on cadmium absorption and accumulation of plant[J]. Chinese Agricultural Science Bulletin, 2013, 29(3): 6-11. DOI:10.3969/j.issn.1000-6850.2013.03.004 |
| [6] |
彭鸥, 李丹阳, 刘寿涛, 等. 镉胁迫对水稻生长发育的影响及伤流液与稻米镉含量的相关性研究[J]. 生态与农村环境学报, 2019, 35(1): 76-82. PENG Ou, LI Dan-yang, LIU Shou-tao, et al. Effects of cadmium stress on rice growth and correlation between bleeding sap and cadmium content in rice[J]. Journal of Ecology and Rural Environment, 2019, 35(1): 76-82. |
| [7] |
Hartwig A. Cadmium and cancer cadmium:From toxicity to essentiality[M]. Netherlands: Springer, 2013: 491-507.
|
| [8] |
Milham P J, Payne T E, Lai B, et al. Can synchrotron micro-X-ray fluorescence spectroscopy be used to map the distribution of cadmium in soil particles?[J]. Soil Research, 2017, 45(8): 624-628. |
| [9] |
Chen C, Xun P C, Nishijo M, et al. Cadmium exposure and risk of lung cancer:A meta-analysis of cohort and case-control studies among general and occupational populations[J]. Journal of Exposure Science and Environmental Epidemiologyl, 2016, 26(5): 437-444. DOI:10.1038/jes.2016.6 |
| [10] |
Kavamura V N, Esposito E. Biotechnological strategies applied to the decontamination of soils polluted with heavy metals[J]. Biotechnology Advances, 2010, 28(1): 61-69. DOI:10.1016/j.biotechadv.2009.09.002 |
| [11] |
刘玉玲, 铁柏清, 李园星露, 等. 耐镉细菌的分离及其对土壤中镉的形态影响[J]. 农业环境科学学报, 2018, 37(2): 250-258. LIU Yu-ling, TIE Bai-qing, LI Yuan-xing-lu, et al. Isolation of a Cd-resistant bacterium and its effect on the speciation of Cd in soil[J]. Journal of Agro-Environment Science, 2018, 37(2): 250-258. |
| [12] |
Gusseme B D, Vanhaecke L, Verstraete W, et al. Degradation of acetaminophen by Delftia tsuruhatensis and Pseudomonas aeruginosa in a membrane bioreactor[J]. Water Research, 2011, 45(4): 1829-1837. DOI:10.1016/j.watres.2010.11.040 |
| [13] |
Maisuria V B, Nerurkar A S. Interference of quorum sensing by Delftia sp. VM4 depends on the activity of a novel N-Acylhomoserine lactone-acylase[J]. PLoS One, 2015, 10(9): e0138034. DOI:10.1371/journal.pone.0138034 |
| [14] |
Wu W Y, Huang H Y, Ling Z M, et al. Genome sequencing reveals mechanisms for heavy metal resistance and polycyclic aromatic hydrocarbon degradation in Delftia lacustris strain LZ-C[J]. Ecotoxicology, 2016, 25(1): 234-247. DOI:10.1007/s10646-015-1583-9 |
| [15] |
Prakash D, Pandey J, Tiwary B N, et al. Physiological adaptations and tolerance towards higher concentration of selenite(Se4+)in Enterobacter sp. AR-4, Bacillus sp. AR-6 and Delftia tsuruhatensis AR-7[J]. Extremophiles, 2010, 14(3): 261-272. DOI:10.1007/s00792-010-0305-8 |
| [16] |
Garavaglia L, Cerdeira S B, Vullo D L. Chromium(Ⅵ)biotransformation by β-and γ-proteobacteria from natural polluted environments:A combined biological and chemical treatment for industrial wastes[J]. Journal of Hazardous Materials, 2010, 175(1/2/3): 104-110. |
| [17] |
Ubalde M C, Braña V, Sueiro F, et al. The versatility of Delftia sp. isolates as tools for bioremediation and biofertilization technologies[J]. Current Microbiology, 2012, 64(6): 597-603. DOI:10.1007/s00284-012-0108-5 |
| [18] |
Han J G, Sun L, Dong X Z, et al. Characterization of a novel plant growth-promoting bacteria strain Delftia tsuruhatensis HR4 both as a diazotroph and a potential biocontrol agent against various plant pathogens[J]. Systematic Applied Microbiology, 2005, 28: 66-76. DOI:10.1016/j.syapm.2004.09.003 |
| [19] |
Morel M, Cagide C, Minteguiaga M, et al. The pattern of secreted molecules during the co-inoculation of alfalfa plants with Sinorhizobium meliloti and Delftia sp. JD2:An interaction that improves plant yield[J]. Mol Plant Microbe Interact, 2015, 28: 134-142. DOI:10.1094/MPMI-08-14-0229-R |
| [20] |
王秋菊, 焦峰, 崔战利, 等. 光合细菌浸种对水稻种子萌发的影响[J]. 作物杂志, 2012(3): 126-129. WANG Qiu-ju, JIAO Feng, CUI Zhan-li, et al. Influence of soaking seeds with PSB solution on germination of rice seed[J]. Crops, 2012(3): 126-129. |
| [21] |
王平, 董飚, 李阜棣, 等. 小麦根圈细菌铁载体的检测[J]. 微生物学通报, 1994, 21(6): 323-326. WANG Ping, DONG Biao, LI Fu-di, et al. Detection and determination of the siderophores produced by wheat rhizobacteria[J]. Microbiology China, 1994, 21(6): 323-326. |
| [22] |
Glickmann E, Dessaux Y. A critical examination of the specificity of the Salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied and Environmental Microbiology, 1995, 61(2): 793-796. |
| [23] |
曾翔, 张玉烛, 王凯荣, 等. 镉对水稻种子萌发的影响[J]. 应用生态学报, 2007, 18(7): 1665-1668. ZENG Xiang, ZHANG Yu -zhu, WANG Kai-rong, et al. Effects of cadmium on rice seed germination[J]. Chinese Journal of Applied Ecology, 2007, 18(7): 1665-1668. DOI:10.3321/j.issn:1001-9332.2007.07.041 |
| [24] |
何俊瑜, 任艳芳, 周国强, 等. 不同水稻品种种子萌发期耐镉性的研究[J]. 华北农学报, 2010, 25(3): 108-112. HE Jun-yu, REN Yan-fang, ZHOU Guo-qiang, et al. Study on cadmium tolerance of different varieties of Oryza sativa L. during seed germination stage[J]. Acta Agriculturae Boreali-Sinica, 2010, 25(3): 108-112. |
| [25] |
Wilkins D A. The measurement of tolerance to edaphic factors by means of root growth[J]. New Phytol, 1978, 80(3): 623-633. DOI:10.1111/j.1469-8137.1978.tb01595.x |
| [26] |
Arnon D I, Stour P R. Molybdenum as an essential element for higher plants[J]. Plant Physiology, 1939, 14(3): 599-602. DOI:10.1104/pp.14.3.599 |
| [27] |
薛应龙. 植物生理学实验手册[M]. 上海: 上海科学技术出版社, 1985: 145-146. XUE Ying-long. Handbook of plant physiological experiments[M]. Shanghai: Shanghai Scientific and Technical Publishers, 1985: 145-146. |
| [28] |
王备芳, 陈玉宇, 张迎信, 等. 水稻早衰突变体es5的鉴定及其突变基因的精细定位[J]. 中国农业科学, 2018, 51(4): 613-625. WANG Bei-fang, CHEN Yu-yu, ZHANG Ying-xin, et al. Identification and fine mapping of an early senescent leaf mutant es5 in Oryza sativa L.[J]. Scientia Agricultura Sinica, 2018, 51(4): 613-625. |
| [29] |
杨鸿儒, 袁博, 赵霞, 等. 三种荒漠灌木根际可培养固氮细菌类群及其固氮和产铁载体能力[J]. 微生物学通报, 2016, 43(11): 2366-2373. YANG Hong-ru, YUAN Bo, ZHAO Xia, et al. Cultivable diazotrophic community in the rhizosphere of three desert shrubs and their nitrogen-fixation and siderophore-producing capabilities[J]. Microbiology China, 2016, 43(11): 2366-2373. |
| [30] |
张敏, 朱教君, 闫巧玲. 光对种子萌发的影响机理研究进展[J]. 植物生态学报, 2012, 36(8): 899-908. ZHANG Min, ZHU Jiao-jun, YAN Qiao-ling. Review on influence mechanisms of light in seed germination[J]. Chinese Journal of Plant Ecology, 2012, 36(8): 899-908. |
| [31] |
刘会良, 宋明方, 段士民, 等. 古尔班通古特沙漠及周缘52种植物种子的萌发特性与生态意义[J]. 生态学报, 2011, 31(15): 4308-4317. LIU Hui-liang, SONG Ming-fang, DUAN Shi-min, et al. A comparative study of seed germination traits of 52 species from Gurbantunggut Desert and its peripheral zone[J]. Acta Ecologica Sinica, 2011, 31(15): 4308-4317. |
| [32] |
Liu J, Qian M, Cai G, et al. Uptake and translocation of Cd in different rice cultivars and the relation with Cd accumulation in rice grain[J]. Journal of Hazardous Materials, 2007, 143(1/2): 443-447. |
| [33] |
孙亚莉, 刘红梅, 徐庆国. 镉胁迫对不同水稻品种种子萌发特性的影响[J]. 中国水稻科学, 2017, 31(4): 425-431. SUN Ya-li, LIU Hong-mei, XU Qing-guo. Effects of cadmium stress on rice seed germination characteristics[J]. Chinese Journal of Rice Science, 2017, 31(4): 425-431. |
| [34] |
韩宝贺, 朱宏, 张艺馨. 镉对三种草坪草种子萌发与生长的影响[J]. 中国草地学报, 2014, 36(3): 98-103. HAN Bao-he, ZHU Hong, ZHANG Yi-xin. Effect of cadmium stress on the seed germination and growth of three turfgrasses[J]. Chinese Journal of Grassland, 2014, 36(3): 98-103. |
| [35] |
赵艳艳, 胡晓辉, 邹志荣, 等. 不同浓度5-氨基乙酰丙酸(ALA)浸种对NaCl胁迫下番茄种子发芽率及芽苗生长的影响[J]. 生态学报, 2013, 33(1): 62-70. ZHAO Yan-yan, HU Xiao-hui, ZOU Zhi-rong, et al. Effects of seed soaking with different concentrations of 5-aminolevulinic acid on the germination of tomato(Solanum lycopersicum) seeds under NaCl stress[J]. Acta Ecologica Sinica, 2013, 33(1): 62-70. |
| [36] |
何俊瑜, 任艳芳, 朱成, 等. 镉胁迫对水稻种子萌发、幼苗生长和淀粉酶活性的影响[J]. 中国水稻科学, 2008, 22(4): 399-404. HE Jun-yu, REN Yan-fang, ZHU Cheng, et al. Effects of cadmium stress on seed germination, seedling growth, and amylase activities in rice[J]. Chinese Journal of Rice Science, 2008, 22(4): 399-404. |
| [37] |
徐芬芬, 楚婕妤, 刘誉, 等. 盐胁迫对大豆种子萌发过程中吸水和水解酶活性的影响[J]. 大豆科学, 2017, 36(1): 74-77. XU Fen-fen, CHU Jie-yu, LIU Yu, et al. Effects of salt stress on water uptake and hydrolytic enzyme activities during soybean seed germination[J]. Soybean Science, 2017, 36(1): 74-77. |
| [38] |
Eun S O, Young H S, Lee Y. Lead disturbs microtubule organization in the root meristem of Zea mays[J]. Physiol Plantarum, 2008, 110(3): 357-365. DOI:10.1111/j.1399-3054.2000.1100310.x |
| [39] |
柯庆明, 林文雄, 梁康迳, 等. 水稻抗Cd胁迫的生理生化特性研究[J]. 中国农学通报, 2008, 24(4): 374-378. KE Qing-ming, LIN Wen-xiong, LIANG Kang-jing, et al. Studies on rice genotypes tolerant to Cd contamination and their characters of physio-biochemistry[J]. Chinese Agricultural Science Bulletin, 2008, 24(4): 374-378. |
| [40] |
张锡洲, 张洪江, 李廷轩, 等. 水稻镉耐性差异及镉低积累种质资源的筛选[J]. 中国生态农业学报, 2013, 21(11): 1434-1440. ZHANG Xi-zhou, ZHANG Hong-jiang, LI Ting-xuan, et al. Differences in Cd-tolerance of rice and screening for Cd low-accumulation rice germplasm resources[J]. Chinese Journal of Eco-Agriculture, 2013, 21(11): 1434-1440. |
| [41] |
邬飞波, 张国平. 植物螯合肽及其在重金属耐性中的作用[J]. 应用生态学报, 2003, 14(4): 632-636. WU Fei-bo, ZHANG Guo-ping. Phytochelatin and its function in heavy metal tolerance of higer plants[J]. Chinese Journal of Applied Ecology, 2003, 14(4): 632-636. DOI:10.3321/j.issn:1001-9332.2003.04.035 |
| [42] |
陆仲烟, 宋正国, 郭军康, 等. 伯克氏菌对水稻种子萌发及初生幼苗耐镉性的影响[J]. 农业资源与环境学报, 2013, 30(6): 87-90. LU Zhong-yan, SONG Zheng-guo, GUO Jun-kang, et al. Effects of Burkholderia on rice seed germination and Cd-tolerance of rice seedlings[J]. Journal of Agricultural Resources and Environment, 2013, 30(6): 87-90. DOI:10.3969/j.issn.1005-4944.2013.06.018 |
| [43] |
王立, 安广楠, 马放, 等. AMF对镉污染条件下水稻抗逆性及根际固定性的影响[J]. 农业环境科学学报, 2014, 33(10): 1882-1889. WANG Li, AN Guang-nan, MA Fang, et al. Effects of arbuscular mycorrhizal fungi on cadmium tolerance and rhizospheric fixation of rice[J]. Journal of Agro-Environment Science, 2014, 33(10): 1882-1889. DOI:10.11654/jaes.2014.10.002 |
| [44] |
Morel M A, Ubalde M C, Braña V, et al. Delftia sp. JD2:A potential Cr(Ⅵ)-reducing agent with plant growth-promoting activity[J]. Archives of Microbiology, 2011, 193(1): 63-68. DOI:10.1007/s00203-010-0632-2 |
| [45] |
庞海东, 贺卓, 燕传明, 等. 耐重金属的植物促生芽孢杆菌筛选及其强化香蒲去除Cd的作用[J]. 农业环境科学学报, 2017, 36(11): 2314-2321. PANG Hai-dong, HE Zhuo, YAN Chuan-ming, et al. Isolation of heavy metal resistant and plant growth promoting Bacillus strains and effects on cadmium removal by Typha angustifolia[J]. Journal of Agro-Environment Science, 2017, 36(11): 2314-2321. DOI:10.11654/jaes.2017-0648 |
| [46] |
杨丽, 燕传明, 贺卓, 等. 重金属耐性芽孢杆菌的筛选及其对辣椒吸收镉铅的阻控效应[J]. 农业环境科学学报, 2018, 37(6): 1086-1093. YANG Li, YAN Chuan-ming, HE Zhuo, et al. Effect of heavy metaltolerant spore-forming bacteria on the cadmium and lead uptake of pepper[J]. Journal of Agro-Environment Science, 2018, 37(6): 1086-1093. |
| [47] |
Piotrowska-Niczyporuk A, Bajguz A, Zambrzycka E, et al. Phytohormones as regulators of heavy metal biosorption and toxicity in green alga Chlorella vulgaris(Chlorophyceae)[J]. Plant Physiology & Biochemistry, 2012, 52: 52-65. |
 2019, Vol. 38
2019, Vol. 38