2. 广西师范大学环境与资源学院, 广西 桂林 541004;
3. 岩溶生态与环境变化研究广西高校重点实验室, 广西 桂林 541004;
4. 广西师范大学生命科学学院, 广西 桂林 541004
2. College of Environment and Resource, Guangxi Normal University, Guilin 541004, China;
3. Key Laboratory of Karst Ecology and Environment Change of Guangxi Department of Education, Guangxi Normal University, Guilin 541004, China;
4. College of Life Science, Guangxi Normal University, Guilin 541004, China
锰是植物和人体正常生长发育的必需微量元素之一,也是植物体内超氧化物歧化酶(SOD)的重要组成成分,在维持叶绿体正常的结构过程中起着重要的作用[1-2]。同时植物光合作用中电子传递系统的氧化还原过程也需要锰的参与[3]。但过量的锰会抑制植物叶绿素的合成[4],打破植物体内清除机制的平衡,导致叶片中产生大量的丙二醛(MDA),造成膜脂过氧化和膜脂脱脂反应[5]。油茶是世界四大木本油料之一,具有经济价值高和生态功能强等特点,是我国特有优良木本油料树种。在广西,油茶是一种传统的经济树种,经过几十年的发展,油茶种植面积已超过30万hm2,已成为广西重要的经济和生态资源。有研究表明,在矿山生长的油茶叶片中的锰含量达到了2 191.7±213.1 mg·kg-1,是一种潜在的锰污染土壤修复物种[6]。
无机改良剂作为重金属土壤最重要的钝化剂之一,主要是通过提高土壤pH值和土壤颗粒表面负电荷,使重金属吸附于土壤颗粒表面,形成氢氧化物或者碳酸盐结合态盐类沉淀而达到降低土壤重金属有效态的目的[7]。石灰作为普遍使用的无机改良剂之一,其施用能有效提高土壤pH值,使土壤颗粒表面负电荷增加,促使土壤中污染重金属元素形成氢氧化物类沉淀[8-9]。有研究表明,石灰处理提高了铅、铜、镉和锌在土壤中的稳定效率和有效态含量,降低了植物对重金属的吸收[10-13]。锰作为一种多变价态的化学元素,在石灰作用下,其对油茶的生长及生理特征的影响研究相对较少。因此,本研究通过在锰污染土壤中添加不同比例的石灰,研究锰污染土壤石灰改良对油茶生长及其抗氧化酶系统的影响,旨在为锰污染土壤修复利用提供理论依据。
1 材料与方法 1.1 试验材料供试土壤样品分别采自广西来宾八一锰矿区(23°54′~24°01′N,109°14′~109°23′E)的采矿区及恢复区。采矿区土壤采自采矿区的表层土壤,恢复区土壤采自采矿区上游3 km处自然恢复区表层土壤。土壤采集时先去除地表杂物,然后采用蛇形5点法采集0~20 cm的土壤,混合均匀后,置于塑料袋中运回实验室。土壤经自然风干后,一部分过4 mm筛,另一部分过0.149 mm的尼龙筛备用。土壤理化性质见表 1。油茶苗购于广西壮族自治区桂林市林业科学研究所。
|
|
表 1 土壤理化性质 Table 1 Physical and chemical characters of test soil |
称取上述过4 mm筛的土壤样品5.0 kg,置于直径为18 cm、高为23 cm的圆形塑料花盆中,分别添加质量分数为0.05%(S1)和0.10%(S2)的石灰,以不添加石灰为对照,每处理重复3次。选择生长一致,且高约为25 cm的油茶幼苗进行栽培,每盆1株,共9盆,置于广西师范大学环境与资源学院温室中培养。在25±0.5 ℃条件下培养90 d(2017年5月3日—8月3日),每隔1 d采用称重法保持土壤含水率维持在田间最大含水率的70%。
1.3 取样与测定 1.3.1 土壤中重金属的形态分析土壤重金属形态测定方法采用欧盟BCR三步连续提取法[14-15]。提取形态分别为可交换态(F1)、可还原态(F2)、可氧化态(F3)和残渣态(F4)。
1.3.2 植物收获及锰含量的分析培养90 d后,将植物样品从土壤中取出,用自来水冲净,再浸入20 mmol·L-1的EDTA-Na2溶液中交换20 min,以除去附着的重金属,最后用去离子水洗净,用吸水纸将水分吸干,天平称量生物量。将植物根、茎和叶分别装入信封,在105 ℃烘箱中杀青30 min后,在70 ℃下烘干至恒质量。烘干的植物样品用不锈钢粉碎机磨碎,用于分析重金属含量。根际土壤pH值及植物重金属含量测定方法参照文献[16]。
1.3.3 叶片叶绿素、类胡萝卜素、O2-·和MDA含量的分析叶绿素、类胡萝卜素和O2-·的分析参考李合生[17]的方法。MDA的分析采用Quan等[18]的分析方法。
1.3.4 叶片抗氧化酶活性测定准确称取0.20 g已去除叶脉且剪碎的叶片于预冷的研钵中,加入1.00 mL预冷的0.1 mol·L-1磷酸缓冲液,冰浴上研磨成匀浆后,加缓冲液至体积为8.00 mL。在4 ℃条件下10 000 r·.min-1离心15 min,上清液即为粗提液,用于SOD、催化酶(CAT)、过氧化物酶(POD)和抗坏血酸(APX)活性的测定。SOD、CAT、POD和APX的分析参考Wu等[19]和Parida等[20]的方法。
1.3.5 叶片巯基(-SH)、谷胱甘肽(GSH)和植物螯合肽(PCs)含量的测定-SH、GSH和PCs的分析采用El-Zohri等[21]的分析方法。
1.4 数据处理文中所有实验数据均为3次重复的平均值,数据采用平均值±标准偏差表示。方差分析采用SPSS 19.0软件完成,绘图采用Excel 2010软件完成。
植物提取系数(PEC)=植物体内总锰含量(mg·kg-1)/土壤锰总量(mg·kg-1)
生物累积系数(BAF)=植物体内总锰含量(mg·kg-1)/土壤有效态锰含量(mg·kg-1)
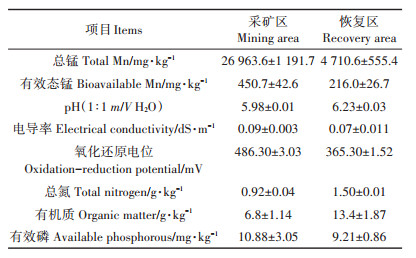
2 结果与分析 2.1 石灰添加对根际土壤pH值及土壤锰形态的影响如表 2所示,在植物收获后,石灰添加显著增加了根际土壤pH值(P<0.05)。S1处理下,采矿区和恢复区油茶根际土壤pH值比对照增加了0.42个和0.49个单位;S2处理下,采矿区和恢复区油茶根际土壤pH值比对照增加了0.84个和0.75个单位。由图 1可知,在采矿区和恢复区土壤中,石灰处理降低了土壤中可交换态锰含量,采矿区S1和S2处理分别较对照降低了18.70%和11.24%,恢复区中分别较对照降低了19.26%和32.59%。采矿区土壤中可还原态和可氧化态含量较对照含量增加,其中可氧化态增加显著(P<0.05),S1和S2处理分别较对照增加了20.21%和23.91%。恢复区土壤中,可还原态、可氧化态和残渣态锰的含量虽然有所变化,但较对照均没有显著差异(P>0.05)。
|
|
表 2 石灰添加对油茶根际土壤pH值的影响 Table 2 Effect of rhizosphere soil pH of C. oleifera. under different lime addition level |
|
数据表示平均值±标准偏差(n=3),不同小写字母代表各处理组间差异显著(P<0.05)。下同 Data is shown as mean±SE(n=3). The different lowercase letters indicate significant differences among different treatments(P < 0.05). The same below 图 1 石灰添加对采矿区和恢复区土壤中锰形态的影响 Figure 1 Fraction distribution of Mn concentration in contaminated soil in the present of C. oleifera under different lime addition levels |
在采矿区(图 2A)和恢复区(图 2B),S1处理时油茶根、叶中的锰含量分别比对照降低了46.84%、19.50%和35.90%、31.24%,采矿区茎中的锰含量提高了50.53%,但对恢复区茎中的锰含量无显著影响(P>0.05)。S2处理时,在采矿区,除了茎中锰含量比对照提高了37.19%外,根、叶中锰含量无显著变化(P>0.05);在恢复区,根和茎中的锰含量分别比对照显著增加了21.08%和48.90%,叶中的锰含量相对降低了14.23%。

|
图 2 石灰添加对油茶锰摄取量及生物量的影响 Figure 2 Effects of lime addition on the Mn uptake capacity and biomass of C. oleifera |
采矿区S2处理显著提高了油茶的株高(P<0.05)(图 2C),株质量变化不明显(P>0.05)(图 2D);而在恢复区中,添加石灰对油茶的株高无显著影响(P>0.05)(图 2D),但S1处理提高了油茶的株质量,是对照的1.37倍,S2处理时油茶的株质量较S1处理明显降低(P<0.05)。由表 3可知,S1处理显著降低了恢复区中油茶的植物提取系数和生物累积系数(P<0.05),分别比对照降低了24.53%和6.30%。而在采矿区,S1处理在一定程度上降低了油茶的植物提取系数,但差异不显著(P>0.05)。
|
|
表 3 石灰添加对油茶植物提取系数和累积系数的影响 Table 3 Performance of C. oleifera on Mn phytoextraction and bioaccumulation under different lime additions |
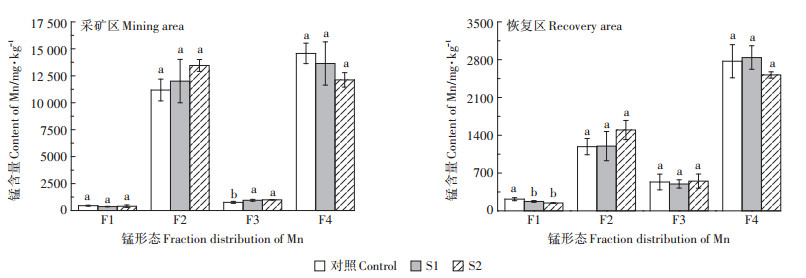
石灰添加显著增加了采矿区油茶叶片中的叶绿素a、叶绿素b的含量及恢复区中叶绿素b的含量(P<0.05)(图 3A和图 3B)。其中S2处理时,采矿区油茶中叶绿素a、叶绿素b的含量分别是对照的1.98倍和3.69倍,恢复区油茶中叶绿素b的含量是对照的3.01倍。S1处理时,恢复区油茶中叶绿素a的含量与对照间的差异不显著(P>0.05),S2处理时,油茶中叶绿素a的含量是对照的1.69倍。
|
图 3 石灰添加对油茶叶片中叶绿素和类胡萝卜素含量的影响 Figure 3 Effects of lime addition on the content of chlorophyll a, chlorophyll b and carotenoid in the leaves and biomass of C. oleifera |
由图 3C可知,采矿区油茶中类胡萝卜素的含量随着石灰投加量的增加而增加。而恢复区土壤中,油茶中类胡萝卜素含量相对于对照的变化不显著(P>0.05)。
2.4 石灰添加对油茶O2-·和MDA含量的影响在采矿区和恢复区,石灰添加显著增加了油茶叶片中的O2-·含量(P<0.05),且随着石灰添加量的增加而增加(图 4A)。S2处理时,油茶叶片中O2-·含量分别是对照的1.91倍和1.75倍。在相同的处理条件下,采矿区油茶叶片中O2-·含量高于恢复区。

|
图 4 石灰添加对油茶叶片中O2-·及MDA含量的影响 Figure 4 Effects of lime addition on the content of O2-·and MDA in leaves of C. oleifera |
由图 4B可知,在采矿区,在S2处理时,油茶叶片中MDA含量比对照提高了42.1%(P<0.05)。在恢复区,石灰添加显著提高了油茶叶片中MDA的含量(P<0.05),S1和S2处理下MDA含量分别是对照的1.46倍和1.34倍;但是S1和S2处理之间的差异不明显。
2.5 石灰添加对油茶抗氧化酶活性的影响由表 4可知,在采矿区,石灰添加提高了油茶叶片中SOD、POD活性,S1和S2处理SOD活性分别是对照的1.23倍和1.40倍,POD活性分别是对照的1.47倍和1.75倍。而在恢复区,石灰的添加对油茶叶片中SOD、POD活性的影响不显著(P>0.05)。在采矿区和恢复区,S2处理显著提高了油茶叶片中CAT活性(P<0.05),分别是对照的6.02倍和2.11倍。S1处理显著提高了恢复区油茶叶片中APX的活性(P<0.05),为对照的2.75倍。
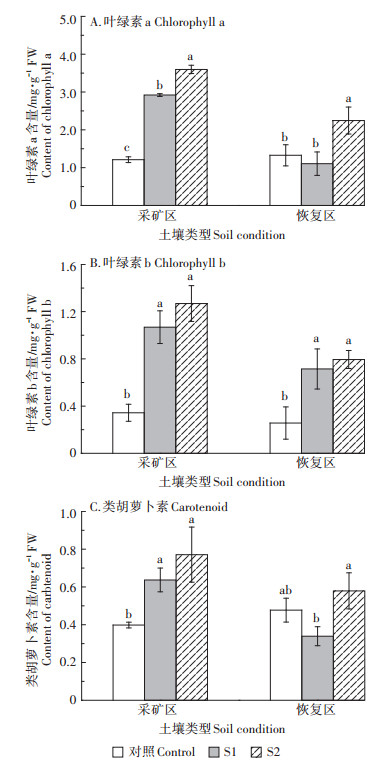
2.6 石灰对油茶-SH、PCs、GSH含量的影响由图 5A可知,在采矿区,石灰添加显著提高了油茶叶片中- SH和PCs的含量(P<0.05)。S2处理时,-SH和PCs的含量分别是对照的1.34倍和1.45倍。但是石灰的添加显著降低了油茶叶片中GSH的含量,在S1处理时,GSH的含量比对照降低了53.46%。
|
图 5 石灰对油茶叶片中-SH、PCs、GSH含量的影响 Figure 5 Effects of lime addition on the content of -SH, PCs and GSH in the leaves of C. oleifera |
在恢复区,S2处理油茶叶片中-SH、PCs和GSH的含量分别比对照降低了23.27%、22.26%和29.61%,且差异显著(P<0.05)(图 5B)。而S1处理时,油茶叶片中-SH和PCs的含量与对照无显著差异(P>0.05);但GSH的含量显著提高了38%(P<0.05)。
3 讨论石灰是一种常见的污染土壤改良剂,很多研究均表明施加石灰能有效提高土壤pH值,降低重金属在土壤中的有效态,从而减少重金属的生物可利用性。本研究结果表明,石灰添加显著增加了根际土壤pH值(P<0.05),降低了土壤中可交换态锰的含量。这可能是因为石灰处理提高了土壤pH值,增加了土壤表面胶体的负电荷量,从而增加了对阳离子Mn2+的吸附,同时pH值升高,形成重金属阳离子羟基态,增加了重金属的专性吸附,土壤中Mn2+开始水解为Mn(OH)2+,从而使可交换态重金属含量降低[22]。
土壤中Mn(OH)2+的形成,降低了Mn2+的浓度,不利于植物对Mn2+的吸收和转运。在本研究S1处理时,采矿区和恢复区油茶根、叶中的锰含量分别比对照降低了46.84%、19.50%和35.90%、31.24%;恢复区油茶的植物提取系数和生物累积系数分别比对照降低了24.53%和6.30%,这可能与土壤中植物可利用态锰含量降低有关,与李青峰等[23]研究石灰对伞竹和麦冬等5种植物吸收重金属影响的结果相似。另外,土壤有效态锰含量的降低,也将降低Mn2+对植物的伤害,从而有利于植物的生长。在恢复区,S1处理时,株质量增加了37%;但当石灰添加量增加到0.10%(S2)时,油茶的株质量明显降低。表明过量添加石灰改变了土壤的pH值,超出了最适油茶生长的pH值范围,从而影响了油茶的生长。另外,采矿区油茶的株质量明显低于恢复区,表明高浓度的锰污染会抑制油茶的生长。这与陈杨明珠等[24]研究石灰对锰土甘蔗幼苗生长的影响中的结论相似。
植物最重要的光合色素是叶绿素,其由叶绿素a和叶绿素b组成,是植物生长的重要生物标志物[25]。锰含量过高会导致叶绿素的合成受阻[4]。而本研究中,采矿区油茶叶片中的叶绿素a、叶绿素b的含量及恢复区中叶绿素b的含量随着石灰投加量的增加而增加。这表明石灰的添加降低了土壤有效态锰含量,从而有效促进了植物叶片叶绿素的合成,有利于油茶的生长(图 2D)。这与詹云等[26]研究石灰对秋葵幼苗叶片叶绿素含量影响的结果相似。
氧化应激是外界胁迫影响植物生长的主要机制之一,它会进一步影响植物的细胞结构、蛋白质、脂质、碳水化合物和DNA[27-28]。在植物正常生长情况下,植物体内各种物质之间处于平衡状态,但是在植物受到重金属胁迫后,植物体内清除机制的平衡将被打破,导致叶片中大量产生有毒物质MDA,造成膜脂过氧化和膜脂脱脂反应[5]。本研究结果表明,石灰的添加不同程度地增加了油茶叶片中MDA的含量(图 4B),说明油茶受到了不同程度的胁迫。这可能与叶片中的O2-·含量增加有关,与杨贤均等[29]的研究结果相似。S2处理时,油茶叶片中O2-·含量分别是对照的1.91倍和1.75倍。且在相同的处理条件下,采矿区油茶叶片的O2-·含量高于恢复区,说明在锰浓度较高时,油茶叶片中O2-·含量显著提高。这与Khoshgoftarmanesh等[30]研究镍胁迫对黄瓜O2-·含量的影响相似,重金属浓度的增加会显著提高植物体内O2-·的含量。
植物对各种胁迫的耐受性在很大程度上取决于非酶类抗氧化剂的积累以及抗氧化酶在细胞中的作用方式[25, 31]。植物产生的SOD、POD、APX和CAT等抗氧化酶在清除环境胁迫下植物产生的活性氧(Reactive oxygen species,ROS)中发挥着重要作用[28, 32]。SOD等的作用是消除植物体内产生的过量的O2-·等活性自由基,它可以将植物体内的O2-·转化为H2O2[33]。
表 4和图 4A的结果说明,在外界锰浓度较高时,添加石灰能够更好地激活油茶叶片中SOD酶活性,加速催化O2-·向H2O2的转变。这与张青等[34]研究的石灰对重金属胁迫下油菜叶片中SOD变化相似。除了SOD之外,细胞产生的活性氧物质还可以通过其他抗氧化酶的参与来消除[31, 35]。其中,POD、CAT在清除由O2-·转化成的H2O2中起重要作用[36]。本研究结果表明,石灰添加下POD和CAT均有不同程度的提高(表 4),这与许多重金属胁迫下植物体内POD、CAT等的变化一致[33, 37-38]。
|
|
表 4 石灰添加对油茶叶片中抗氧化酶含量的影响 Table 4 Effects of lime addition on the antioxidant enzyme activity in the leaves of C. oleifera |
植物不仅可以通过抗氧化酶系统来清除活性氧物质的胁迫,还可以通过非酶物质消除活性氧物质的胁迫[39]。其中GSH通过Halliwell-Asada途径来清除H2O2[40]。有研究表明,GSH是PCs的合成前体,PCs、GSH通过与植物体中的重金属进行螯合作用来缓解植物体内重金属的胁迫,并通过直接清除ROS来降低植物对重金属的吸收[25, 41-42]。本研究的结果表明,在高浓度的锰环境中,石灰处理能够使GSH大量转化为PCs,使GSH含量减小,并在S1处理时达到最小,说明S1处理能够促进GSH在高浓度的重金属胁迫下消除油茶体内的H2O2。
4 结论(1)石灰添加显著提高了油茶根际土壤的pH值(P<0.05),降低了土壤中可交换态锰的含量;同时,石灰处理促进了锰在油茶茎中的累积,而降低了在根和叶中的积累。
(2)在采矿区土壤中添加石灰显著提高了油茶叶片中叶绿素a的含量(P<0.05),且叶绿素a的含量随着石灰投加量的增加而增加。S1处理提高了油茶的株质量,一定量的石灰能促进油茶的生长。
(3)石灰添加增加了油茶叶片中O2-·、MDA的含量,表明油茶受到了活性氧物质的胁迫;而油茶通过提高叶片中SOD、POD和CAT的活性以及GSH和PCs的参与,来消除活性氧物质对油茶的胁迫,有利于植物的生长。
| [1] |
Peng L, Tang X M, Gong C F, et al. Manganese tolerance and accumulation in six Mn hyperaccumulators or accumulators[J]. Plant & Soil, 2010, 335(1/2): 385-395. |
| [2] |
叶攀骅, 王洋, 刘可慧, 等. 改良剂对锰超富集植物短毛蓼锰吸收及抗氧化酶系统的影响[J]. 土壤, 2016, 48(1): 109-116. YE Pan -hua, WANG Yang, LIU Ke-hui, et al. Effects of mineral amendment on manganese absorption and antioxidant enzymes activities in hyperaccumulator Polygonum pubescens Blume[J]. Soils, 2016, 48(1): 109-116. |
| [3] |
Yang Q W, Zeng Q, Xiao F, et al. Investigation of manganese tolerance and accumulation of two Mn hyperaccumulators Phytolacca americana L. and Polygonum hydropiper L. in the real Mn-contaminated soils near a manganese mine[J]. Environmental Earth Sciences, 2013, 68(4): 1127-1134. DOI:10.1007/s12665-012-1814-9 |
| [4] |
Weng X Y, Zhao L L, Zheng C J, et al. Characteristics of the hyperaccumulator plant Phytolacca acinosa(Phytolaccaceae)in reponse to excess manganese[J]. Journal of Plant Nutrition, 2013, 36(9): 1355-1365. DOI:10.1080/01904167.2013.790428 |
| [5] |
Moore K, Nd R L. Measurement of lipid peroxidation[J]. Free Radical Research Communications, 1998, 28(6): 659-671. DOI:10.3109/10715769809065821 |
| [6] |
杨胜香, 田启建, 梁士楚, 等. 湘西花垣矿区主要植物种类及优势植物重金属蓄积特征[J]. 环境科学, 2012, 33(6): 2038-2045. YANG Sheng-xiang, TIAN Qi-jian, LIANG Shi-chu, et al. Bioaccumulation of heavy metals by the dominant plants growing in Huayuan manganese and lead/zinc mineland, Xiangxi[J]. Environmental Science, 2012, 33(6): 2038-2045. |
| [7] |
Shaheen S M, Tsadilas C D, Rinklebe J, et al. Immobilization of soil copper using organic and inorganic amendments[J]. Journal of Plant Nutrition and Soil Science, 2015, 178(1): 112-117. DOI:10.1002/jpln.201400400 |
| [8] |
Healy M G, Ryan P C, Fenton O, et al. Bioaccumulation of metals in ryegrass(Lolium perenne L.)following the application of lime stabilised, thermally dried and anaerobically digested sewage sludge[J]. Ecotoxicology and Environmental Safety, 2016, 130: 303-309. DOI:10.1016/j.ecoenv.2016.04.026 |
| [9] |
崔红标, 范玉超, 周静, 等. 改良剂对土壤铜镉有效性和微生物群落结构的影响[J]. 中国环境科学, 2016, 36(1): 197-205. CUI Hong-biao, FAN Yu-chao, ZHOU Jing, et al. Availability of soil Cu and Cd and microbial community structure as affected by applications of amendments[J]. China Environmental Science, 2016, 36(1): 197-205. DOI:10.3969/j.issn.1000-6923.2016.01.033 |
| [10] |
范玉超, 吴求刚, 崔红标, 等. 磷灰石和石灰稳定化修复对污染土壤铜和镉垂直迁移的影响[J]. 土壤, 2017, 49(6): 1187-1194. FAN Yu-chao, WU Qiu-gang, CUI Hong-biao, et al. Vertical migration of Cu and Cd in soils immobilized by lime and apatite[J]. Soils, 2017, 49(6): 1187-1194. |
| [11] |
倪中应, 章明奎. 生物炭配施石灰降低稻米镉和铅积累的效果[J]. 中国农学通报, 2018, 34(2): 54-59. NI Zhong-ying, ZHANG Ming-kui. Combined application of biochar and lime:Effect on reducing cadmium and lead accumulation in rice[J]. Chinese Agricultural Science Bulletin, 2018, 34(2): 54-59. |
| [12] |
史磊, 郭朝晖, 彭驰, 等. 石灰组配土壤改良剂抑制污染农田水稻镉吸收[J]. 农业工程学报, 2018, 34(11): 209-216. SHI Lei, GUO Zhao-hui, PENG Chi, et al. Lime based amendments inhibiting uptake of cadmium in rice planted in contaminated soils[J]. Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(11): 209-216. DOI:10.11975/j.issn.1002-6819.2018.11.027 |
| [13] |
徐持平, 周卫军, 徐庆国. 复配钝化剂对污染土壤中铅具有良好的稳定效果[J]. 基因组学与应用生物学, 2018, 37(6): 2443-2450. XU Chi-ping, ZHOU Wei-jun, XU Qing-guo. Better effect of compound passivator on lead contaminated soil[J]. Genomics and Applied Biology, 2018, 37(6): 2443-2450. |
| [14] |
Wang F H, Zhang F, Chen Y J, et al. A comparative study on the heavy metal solidification/stabilization performance of four chemical solidifying agents in municipal solid waste incineration fly ash[J]. Journal of Hazardous Materials, 2015, 300: 451-458. DOI:10.1016/j.jhazmat.2015.07.037 |
| [15] |
Nemati K, Abu Bakar N K, Abas M R, et al. Speciation of heavy metals by modified BCR sequential extraction procedure in different depths of sediments from Sungai Buloh, Selangor, Malaysia[J]. Journal of Hazardous Materials, 2011, 192(1): 402-410. |
| [16] |
Li Y, Liu K H, Wang Y, et al. Improvement of cadmium phytoremediation by Centella asiatica L. after soil inoculation with cadmium-resistant Enterobacter sp. FM-1[J]. Chemosphere, 2018, 202: 280-288. DOI:10.1016/j.chemosphere.2018.03.097 |
| [17] |
李合生. 植物生理生化实验原理与技术[M]. 北京: 高等教育出版社, 2000. LI He-sheng. Principles and techniques of plant physiological biochemical experiment[M]. Beijing: Higher Education Press, 2000. |
| [18] |
Quan R D, Shang M, Zhang H, et al. Improved chilling tolerance by transformation with betA gene for the enhancement of glycinebetaine synthesis in maize[J]. Plant Science, 2004, 166(1): 141-149. DOI:10.1016/j.plantsci.2003.08.018 |
| [19] |
Wu S W, Hu C X, Tan Q L, et al. Effects of molybdenum on water utilization, antioxidative defense system and osmotic-adjustment ability in winter wheat(Triticum aestivum) under drought stress[J]. Plant Physiology & Biochemistry, 2014, 83: 365-374. |
| [20] |
Parida A K, Das A B, Mohanty P. Defense potentials to NaCl in a mangrove, Bruguiera parviflora:Differential changes of isoforms of some antioxidative enzymes[J]. Journal of Plant Physiology, 2004, 161(5): 531-542. DOI:10.1078/0176-1617-01084 |
| [21] |
El-Zohri M H, Cabala R, Frank H. Quantification of phytochelatins in plants by reversed-phase HPLC-ESI-MS-MS[J]. Analytical & Bioanalytical Chemistry, 2005, 382(8): 1871-1876. |
| [22] |
王陈丝丝, 马友华, 于倩倩, 等. 钝化剂对农田土壤重金属形态与其稳定性影响研究[J]. 中国农学通报, 2016, 32(1): 172-177. WANG Chen-sisi, MA You-hua, YU Qian-qian, et al. Effect of passivation agent on morphology and stability of heavy metals in cropland soil[J]. Chinese Agricultural Science Bulletin, 2016, 32(1): 172-177. |
| [23] |
李青峰, 武小芬, 刘军, 等. 5种植物冬季治理重金属效果研究[J]. 作物研究, 2014, 28(8): 885-889. LI Qing-feng, WU Xiao-fen, LIU Jun, et al. Treatments on 5 plants' absorbing heavy metal effects in winter[J]. Agricultural Science & Technology, 2014, 28(8): 885-889. |
| [24] |
陈杨明珠, 杨曙, 梁丽萍, 等. 石灰及其与有机肥配施对甘蔗幼苗黄化的影响[J]. 热带作物学报, 2018, 39(6): 1050-1054. CHEN Yang-mingzhu, YANG Shu, LIANG Li-ping, et al. Impact of lime and its composite application with manure on Sugarcane Chlorosis[J]. Chinese Journal of Tropical Crops, 2018, 39(6): 1050-1054. DOI:10.3969/j.issn.1000-2561.2018.06.002 |
| [25] |
Maleva M, Borisova G, Chukina N, et al. Urea increased nickel and copper accumulation in the leaves of Egeria densa(Planch.)Casp. and Ceratophyllum demersum L. during short-term exposure[J]. Ecotoxicology & Environmental Safety, 2018, 148: 152-159. |
| [26] |
詹云, 刘思宇. 石灰对秋葵幼苗生长发育的影响[J]. 黑龙江科学, 2018, 9(2): 15-19. ZHAN Yun, LIU Si-yu. Effect of lime on seedling growth of okra[J]. Heilongjiang Science, 2018, 9(2): 15-19. DOI:10.3969/j.issn.1674-8646.2018.02.003 |
| [27] |
Hatami M, Kariman K, Ghorbanpour M. Engineered nanomaterialmediated changes in the metabolism of terrestrial plants[J]. Science of the Total Environment, 2016, 571: 275-291. DOI:10.1016/j.scitotenv.2016.07.184 |
| [28] |
Li Y, Jin Q, Yang D, et al. Molybdenum sulfide Induce growth enhancement effect of rice(Oryza sativa L.)through regulating the synthesis of chlorophyll and the expression of aquaporin gene[J]. Journal of Agricultural and Food Chemistry, 2018, 66(16): 4013-4021. DOI:10.1021/acs.jafc.7b05940 |
| [29] |
杨贤均, 刘可慧, 李艺, 等. 锰污染土壤对酸模叶蓼氮素代谢的影响[J]. 生态环境学报, 2017, 26(10): 1776-1781. YANG Xian-jun, LIU Ke-hui, LI Yi, et al. Effects of manganese contaminated soil on nitrogen metabolism of manganese hyperaccumulator Polygonum lapathifolium L.[J]. Ecology and Environmental Sciences, 2017, 26(10): 1776-1781. |
| [30] |
Khoshgoftarmanesh A H, Bahmanziari H, Sanaeiostovar A. Responses of cucumber to deficient and toxic amounts of nickel in nutrient solution containing urea as nitrogen source[J]. Biologia Plantarum, 2014, 58(3): 524-530. DOI:10.1007/s10535-014-0415-8 |
| [31] |
Jouili H, Bouazizi H, El Ferjani E. Plant peroxidases:Biomarkers of metallic stress[J]. Acta Physiologiae Plantarum, 2011, 33(6): 2075. DOI:10.1007/s11738-011-0780-2 |
| [32] |
Ahmad P, Sarwat M, Sharma S. Reactive oxygen species, antioxidants and signaling in plants[J]. Journal of Plant Biology, 2008, 51(3): 167-173. DOI:10.1007/BF03030694 |
| [33] |
肖旭峰, 解庆娓, 范淑英, 等. 镉、铅胁迫对芹菜生长及抗氧化酶活性的影响[J]. 江西农业大学学报, 2015, 37(5): 793-797. XIAO Xu-feng, XIE Qing-wei, FAN Shu-ying, et al. Effect of Cd, Pb stress on growth and the activity of antioxidant enzymes in Apium graveolens[J]. Acta Agriculturae Universitatis Jiangxiensis, 2015, 37(5): 793-797. |
| [34] |
张青, 王煌平, 孔庆波, 等. 几种改良剂及其复合对Cd污染菜园土上油菜生长和生理代谢的影响[J]. 热带作物学报, 2012, 32(8): 1426-1430. ZHANG Qing, WANG Huang-ping, KONG Qing-bo, et al. Effects of amendments and compound on rape growth and physiological metabolism in Cd polluted garden soil[J]. Chinese Journal of Tropical Crops, 2012, 32(8): 1426-1430. DOI:10.3969/j.issn.1000-2561.2012.08.018 |
| [35] |
Gratão P L, Polle A, Lea P J, et al. Making the life of heavy metalstressed plants a little easier[J]. Functional Plant Biology, 2005, 32(6): 481-494. DOI:10.1071/FP05016 |
| [36] |
王宇霞.几种改良剂在重金属复合污染土壤修复中的作用研究[D].乌鲁木齐: 新疆大学, 2015. WANG Yu-xia. Ability of several amendments on remediation of soils contaminated with heavy metals[D]. Urumqi: Xinjiang University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10755-1015800453.htm |
| [37] |
苏银萍, 刘华, 于方明, 等. Mn污染对木荷叶片抗氧化酶系统的影响[J]. 农业环境科学学报, 2014, 33(4): 680-686. SU Yin-ping, LIU Hua, YU Fang-ming, et al. Effects of manganese contamination on activities of antioxidant enzyme systems in leaves of Schima superba[J]. Journal of Agro-Enrivenment Science, 2014, 33(4): 680-686. |
| [38] |
徐佳佳, 刘宁宁, 秦丽, 等. 镉胁迫对续断菊与玉米间作体系中植物叶片抗氧化酶活性的影响[J]. 云南农业大学学报, 2016, 30(2): 348-355. XU Jia-jia, LIU Ning-ning, QIN Li, et al. Effects of Cd stress on antioxidant enzymes activity of Sonchus asper L. Hill. and Zea mays L. in intercropping system[J]. Journal of Yunnan Agricultural University (Natural Science), 2016, 30(2): 348-355. |
| [39] |
李燕, 刘可慧, 于方明, 等. Mn对超富集植物短毛蓼(Polygonum pubescens Blume)抗氧化机理的影响[J]. 农业环境科学学报, 2011, 30(12): 2422-2427. LI Yan, LIU Ke-hui, YU Fang-ming, et al. Effects of manganese on enzymatic and non-enzymatic antioxidative defenses of the hyperaccumulator Polygonum pubescens Blume[J]. Journal of Agro-Environment Science, 2011, 30(12): 2422-2427. |
| [40] |
于方明, 汤叶涛, 仇荣亮, 等. Cd胁迫下超富集植物圆锥南芥抗氧化机理[J]. 环境科学学报, 2010, 30(2): 409-414. YU Fang-ming, TANG Ye-tao, QIU Rong-liang, et al. Antioxidative responses to cadmium stress in the hyperaccumulator Arabis paniculata Franch[J]. Acta Scientiae Circumstantiae, 2010, 30(2): 409-414. |
| [41] |
Cao Z Z, Qin M L, Lin X Y, et al. Sulfur supply reduces cadmium uptake and translocation in rice grains(Oryza sativa L.)by enhancing iron plaque formation, cadmium chelation and vacuolar sequestration[J]. Environmental Pollution, 2018, 237: 76-84. |
| [42] |
Szabados L, Savouré A. Proline:A multifunctional amino acid[J]. Trends in Plant Science, 2010, 15(2): 89-97. |
 2019, Vol. 38
2019, Vol. 38